预防或治疗EGFR功能异常相关的副作用的方法与流程
预防或治疗egfr功能异常相关的副作用的方法
1.本技术是申请日为2021年2月9日、申请号为202110179315.7、发明名称为“预防或治疗egfr功能异常相关的副作用的方法”的中国专利申请的分案申请。
技术领域
2.本技术涉及生物医药领域,具体的涉及一种预防或治疗受试者中与egfr功能异常相关的副作用的药物中的用途。
背景技术:
3.表皮生长因子受体(egfr)的突变或过表达已被发现与多种癌症相关,并且可以通过抑制egfr疗法(例如,施用egfr抑制剂)来治疗患有此类肿瘤的患者。然而,这类治疗会引起严重的副作用(特别是在皮肤,五官和胃肠道)。据报道,超过50%的接受egfr抑制剂治疗的患者会产生皮肤副作用(例如,参见heidary等人,journal of the american academy of dermatology,58(4):545,2008)。抑制egfr疗法的各种副作用会导致停药或剂量减少,并且会损害患者的生活质量。
4.现有技术中尚没有成功的治疗方案来控制抑制egfr疗法所引起的副作用。因此,目前迫切需要能够成功控制该等副作用的治疗方案。
技术实现要素:
5.本技术提供了式i所示的化合物或其药学上可接受的盐在制备药物中的用途,所述药物用于预防和/或治疗受试者中与egfr功能异常相关的副作用:式i,其中,环a为任意地被取代基取代或未取代的包含
1-3
个环的c
4-c9环烷基或杂环基,r5选自氢原子、c
1-c6烷基、c
1-c6烷基磺酰基、c
2-c6烯基和c
2-c6炔基,其中所述烷基、烯基、炔基任选地被氘、羟基、氨基、卤素、氰基和/或硝基取代。
6.在某些实施方式中,所述环a为任选地被取代基取代或未取代的单环的c
4-c7环烷基或杂环基。
7.在某些实施方式中,所述环a为单环的c
4-c7环烷基、单环的c
4-c7含氮杂环基,所述环烷基或含氮杂环基任选地被一个或多个取代基取代。
8.在某些实施方式中,所述环a为其中,所述r1选自氢原子、c
1-c6烷基、c2-c6烯基和c
2-c6炔基,r2选自氢原子、c
1-c6烷基、c
1-c6烯基、c
1-c6炔基、酰基和氰基,其中所述烷基、烯基、炔基、酰基任选地被卤素、c
1-c6烷基、c
2-c6炔基、c
2-c6炔基和/或氰基取代。
9.在某些实施方式中,所述r1选自c
1-c6烷基和氢原子。
10.在某些实施方式中,所述r1为甲基或氢原子。
11.在某些实施方式中,所述r2为-c(o)-r4,其中所述r4选自c
1-c6烷基、c
2-c6烯基、c
2-c6炔基和氰基,所述烷基、烯基、炔基、氰基进一步任选地被c
1-c6烷基、c
2-c6烯基、c
2-c6炔基和氰基取代。
12.在某些实施方式中,所述r2选自-c(o)-ch=ch2和-c(o)-ch
2-cn。
13.在某些实施方式中,所述环a为其中,所述r3选自氢原子、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、酰基、氨基和/或磺酸基,所述c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、酰基、氨基或磺酸基进一步被一个或多个c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、酰基、氨基和/或磺酸基取代。
14.在某些实施方式中,所述r3为其中,所述r6选自c
1-c6烷基。
15.在某些实施方式中,所述r3为
16.在某些实施方式中,所述环a为任意地被取代基取代或未取代的c
5-c
10
的二环烷基或二环杂烷基,所述二环烷基或二环杂烷基任选地被取代基取代。
17.在某些实施方式中,所述环a为其中,所述r8为-c(o)r7或-(ch2)n-c(o)or7,其中所述r7选自氢原子、c
1-c6烷基、c
1-c6烷氧基、c
2-c6烯基、5至10元杂芳基和氨基,所述c
1-c6烷基、c
1-c6烷氧基、c
2-c6烯基和5至10元杂芳基和氨基进一步任选地被c
1-c6烷基、c
1-c6烷氧基、c
2-c6烯基和/或5至10元杂芳基取代。
18.在某些实施方式中,所述r8为-c(o)r7,且所述r7为其中,环b为5至7元杂芳基,任选地被r9取代,所述r9选自氢原子、c
1-c6烷基、c
1-c6烷氧基和c
2-c6烯基。
19.在某些实施方式中,所述环b为5元杂芳基,任选地被r9取代,所述r9选自氢原子、c
1-c6烷基、c
1-c6烷氧基和c
2-c6烯基。
20.在某些实施方式中,所述环b为所述r9为c
1-c6烷氧基。
21.在某些实施方式中,所述r9为-o-ch3。
suppurativa)、与egfr功能异常相关的麻疹(hives)、与egfr功能异常相关的皮炎(dermatitis)、与egfr功能异常相关的乳痂(cradle cap)、与egfr功能异常相关的紫癜(purpura)、与egfr功能异常相关的玫瑰糠疹(pityriasis rosea)、与egfr功能异常相关的红斑(erythema)、与egfr功能异常相关的带状疱疹(shingles)、与egfr功能异常相关的瘀伤(bruise)和/或与egfr功能异常相关的黄瘤(xanthelasma)、与egfr功能异常相关的黑色素瘤(melanoma)、与egfr功能异常相关的基底细胞癌(basal cell carcinoma)、与egfr功能异常相关的鳞状细胞癌(squamous cell carcinoma)、与egfr功能异常相关的卡波西氏肉瘤(kaposi's sarcoma)、与egfr功能异常相关的环形红斑离心(erythema annulare centrifugum)、与egfr功能异常相关的毛囊炎、与egfr功能异常相关的滤泡性丘疹、与egfr功能异常相关的干燥病、与egfr功能异常相关的干燥性湿疹和/或与egfr功能异常相关的乳头脓疱疹。
36.在某些实施方式中,所述与egfr功能异常相关的副作用包括粘膜损伤疾病或病症。
37.在某些实施方式中,所述粘膜损伤疾病或病症包括口干、口腔黏膜炎、鼻衄、鼻咽炎、唇炎、口唇炎、食管黏膜炎、胃肠黏膜炎、胃溃疡、直肠黏膜炎、腹泻、呕吐、恶心、厌食、便秘和/或腹痛。
38.在某些实施方式中,所述与egfr功能异常相关的粘膜损伤疾病或病症包括与egfr功能异常相关的口干、与egfr功能异常相关的口腔黏膜炎、与egfr功能异常相关的鼻衄、与egfr功能异常相关的鼻咽炎、与egfr功能异常相关的唇炎、与egfr功能异常相关的口唇炎、与egfr功能异常相关的食管黏膜炎、与egfr功能异常相关的胃肠黏膜炎、与egfr功能异常相关的胃溃疡、与egfr功能异常相关的直肠黏膜炎、与egfr功能异常相关的腹泻、与egfr功能异常相关的呕吐、与egfr功能异常相关的恶心、与egfr功能异常相关的厌食、与egfr功能异常相关的便秘和/或与egfr功能异常相关的腹痛。
39.在某些实施方式中,所述副作用的严重程度为依据nci-ctcae v5.0中的第1级或其以上、第2级或其以上、第3级或其以上、第4级或其以上,或者第5级。
40.在某些实施方式中,与egfr被抑制相关的副作用包括与施用egfr抑制剂相关的副作用。
41.在某些实施方式中,所述egfr抑制剂包括用于治疗癌症的药物。
42.在某些实施方式中,所述egfr抑制剂直接作用于egfr蛋白和/或编码egfr蛋白的核酸。
43.在某些实施方式中,所述egfr抑制剂包括小分子egfr抑制剂、特异性结合egfr的蛋白大分子、抑制egfr蛋白表达的rnai和/或抑制egfr蛋白表达的反义寡核苷酸。
44.在某些实施方式中,小分子egfr抑制剂包括与egfr可逆结合的小分子egfr抑制剂、与egfr不可逆结合的小分子egfr抑制剂和/或特异性结合突变型egfr的小分子egfr抑制剂。
45.在某些实施方式中,所述egfr抑制剂包括西妥昔单抗、吉非替尼、厄洛替尼、埃克替尼、sapitinib、阿法替尼、拉帕替尼、凡德替尼、来那替尼、brigatinib、帕尼单抗、耐昔妥珠单抗、尼妥珠单抗、tesevatinib、艾力替尼、席栗替尼、rociletinib、卡奈替尼、azd3759、yzj-0318、萘普替尼、naquotinib、pf-06747775、sph1188-11、poziotinib、依吡替尼、
varlitinib、艾氟替尼、hm61713、ck-101、吡咯替尼、莱洛替尼、hs-10296、ap32788、西莫替尼、gma204、virlitinib、yinlitinib、那扎替尼、诺司替尼、奥莫替尼、奥希替尼、达克替尼、艾维替尼和/或eai045。
46.在某些实施方式中,所述egfr抑制剂与一种或多种其他疗法联用。
47.在某些实施方式中,所述受试者包括癌症患者。
48.在某些实施方式中,所述受试者曾经、正在和/或将来被施用所述egfr抑制剂。
49.在某些实施方式中,所述式i所示的化合物被制备为适用于透皮给药。
50.在某些实施方式中,所述药物中所述式i所示的化合物的浓度为约0.0001%至约50%。
51.在某些实施方式中,所述式i所示的化合物被制备为适用于胃肠道给药。
52.在某些实施方式中,所述式i所示的化合物被制备为适用于注射给药。
53.在某些实施方式中,所述式i所示的化合物有效剂量为0.001mg/kg体重/天至3000mg/kg体重/天。
54.在某些实施方式中,所述式i所示的化合物有效剂量为0.1mg/kg体重/天~150mg/kg体重/天。
55.在某些实施方式中,所述药物基本上不影响所述egfr抑制剂的治疗效果。
56.在某些实施方式中,所述药物中还包括一种或多种其他活性成分。
57.另一方面,本技术提供了化合物i-a、i-b、i-c和/或i-d及其药学上可接受的盐在制备药物中的用途,所述药物用于预防和/或治疗受试者中与egfr功能异常相关的副作用,
[0058][0059]
另一方面,本技术提供了一种预防或治疗与egfr功能异常相关的副作用的方法,包括向有需要的受试者施用本技术所述的式i所示的化合物,或其药学上可接受的盐:式i,其中,环a为任意地被取代基取代或未取代的包含
1-3
个环的c
4-c9环烷基或杂环基,r5选自氢原子、c
1-c6烷基、c
1-c6烷基磺酰基、c
2-c6烯基和c
2-c6炔基,其中所述烷基、烯基或炔基任选地被氘、羟基、氨基、卤素、氰基和/或硝基取代。
[0060]
在某些实施方式中,所述受试者曾经、正在和/或将来被施用egfr抑制剂。
[0061]
另一方面,本技术提供了一种预防或治疗与egfr功能异常相关的副作用的方法,包括向有需要的受试者施用化合物i-a、i-b、i-c和/或i-d,或其药学上可接受的盐。
[0062]
另一方面,本技术提供了药物组合或试剂盒,其包含:1)egfr抑制剂;以及2)本申
请所述的式i所示的化合物:式i,其中,环a为任意地被取代基取代或未取代的包含
1-3
个环的c
4-c9环烷基或杂环基,r5选自氢原子、c
1-c6烷基、c
1-c6烷基磺酰基、c
2-c6烯基和c
2-c6炔基,其中所述烷基、烯基或炔基任选地被氘、羟基、氨基、卤素、氰基和/或硝基取代。
[0063]
在某些实施方式中,所述egfr抑制剂与所述式i所示的化合物彼此不混合。
[0064]
在某些实施方式中,所述egfr抑制剂与所述式i所示的化合物各自独立地存在于单独的容器中。
[0065]
在某些实施方式中,所述式i所示的化合物被制备为适用于胃肠道给药、注射给药和/或透皮给药。
[0066]
在某些实施方式中,所述式i所示的化合物的浓度为约0.0001%至约50%。
[0067]
在某些实施方式中,所述式i所示的化合物被制备为适用于胃肠道给药。
[0068]
在某些实施方式中,所述式i所示的化合物被制备为适用于注射给药。
[0069]
在某些实施方式中,所述式i所示的化合物有效剂量为0.001mg/kg体重/天至3000mg/kg体重/天。
[0070]
在某些实施方式中,所述式i所示的化合物有效剂量为0.1mg/kg体重/天~150mg/kg体重/天。
[0071]
在某些实施方式中,2)中的所述式i所示的化合物能够预防或治疗与施用1)中的所述egfr抑制剂相关的疾病或病症。
[0072]
在某些实施方式中,2)中的所述式i所示的化合物基本上不影响1)中的所述egfr抑制剂的治疗效果。
[0073]
在某些实施方式中,在施用1)的所述egfr抑制剂之前、同时或者之后施用2)的所述式i所示的化合物。
[0074]
另一方面,本技术提供了一种方法,所述方法包括下述步骤:
[0075]
1)监测被施用egfr抑制剂的受试者的副作用;
[0076]
2)当所述监测显示所述受试者出现与施用所述egfr抑制剂相关的副作用时,向所述受试者施用式i所示的化合物,或其药学上可接受的盐:式i,其中,环a为任意任选地被取代基取代或未取代的包含1-3个环的c4-c9环烷基或杂环基,r5选自氢原子、c1-c6烷基、c1-c6烷基磺酰基、c2-c6烯基和c2-c6炔基,其中所述烷基、烯基、炔基任意任选地被氘、羟基、氨基、卤素、氰基和/硝基取代。
[0077]
在某些实施方式中,所述的方法还包括继续监控所述副作用,以及任选地减少或停用所述egfr抑制剂。
[0078]
在某些实施方式中,所述副作用的严重程度在所述施用egfr抑制剂之后增加。
[0079]
在某些实施方式中,在所述施用egfr抑制剂之前,所述受试者未患有所述副作用皮疹。
[0080]
在某些实施方式中,所述egfr抑制剂不包含所述式i所示的化合物。
[0081]
在某些实施方式中,施用所述egfr抑制剂来治疗癌症。
[0082]
在某些实施方式中,所述副作用的患处与癌症的患处不同。
[0083]
本领域技术人员能够从下文的详细描述中容易地洞察到本技术的其它方面和优势。下文的详细描述中仅显示和描述了本技术的示例性实施方式。如本领域技术人员将认识到的,本技术的内容使得本领域技术人员能够对所公开的具体实施方式进行改动而不脱离本技术所涉及发明的精神和范围。相应地,本技术的附图和说明书中的描述仅仅是示例性的,而非为限制性的。
附图说明
[0084]
本技术所涉及的发明的具体特征如所附权利要求书所显示。通过参考下文中详细描述的示例性实施方式和附图能够更好地理解本技术所涉及发明的特点和优势。对附图简要说明书如下:
[0085]
图1:显示的是本技术所述egfr抑制剂导致皮疹的大鼠模型左侧、背部和右侧的照片。
[0086]
图2:显示了本技术实施例1-37中的对照组、jak抑制剂组典型大鼠的左侧、背部和右侧的照片。
[0087]
图3:显示了本技术实施例1-37中的对照组、jak抑制剂组的皮疹等级结果。
[0088]
图4:显示了本技术实施例38-65中的对照组、jak抑制剂组的皮疹等级结果。
[0089]
图5:显示了本技术实施例66-67中的对照组(单抗类egfr抑制剂)、jak抑制剂组的皮疹等级。
[0090]
图6:显示了本技术实施例68中的对照组(单抗类egfr抑制剂)、jak抑制剂组的皮疹等级。
[0091]
图7:显示了本技术实施例69-98中的对照组、jak抑制剂组典型大鼠的左侧、背部和右侧的照片。
[0092]
图8:显示了本技术实施例69-98中的对照组、jak抑制剂组的皮疹等级结果。
[0093]
图9:显示了本技术实施例99-122中的对照组、jak抑制剂组的皮疹等级结果。
[0094]
图10:显示了本技术实施例123-124中的对照组(单抗类egfr抑制剂)、jak抑制剂组的皮疹等级。
[0095]
图11:显示了本技术实施例125-130中其他皮肤用药组、jak抑制剂组典型大鼠的左侧、背部和右侧的照片。
[0096]
图12:显示了本技术实施例125-130中其他皮肤用药组、jak抑制剂组的皮疹等级结果。
[0097]
图13:显示了本技术egfr抑制剂导致大鼠腹泻的不同等级照片。
[0098]
图14:显示了本技术实施例131-155中的对照组、jak抑制剂组的腹泻等级结果。
[0099]
图15:显示了本技术实施例157-178中的对照组、jak抑制剂组的腹泻等级结果。
[0100]
图16:显示了本技术实施例180-185中的其他用药组、jak抑制剂组的腹泻等级结果
[0101]
图17:显示了本技术实施例186-202中的对照组、jak抑制剂组典型大鼠的口唇炎照片。
具体实施方式
[0102]
以下由特定的具体实施例说明本技术发明的实施方式,熟悉此技术的人士可由本说明书所公开的内容容易地了解本技术发明的其他优点及效果。
[0103]
发明详述
[0104]
上皮组织疾病
[0105]
在本技术中,提供了一种预防和/或治疗上皮组织疾病的方法。
[0106]
本技术中使用的术语“上皮组织”通常是指包括一层或多层覆盖整个身体的自由和封闭表面的细胞,包括皮肤、粘液、腔、浆液和腺体空间。所有上皮层都包含两个特殊的结构域:面向粘膜(或腔)空间的顶端结构域和面向浆膜(或深层)空间的基底外侧膜。因此,上皮组织的重要功能是提供适当的屏障功以分离和控制这两个空间之间的许多生理过程。上皮组织可以包括上皮细胞以及内皮细胞。上皮细胞可以包括皮肤上皮细胞、口腔上皮细胞、胃上皮细胞和/或小肠上皮细胞。
[0107]
本技术中使用的术语“上皮组织疾病”通常是指上皮细胞和/或内皮细胞病变引起的疾病在一些实施方式中,“上皮组织疾病”可以包括选自下组的疾病或病症:皮疹、痤疮、皮肤瘙痒、手足综合征、脱发、毛发改变、红斑、皮肤脱落(skin exfoliation)、疱脓疹、多毛症、色素沉着(hyper-pigmentation)、指甲疾病(nail disorders)、甲沟炎及甲裂、皮肤干燥、超敏反应、黏膜炎、鼻咽炎、鼻出血、口腔干燥、唇炎、口腔溃疡和胃肠道粘膜损伤。例如,所述上皮组织疾病可以包括腹泻。例如,所述上皮组织疾病可以包括皮疹。例如,所述上皮组织疾病可以包括口唇炎。
[0108]
根据疾病发生部位的不同,上皮组织疾病可分为上皮细胞疾病和/或内皮细胞疾病。在一些实施方式中,上皮细胞疾病可分为皮肤上皮细胞疾病(例如,皮疹、痤疮、酒糟鼻、异位性皮炎、接触性皮炎、脂溢性皮炎、狼疮、硬皮病、天胞疮、色素沉淀、黑斑病、白癜风、荨麻疹、体癣、皮肤瘙痒、脱发、毛发改变、红斑、甲沟炎及甲裂、皮肤干燥、超敏反应以及牛皮癣)、口腔上皮细胞疾病(例如,天疱疮、唇疱疹、疱疹性口炎、肉芽肿性唇炎、口腔溃疡、类天疱疮、舍格林氏综合征、贝赫切特综合征以及口腔结节病等)、胃上皮细胞疾病(例如,胃炎、肠化生、胃穿孔、胃瘘、胃溃疡以及胃肠道息肉)或小肠上皮细胞疾病(例如,肠炎、克罗恩病、肠穿孔、肠瘘、肠溃疡、溃疡性结肠炎以及nsaids肠病)。
[0109]
上皮组织疾病的严重程度分级可以根据美国国家癌症研究所发布的常见不良事件术语标准(ctcae)进行划分,该标准是癌症治疗临床试验和其他肿瘤学设置中的不良事件的标准分类和严重度的分级标准(nci-ctcae v5.0)。在一些实施方式中,所述上皮组织疾病的严重程度可以为依据nci-ctcae v5.0中的第1级或其以上、第2级或其以上、第3级或其以上、第4级或其以上、或者第5级。
[0110]
在一些实施方式中,内皮细胞可以是血管内皮细胞。在一些实施方式中,内皮细胞疾病可以是血管内皮细胞疾病。血管内皮细胞疾病可以包括但不限于:退行性变性血管疾
病(例如,动脉粥样硬化、动脉中层硬化以及小动脉硬化(例如,透明变性型小动脉硬化和增生型小动脉硬化))、炎症性血管疾病(例如,感染性动脉炎、梅毒性动脉炎、巨细胞性动脉炎、血栓闭塞性脉管炎以及风湿性动脉炎)、功能性血管疾病(例如,雷诺氏病、手足发绀以及红斑肢痛症)以及先天性血管疾病(例如,先天性动静脉瘘)等。
[0111]
在本技术中,所述上皮细胞疾病可以是皮肤上皮细胞疾病。例如,皮肤上皮细胞疾病可以是皮疹。
[0112]
本技术提供了一种预防或治疗皮疹的方法。
[0113]
本技术中使用的术语“皮疹”通常是指会影响皮肤颜色、外观或纹理的皮肤变化。皮疹可以仅局限在在身体的一部分,或影响整个皮肤。皮疹还可以包括荨麻疹。所述皮疹可以是免疫性皮疹和/或非免疫性皮疹。本技术所述皮疹可以是受试者施用egfr抑制剂后出现的皮疹。
[0114]
例如,所述皮疹的病理表现可包括皮肤表皮生长和/或分化的明显改变、角质细胞终末分化的改变在、受影响和未受影响的皮肤中都可以看到致密的角膜塑形和表皮角化不全、皮脂腺和/或毛囊漏斗的损伤、有或无感染迹象、表皮屏障受损、表皮角膜下裂、细胞因子产生、炎性细胞浸润(如中性粒细胞、淋巴细胞)、细菌感染、毛细血管扩张、色素沉着和/或致密的上皮发炎性通透性。
[0115]
例如,所述皮疹的临床表现可以为红斑、皮肤干燥、瘙痒、鳞状的斑块、压痛、灼热感、裂痕、脓疱、滤泡、溃疡、脓肿、红色凸起和/或脓性病变。
[0116]
例如,所述皮疹的发生部位可以为表皮,例如,包括皮肤的脂溢性区域。例如,所述皮疹的发生部位可以包括头皮、面部、颈部、胸部、上背部、四肢、下背部、腹部、臀部、牙周区域、腹部、手掌、脚掌、指甲和/或粘膜。
[0117]
在本技术中,所述皮疹可以包括寻常痤疮(acne vulgaris)、丘疹性皮疹(papulopustular rash)玫瑰痤疮(acne rosacea)、瘙痒性皮疹(pruritus rash)、痤疮样皮疹(acneiform rash)蜂窝织炎(cellulitis)、莱姆病(lyme disease)、过敏反应(allergic reaction)、化脓性汗腺炎(hidradenitis suppurativa)、麻疹(hives)、皮炎(dermatitis)、乳痂(cradle cap)、紫癜(purpura)、玫瑰糠疹(pityriasis rosea)、红斑(erythema)、带状疱疹(shingles)、瘀伤(bruise)和/或黄瘤(xanthelasma)、黑色素瘤(melanoma)、基底细胞癌(basal cell carcinoma)、鳞状细胞癌(squamous cell carcinoma)、卡波西氏肉瘤(kaposi's sarcoma)、环形红斑离心(erythema annulare centrifugum)、毛囊炎、滤泡性丘疹、干燥病、干燥性湿疹和/或乳头脓疱疹。
[0118]
在本技术中,提供了一种预防和/或治疗粘膜损伤疾病或病症的方法。例如,所述粘膜可以包括口腔黏膜、眼睑黏膜、鼻黏膜、尿道黏膜、胃粘膜、消化道粘膜、直肠粘膜、食管黏膜粘膜和/或外阴部黏膜。所述粘膜损伤疾病或病症可以包括粘膜变薄、破损、感染、溃疡或脓肿。
[0119]
在某些实施方式中,所述粘膜损伤疾病或病症包括口干、口腔黏膜炎、鼻衄、鼻咽炎、唇炎、口唇炎、食管黏膜炎、胃肠黏膜炎、胃溃疡、直肠黏膜炎、腹泻、呕吐、恶心、厌食、便秘和/或腹痛。例如,所述粘膜损伤疾病或病症可以为口唇炎。例如,所述粘膜损伤疾病或病症可以为腹泻。
[0120]
在本技术中,术语“口唇炎”通常是指口腔或嘴唇发炎,主要症状可以包括嘴唇干
燥、脱皮、皲裂、结痂、出现水泡、渗出液、红肿、溃疡和/或出血。本技术所述口唇炎可以是受试者施用egfr抑制剂后出现的口唇炎。
[0121]
在本技术中,术语“腹泻”通常是指肠道的液体样、水样或松弛性蠕动。腹泻可以为受试者每天有三次以上排便或三次以上排液体便,或大便次数多于该受试者在正常情况下的排便次数。本技术所述腹泻可以是受试者施用egfr抑制剂后出现的腹泻。
[0122]
例如,粘膜损伤疾病或病症的口唇炎可包括嘴唇干裂、光化性唇炎、角性唇炎、湿疹性唇炎、传染性唇炎、肉芽肿性唇炎、药物相关性唇炎、剥脱性唇炎、腺炎和/雄浆细胞性唇炎。
[0123]
egfr功能异常
[0124]
一方面,本技术提供一种预防或治疗egfr功能异常相关的副作用。在本技术中,术语“egfr”通常是指表皮生长因子受体(epidermal growth factor receptor),也称为erbb1或her1,其是由c-erbb1原癌基因编码的170kda的跨膜糖蛋白。egfr是受体酪氨酸激酶(rtk)的人表皮生长因子受体(her)家族的成员,该家族还包括her2(erbb2)、her3(erbb3)和her4(erbb4)。egfr信号通过配体结合引发,随后通过诱导受体与其他erbb家族成员的构象变化、同二聚化或异二聚化、以及受体的反式自磷酸化等(参见,ferguson等人,annu rev biophys,37:353-73,2008),来启动信号转导级联,从而最终影响多种细胞功能(例如,细胞增殖和存活)。egfr的表达或其激酶活性的增加与一系列人类癌症相关(参见,mendelsohn等人,oncogene 19:6550-6565,2000;grunwald等人,j natl cancer inst 95:851-67,2003;mendelsohn等人,semin oncol 33:369-85,2006)。已知在众多癌症,如脑胶质瘤、乳腺癌、卵巢癌、子宫颈癌等中发现了egfr的表达升高。
[0125]
在某些情形中,所述egfr功能异常相关的副作用包括与egfr被抑制相关的副作用。本技术中,术语“egfr被抑制”包括任何原因导致的(例如,由治疗引起的或者由受试者自身身体状况造成的)egfr活性、表达或者数量的降低。在一些实施方式中,egfr被抑制通常是指egfr的活性或者数量降低至少10%。在一些实施方式中,egfr被抑制通常是指egfr的活性或者数量降低至少20%、40%、50%、80%、90%、95%或更多。在一些实施方式中,所述的降低是与同类受试者(例如,同样的正常人或者同类型的患者)中的标准值相比较的。在一些实施方式中,所述的降低是与相同受试者一段时间之前的数值相比较的。
[0126]
在某些情形中,与egfr功能异常相关的副作用包括与施用egfr抑制剂相关的副作用。对于受试者来说,施用egfr抑制剂后可能产生所述副作用。对于受试者来说,施用egfr抑制剂后可能加重所述副作用的严重程度。
[0127]
在某些情形中,egfr被抑制是由于施用了egfr抑制剂。本技术中,术语“egfr抑制剂”通常是指本领域中已知的或将来发现的任何egfr抑制剂,包括任何当其被施用至受试者时,导致了受试者中与egfr活性相关的生物活性的抑制(包括任何egfr与其天然配体结合产生的下游生物效应的抑制)的任何物质。在一些实施方式中,egfr抑制剂包括在治疗癌症过程中任何能够阻断egfr活性或其任何下游生物效应的试剂。
[0128]
可以通过本领域公知的方法来确定或筛选egfr抑制剂,例如通过检测施用受试化合物之后egfr表达水平的变化。检测egfr的表达水平可以通过本领域公知的方法,例如,免疫组织化学方法、pcr、rt-pcr、原位杂交、southern blot,western blot,northern blot、分光光度法和elisa等。
[0129]
例如,所述egfr抑制剂可以被用于对所述受试者进行癌症治疗。本技术中,术语“癌症”通常是指任何由肿瘤或恶性细胞生长、增殖或转移所介导,并引发实体瘤和非实体瘤(例如,白血病)的医学状况。
[0130]
例如,egfr抑制剂可以通过与egfr受体细胞内结构域直接结合阻断其激酶活性;或者占据了egfr受体的配体结合位点或其一部分,从而使得egfr受体与其天然配体无法接近而导致其生物活性降低或被阻断;或者通过调节egfr多肽的二聚化或调节egfr多肽与其他蛋白的相互作用,增加egfr的泛素化和内吞降解,从而降低egfr活性。
[0131]
例如,egfr抑制剂可以是egfr的非特异性抑制剂,即,该等抑制剂除了抑制egfr之外,还抑制其它的靶蛋白。
[0132]
例如,egfr抑制剂直接作用于egfr蛋白或者编码egfr蛋白的核酸。在一些实施方式中,egfr抑制剂直接作用于egfr蛋白。在本技术中当使用术语“直接作用于”来形容抑制剂与靶蛋白时,通常是指抑制剂与靶蛋白之间能够直接的、不需要通过其它分子的结合(包括共价结合和非共价结合)。
[0133]
例如,egfr抑制剂可以是小分子egfr抑制剂、特异性结合egfr的蛋白大分子(例如,抗体或其抗原结合片段)或者抑制egfr蛋白表达的rnai或者反义寡核苷酸。例如,egfr抑制剂可以是小分子egfr抑制剂或特异性结合egfr的蛋白大分子(例如,抗体或其抗原结合片段)。
[0134]
本技术中,术语“核酸”通常是指由单体核苷酸组成的多核苷酸分子。核酸包括核糖核酸(rna)、脱氧核糖核酸(dna)、单链核酸(ssdna)、双链核酸(dsdna)、小干扰核糖核酸(sirna)和微rna(mirna)。多核苷酸的其他非限制性实例包括基因,基因片段,外显子,内含子,信使rna(mrna),转移rna,核糖体rna,核酶,cdna,shrna,单链短或长rna,重组多核苷酸,支链多核苷酸,质粒,载体,任何序列的分离的dna,对照区,任何序列的分离的rna,核酸探针和引物。核酸可以是直链或环状的。
[0135]
本技术中,术语“rnai”通常是指rna干扰技术,是外源或内源双链rna分子或小分子rna通过靶向mrna并将其特异性降解而抑制基因的表达或翻译的过程。
[0136]
本技术中,术语“寡核苷酸”通常是指核糖核酸(rna)或脱氧核糖核酸(dna)或其任何模拟物或结构修饰的核酸的低聚物或聚合物。该术语包括由天然存在的核碱基、糖和共价核苷(主链)间键组成的寡核苷酸,以及具有类似功能的非天然存在的寡核苷酸。
[0137]
本技术中,术语“反义寡核苷酸”通常是指具有允许与靶核酸的对应区域或片段至少一部分地杂交的核碱基序列的单链寡核苷酸。
[0138]
本技术中,术语“小分子egfr抑制剂”可以包括与egfr可逆结合的小分子egfr抑制剂(例如,吉非替尼、厄洛替尼、sapitinib和埃克替尼),与egfr不可逆结合的小分子egfr抑制剂(例如,阿法替尼、dacomitinib、拉帕替尼(lapatinib,例如gw572016 glaxosmithkline)、凡德替尼(vandetanib,例如zactimatm,zd6474)、乐伐替尼、卡奈替尼、伐利替尼和来那替尼)和/或特异性结合突变型egfr的小分子egfr抑制剂(例如,奥希替尼、那扎替尼、诺司替尼、奥莫替尼、艾维替尼和eai045)。
[0139]
特异性结合egfr的蛋白大分子可以是针对egfr的抗体、抗体变体、融合蛋白、衍生物或其片段。在一些实施方式中,特异性结合egfr的蛋白大分子是特异性结合egfr的抗体或其抗原结合片段。
[0140]
本技术中使用的术语“特异性结合”当用于形容egfr抑制剂时通常是指:在复杂混合物中该egfr抑制剂可识别egfr,所述抑制剂与egfr的结合常数为其与其他非特异性结合蛋白的结合常数的至少2倍。
[0141]
在某些情形中,所述egfr抑制剂可以与一种或多种其他癌症治疗法联用。所述其他癌症治疗法可以是本领域中常规用于治疗癌症的方法,例如细胞毒抗癌剂、免疫治疗抗癌剂或激素治疗抗癌剂。根据本技术,用于癌症治疗的药物也可以与放射治疗或手术组合使用。在一些实施方式中,在将egfr抑制剂和其他抗癌剂组合使用的情况下,它们可以同时施用于受试者,或者以一定间隔分开施用。
[0142]
egfr功能异常相关的副作用
[0143]
在本技术中,所述副作用包括与egfr被抑制相关的上皮组织疾病。
[0144]
本技术中使用的术语“与egfr被抑制相关的上皮组织疾病”通常是指上皮细胞和/或内皮细胞病变引起的疾病(例如,与egfr被抑制相关或由施用egfr抑制剂引起的上皮细胞和/或内皮细胞病变)。在一些实施方式中,“与egfr被抑制相关的上皮组织疾病”可以包括选自下组的疾病或病症:与egfr被抑制相关的皮疹、与egfr被抑制相关的痤疮、与egfr被抑制相关的皮肤瘙痒、与egfr被抑制相关的手足综合征、与egfr被抑制相关的脱发、与egfr被抑制相关的毛发改变、与egfr被抑制相关的红斑、与egfr被抑制相关的皮肤脱落(skin exfoliation)、与egfr被抑制相关的疱脓疹、与egfr被抑制相关的多毛症、与egfr被抑制相关的色素沉着(hyper-pigmentation)、与egfr被抑制相关的指甲疾病(nail disorders)、与egfr被抑制相关的甲沟炎及甲裂、与egfr被抑制相关的皮肤干燥、与egfr被抑制相关的超敏反应、与egfr被抑制相关的黏膜炎、与egfr被抑制相关的鼻咽炎、与egfr被抑制相关的鼻出血、与egfr被抑制相关的口腔干燥、与egfr被抑制相关的唇炎、与egfr被抑制相关的口腔溃疡和与egfr被抑制相关的胃肠道粘膜损伤。所述与egfr功能异常相关的上皮组织疾病可以指与施用egfr抑制剂相关的上皮组织疾病。例如,所述上皮组织疾病可以包括与egfr被抑制相关的腹泻。所述与egfr功能异常相关的腹泻可以指与施用egfr抑制剂相关的腹泻。例如,所述上皮组织疾病可以包括与egfr被抑制相关的皮疹。所述与egfr功能异常相关的皮疹可以指与施用egfr抑制剂相关的皮疹。例如,所述上皮组织疾病可以包括与egfr被抑制相关的口唇炎。所述与egfr功能异常相关的口唇炎可以指与施用egfr抑制剂相关的口唇炎。
[0145]
根据疾病发生部位的不同,上皮组织疾病可分为上皮细胞疾病和/或内皮细胞疾病。在一些实施方式中,上皮细胞疾病可分为与egfr被抑制相关的皮肤上皮细胞疾病(例如,皮疹、痤疮、酒糟鼻、异位性皮炎、接触性皮炎、脂溢性皮炎、狼疮、硬皮病、天胞疮、色素沉淀、黑斑病、白癜风、荨麻疹、体癣、皮肤瘙痒、脱发、毛发改变、红斑、甲沟炎及甲裂、皮肤干燥、超敏反应以及牛皮癣)、与egfr被抑制相关的口腔上皮细胞疾病(例如,天疱疮、唇疱疹、疱疹性口炎、肉芽肿性唇炎、口腔溃疡、类天疱疮、舍格林氏综合征、贝赫切特综合征以及口腔结节病等)、与egfr被抑制相关的胃上皮细胞疾病(例如,胃炎、肠化生、胃穿孔、胃瘘、胃溃疡以及胃肠道息肉)或与egfr被抑制相关的小肠上皮细胞疾病(例如,肠炎、克罗恩病、肠穿孔、肠瘘、肠溃疡、溃疡性结肠炎以及nsaids肠病)。
[0146]
本技术提供了一种预防或治疗皮疹的方法。
[0147]
在本技术中,所述与egfr功能异常相关的皮疹可以包括与egfr功能异常相关的寻
常痤疮(acne vulgaris)、与egfr功能异常相关的丘疹性皮疹(papulopustular rash)与egfr功能异常相关的玫瑰痤疮(acne rosacea)、与egfr功能异常相关的瘙痒性皮疹(pruritus rash)、与egfr功能异常相关的痤疮样皮疹(acneiform rash)与egfr功能异常相关的蜂窝织炎(cellulitis)、与egfr功能异常相关的莱姆病(lyme disease)、与egfr功能异常相关的过敏反应(allergic reaction)、与egfr功能异常相关的化脓性汗腺炎(hidradenitis suppurativa)、与egfr功能异常相关的麻疹(hives)、与egfr功能异常相关的皮炎(dermatitis)、与egfr功能异常相关的乳痂(cradle cap)、与egfr功能异常相关的紫癜(purpura)、与egfr功能异常相关的玫瑰糠疹(pityriasis rosea)、与egfr功能异常相关的红斑(erythema)、与egfr功能异常相关的带状疱疹(shingles)、与egfr功能异常相关的瘀伤(bruise)和/或与egfr功能异常相关的黄瘤(xanthelasma)、与egfr功能异常相关的黑色素瘤(melanoma)、与egfr功能异常相关的基底细胞癌(basal cell carcinoma)、与egfr功能异常相关的鳞状细胞癌(squamous cell carcinoma)、与egfr功能异常相关的卡波西氏肉瘤(kaposi's sarcoma)、与egfr功能异常相关的环形红斑离心(erythema annulare centrifugum)、与egfr功能异常相关的毛囊炎、与egfr功能异常相关的滤泡性丘疹、与egfr功能异常相关的干燥病、与egfr功能异常相关的干燥性湿疹和/或与egfr功能异常相关的乳头脓疱疹。所述与egfr功能异常相关的皮疹可以指与施用egfr抑制剂相关的皮疹。
[0148]
在某些实施方式中,所述与egfr功能异常相关的副作用包括粘膜损伤疾病或病症。所述与egfr功能异常相关的副作用可以包括与施用egfr抑制剂相关的粘膜损伤疾病或病症。
[0149]
在某些实施方式中,所述粘膜损伤疾病或病症包括口腔粘膜、胃黏膜、小肠粘膜、直肠粘膜和/或鼻黏膜。在某些实施方式中,所述粘膜损伤疾病或病症包括口干、口腔黏膜炎、鼻衄、鼻咽炎、唇炎、口唇炎、食管黏膜炎、胃肠黏膜炎、胃溃疡、直肠黏膜炎、腹泻、呕吐、恶心、厌食、便秘和/或腹痛。在某些实施方式中,所述粘膜损伤疾病或病症包括口腔粘膜、胃黏膜、和/或小肠粘膜。例如,使腹泻或口唇炎。
[0150]
在某些实施方式中,所述与egfr功能异常相关的粘膜损伤疾病或病症包括与egfr功能异常相关的口干、与egfr功能异常相关的口腔黏膜炎、与egfr功能异常相关的鼻衄、与egfr功能异常相关的鼻咽炎、与egfr功能异常相关的唇炎、与egfr功能异常相关的口唇炎、与egfr功能异常相关的食管黏膜炎、与egfr功能异常相关的胃肠黏膜炎、与egfr功能异常相关的胃溃疡、与egfr功能异常相关的直肠黏膜炎、与egfr功能异常相关的腹泻、与egfr功能异常相关的呕吐、与egfr功能异常相关的恶心、与egfr功能异常相关的厌食、与egfr功能异常相关的便秘和/或与egfr功能异常相关的腹痛。
[0151]
化合物
[0152]
本技术提供了一种预防或治疗副作用的方法,所述方法包括施用式i所示的化合物或其药学上可接受的盐:
[0153]
式i,其中,环a为任意地被取代基取代或未取代的包含1-3个环的c4-c9环烷基或杂环基,r5选自氢原子、c
1-c6烷基、c
1-c6烷基磺酰基、c
2-c6烯基和c
2-c6炔基,其中所述烷基、烯基、炔基任选地被氘、羟基、氨基、卤素、氰基和/或硝基取代。
[0154]
在本技术中,术语“烷基”通常指包含1-20个碳原子的直链或支链饱和烃基取代基(例如,通过除去氢而从烃中获得的取代基);例如1-12个碳原子;在另一些实施方案中,碳原子数为1-10;在另一些实施方案中,为1-6个碳原子,在另一些实施方案中,为1-4个碳原子(比如1,2,3或更多碳原子)。取代基的实例包括:例如,甲基、乙基、丙基(包括正丙基和异丙基),丁基(包括正丁基,异丁基,仲丁基和叔丁基),戊基,异戊基,己基等。在某些情况下,烃基取代基(即烷基,烯基,环烷基,芳基等)中的碳原子数用前缀“c
a-c
b”表示,其中a为最小,b为最大的取代基中的碳原子数。因此,例如,“c
1-c6烷基”是指含有1至6个碳原子的烷基取代基,可包括直链或支链的甲基、乙基、丙基、丁基、戊基和己基。
[0155]
在本技术中,术语“环烷基”通常指通过从饱和碳环分子中除去氢并具有3-14个碳原子的碳原子而获得的碳环取代基。在一些实施方案中,一个环烷基取代基具有3-10个碳原子。环烷基可以是单环,其通常包含4-7个环原子。环烷基包括环丙基、环丁基、环戊基和环己基。环烷基也可以是稠合在一起的2-3个环,也可以称为“双环烷基”。在本技术中,术语“环烷基”还包括稠合至c
6-c
10
芳环或5-10元杂芳族环的取代基,其中具有这种稠合的环烷基作为取代基的基团结合至环烷基的碳原子上。当这种稠合的环烷基被一个或多个取代基取代时,除非另有说明,一个或多个取代基各自键合至环烷基的碳原子上。稠合的c
6-c
10
芳环或5-10元杂芳环可任选被进一步取代。
[0156]
在本技术中,术语“烯基”通常是指含有至少一个碳-碳双键的直链和支链脂肪族烃基。“c
1-c6烯基”是指含有1至6个碳原子的烯基取代基,可包括直链或支链的乙烯基、丙烯基、丁烯基、戊烯基和己烯基。在本技术中,术语“炔基”通常是指含有至少一个碳-碳三键的直链和支链脂肪族烃基。“c
1-c6炔基”是指含有1至6个碳原子的炔基取代基,可包括直链或支链的乙炔基、丙炔基、丁炔基、戊炔基和己炔基。
[0157]
在本技术中,术语“氘”通常指氢的一种稳定形态同位素,又称重氢,元素符号一般为d或2h。它的原子核由一个质子和一个中子组成。在本技术中,术语“羟基”通常指化学式为-oh的基团。在本技术中,术语“氨基”通常指化学式为-nh2的基团。在本技术中,术语“氰基”通常指化学式为-cn的基团。在本技术中,术语“硝基”通常指硝酸分子中去掉一个羟基后剩下的基团。在本技术中,术语“卤素”通常包括氟、氯、溴和碘。在本技术中,术语“氢”通常指氢取代基,可能被描述为-h。在本技术中,术语“氧”通常指氧取代基,可能被描述为-o-。
[0158]
在本技术中,术语“取代基”“自由基”和“基团”可以互换使用。
[0159]
如果取代基被描述为是“任选地被取代”,则该取代基可以是:(1)未取代的或(2)取代的。如果取代基的碳被描述为任选地被一个或多个取代基取代,则该碳上的一个或多
个氢(就存在的程度而言)可以分别和/或一起被独立选择的任选取代基取代。如果取代基的氮被描述为任选地被一个或多个取代基取代,则该氮上的一个或多个氢(就存在的程度而言)可以各自被独立选择的任选取代基取代。一个示例性的取代基可以被描述为
–
nr’r”,其中r’和r”与它们所连接的氮原子一起可以形成包含1或2个独立地选自氧、氮和硫的杂原子的杂环,其中所述杂环烷基部分可以任选地被取代。由r’和r”与它们所连接的氮原子一起形成的杂环可以是部分或完全饱和的,或者是芳香族的。
[0160]
在本技术中,术语“式i”可以称为“式i化合物”,“式i所示的化合物”。这样的术语也被定义为包括式i化合物的所有形式,包括水合物,溶剂合物,异构体,结晶和非结晶形式,同晶型,多晶型和代谢物。例如,式i化合物或其药学上可接受地盐,可以未溶剂化和溶剂化地形式存在。当溶剂或水的结合力较强时,配合物具有明确地化学计量,其不受湿度影响。但是,当溶剂或水的结合力较弱时,例如在通道溶剂化物和吸湿性化合物中,水/溶剂的含量将取决于湿度和干燥条件,在这种情况下,非化学计量是常态。
[0161]“式i化合物”可具有不对称碳原子。在本技术中,式i化合物的碳-碳键可用实线,实心楔形或点状楔形表示。使用实线描绘与不对称碳原子的键表示包括该碳原子上的所有可能的立体异构体(例如特定对映异构体,外消旋混合物等)。本技术的化合物可能包含一个以上的不对称碳原子。在这些化合物中,使用实线表示与不对称碳原子的键意在表明所有可能的立体异构体均应包括在内。例如,除非另有说明,否则意指式i化合物可以对映体和非对映体或作为外消旋体和混合物存在。表示使用实线描绘与式i化合物中一个或多个不对称碳原子的键,以及使用实心或虚线楔形描述与同一化合物中其他不对称碳原子的键表明存在非对映异构体的混合物。
[0162]
本技术的化合物可以以包合物或其他配合物的形式存在。在本发明的范围内包括复合物,例如包合物,药物-宿主包合复合物,其中与上述溶剂化物相反,药物和主体以化学计量或非化学计量的量存在。还包括式i的配合物,其含有两种或更多种可以化学计量或非化学计量的有机和/或无机组分。所得的络合物可以被电离,部分被电离或未被电离。
[0163]
式i的立体异构体包括顺式和反式异构体,光学异构体,例如r和s对映异构体,非对映异构体,几何异构体,旋转异构体,构象异构体和互变异构体,式i化合物,包括表现出一种以上类型异构性的化合物;及其混合物(例如外消旋体和非对映体对)。还包括其中抗衡离子具有旋光性的酸加成盐或碱加成盐,例如d-乳酸酯或l-赖氨酸,或外消旋体,例如dl-酒石酸酯或dl-精氨酸。
[0164]
当任何外消旋物结晶时,可能有两种不同类型的晶体。第一类是上述外消旋化合物(真正的外消旋体),其中产生了一种均质形式的晶体,其中含有等摩尔量的两种对映异构体。第二类是外消旋混合物或团聚体,其中以等摩尔量产生两种形式的晶体,每种形式包含单个对映体。
[0165]
式i化合物可以表现出互变异构现象和结构异构现象。例如,式i化合物可以几种互变异构形式存在,包括烯醇和亚胺形式,以及酮和烯胺形式,以及几何异构体及其混合物。所有这些互变异构形式都包括在式i化合物的范围内。互变异构体以互变异构体的混合物形式存在于溶液中。在固体形式中,通常一个互变异构体占主导。即使可以描述一个互变异构体,本发明也包括式i化合物的所有互变异构体。
[0166]
本发明还包括同位素标记的化合物,其与式i中所述相同,但其一个或多个原子被
具有不同于自然界已发现的原子质量或质量数的原子取代。可加入式i化合物的同位素包括氢,碳,氮,氧,磷,氟和氯的同位素,例如但不限于:2h、3h、
13
c、
14
c、
15
n、
18
o、
17
o、
31
p、
32
p、
35
s、
18
f和
36
cl。某些同位素标记的式i化合物,例如其中加入放射性同位素(如3h和
14
c),由于其易于制备和可检测性,可用于药物和/或底物组织分布测定。较重的同位素如2h,由于其较大的代谢稳定性,例如在体内半衰期延长或剂量要求降低,可以提供某些治疗上的优势。同位素标记的式i化合物通常可通过用同位素标记的试剂代替非同位素标记的试剂制备。
[0167]
本技术的化合物可以以衍生自无机或有机酸的盐的形式使用。某些化合物由于具有一种或多种盐的物理性质,具有如在不同温度和湿度下增强的药物稳定性,或在水/油中的所需溶解度的优势。在某些情况下,化合物的盐也可以用作化合物的分离,纯化和/或解析的助剂。
[0168]
在某些情形中,本技术所述化合物的药学上可接受的盐可以是枸橼酸盐。例如,本技术的所述化合物可以是化合物i-a的枸橼酸盐。
[0169]
在本技术中,式i中的环a可以为任意的包含1-3个环的c
4-c9环烷基,或1-3个环的c
4-c9的杂环基,杂环烷基中的杂原子可以是一个或多个氮原子,所述环烷基或杂环基可以任选地被取代基取代,所述取代基可以选自氢原子、c
1-c6烷基、c
2-c6烯基和c
2-c6炔基、酰基和氰基,其中前述的取代基可以进一步任选地被卤素、c
1-c6烷基、c
2-c6炔基、c
2-c6炔基和/或氰基取代。
[0170]
例如,所述式i中的环a可以为任选地被取代基取代或未取代的单环的c
4-c7环烷基或单环的c
4-c7杂环基,杂环烷基中的杂原子可以是一个或多个氮原子,其中所述取代基可以选自氢原子、c
1-c6烷基、c
2-c6烯基和c
2-c6炔基、酰基和氰基,其中前述的取代基可以进一步任选地被卤素、c
1-c6烷基、c
2-c6炔基、c
2-c6炔基和/或氰基取代。
[0171]
例如,所述式i中的所述环a可以为其中,所述r1可以选自氢原子、c
1-c6烷基、c
2-c6烯基和c
2-c6炔基,r2可以为-c(o)-r4,其中所述r4可以选自c
1-c6烷基、c
2-c6烯基、c
2-c6炔基和氰基,所述烷基、烯基、炔基、氰基可以进一步任选地被c
1-c6烷基、c
2-c6烯基、c
2-c6炔基和氰基取代。
[0172]
例如,所述式i中的所述环a可以为其中,所述r1可以选自c
1-c6烷基或氢原子,r2可以选自-c(o)-ch=ch2和-c(o)-ch
2-cn。
[0173]
例如,所述式i中的所述环a可以为其中,所述r1可以为甲基或氢原子,r2可以选自-c(o)-ch=ch2和-c(o)-ch
2-cn。
[0174]
例如,所述式i中的所述环a可以为
[0175]
在本技术中,式i中的环a可以是其中,所述r3可以选自氢原子、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、酰基、氨基和/或磺酸基,且所述c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、酰基、氨基或磺酸基可以进一步被一个或多个c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、酰基、氨基和/或磺酸基取代。
[0176]
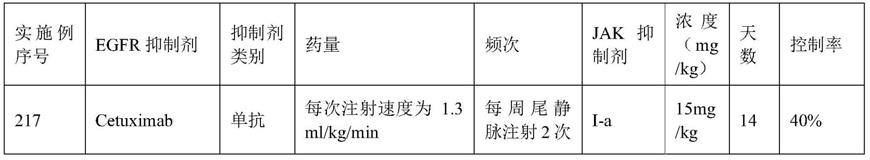
例如,式i中的环a可以是其中,所述r3可以为其中,所述r6可以选自c
1-c6烷基。
[0177]
例如,式i中的环a可以是其中,所述r3可以为
[0178]
例如,式i中的环a可以是
[0179]
在本技术中,式i中的所述环a可以为任意地被取代基取代或未取代的c
5-c
10
的二环烷基或二环杂烷基,所述二环烷基或二环杂烷基任选地被取代基取代。
[0180]
在本技术中,术语“二环”通常是指具有两个连接环的分子。二环化合物可以是碳环的(所有环原子都是碳),也可以是杂环的(环原子由至少两个元素组成),而且,两个环都可以是脂肪族的,或者可以是芳族的,或脂族和芳族的组合。二环的两个环之间的连接方式可以包含:两个环仅共享一个原子,两个环共享两个相邻的原子(两个环共享一个共价键,即所谓的桥头原子直接连接),或,两个环共享三个或三个以上的原子,并通过包含至少一个原子的桥将两个桥头原子隔开。
[0181]
在本技术中,式i中的所述环a可以为两个环共享两个相邻的原子的二环。在本技术中,式i中的所述环a可以为杂环,所述杂原子可以是氮原子。
[0182]
例如,所述环a可以是其中,所述r8可以为-c(o)r7或-(ch2)
n-c(o)or7,其中所述r7可以选自氢原子、c
1-c6烷基、c
1-c6烷氧基、c
2-c6烯基、5至10元杂芳基和氨基,所述c
1-c6烷基、c
1-c6烷氧基、c
2-c6烯基和5至10元杂芳基和氨基可以进一步任选地被c
1-c6烷基、c
1-c6烷氧基、c
2-c6烯基和/或5至10元杂芳基取代。
[0183]
例如,所述环a可以是其中,所述r8可以为-c(o)r7,且所述r7可以
为其中,环b可以为5至7元杂芳基,任选地被r9取代,所述r9可以选自氢原子、c
1-c6烷基、c
1-c6烷氧基和c
2-c6烯基。
[0184]
例如,所述环a可以是其中,所述r8可以为-c(o)r7,且所述r7可以为其中,环b可以为5元杂芳基,任选地被r9取代,所述r9选自氢原子、c
1-c6烷基、c
1-c6烷氧基和c
2-c6烯基。例如,所述环a可以是
[0185]
例如,所述环a可以是其中,所述r8可以为-c(o)r7,且所述r7可以为其中,环b可以为所述r9选自氢原子、c
1-c6烷基。
[0186]
例如,,所述环a可以是
[0187]
在本技术中,式i中的r5可以选自氢原子、c
1-c6烷基、c
1-c6烷基磺酰基、c
2-c6烯基和c
2-c6炔基,其中所述烷基、烯基、炔基可以任选地被氘、羟基、氨基、卤素、氰基和/或硝基取代。所述烷基磺酰基是指被磺酰基取代的烷基。
[0188]
例如,式i中的所述r5可以选自氢原子和c
1-c6烷基。例如,所述r5可以选自氢原子和甲基。
[0189]
在本技术中,式i所述的化合物可以选自化合物i-a、i-b、i-c和i-d:
[0190]
[0191]
方法
[0192]
本技术提供了一种预防或治疗egfr功能异常相关的副作用的方法,所述方法包括向受试者施用上文所述的式i所示的化合物。
[0193]
本技术中使用的术语“预防”通常是指预防疾病或其一种或多种症状的发作,复发或扩散。在本技术中“预防”可以与“预防性治疗”互换使用。在某些实施方案中,“预防”通常是指在症状发作之前,在有或没有本技术所述的其他药物的情况下,向患有本技术所述的疾病或病症的患者提供本技术所述的药物的治疗。
[0194]
本技术中使用的术语“治疗”通常是指消除或改善疾病,或与疾病相关的一种或多种症状。在一些实施方式中,治疗通常是指通过向患有这种疾病的患者施用一种或多种治疗剂而使得疾病消除或缓解。在一些实施方式中,“治疗”可以是在特定疾病的症状发作后,在其他治疗剂存在或不存在的情况下施用药物。
[0195]
本技术中使用的术语“受试者”通常是指需要诊断、预后、改善、预防和/或治疗疾病的人或非人动物(包括哺乳动物),特别是需要式i所示化合物治疗或预防的那些受试者。
[0196]
在一些实施方式中,所述受试者可以包括癌症患者。例如,所述癌症患者可以曾经、正在和/或将来被施用egfr抑制剂。例如,所述egfr抑制剂可以为本技术所述的egfr抑制剂。
[0197]
在一些实施方式中,所述受试者可以是人或非人哺乳动物。非人哺乳动物可以包括任何除人之外的哺乳动物物种,例如家畜动物(例如,牛、猪、羊、鸡、兔或马),或啮齿类动物(例如,大鼠和小鼠),或灵长类动物(例如,大猩猩和猴子),或家养动物(例如,狗和猫)。
[0198]
在一些实施方式中,在施用了本技术的式i所示化合物后,受试者的所述egfr功能异常引起的副作用的严重程度得到了缓解。在一些实施方式中,所述缓解可以是依据nci-ctcae v5.0的分级标准进行判断的,例如,所述受试者的上皮组织疾病的严重程度从5级降低至1级(例如,5级降低至4级、5级降低至3级、5级降低至2级,4级降低至3级、4级降低至2级、4级降低至1级、3级降低至2级、3级降低至1级或2级降低至1级)。在一些实施方式中,所述缓解通常可以指所述受试者的所述egfr功能异常引起的副作用的发作或发展被推迟。
[0199]
在一些实施方案中,向需要受试者施用有效量的本技术所述的式i所示的化合物,能够使得受试者的皮疹、腹泻或口唇炎的严重程度从5级降低至1级(例如,5级降低至4级、5级降低至3级、5级降低至2级,4级降低至3级、4级降低至2级、4级降低至1级、3级降低至2级、3级降低至1级或2级降低至1级)。
[0200]
在一些实施方案中,在本技术的方法中的式i所示的化合物可以是并且预防或者治疗的egfr功能异常相关的副作用是皮疹、腹泻或口唇
炎。在一些实施方案中,向需要其的受试者施用有效量的能够使得受试者的皮疹、腹泻或口唇炎的严重程度从5级降低至1级(例如,5级降低至4级、5级降低至3级、5级降低至2级,4级降低至3级、4级降低至2级、4级降低至1级、3级降低至2级、3级降低至1级或2级降低至1级)。
[0201]
在一些实施方案中,在本技术的方法中的式i所示的化合物可以是并且预防或者治疗的egfr功能异常相关的副作用是皮疹、腹泻或口唇炎。在一些实施方案中,向需要其的受试者施用有效量的能够使得受试者的皮疹、腹泻或口唇炎的严重程度从5级降低至1级(例如,5级降低至4级、5级降低至3级、5级降低至2级,4级降低至3级、4级降低至2级、4级降低至1级、3级降低至2级、3级降低至1级或2级降低至1级)。
[0202]
在一些实施方案中,在本技术的方法中的式i所示的化合物可以是并且预防或者治疗的egfr功能异常相关的副作用是皮疹、腹泻或口唇炎。在一些实施方案中,向需要其的受试者施用有效量的能够使得受试者的皮疹、腹泻或口唇炎的严重程度从5级降低至1级(例如,5级降低至4级、5级降低至3级、5级降低至2级,4级降低至3级、4级降低至2级、4级降低至1级、3级降低至2级、3级降低至1级或2级降低至1级)。
[0203]
在一些实施方案中,在本技术的方法中的式i所示的化合物可以是
并且预防或者治疗的egfr功能异常相关的副作用是皮疹、腹泻或口唇炎。在一些实施方案中,向需要其的受试者施用有效量的能够使得受试者的皮疹、腹泻或口唇炎的严重程度从5级降低至1级(例如,5级降低至4级、5级降低至3级、5级降低至2级,4级降低至3级、4级降低至2级、4级降低至1级、3级降低至2级、3级降低至1级或2级降低至1级)。
[0204]
本技术中使用的术语“有效量”通常是指可以缓解或者消除受试者的疾病或症状,或者可以预防性地抑制或防止疾病或症状发生的药物的量。有效量可以是将受试者的一种或多种疾病或症状缓解到一定程度的药物的量;可以将那些跟疾病或症状成因相关的一种或多种生理或生物化学参数部分或完全恢复到正常的药物的量;和/或可以降低疾病或症状发生的可能性的药物的量。
[0205]
本技术所述的式i所示的化合物可以通过本领域已知的给药方式给药,例如注射给药(例如,皮下、腹腔、关节内、动脉内、鞘内、胸骨内、鞘内、病灶内、颅内、肌肉、皮内以及静脉推注或者滴注)或非注射给药(例如,口服、鼻腔、舌下、阴道、直肠或外用给药)。本技术的式i所示的化合物可以以药物组合或试剂盒的形式施用。
[0206]
在本技术中,所述式i所示的化合物可以被制备为适用于透皮给药。
[0207]
在一些实施方式中,本技术提供的式i所示的化合物的浓度可以为约0.0001%(w/w)至约50%(w/w),例如,约0.0001%(w/w)至约40%(w/w)、约0.0001%(w/w)至约30%(w/w)、约0.0001%(w/w)至约20%(w/w)、约0.0001%(w/w)至约10%(w/w)、约0.0001%(w/w)至约5%(w/w)、约0.0001%(w/w)至约1%(w/w)、约0.0001%(w/w)至约0.5%(w/w)、约0.0001%(w/w)至约0.1%(w/w)、约0.0001%(w/w)至约0.05%(w/w)、约0.0001%(w/w)至约0.01%(w/w)、约0.0001%(w/w)至约0.005%(w/w)、或约0.0001%(w/w)至约0.005%(w/w)。
[0208]
例如,本技术提供的式i所示的化合物的浓度可以为约0.02%(w/w)至约10%(w/w),例如,约0.002%(w/w)至约0.2%(w/w)、约0.002%(w/w)至约1%(w/w)、约0.002%(w/w)至约2%(w/w)、约0.002%(w/w)至约3%(w/w)、约0.002%(w/w)至约1.5%(w/w)、约0.002%(w/w)至约0.5%(w/w)、约0.002%(w/w)至约5%(w/w)、约0.002%(w/w)至约8%(w/w)、约0.02%(w/w)至约5%(w/w)、约0.5%(w/w)至约3%(w/w)、约1.5%(w/w)至约5%(w/w)或约0.5%(w/w)至约5%(w/w)。
[0209]
在本技术中,所述式i所示的化合物可以被制备为适用于局部给药。
[0210]
在本技术中,所述药物或所述jak抑制剂可以被制备为适用于透皮给药。在本技术中,所述药物或所述jak抑制剂可以被制备为适用于局部给药。在一些实施方式中,所述药物或所述jak抑制剂被制备为用于局部皮肤施用。例如在本技术中,所述药物或所述jak抑制剂可以被制备为乳膏、洗液、凝胶、软膏、油膏、喷剂、脂质体制剂、擦剂和/或气雾剂。本技术中,透皮给药的剂型,可以是溶液型透皮制剂(乳膏、凝胶、软膏、糊剂等),也可以是混悬型透皮制剂(乳膏、凝胶、软膏、糊剂等)。
[0211]
在一些实施方式中,所述局部给药的给药部位可以不为癌症的发生部位或癌症的潜在转移部位。例如,所述给药部分可以不为癌症的原发部位。又例如,所述给药部分可以不为癌症的转移部位。例如,所述转移部位可以包括淋巴转移、血管转移和/或种植性转移导致的癌症转移的发生部位。在一些实施方式中,所述转移部位可以包括骨、脑、肝、胃和/或肺。又例如,所述给药部分可以不为癌症的复发部位。
[0212]
在本技术中,所述式i所示的化合物可以被制备为适用于注射给药。在本技术中,所述式i所示的化合物还可以被制备为适用于胃肠道给药。
[0213]
在一些实施方式中,本技术提供的式i所示的化合物的有效剂量可以为约0.001mg/kg到约3000mg/kg之间给药(例如,约0.01mg/kg到约2000mg/kg、约0.05mg/kg到约1000mg/kg、约0.01mg/kg到约10mg/kg、约0.02mg/kg到约10mg/kg、约0.05mg/kg到约10mg/kg、约0.1mg/kg到约10mg/kg、约0.15mg/kg到约10mg/kg、约0.2mg/kg到约10mg/kg、约0.25mg/kg到约10mg/kg、约0.3mg/kg到约10mg/kg、约0.35mg/kg到约10mg/kg、约0.4mg/kg到约10mg/kg、约0.45mg/kg到约10mg/kg、约0.5mg/kg到约10mg/kg、约0.55mg/kg到约10mg/kg、约0.6mg/kg到约10mg/kg、约0.65mg/kg到约10mg/kg、约0.7mg/kg到约10mg/kg、约0.75mg/kg到约10mg/kg、约0.8mg/kg到约10mg/kg、约0.85mg/kg到约10mg/kg、约0.9mg/kg到约10mg/kg、约0.95mg/kg到约10mg/kg、约1mg/kg到约10mg/kg、约2mg/k到约10mg/kg、约5mg/k到约10mg/kg、约6mg/kg到约10mg/kg、约8mg/kg到约10mg/kg、约9mg/kg到约10mg/kg、约10mg/kg到约50mg/kg、约10mg/kg到约100mg/kg、约10mg/kg到约500mg/kg、约10mg/kg到约1000mg/kg、约10mg/kg到约2000mg/kg或约10mg/kg到约3000mg/kg)。
[0214]
在一些实施方式中,本技术提供的式i所示的化合物的有效剂量可以为约0.1mg/kg到约150mg/kg之间给药(例如,约0.1mg/kg到约120mg/kg、约0.1mg/kg到约100mg/kg、约0.1mg/kg到约5mg/kg、约0.1mg/kg到约10mg/kg、约0.1mg/kg到约15mg/kg、约0.1mg/kg到约20mg/kg、约0.1mg/kg到约50mg/kg、约0.1mg/kg到约30mg/kg、约0.1mg/kg到约60mg/kg、约0.1mg/kg到约75mg/kg、约0.1mg/kg到约100mg/kg、约10mg/kg到约120mg/kg、约1mg/kg到约100mg/kg、约10mg/kg到约5mg/kg、约10mg/kg到约10mg/kg、约10mg/kg到约20mg/kg、约10mg/kg到约50mg/kg、约10mg/kg到约75mg/kg或约10mg/kg到约100mg/kg)。
[0215]
在一些实施方式中,所述式i所示的化合物以约5mg/kg或更少的剂量给药。在一些实施方式中,给药剂量为1mg/kg或更少、0.5mg/kg或更少、0.1mg/kg或更少、0.05mg/kg或更少或0.01mg/kg或更少。某一特定剂量可分为多次间隔给药,例如每天一次、每天两次或更多、每周一次、每两周一次、每三周一次、每月一次或每两月或更多月一次。例如,所述特定剂量可以为每天一次。
[0216]
在一些实施方案中,本技术所述的式i所示的化合物可以与egfr抑制剂共同施用。在一些实施方式中,所述式i所示的化合物可以在受试者接受了egfr抑制剂之前、同时或者
之后施用。在某些实施方案中,所述式i所示的化合物可以作为多剂量方案的一部分与egfr抑制剂分别施用。在一些实施方案中,所述式i所示的化合物可以与egfr抑制剂可以同时给药。在同时给药的实施方式中,这些式i所示的化合物可以是单一剂型的一部分,其与目前公开的egfr抑制剂混合成为单一组合物。在另一些实施方案中,这些式i所示的化合物可以作为单独的剂量给予,与egfr抑制剂大约同时施用。
[0217]
在所述式i所示的化合物与egfr抑制剂间隔给药的实施方式中,所述式i所示的化合物可以在施用egfr抑制剂之前或之后间隔给药。所述间隔的时间可以为1分钟、2分钟、5分钟、10分钟、20分钟、30分钟、45分钟、1小时、2小时、3小时、4小时、5小时、6小时、12小时、18小时、1天、2天、3天、1周、2周、3周、1个月、2个月、3个月或更长。
[0218]
在一些实施方案中,本技术所述的egfr抑制剂可以与式i所示的化合物以相同的给药途径给药或者以不同的给药途径给药。
[0219]
药物组合物和试剂盒
[0220]
在一些实施方式中,式i所示的化合物或其药学上可接受的盐可以作为药物或药物组合的一部分而被施用。
[0221]
在一些实施方式中,所述药物可包括式i所示的化合物或其药学上可接受的盐和一种或多种药学上可接受的载体。
[0222]
在一些实施方式中,所述药物组合或试剂盒可包含1)egfr抑制剂;以及2)式i所示的化合物或其药学上可接受的盐。在一些实施方式中,所述egfr抑制剂可以与所述式i所示的化合物或其药学上可接受的盐彼此不混合。例如,所述egfr抑制剂可以与所述式i所示的化合物或其药学上可接受的盐各自独立地存在于单独的容器中。例如,所述egfr抑制剂可以被分装在一个试剂瓶中,而所述式i所示的化合物或其药学上可接受的盐可以被分装在另一个试剂瓶中。
[0223]
在本技术的所述药物组合或试剂盒中,2)中的所述式i所示的化合物或其药学上可接受的盐可以预防或治疗1)中的所述egfr抑制剂引起的疾病或病症。
[0224]
在本技术的所述药物组合或试剂盒中,2)中的所述式i所示的化合物或其药学上可接受的盐基本上不影响1)中的所述egfr抑制剂的治疗效果。
[0225]
在本技术中,所述“基本上不影响”可以指,与单独使用所述egfr抑制剂的治疗效果相比,使用所述药物组合或试剂盒的2)中的所述式i所示的化合物或其药学上可接受的盐和1)中的所述式i所示的化合物或其药学上可接受的盐的治疗效果相当,或者不产生显著的劣势。例如,对任意的受试者,与单独使用式i所示的化合物或其药学上可接受的盐的治疗效果相比,使用所述药物组合或试剂盒的2)中的所述式i所示的化合物或其药学上可接受的盐和1)中的所述式i所示的化合物或其药学上可接受的盐导致的肿瘤体积减少的程度是相同的,或者,减少的程度不小于约5%、不小于约4%、不小于约3%、不小于约2%、不小于约1%、不小于约0.5%、不小于约0.1%、不小于约0.01%、不小于约0.001%或更小。
[0226]
在本技术的所述药物组合或试剂盒中,2)中的所述式i所示的化合物或其药学上可接受的盐用于在施用1)中的所述egfr抑制剂之前、同时或者之后施用。
[0227]
另一方面,本技术提供了一种方法,所述方法包括下述步骤:
[0228]
1)监测被施用egfr抑制剂的受试者的皮疹副作用;
[0229]
2)当所述监测显示所述受试者出现与施用所述egfr抑制剂相关的皮疹副作用时,
向所述受试者施用本技术式i所示的化合物或其药学上可接受的盐。
[0230]
另一方面,本技术还提供了以下实施方式:
[0231]
1.式i所示的化合物或其药学上可接受的盐在制备药物中的用途,所述药物用于预防和/或治疗受试者中与egfr功能异常相关的副作用:
[0232]
式i,其中,环a为任意地被取代基取代或未取代的包含1-3个环的c
4-c9环烷基或杂环基,r5选自氢原子、c
1-c6烷基、c
1-c6烷基磺酰基、c
2-c6烯基和c
2-c6炔基,其中所述烷基、烯基、炔基任选地被氘、羟基、氨基、卤素、氰基和/或硝基取代。
[0233]
2.根据实施方式1所述的用途,其中所述环a为任选地被取代基取代或未取代的单环的c
4-c7环烷基或杂环基。
[0234]
3.根据实施方式1-2中任一项所述的用途,其中所述环a为单环的c
4-c7环烷基、单环的c
4-c7含氮杂环基,所述环烷基或含氮杂环基任选地被一个或多个取代基取代。
[0235]
4.根据实施方式1-3中任一项所述的用途,其中所述环a为其中,所述r1选自氢原子、c
1-c6烷基、c
2-c6烯基和c
2-c6炔基,r2选自氢原子、c
1-c6烷基、c
1-c6烯基、c
1-c6炔基、酰基和氰基,其中所述烷基、烯基、炔基、酰基任选地被卤素、c
1-c6烷基、c
2-c6炔基、c
2-c6炔基和/或氰基取代。
[0236]
5.根据实施方式4所述的用途,其中所述r1选自c
1-c6烷基和氢原子。
[0237]
6.根据实施方式4-5中任一项所述的用途,其中所述r1为甲基或氢原子。
[0238]
7.根据实施方式4-6中任一项所述的用途,其中所述r2为-c(o)-r4,其中所述r4选自c
1-c6烷基、c
2-c6烯基、c
2-c6炔基和氰基,所述烷基、烯基、炔基、氰基进一步任选地被c
1-c6烷基、c
2-c6烯基、c
2-c6炔基和氰基取代。
[0239]
8.根据实施方式4-7中任一项所述的用途,其中所述r2选自-c(o)-ch=ch2和-c(o)-ch
2-cn。
[0240]
9.根据实施方式1-8中任一项所述的用途,其中所述环a为其中,所述r3选自氢原子、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、酰基、氨基和/或磺酸基,所述c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、酰基、氨基或磺酸基进一步被一个或多个c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、酰基、氨基和/或磺酸基取代。
[0241]
10.根据实施方式9所述的用途,其中所述r3为其中,所述r6选自c
1-c6烷基。
[0242]
11.根据实施方式9-10中任一项所述的用途,其中所述r3为
[0243]
12.根据实施方式1-11中任一项所述的用途,其中所述环a为任意地被取代基取代或未取代的c
5-c
10
的二环烷基或二环杂烷基,所述二环烷基或二环杂烷基任选地被取代基取代。
[0244]
13.根据实施方式1-12中任一项所述的用途,其中所述环a为其中,所述r8为-c(o)r7或-(ch2)
n-c(o)or7,其中所述r7选自氢原子、c
1-c6烷基、c
1-c6烷氧基、c
2-c6烯基、5至10元杂芳基和氨基,所述c
1-c6烷基、c
1-c6烷氧基、c
2-c6烯基和5至10元杂芳基和氨基进一步任选地被c
1-c6烷基、c
1-c6烷氧基、c
2-c6烯基和/或5至10元杂芳基取代。
[0245]
14.根据实施方式13所述的用途,其中所述r8为-c(o)r7,且所述r7为其中,环b为5至7元杂芳基,任选地被r9取代,所述r9选自氢原子、c
1-c6烷基、c
1-c6烷氧基和c
2-c6烯基。
[0246]
15.根据实施方式14所述的用途,其中所述环b为5元杂芳基,任选地被r9取代,所述r9选自氢原子、c
1-c6烷基、c
1-c6烷氧基和c
2-c6烯基。
[0247]
16.根据实施方式14-15中任一项所述的用途,其中所述环b为所述r9为c
1-c6烷氧基。
[0248]
17.根据实施方式16所述的用途,其中所述r9为-o-ch3。
[0249]
18.根据实施方式1-17中任一项所述的用途,其中所述r5选自氢原子和c
1-c6烷基。
[0250]
19.根据实施方式1-18中任一项所述的用途,其中所述r5选自氢原子和甲基。
[0251]
20.根据实施方式1-19中任一项所述的用途,其中所述式i所述的化合物选自化合物i-a、i-b、i-c和i-d:
[0252][0253]
21.根据实施方式1-20中任一项所述的用途,其中与egfr功能异常相关的副作用包括与egfr被抑制相关的副作用。
[0254]
22.根据实施方式1-21中任一项所述的用途,其中所述副作用由egfr被抑制直接引起的。
[0255]
23.根据实施方式1-22中任一项所述的用途,其中所述副作用由egfr抑制剂引起。
[0256]
24.根据实施方式1-23中任一项所述的用途,其中与egfr被抑制相关的副作用包括与egfr被抑制相关的上皮组织疾病。
[0257]
25.根据实施方式24所述的用途,其中与egfr被抑制相关的副作用包括与egfr被抑制相关的上皮组织疾病。
[0258]
26.根据实施方式25所述的用途,其中上皮组织疾病包括上皮细胞疾病和/或内皮细胞疾病。
[0259]
27.根据实施方式26所述的用途,其中所述上皮细胞包括皮肤上皮细胞、口腔上皮细胞、胃上皮细胞和/或小肠上皮细胞。
[0260]
28.根据实施方式1-27中任一项所述的用途,其中所述与egfr功能异常相关的副作用包括皮疹。
[0261]
29.根据实施方式28所述的用途,其中所述皮疹包括免疫性皮疹和/或非免疫性皮疹。
[0262]
30.根据实施方式1-29中任一项所述的用途,其中与egfr功能异常相关的皮疹包括与egfr功能异常相关的寻常痤疮(acne vulgaris)、与egfr功能异常相关的丘疹性皮疹(papulopustular rash)、与egfr功能异常相关的玫瑰痤疮(acne rosacea)、与egfr功能异常相关的瘙痒性皮疹(pruritus rash)、与egfr功能异常相关的痤疮样皮疹(acneiform rash)与egfr功能异常相关的蜂窝织炎(cellulitis)、与egfr功能异常相关的莱姆病(lyme disease)、与egfr功能异常相关的过敏反应(allergic reaction)、与egfr功能异常相关的化脓性汗腺炎(hidradenitis suppurativa)、与egfr功能异常相关的麻疹(hives)、与egfr功能异常相关的皮炎(dermatitis)、与egfr功能异常相关的乳痂(cradle cap)、与egfr功能异常相关的紫癜(purpura)、与egfr功能异常相关的玫瑰糠疹(pityriasis rosea)、与egfr功能异常相关的红斑(erythema)、与egfr功能异常相关的带状疱疹(shingles)、与egfr功能异常相关的瘀伤(bruise)和/或与egfr功能异常相关的黄瘤(xanthelasma)、与egfr功能异常相关的黑色素瘤(melanoma)、与egfr功能异常相关的基底细胞癌(basal cell carcinoma)、与egfr功能异常相关的鳞状细胞癌(squamous cell carcinoma)、与egfr功能异常相关的卡波西氏肉瘤(kaposi's sarcoma)、与egfr功能异常相关的环形红斑离心(erythema annulare centrifugum)、与egfr功能异常相关的毛囊炎、与egfr功能异常相关的滤泡性丘疹、与egfr功能异常相关的干燥病、与egfr功能异常相关的干燥性湿疹和/或与egfr功能异常相关的乳头脓疱疹。
[0263]
31.根据实施方式1-30中任一项所述的用途,其中所述与egfr功能异常相关的副作用包括粘膜损伤疾病或病症。
[0264]
32.根据实施方式31所述的用途,其中粘膜损伤疾病或病症包括口干、口腔黏膜炎、鼻衄、鼻咽炎、唇炎、口唇炎、食管黏膜炎、胃肠黏膜炎、胃溃疡、直肠黏膜炎、腹泻、呕吐、恶心、厌食、便秘、腹痛。
[0265]
33.根据实施方式31-32中任一项所述的用途,其中与egfr功能异常相关的粘膜损伤疾病或病症包括与egfr功能异常相关的口干、与egfr功能异常相关的口腔黏膜炎、与
egfr功能异常相关的鼻衄、与egfr功能异常相关的鼻咽炎、与egfr功能异常相关的唇炎、与egfr功能异常相关的口唇炎、与egfr功能异常相关的食管黏膜炎、与egfr功能异常相关的胃肠黏膜炎、与egfr功能异常相关的胃溃疡、与egfr功能异常相关的直肠黏膜炎、与egfr功能异常相关的腹泻、与egfr功能异常相关的呕吐、与egfr功能异常相关的恶心、与egfr功能异常相关的厌食、与egfr功能异常相关的便秘、与egfr功能异常相关的腹痛。
[0266]
34.根据实施方式1-33中任一项所述的用途,其中所述副作用的严重程度为依据nci-ctcae v5.0中的第1级或其以上、第2级或其以上、第3级或其以上、第4级或其以上,或者第5级。
[0267]
35.根据实施方式21-34中任一项所述的用途,其中与egfr被抑制相关的副作用包括与施用egfr抑制剂相关的副作用。
[0268]
36.根据实施方式35所述的用途,其中所述egfr抑制剂包括用于治疗癌症的药物。
[0269]
37.根据实施方式35-36中任一项所述的用途,其中所述egfr抑制剂直接作用于egfr蛋白和/或编码egfr蛋白的核酸。
[0270]
38.根据实施方式35-37中任一项所述的用途,其中所述egfr抑制剂包括小分子egfr抑制剂、特异性结合egfr的蛋白大分子、抑制egfr蛋白表达的rnai和/或抑制egfr蛋白表达的反义寡核苷酸。
[0271]
39.根据实施方式38所述的用途,其中所述小分子egfr抑制剂包括与egfr可逆结合的小分子egfr抑制剂、与egfr不可逆结合的小分子egfr抑制剂和/或特异性结合突变型egfr的小分子egfr抑制剂。
[0272]
40.根据实施方式35-39中任一项所述的用途,其中所述egfr抑制剂包括西妥昔单抗、吉非替尼、厄洛替尼、埃克替尼、sapitinib、阿法替尼、拉帕替尼、凡德替尼、来那替尼、brigatinib、帕尼单抗、耐昔妥珠单抗、尼妥珠单抗、tesevatinib、艾力替尼、席栗替尼、rociletinib、卡奈替尼、azd3759、yzj-0318、萘普替尼、naquotinib、pf-06747775、sph1188-11、poziotinib、依吡替尼、varlitinib、艾氟替尼、hm61713、ck-101、吡咯替尼、莱洛替尼、hs-10296、ap32788、西莫替尼、gma204、virlitinib、yinlitinib、那扎替尼、诺司替尼、奥莫替尼、奥希替尼、达克替尼、艾维替尼和/或eai045。
[0273]
41.根据实施方式35-40中任一项所述的用途,其中所述egfr抑制剂与一种或多种其他疗法联用。
[0274]
42.根据实施方式1-41中任一项所述的用途,其中所述受试者包括癌症患者。
[0275]
43.根据实施方式1-42中任一项所述的用途,其中所述受试者曾经、正在和/或将来被施用所述egfr抑制剂。
[0276]
44.根据实施方式1-43中任一项所述的用途,其中所述式i所示的化合物被制备为适用于透皮给药。
[0277]
45.根据实施方式1-44中任一项所述的用途,其中所述药物中所述式i所示的化合物的浓度为约0.0001%至约50%。
[0278]
46.根据实施方式1-45中任一项所述的用途,其中所述式i所示的化合物被制备为适用于胃肠道给药。
[0279]
47.根据实施方式1-46中任一项所述的用途,其中所述式i所示的化合物被制备为适用于注射给药。
[0280]
48.根据实施方式1-47中任一项所述的用途,其中所述式i所示的化合物有效剂量为0.001mg/kg体重/天至3000mg/kg体重/天。
[0281]
49.实施方式1-48中任一项所述的用途,其中所述式i所示的化合物有效剂量为0.1mg/kg体重/天~150mg/kg体重/天。
[0282]
50.根据实施方式35-49中任一项所述的用途,其中所述药物基本上不影响所述egfr抑制剂的治疗效果。
[0283]
51.根据实施方式1-50中任一项所述的用途,其中所述药物中还包括一种或多种其他活性成分。
[0284]
52.化合物i-a、i-b、i-c和/或i-d及其药学上可接受的盐在制备药物中的用途,所述药物用于预防和/或治疗受试者中与egfr功能异常相关的副作用,
[0285][0286]
53.一种预防或治疗与egfr功能异常相关的副作用的方法,包括向有需要的受试者施用实施方式1-51中任一项所述的式i所示的化合物,或其药学上可接受的盐:式i,其中,环a为任意地被取代基取代或未取代的包含
1-3
个环的c
4-c9环烷基或杂环基,r5选自氢原子、c
1-c6烷基、c
1-c6烷基磺酰基、c
2-c6烯基和c
2-c6炔基,其中所述烷基、烯基或炔基任选地被氘、羟基、氨基、卤素、氰基和/或硝基取代。
[0287]
54.根据实施方式53所述的方法,其中所述受试者曾经、正在和/或将来被施用egfr抑制剂。
[0288]
55.一种预防或治疗与egfr功能异常相关的副作用的方法,包括向有需要的受试者施用化合物i-a、i-b、i-c和/或i-d,或其药学上可接受的盐。
[0289]
56.药物组合或试剂盒,其包含:1)egfr抑制剂;以及2)实施方式1-51中任一项所述的式i所示的化合物:式i,其中,环a为任意地被取代基取代或未取代的包含
1-3
个环的c
4-c9环烷基或杂环基,r5选自氢原子、c
1-c6烷基、c
1-c6烷基磺酰基、c
2-c6烯基和c
2-c6炔基,其中所述烷基、烯基或炔基任选地被氘、羟基、氨基、卤素、氰基和/或硝基取
代。
[0290]
57.根据实施方式56所述的药物组合或试剂盒,其中所述egfr抑制剂与所述式i所示的化合物彼此不混合。
[0291]
58.根据实施方式56-57中任一项所述的药物组合或试剂盒,其中所述egfr抑制剂与所述式i所示的化合物各自独立地存在于单独的容器中。
[0292]
59.根据实施方式56-58中任一项所述的药物组合或试剂盒,其中所述式i所示的化合物被制备为适用于透皮给药。
[0293]
60.根据实施方式56-59中任一项所述的药物组合或试剂盒,其中所述式i所示的化合物的浓度为约0.0001%至约50%。
[0294]
61.根据实施方式56-60中任一项所述的药物组合或试剂盒,其中所述式i所示的化合物被制备为适用于胃肠道给药。
[0295]
62.根据实施方式56-61中任一项所述的药物组合或试剂盒,其中所述式i所示的化合物被制备为适用于注射给药。
[0296]
63.根据实施方式56-62中任一项所述的药物组合或试剂盒,其中所述式i所示的化合物有效剂量为0.001mg/kg体重/天至3000mg/kg体重/天。
[0297]
64.实施方式56-63中任一项所述的药物组合或试剂盒,其中所述式i所示的化合物有效剂量为0.1mg/kg体重/天~150mg/kg体重/天。
[0298]
65.根据实施方式56-64中任一项所述的药物组合或试剂盒,其中2)中的所述式i所示的化合物能够预防或治疗与施用1)中的所述egfr抑制剂相关的疾病或病症。
[0299]
66.根据实施方式56-65中任一项所述的药物组合或试剂盒,其中2)中的所述式i所示的化合物基本上不影响1)中的所述egfr抑制剂的治疗效果。
[0300]
67.根据实施方式56-66中任一项所述的药物组合或试剂盒,其中在施用1)的所述egfr抑制剂之前、同时或者之后施用2)的所述式i所示的化合物。
[0301]
68.一种方法,所述方法包括下述步骤:
[0302]
1)监测被施用egfr抑制剂的受试者的副作用;
[0303]
2)当所述监测显示所述受试者出现与施用所述egfr抑制剂相关的副作用时,向所述受试者施用实施方式1-51中任一项所述的式i所示的化合物,或其药学上可接受的盐:式i,其中,环a为任选地被取代基取代或未取代的包含
1-3
个环的c
4-c9环烷基或杂环基,r5选自氢原子、c
1-c6烷基、c
1-c6烷基磺酰基、c
2-c6烯基和c
2-c6炔基,其中所述烷基、烯基、炔基任选地被氘、羟基、氨基、卤素、氰基和/硝基取代。
[0304]
69.根据实施方式68所述的方法,其还包括继续监控所述副作用,以及任选地减少或停用所述egfr抑制剂。
[0305]
70.根据实施方式68-69中任一项所述的方法,其中所述副作用的严重程度在所述施用egfr抑制剂之后增加。
[0306]
71.根据实施方式68-70中任一项所述的方法,其中在所述施用egfr抑制剂之前,所述受试者未患有所述副作用。
[0307]
72.根据实施方式68-71中任一项所述的方法,其中所述egfr抑制剂不包含所述式i所示的化合物。
[0308]
73.根据实施方式68-72中任一项所述的方法,其中施用所述egfr抑制剂来治疗癌症。
[0309]
74.根据实施方式68-73中任一项所述的方法,其中所述副作用的患处与癌症的患处不同。
[0310]
不欲被任何理论所限,下文中的实施例仅仅是为了阐释本技术的化合物、制备方法和用途等,而不用于限制本技术发明的范围。
[0311]
实施例
[0312]
实施例1-37:在大鼠动物模型上验证局部给药jak抑制剂预防小分子egfr抑制剂产生皮疹的实验
[0313]
构建大鼠动物模型。通过每日灌胃的方式给予6周雌性sd大鼠小分子egfr抑制剂,若干天后,大鼠的背部大面积出现皮疹(照片如图1所示)。出现皮疹的部位没有左右的差异,两侧出现皮疹的程度相似。与在人体上类似,大鼠在口服小分子egfr抑制剂之后面部、身上会产生皮疹。两者病因完全相同,而病症也非常相似。因此,大鼠是非常好的用于模拟egfr抑制剂引起的皮疹动物模型。
[0314]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验前一天将大鼠后背的毛发用电动剃发刀轻轻除去,然后进行灌胃给药试验。egfr抑制剂溶解在无菌水溶液中,用pbs缓冲溶液稀释,每次灌胃量不超过2ml,给药剂量如表1所示。实验分为jak抑制剂组和对照组。灌胃后,对jak抑制剂组大鼠的背部(约3cm*3cm)涂抹jak抑制剂的药膏(种类和浓度如表1所示);对照组大鼠的背部(约3cm*3cm)涂抹空白基质软膏(约0.5g);涂药后用固定筒将大鼠固定约4小时,4小时后放出大鼠,并用清水擦去涂药部位残留药物,放回鼠笼。egfr抑制剂的灌胃频率如表1所示,但jak抑制剂和空白基质软膏每天只涂药一次。每日重复灌胃和涂抹试验,直到对照组出现明显的皮疹,此时将jak抑制剂组皮肤保持正常或明显轻于对照组皮疹的大鼠只数计算为有效抑制皮疹大鼠的只数。
[0315]
表1列出了各种小分子egfr抑制剂和jak抑制剂药膏的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak组皮疹轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0316]
表1:实施例1-37的实验条件和实验结果
[0317]
[0318]
[0319][0320]
图2显示了表1中对照组、jak抑制剂组中典型大鼠的左侧、背部和右侧的照片。图3显示了实验终点时jak抑制剂组和对照组的皮疹等级。
[0321]
从表1和图2-3的结果可以看出:jak抑制剂药膏能够有效地预防小分子egfr抑制剂引起的皮疹。
[0322]
实施例38-65:在大鼠动物模型上验证jak抑制剂预防小分子egfr抑制剂产生皮疹的实验
[0323]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验前一天将大鼠的后背的毛发用电动剃发刀轻轻除去,然后进行给药试验。egfr抑制剂溶解在无菌水溶液中,用pbs缓冲溶液稀释,每次灌胃量不超过2ml,给药剂量如表2所示。实验分为jak抑制剂组和对照组(溶剂对照组)。jak抑制剂组:分别灌胃/注射jak抑制剂和egfr抑制剂(种类和浓度如表2所示);对照组:分别灌胃/注射与jak抑制剂相同的溶剂和egfr抑制剂(种类和浓度如表2所示)。egfr抑制剂的灌胃频率如表2所示,jak抑制剂和溶剂对照组每天灌胃/注射两次。每日重复灌胃/注射实验,直到对照组出现明显的皮疹,此时将jak抑制剂组皮肤保持正常或明显轻于对照组皮疹的大鼠只数计算为有效抑制皮疹大鼠的只数。
[0324]
表2列出了各种小分子egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak组皮疹轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0325]
表2:实施例38-65的实验条件和实验结果
[0326]
[0327][0328]
图4显示了实验终点时jak抑制剂组和对照组的皮疹等级。
[0329]
从表2和图4的结果可以看出:jak抑制剂能够有效地预防小分子egfr抑制剂引起
的皮疹。
[0330]
实施例66-67:在大鼠动物模型上验证局部给药jak抑制剂预防单抗类egfr抑制剂产生皮疹的实验
[0331]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验前一天将大鼠的后背的毛发用电动剃发刀轻轻除去,然后进行给药试验。实验分为jak抑制剂组和对照组。将用生理盐水稀释后的egfr单抗溶液每周尾静脉注射2次,注射速度及时间见表3。注射给药后,jak抑制剂组每天对大鼠背部(约3cm*3cm)涂jak抑制剂软膏,对照组对大鼠背部(约3cm*3cm)涂空白基质软膏(约0.5g),涂药后用固定筒将大鼠固定4小时,4小时后放出大鼠并用清水擦去涂药部位残留药物,放鼠回笼。每周尾静脉注射2次单抗类egfr抑制剂,jak抑制剂和空白软膏每日涂抹一次,直到对照组出现明显的皮疹。统计涂药10-14天后,jak抑制剂组皮肤保持正常或明显轻于对照组皮疹的大鼠只数计算为有效抑制皮疹大鼠的只数。
[0332]
表3列出了各种单抗类egfr抑制剂和jak抑制剂药膏的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak组皮疹轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0333]
表3:实施例66-67的实验条件和实验结果
[0334][0335]
图5显示了实验终点时jak抑制剂组和对照组(单抗类egfr抑制剂)的皮疹等级。
[0336]
从表3和图5的结果可以看出:jak抑制剂药膏能够有效的预防单抗类egfr抑制剂引起的皮疹。
[0337]
实施例68:在大鼠动物模型上验证jak抑制剂预防单抗类egfr抑制剂产生皮疹的实验
[0338]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验前一天将大鼠的后背的毛发用电动剃发刀轻轻除去,然后进行给药试验。实验分为jak抑制剂组和对照组(溶剂对照组)。将用生理盐水稀释后的egfr单抗溶液每周尾静脉注射2次,注射速度及时间见表4。jak抑制剂组:分别灌胃jak抑制剂(种类和浓度如表4所示);对照组:分别灌胃与jak抑制剂相同的溶剂(种类和浓度如表4所示)。单抗类egfr抑制剂每周尾静脉注射2次,jak抑制剂和对照组每日灌胃两次,直到对照组出现明显的皮疹。统计给药10天后,jak抑制剂组皮肤保持正常或明显轻于对照组皮疹的大鼠只数计算为有效抑制皮疹大鼠的只数。
[0339]
表4列出了各种单抗类egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak组皮疹轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0340]
表4:实施例68的实验条件和实验结果
[0341][0342]
图6显示了实验终点时jak抑制剂组和对照组(单抗类egfr抑制剂)的皮疹等级。
[0343]
从表4和图6的结果可以看出:口服jak抑制剂能够有效的预防单抗类egfr抑制剂引起的皮疹。
[0344]
实施例69-98:在大鼠动物模型上验证jak抑制剂治疗小分子egfr抑制剂产生皮疹的实验
[0345]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验前一天将大鼠的后背的毛发用电动剃发刀轻轻除去,然后进行灌胃给药试验。egfr抑制剂溶解在无菌水溶液中,用pbs缓冲溶液稀释,每次灌胃量不超过2ml,给药剂量如表5所示。每天持续灌胃,直到大鼠出现皮疹的症状,此时开始进行治疗实验。实验分为jak抑制剂组和对照组。治疗实验过程中,持续每日灌胃egfr抑制剂,灌胃后,jak抑制剂组对大鼠的背部(约3cm*3cm)涂抹jak抑制剂的药膏,对照组大鼠的背部(约3cm*3cm)涂抹空白基质软膏;涂药后用固定筒将大鼠固定约4小时,4小时后放出大鼠并用清水擦去涂药部位残留药物,放回鼠笼。egfr抑制剂的灌胃频率如表5所示,但jak抑制剂和空白软膏每天只涂药一次。每日重复用egfr抑制剂灌胃,将实验终点时jak抑制剂组皮肤恢复正常或明显轻于对照组皮疹的大鼠只数计算为有效治疗皮疹大鼠的只数。
[0346]
表5列出了各种小分子egfr抑制剂和jak抑制剂药膏的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak组皮疹轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0347]
表5:实施例69-98的实验条件和实验结果
[0348][0349]
[0350]
图7显示了表5中对照组、jak抑制剂组中典型大鼠的左侧、背部和右侧的照片。图8显示了实验终点时jak抑制剂组和对照组的皮疹等级。
[0351]
从表5和图8中的结果可以看出:jak抑制剂药膏能够有效的治疗小分子egfr抑制剂引起的皮疹。
[0352]
实施例99-122:在大鼠动物模型上验证jak抑制剂治疗小分子egfr抑制剂产生皮疹的实验
[0353]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验前一天将大鼠的后背的毛发用电动剃发刀轻轻除去,然后进行给药试验。egfr抑制剂溶解在无菌水溶液中,用pbs缓冲溶液稀释三倍,每次灌胃量不超过2ml,给药剂量如表6所示。每天持续灌胃,直到大鼠出现皮疹的症状,此时开始进行治疗实验。实验分为jak抑制剂组和对照组(溶剂对照组)。jak抑制剂组:分别灌胃/注射jak抑制剂和egfr抑制剂(种类和浓度如表6所示);对照组:分别灌胃/注射与jak抑制剂相同的溶剂和egfr抑制剂(种类和浓度如表6所示)。egfr抑制剂的灌胃频率如表6所示,jak抑制剂和空白溶剂对照组每日灌胃/注射2次。治疗实验过程中,每日重复给药,将实验终点时jak抑制剂组皮肤恢复正常或明显轻于对照组皮疹的大鼠只数计算为有效治疗皮疹大鼠的只数。
[0354]
表6列出了各种小分子egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak组皮疹轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0355]
表6:实施例99-122的实验条件和实验结果
[0356]
[0357][0358]
图9显示了实验终点时jak抑制剂组和对照组的皮疹等级。
[0359]
从表6和图9中的结果可以看出:jak抑制剂能够有效的治疗小分子egfr抑制剂引起的皮疹。
[0360]
实施例123-124:在大鼠动物模型上局部给药jak抑制剂治疗单抗egfr抑制剂产生皮疹的实验
[0361]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验前一天将大鼠的后背的毛发用电动剃发刀轻轻除去,然后进行给药试验。生理盐水稀释后的egfr单抗溶液每周尾静脉注射2次,注射速度及时间见表7;连续给药1-2周至大鼠出现皮疹,此时开始进行治疗实验。实验分为jak抑制剂组和对照组。治疗实验过程中,持续注射单抗egfr抑制剂一周2次,每日对jak抑制剂组大鼠的背部(约3cm*3cm)涂抹jak抑制剂的药膏,对照组大鼠的背部(约3cm*3cm)涂抹空白基质软膏;涂药后用固定筒将大鼠固定约4小时,4小时后放出大鼠并用清水擦去涂药部位残留药物,放回鼠笼。统计涂药10天后,jak抑制剂组皮肤保持正常或明显轻于对照组皮疹的大鼠只数计算为有效抑制皮疹大鼠的只数。
[0362]
表7列出了单抗类egfr抑制剂和jak抑制剂药膏的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak组皮疹轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0363]
表7:实施例123-124的实验条件和实验结果
[0364][0365]
图10显示了实验终点时jak抑制剂组和对照组(单抗类egfr抑制剂)的皮疹等级。
[0366]
从表7和图10结果可以看出:jak抑制剂药膏能够有效的治疗单抗类egfr抑制剂引起的皮疹。
[0367]
实施例125:在大鼠动物模型上jak抑制剂治疗单抗egfr抑制剂产生皮疹的实验
[0368]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验前一天将大鼠的后背的毛发用电动剃发刀轻轻除去,然后进行给药试验。生理盐水稀释后的egfr单抗溶液每周尾静脉注射2次,注射速度及时间见表8;连续给药1-2周至大鼠出现皮疹,此时开始进行治疗实验。实验分为jak抑制剂组和对照组(溶剂对照组)。jak抑制剂组:分别灌胃jak抑制剂(种类和浓度如表8所示);对照组:分别灌胃与jak抑制剂相同的溶剂(种类和浓度如表8所示)。治疗实验过中,持续注射单抗egfr抑制剂一周2次,jak抑制剂和对照组每日灌胃两次。统计灌胃10天后,jak抑制剂组皮肤保持正常或明显轻于对照组皮疹的大鼠只数计算为有效抑制皮疹大鼠的只数。
[0369]
表8列出了单抗类egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak抑制剂组轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0370]
表8:实施例125的实验条件和实验结果
[0371][0372]
从表8结果可以看出:口服jak抑制剂能够有效的治疗单抗类egfr抑制剂引起的皮疹。
[0373]
实施例126-130:在预防小分子egfr抑制剂产生皮疹的实验中,jak抑制剂软膏与临床上现有的其它皮肤用药对比。
[0374]
大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验前一天将大鼠的后背的毛发用电动剃发刀轻轻除去,然后进行灌胃给药试验。egfr抑制剂溶解在无菌水溶液中,用pbs缓冲溶液稀释,每次灌胃量不超过2ml,给药剂量如表9所示。实验分为jak抑制剂组和其他皮肤用药组。灌胃后,对jak抑制剂组大鼠的背部(约3cm*3cm)涂抹jak抑制剂软膏,其他皮肤用药组大鼠的背部(约3cm*3cm)分别涂抹临床上现有皮肤用药(实施例126-130);涂药后用固定筒将大鼠固定约4小时,4小时后放出大鼠并用清水擦去涂药部位残留药物,放回鼠笼。egfr抑制剂的灌胃频率如表9所示,但临床上现有的其它皮肤用药和jak抑制剂只
涂药一次。每日重复用egfr抑制剂灌胃,用药物涂抹背部,直到其他皮肤用药组出现明显的皮疹。统计jak组有多少大鼠的皮疹明显轻于其他皮肤用药组皮疹。
[0375]
表9列出了jak抑制剂软膏与临床上现有皮肤用药的动物实验组合,以及相应的实验结果(其中,相对缓解率栏的数值=jak组皮疹轻于其他皮肤用药组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0376]
表9:实施例126-130的实验条件和实验结果
[0377][0378][0379]
图11显示了表9中其他皮肤用药组、jak抑制剂组中典型大鼠的左侧、背部和右侧的照片。图12显示了实验终点时jak抑制剂组和对照组的皮疹等级。
[0380]
从表9中的结果可以看出:相比于临床上现有的皮肤用药(几乎对egfr抑制剂所导致的皮疹没有治疗作用),jak抑制剂软膏能有效地控制egfr抑制剂所导致的皮疹。
[0381]
实施例131-155在大鼠动物模型上验证jak抑制剂预防小分子egfr抑制剂产生腹泻的实验
[0382]
构建大鼠动物模型,通过每日灌胃的方式向8周雌性的sd大鼠分别施用表10中所示的小分子egfr抑制剂,给药几天后,大鼠出现腹泻症状(大鼠的腹泻等级如图13所示),与在人体上类似。因此,大鼠egfr抑制剂引起的腹泻模型是很好的模拟人体egfr抑制剂引起的腹泻模型。
[0383]
将所述大鼠(约200g)饲养适应一周后,将其分组,实验分为对照组和jak抑制剂组,每组10只,进行灌胃给药试验。将各种小分子egfr抑制剂溶解在无菌水溶液,灌胃前用pbs将所述egfr抑制剂药物溶液定容至所需浓度(用pbs溶液稀释约3倍),每次灌胃量不超过2ml,给药剂量如表9所示。实验分为jak抑制剂组和对照组(溶剂对照组)。jak抑制剂组:分别灌胃jak抑制剂和egfr抑制剂(种类和浓度如表10所示);对照组:分别灌胃与jak抑制
剂相同的溶剂和egfr抑制剂(种类和浓度如表10所示)。egfr抑制剂的灌胃频率如表9所示,jak抑制剂和空白溶剂对照组每日灌胃2次。每天记录各组大鼠腹泻等级,统计实验终点时jak抑制剂组有多少大鼠的腹泻等级明显轻于对照组腹泻等级。
[0384]
表10列出了各egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,相对缓解率栏的数值=jak抑制剂组腹泻轻于对照组的大鼠只数/jak抑制剂组大鼠的总数量
×
100%)。
[0385]
表10:实施例131-155的实验条件和实验结果
[0386]
[0387][0388]
图14显示了实验终点时jak抑制剂组和对照组的腹泻等级。
[0389]
从表10和图14的结果可以看出:jak抑制剂能够有效的预防egfr抑制剂引起的腹泻。
[0390]
实施例156:在大鼠动物模型上验证jak抑制剂预防单抗类egfr抑制剂产生腹泻的实验
[0391]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验分为jak抑制剂组和对照组。将用生理盐水稀释后的cetuximab单抗溶液每周尾静脉注射2次,每次注射速度为
1.3ml/kg/min,单只注射时间不得低于15min,给药量为100mg/kg。注射给药后,jak抑制剂组每天灌胃jak抑制剂,对照组除了注射单抗外不做其他处理。每天记录各组大鼠腹泻等级。统计实验终点时jak抑制剂组有多少大鼠的腹泻等级明显轻于对照组腹泻等级。
[0392]
表11列出了单抗egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak抑制剂组腹泻等级轻于对照组的大鼠只数/jak抑制剂组大鼠的总数量
×
100%)。
[0393]
表11:实施例156的实验条件和实验结果
[0394][0395]
从表11的结果可以看出:jak抑制剂能够有效的预防单抗类egfr抑制剂引起的腹泻。
[0396]
实施例157-178:在大鼠动物模型上验证jak抑制剂治疗小分子egfr抑制剂产生腹泻的实验
[0397]
将所述大鼠(约200g)饲养适应一周后,将其分组,实验分为对照组和jak抑制剂组,每组10只,进行灌胃给药试验。将各种小分子egfr抑制剂溶解在无菌水溶液,灌胃前用pbs将所述egfr抑制剂药物溶液定容至所需浓度(用pbs溶液稀释约3倍),每次灌胃量不超过2ml,给药剂量如表12所示。每天持续灌胃,直到大鼠出现腹泻的症状,此时开始进行治疗实验。实验分为jak抑制剂组和对照组(溶剂对照组)。jak抑制剂组:分别灌胃/注射jak抑制剂和egfr抑制剂(种类和浓度如表12所示);对照组:分别灌胃/注射与jak抑制剂相同的溶剂和egfr抑制剂(种类和浓度如表12所示)。egfr抑制剂的灌胃频率如表12所示,jak抑制剂和空白溶剂对照组每日灌胃/注射2次。治疗实验过程中,每日重复给药,每天记录各组大鼠腹泻等级,统计实验终点时jak抑制剂组有多少大鼠的腹泻等级明显轻于对照组腹泻等级。
[0398]
表12列出了各种小分子egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak组腹泻轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0399]
表12:实施例157-178的实验条件和实验结果
[0400][0401]
图15显示了实验终点时jak抑制剂组和对照组的腹泻等级。
[0402]
从表12和图15中的结果可以看出:jak抑制剂能够有效的治疗小分子egfr抑制剂引起的腹泻。
[0403]
实施例179:在大鼠动物模型上验证jak抑制剂治疗单抗类egfr抑制剂产生腹泻的实验
[0404]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验分为jak抑制剂组和对照组。生理盐水稀释后的egfr单抗溶液每周尾静脉注射2次,注射速度及时间见表13;连续给药1-2周至大鼠出现腹泻,此时开始进行治疗实验。实验分为jak抑制剂组和对照组(溶剂对照组)。jak抑制剂组:分别灌胃jak抑制剂(种类和浓度如表13所示);对照组:分别灌胃与jak抑制剂相同的溶剂(种类和浓度如表13所示)。治疗实验过中,持续注射单抗egfr抑制
剂一周2次,jak抑制剂和对照组每日灌胃两次。每天记录各组大鼠腹泻等级,统计实验终点时jak抑制剂组有多少大鼠的腹泻等级明显轻于对照组腹泻等级。
[0405]
表13列出了单抗egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak抑制剂组腹泻等级轻于对照组的大鼠只数/jak抑制剂组大鼠的总数量
×
100%)。
[0406]
表13:实施例179的实验条件和实验结果
[0407][0408]
从表13的结果可以看出:jak抑制剂能够有效的预防单抗类egfr抑制剂引起的腹泻。
[0409]
实施例180-185:在预防小分子egfr抑制剂产生腹泻的实验中,jak抑制剂与临床上现有的其它用药对比。
[0410]
大鼠饲养适应一周(约200g)后,将其分组,实验分为其他用药组和jak抑制剂组,每组10只,进行给药试验。将各种小分子egfr抑制剂溶解在无菌水溶液,灌胃前用pbs将所述egfr抑制剂药物溶液定容至所需浓度(用pbs溶液稀释约3倍),每次灌胃量不超过2ml,给药剂量如表14所示。实验分为jak抑制剂组和其他用药组。jak抑制剂组:分别灌胃jak抑制剂和egfr抑制剂(种类和浓度如表14所示);其他用药组:分别给其他药物(实施例180-185)和egfr抑制剂(种类和浓度如表14所示)。egfr抑制剂的灌胃频率如表14所示,jak抑制剂组每日灌胃2次,其他用药组频率及给药方式如表14所示。每天记录各组大鼠腹泻等级,统计实验终点时jak抑制剂组有多少大鼠的腹泻等级明显轻于其他用药组腹泻等级。
[0411]
表14列出了jak抑制剂软膏与临床上现有用药的动物实验组合,以及相应的实验结果(其中,相对缓解率栏的数值=jak组腹泻轻于其他用药组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0412]
表14:实施例180-185的实验条件和实验结果
[0413][0414]
图16显示了jak抑制剂组、其他用药组的腹泻等级结果。
[0415]
从表14和图16中的结果可以看出:相比于临床上现有的其他用药(对egfr抑制剂所导致的腹泻没有很好的治疗效果),jak抑制剂能有效地控制egfr抑制剂所导致的腹泻。
[0416]
实施例186-202在大鼠动物模型上验证jak抑制剂预防小分子egfr抑制剂产生口唇炎的实验
[0417]
构建大鼠动物模型,通过每日灌胃的方式向8周雌性的sd大鼠分别施用表15中所示的小分子egfr抑制剂,给药几天后,大鼠出现口腔及周围红肿、溃疡、结痂、出血等口唇炎症状(图17)。
[0418]
将所述大鼠(约200g)饲养适应一周后,将其分组,实验分为对照组和jak抑制剂组,每组10只,进行灌胃给药试验。将各种小分子egfr抑制剂溶解在无菌水溶液,灌胃前用pbs将所述egfr抑制剂药物溶液定容至所需浓度(用pbs溶液稀释约3倍),每次灌胃量不超过2ml,给药剂量如表15所示。实验分为jak抑制剂组和对照组(溶剂对照组)。jak抑制剂组:分别灌胃jak抑制剂和egfr抑制剂(种类和浓度如表15所示);对照组:分别灌胃与jak抑制剂相同的溶剂和egfr抑制剂(种类和浓度如表15所示)。egfr抑制剂的灌胃频率如表15所示,jak抑制剂和空白溶剂对照组每日灌胃2次。统计实验终点时jak抑制剂组有多少大鼠的口唇炎症状明显轻于对照组口唇炎症状。
[0419]
表15列出了各egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,相对缓解率栏的数值=jak抑制剂组口唇炎轻于对照组的大鼠只数/jak抑制剂组大鼠的总数量
×
100%)。
[0420]
表15:实施例186-202的实验条件和实验结果
[0421][0422][0423]
图17显示了jak抑制剂组和对照组典型大鼠的口唇炎照片。
[0424]
从表15和图17的结果可以看出:jak抑制剂能够有效的预防egfr抑制剂引起的口唇炎。
[0425]
实施例203:在大鼠动物模型上验证jak抑制剂预防单抗类egfr抑制剂产生口唇炎的实验
[0426]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验分为jak抑制剂组和对照组。将用生理盐水稀释后的cetuximab单抗溶液每周尾静脉注射2次,每次注射速度为1.3ml/kg/min,单只注射时间不得低于15min,给药量为100mg/kg。注射给药后,jak抑制剂组每天灌胃jak抑制剂,对照组除了注射单抗外不做其他处理。统计实验终点时jak抑制剂
组有多少大鼠的口唇炎症状明显轻于对照组口唇炎症状。
[0427]
表16列出了单抗egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak抑制剂组口唇炎症状轻于对照组的大鼠只数/jak抑制剂组大鼠的总数量
×
100%)。
[0428]
表16:实施例203的实验条件和实验结果
[0429][0430]
从表16的结果可以看出:jak抑制剂能够有效的预防单抗类egfr抑制剂引起的口唇炎。
[0431]
实施例204-216:在大鼠动物模型上验证jak抑制剂治疗小分子egfr抑制剂产生口唇炎的实验
[0432]
将所述大鼠(约200g)饲养适应一周后,将其分组,实验分为对照组和jak抑制剂组,每组10只,进行灌胃给药试验。将各种小分子egfr抑制剂溶解在无菌水溶液,灌胃前用pbs将所述egfr抑制剂药物溶液定容至所需浓度(用pbs溶液稀释约3倍),每次灌胃量不超过2ml,给药剂量如表17所示。每天持续灌胃,直到大鼠出现口唇炎的症状,此时开始进行治疗实验。实验分为jak抑制剂组和对照组(溶剂对照组)。jak抑制剂组:分别灌胃jak抑制剂和egfr抑制剂(种类和浓度如表17所示);对照组:分别灌胃与jak抑制剂相同的溶剂和egfr抑制剂(种类和浓度如表17所示)。egfr抑制剂的灌胃频率如表17所示,jak抑制剂和空白溶剂对照组每日灌胃2次。治疗实验过程中,每日重复灌胃,统计实验终点时jak抑制剂组有多少大鼠的口唇炎症状明显轻于对照组口唇炎症状。
[0433]
表17列出了各种小分子egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak组口唇炎症状轻于对照组的大鼠只数/jak组大鼠的总数量
×
100%)。
[0434]
表17:实施例204-216的实验条件和实验结果
[0435][0436]
从表17的结果可以看出:jak抑制剂能够有效的治疗小分子egfr抑制剂引起的口唇炎。
[0437]
实施例217:在大鼠动物模型上验证jak抑制剂治疗单抗类egfr抑制剂产生口唇炎的实验
[0438]
sd大鼠饲养适应一周(约200g)后,将大鼠分成每组10只。实验分为jak抑制剂组和对照组。生理盐水稀释后的egfr单抗溶液每周尾静脉注射2次,注射速度及时间见表18;连续给药1-2周至大鼠出现口唇炎,此时开始进行治疗实验。实验分为jak抑制剂组和对照组(溶剂对照组)。jak抑制剂组:分别灌胃jak抑制剂(种类和浓度如表18所示);对照组:分别灌胃与jak抑制剂相同的溶剂(种类和浓度如表18示)。治疗实验过中,持续注射单抗egfr抑制剂一周2次,jak抑制剂和对照组每日灌胃两次,统计实验终点时jak抑制剂组有多少大鼠的口唇炎症状明显轻于对照组口唇炎症状。
[0439]
表18列出了单抗egfr抑制剂和jak抑制剂的动物实验组合,以及相应的实验结果(其中,控制率栏的数值=jak抑制剂组口唇炎症状轻于对照组的大鼠只数/jak抑制剂组大鼠的总数量
×
100%)。
[0440]
表18:实施例217的实验条件和实验结果
[0441][0442]
从表18的结果可以看出:jak抑制剂能够有效的治疗单抗类egfr抑制剂引起的口唇炎。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1