氟维司群药物组合物、其制备方法及应用与流程
氟维司群药物组合物、其制备方法及应用
1.本技术要求享有2020年12月10日向中国国家知识产权局提交的申请号为202011433060.4,名称为“氟维司群药物组合物、其制备方法及应用”的在先专利申请的优先权权益。该在先申请的全文以引用的方式结合至本文中。
技术领域
2.本发明涉及氟维司群药物组合物、其制备方法及应用,属于药物制剂技术领域。
背景技术:
3.氟维司群是一种选择性雌激素受体降解剂(serd),用于抗雌激素疗法后疾病进展的绝经后妇女的激素受体阳性转移性乳癌的治疗。2002年经美国fda批准可用于治疗激素受体阳性转移性乳腺癌。
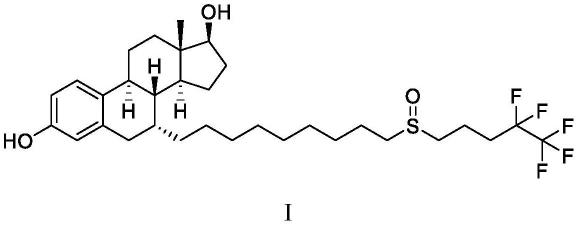
4.氟维司群化学名7-(9-(4,4,5,5,5-五氟戊基亚磺酰基)壬基)雌-1,3,5(10)-三烯-3,17-二醇,其结构如式i所示:
[0005][0006]
氟维司群是一种亲脂分子,水溶性极低。由于氟维司群溶解性差和口服生物利用度低,所以目前普遍通过肌肉内注射油基氟维司群制剂来施用。目前,氟维司群的市售制剂faslodextm以500mg给予,并且需要肌肉内施用两次50mg/ml氟维司群制剂的5ml注射液。每个5ml注射液含有10w/v%乙醇、10w/v%苯甲醇和15w/v%苯甲酸苯甲酯作为共溶剂,并用蓖麻油作为另一种共溶剂和释放速率调节剂补充至100w/v%。由于使用粘性油基载体来溶解氟维司群,所以施用该制剂缓慢(每次注射1-2分钟)并且疼痛。并且,faslodextm标签上增加了关于注射疼痛、坐骨神经痛、神经性疼痛和外周神经病的警告。
[0007]
因此,寻找不含有机溶剂或油、刺激性小、具有适宜的释放速度,给药后迅速达到峰浓度且维持较高血药浓度、且施用方便、疼痛度低的氟维司群剂型,是目前急需解决的技术问题。
技术实现要素:
[0008]
为改善上述技术问题,本发明提供了一种氟维司群药物组合物,其包含氟维司群固体粒子,所述的氟维司群固体粒子的粒径为dv(10)选自小于等于600纳米,例如小于等于400纳米,dv(50)选自小于等于700纳米且dv(90)选自小于等于1000纳米。
[0009]
根据本发明的实施方案,所述的氟维司群固体粒子的粒径可以为dv(10)选自小于等于500纳米,选自小于等于400纳米,如0.01纳米~400纳米,例如dv(10)选自1纳米~550
纳米,也可以选自10纳米~500纳米,如20纳米、30纳米、40纳米、50纳米、60纳米、70纳米、80纳米、90纳米、100纳米、110纳米、120纳米、130纳米、140纳米、150纳米、160纳米、170纳米、180纳米、190纳米、200纳米、210纳米、220纳米、230纳米、240纳米、250纳米、260纳米、270纳米、280纳米、290纳米、300纳米、350纳米、400纳米、450纳米、500纳米,其实例可以选自196.200纳米、132.420纳米、435.63纳米或341.71纳米。
[0010]
根据本发明的实施方案,所述的氟维司群固体粒子的粒径可以为dv(50)选自0.01纳米~700纳米,例如dv(50)选自1纳米~600纳米,也可以选自10纳米~500纳米,如10纳米、20纳米、30纳米、40纳米、50纳米、60纳米、70纳米、80纳米、90纳米、100纳米、110纳米、120纳米、130纳米、140纳米、150纳米、160纳米、170纳米、180纳米、190纳米、200纳米、210纳米、220纳米、230纳米、240纳米、250纳米、260纳米、270纳米、280纳米、290纳米、300纳米、350纳米、400纳米、450纳米、500纳米,其实例可以选自401.800纳米、281.630纳米、448.340纳米、473.84纳米或535.27纳米。
[0011]
根据本发明的实施方案,所述的氟维司群固体粒子的粒径可以为dv(90)选自1纳米~1000纳米,例如dv(90)选自10纳米~900纳米,也可以为100纳米~800纳米,如100纳米、110纳米、120纳米、130纳米、140纳米、150纳米、160纳米、170纳米、180纳米、190纳米、200纳米、210纳米、220纳米、230纳米、240纳米、250纳米、260纳米、270纳米、280纳米、290纳米、300纳米、350纳米、400纳米、450纳米、500纳米、550纳米、600纳米、650纳米、700纳米、750纳米、800纳米,其实例可以选自716.500纳米、866.720纳米、599.350纳米、657.69纳米或657.05纳米。
[0012]
根据本发明的实施方案,所述的氟维司群固体粒子的粒径也可以为dv(25)选自1纳米~600纳米,例如dv(25)选自10纳米~500纳米,也可以为dv(25)选自100纳米~400纳米,如100纳米、110纳米、120纳米、130纳米、140纳米、150纳米、160纳米、170纳米、180纳米、190纳米、200纳米、210纳米、220纳米、230纳米、240纳米、250纳米、260纳米、270纳米、280纳米、290纳米、300纳米、350纳米、400纳米,其实例可以选自272.00纳米、189.28纳米、316.91纳米、480.27纳米或398.95纳米。
[0013]
根据本发明的实施方案,所述的氟维司群固体粒子的粒径也可以为dv(75)选自1纳米~900纳米,例如dv(75)选自10纳米~800纳米,也可以为dv(75)选自100纳米~700纳米,如100纳米、110纳米、120纳米、130纳米、140纳米、150纳米、160纳米、170纳米、180纳米、190纳米、200纳米、210纳米、220纳米、230纳米、240纳米、250纳米、260纳米、270纳米、280纳米、290纳米、300纳米、350纳米、400纳米、450纳米、500纳米、550纳米、600纳米、650纳米、700纳米,其实例可以选自540.00纳米、419.10纳米、634.29纳米、596.56纳米或562.80纳米。
[0014]
本发明中所述的氟维司群药物组合物还可以包括载体。所述的载体可以为非油性载体。优选地,所述的非油性载体包括但不限于水。所述的水可以为常规市售注射用水,优选为灭菌注射用水。
[0015]
根据本发明的实施方案,所述的氟维司群药物组合物的ph为6.5~8.0,例如6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9或8.0,如7.4。
[0016]
根据本发明的实施方案,所述的氟维司群药物组合物还可以包括选自以下的一种或多种:助悬剂、润湿剂、渗透压调节剂、溶剂、稳定剂、缓冲剂、ph调节剂、表面活性剂、聚合
物、电解质和非电解质。其中,所述的聚合物可以为交联聚合物和/或非交联聚合物。
[0017]
根据本发明的实施方案,所述的助悬剂包括但不限于:羧甲基纤维素钠、聚乙二醇和聚维酮中的一种或多种。
[0018]
根据本发明的实施方案,所述的润湿剂包括但不限于:泊洛沙姆、聚维酮、多库酯钠、脱氧胆酸钠和吐温中的一种或多种。所述的吐温可以为常规市售吐温试剂,例如吐温20和吐温80中的一种或多种。
[0019]
根据本发明的实施方案,所述的渗透压调节剂包括但不限于:氯化钠、甘露醇和蔗糖中的一种或多种。
[0020]
根据本发明的实施方案,所述的溶剂包括但不限于:注射用水。
[0021]
根据本发明的实施方案,所述的稳定剂包括但不限于:抗氧化剂、金属离子螯合剂、聚环氧乙烷(peo)、聚环氧乙烷衍生物、聚山梨醇酯、脱氧胆酸钠、多库酯钠、泊洛沙姆、聚乙氧基化植物油、聚乙氧基化蓖麻油、脱水山梨糖醇棕榈酸酯、卵磷脂、聚乙烯醇、人血清白蛋白、聚乙烯吡咯烷酮、聚维酮、聚乙二醇、氯化钠、氯化钙、右旋糖、丙三醇、甘露糖醇和交联聚合物中的一种或多种。所述的抗氧化剂包括但不限于枸橼酸、维生素c和维生素e中的一种或多种。所述的金属离子螯合剂包括但不限于乙二胺四乙酸(edta)。所述的泊洛沙姆包括但不限于泊洛沙姆188、泊洛沙姆124和泊洛沙姆407中的一种或多种。所述的聚山梨醇酯包括但不限于:聚山梨醇酯80和聚山梨醇酯20中的一种或多种。所述的聚维酮包括但不限于:聚维酮k12、聚维酮k17、plasdonetm c-12聚维酮、plasdonetm c-17聚维酮和plasdonetm c-30聚维酮中的一种或多种。所述的聚乙二醇包括但不限于聚乙二醇3350。所述的交联聚合物包括但不限于羧甲基纤维素钠。
[0022]
根据本发明的实施方案,所述的缓冲剂包括但不限于:磷酸、磷酸盐、枸橼酸(柠檬酸)、枸橼酸钠(柠檬酸钠)、三羟甲基氨基甲烷(tris)、氢氧化钠、盐酸(hcl)或其混合物的缓冲剂。
[0023]
根据本发明的实施方案,所述的ph调节剂包括但不限于:磷酸、磷酸盐、枸橼酸、枸橼酸钠、盐酸和氢氧化钠。
[0024]
根据本发明的实施方案,所述的磷酸盐包括但不限于磷酸氢二钠、磷酸二氢钠或其混合物或水合物,例如一水磷酸氢二钠(na2hpo4·
h2o)、二水磷酸氢二钠(na2hpo4·
2h2o)、无水磷酸氢二钠(无水na2hpo4)、一水磷酸二氢钠(nah2po4·
h2o)、二水磷酸二氢钠(nah2po4·
2h2o)和无水磷酸二氢钠(无水nah2po4)中的一种或多种。
[0025]
根据本发明的实施方案,所述的助溶剂包括但不限于:乙醇和丙二醇中的一种或多种。
[0026]
所述的氟维司群药物组合物中,氟维司群固体粒子的重量分数优选1.00%~50.00%,优选2.00%~30.00%,例如2.00%~25.00%,例如2.00%、3.00%、4.00%、5.00%、6.00%、7.00%、8.00%、9.00%、10.00%、11.00%、12.00%、13.00%、14.00%、15.00%、16.00%、17.00%、18.00%、19.00%、20.00%、21.00%、22.00%、23.00%、24.00%、25.00%,如5.00%或25.00%;所述的重量分数是指氟维司群固体粒子的重量占氟维司群药物组合物总重量的百分比。
[0027]
所述的氟维司群药物组合物中,所述的润湿剂的重量分数优选0~5.00%,例如1.00%、2.00%、3.00%、4.00%、5.00%,如1.00%;所述的重量分数是指表面活性剂的重
量占氟维司群药物组合物总重量的百分比。
[0028]
所述的氟维司群药物组合物中,所述的助悬剂的重量分数优选0~5.00%,例如0、1.00%、2.00%、3.00%、4.00%、5.00%;所述的重量分数是指助悬剂的重量占氟维司群药物组合物总重量的百分比。
[0029]
所述的氟维司群药物组合物中,所述的渗透压调节剂的重量分数优选0~5.00%,例如0、1.00%、2.00%、3.00%、4.00%、5.00%;所述的重量分数是指渗透压调节剂的重量占氟维司群药物组合物总重量的百分比。
[0030]
所述的氟维司群药物组合物中,所述的缓冲剂的重量分数优选0~1.00%,例如0、0.10%、0.20%、0.30%、0.40%、0.50%、0.60%、0.70%、0.80%、0.90%、1.00%;所述的重量分数是指缓冲剂的重量占氟维司群药物组合物总重量的百分比。
[0031]
所述的氟维司群药物组合物中,所述的稳定剂的重量分数优选0~1.00%,例如0、0.10%、0.20%、0.30%、0.40%、0.50%、0.60%、0.70%、0.80%、0.90%、1.00%,例如0.60%或0.32%;所述的重量分数是指稳定剂的重量占氟维司群药物组合物总重量的百分比。
[0032]
所述的氟维司群药物组合物中,所述的ph调节剂使用量优选调节组合物溶液的ph为6.5~8.0,例如6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9或8.0,如7.4。
[0033]
所述的氟维司群药物组合物,优选包括以下组分:1.00%~50.00%氟维司群固体粒子、0~5.00%润湿剂、0~5.00%稳定剂、0~5.00%渗透压调节剂、0~1.00%缓冲剂和溶剂,以及任选存在或不存在的0~5.00%的助悬剂。
[0034]
优选地,所述的氟维司群药物组合物,优选包括以下组分:1.00%~50.00%氟维司群固体粒子、0~5.00%润湿剂、0~5.00%稳定剂、0~5.00%渗透压调节剂和0~1.00%缓冲剂,以及任选存在或不存在的0~5.00%的助悬剂,并且余量为溶剂。
[0035]
根据本发明的实施方案,所述的氟维司群药物组合物,可以为以下任一配方:
[0036]
配方一:5.00%氟维司群固体粒子、0.50%聚维酮k12、0.30%脱氧胆酸钠、2.78%甘露醇、ph调节剂和水,其中ph调节剂将稀释剂的ph调节至ph7.4,ph调节剂为磷酸二氢钠和磷酸氢二钠;
[0037]
配方二:5.00%氟维司群固体粒子、0.50%聚维酮k12、0.20%泊洛沙姆188、2.78%甘露醇、ph调节剂和水,其中ph调节剂将稀释剂的ph调节至ph7.4,ph调节剂为磷酸二氢钠和磷酸氢二钠;
[0038]
配方三:5.00%氟维司群、1.00%吐温20、0.30%聚维酮k12、0.30%脱氧胆酸钠、2.76%甘露醇、ph调节剂和水,其中ph调节剂将稀释剂的ph调节至ph7.4,ph调节剂为磷酸二氢钠和磷酸氢二钠;
[0039]
配方四:5.00%氟维司群、1.00%吐温20、0.30%聚维酮k12、0.02%多库酯钠、2.76%甘露醇、ph调节剂和水,其中ph调节剂将稀释剂的ph调节至ph7.4,ph调节剂为磷酸二氢钠和磷酸氢二钠;
[0040]
配方五:25.00%氟维司群、1.00%吐温20、0.20%cmc-na、0.42%磷酸氢二钠、0.09%磷酸二氢钠、2.29%甘露醇、0.30%脱氧胆酸钠、0.30%pvp k12和水。
[0041]
配方六:25.00%氟维司群、1.60%吐温20、0.20%cmc-na、0.42%磷酸氢二钠、
0.09%磷酸二氢钠、2.27%甘露醇、0.30%脱氧胆酸钠、0.30%pvp k12和水。
[0042]
本发明还提供了所述的氟维司群药物组合物的制备方法,其包括以下步骤:
[0043]
步骤1:将氟维司群固体粒子与配方中的其他组分混合,得到预混物;
[0044]
步骤2:将步骤1得到的预混物与锆珠共同研磨,得到氟维司群药物组合物即可。
[0045]
步骤1中,所述的混合优选搅拌混合。
[0046]
步骤2中,所述的锆珠的粒径可以为0.01mm~2mm,例如0.1mm、0.3mm、0.6mm或1mm。
[0047]
步骤2中,所述的锆珠与所述的预混物的体积比值优选1~5,例如1、1.5、2或3。
[0048]
步骤2中,所述的研磨的时间可以为1分钟~24小时,也可以为5分钟~20小时,例如4小时或12小时。
[0049]
根据本发明的实施方案,所述的锆珠是指常规市售氧化锆珠。
[0050]
本发明还提供了所述的氟维司群药物组合物在制备氟维司群药物制剂中的应用。
[0051]
所述的氟维司群药物制剂包括但不限于片剂、颗粒剂、胶囊、微丸、口服液和注射剂等中的一种或多种。优选地,所述片剂包括但不限于缓释片、渗透泵片和口崩片中的一种或多种。优选地,所述注射剂可以为液体注射剂、注射用粉剂或注射用片剂;例如,所述液体注射剂可以为混悬剂,比如为水混悬剂或混悬用粉末;例如,所述混悬用粉末可以为冻干粉针。
[0052]
根据本发明的实施方案,所述的注射剂可以为长效注射剂;所述的长效注射剂可以是水混悬剂,也可以是混悬用粉末,临用时采用特定的稀释剂分散成混悬剂。
[0053]
根据本发明的实施方案,所述的氟维司群在长效注射剂中的浓度不低于50mg/ml。
[0054]
本发明还提供一种氟维司群药物制剂,其含有上述氟维司群药物组合物。
[0055]
根据本发明的实施方案,所述氟维司群药物制剂具有如上文所述的剂型选择和/或氟维司群浓度。
[0056]
本发明还提供上述氟维司群药物组合物和/或氟维司群药物制剂在预防和/或治疗激素受体阳性转移性乳腺癌中的应用。
[0057]
本发明还提供一种预防和/或治疗激素受体阳性转移性乳腺癌的方法,包括将上述氟维司群药物组合物和/或氟维司群药物制剂给予需要的患者,例如人。
[0058]
根据本发明的实施方案,所述的“dv(10)”、“dv(25)”、“dv(50)”、“dv(75)”和“dv(90)”是指体积加权的粒子直径,其中在测量时分别有累积10v/v%、25v/v%、50v/v%、75v/v%或90v/v%的粒子具有相等或较小的直径。例如,如果粒子群的dv(50)为约25微米,则50%体积的粒子具有小于或等于约25微米的直径。
[0059]
除非另有说明,本技术上下文中的粒子直径参数,例如“d(10)”、“d(25)”、“d(50)”、“d(75)”和“d(90)”均指体积加权的粒子直径,其分别具有与“dv(10)”、“dv(25)”、“dv(50)”、“dv(75)”和“dv(90)”相同的含义。
[0060]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0061]
本发明所用试剂和原料均市售可得。
[0062]
根据本发明的实施方案,所述的室温是指环境温度为10℃~35℃。
[0063]
本发明的有益效果在于:本发明的氟维司群药物组合物具有有利的释放速度,给药后迅速达到峰浓度且维持较高血药浓度,生物利用度高;本发明的氟维司群药物组合物
的活性药物成分含量高、不含有机溶剂或油,刺激性小,且施用方便,给药体积减小,注射疼痛度大大降低,市场化前景良好。
附图说明
[0064]
图1为实施例1中研磨后混悬液中氟维司群固体粒子的粒径分布图;
[0065]
图2为实施例1中研磨后混悬液中氟维司群固体偏振光显微镜观察图,标尺为20微米;
[0066]
图3为实施例2中研磨12h后混悬液中氟维司群固体粒子的粒径分布图;
[0067]
图4为实施例2中研磨4h后混悬液中氟维司群固体偏振光显微镜观察图,标尺为10微米;
[0068]
图5为实施例2中研磨12h后混悬液中氟维司群固体偏振光显微镜观察图,标尺为10微米;
[0069]
图6为实施例3中研磨4h后混悬液中氟维司群固体偏振光显微镜观察图,标尺为10微米;
[0070]
图7为实施例4中处方4研磨17h后混悬液中氟维司群固体粒子的粒径分布图;
[0071]
图8为实施例4中处方5研磨17h后混悬液中氟维司群固体粒子的粒径分布图;
[0072]
图9为实施例5中处方6研磨后混悬液中氟维司群固体粒子的粒径分布图;
[0073]
图10为实施例5中处方7研磨后混悬液中氟维司群固体粒子的粒径分布图;
[0074]
图11为实施例5中处方6研磨后混悬液中氟维司群固体粒子的扫描电镜图;
[0075]
图12为实施例5中处方7研磨后混悬液中氟维司群固体粒子的扫描电镜图;
[0076]
图13大鼠给予15mg/kg和30mg/kg剂量氟维司群混悬液的总药时曲线;
[0077]
图14大鼠给予15mg/kg剂量氟维司群混悬液(g1)的药时曲线;
[0078]
图15大鼠给予15mg/kg剂量氟维司群混悬液(g2)的药时曲线;
[0079]
图16大鼠给予15mg/kg剂量氟维司群混悬液(g3)的药时曲线;
[0080]
图17大鼠给予30mg/kg剂量氟维司群混悬液(g4)的药时曲线。
具体实施方式
[0081]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0082]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0083]
实施例1
[0084]
表1混悬注射液处方表
[0085]
处方1组成(w/v%)氟维司群25.00吐温201.62甘露醇2.29
无水磷酸二氢钠0.09无水磷酸氢二钠0.42灭菌注射用水70.58(q.s.100)
[0086]
按表1处方1的用量配制称原辅料,混合均匀后加入1倍体积的0.3mm锆珠放置于研磨罐中进行研磨,研磨3小时,停止研磨,滤出得到氟维司群初始混悬液。将初混悬液加入1倍体积的0.1mm锆珠放置于研磨罐中进行研磨,于不同时间取样采用激光粒度仪测定(激光粒度仪参数设置:分散介质:水;散介质折射率:1.333;样品材质吸收率:0.01;样品材质折射率:1.521)测定粒径,研磨20.5小时,停止研磨,得到氟维司群药物组合物。研磨采用球磨仪进行,行星式球磨仪参数设置:固定参数:公转盘直径约191mm,自转杯直径约71mm,自转杯高度约70mm,自转杯容量100ml,公转盘转速10r/min自转速度:720r/min。
[0087]
采用偏振光显微镜观察研磨后混悬液中粒子的粒径形态。所述不同时间研磨后混悬液中氟维司群固体粒子的粒径分布数据如表2和所示。所述的研磨后混悬液中氟维司群固体粒子的粒径分布和形态分别见图1、图2。
[0088]
结果显示,偏振光显微镜观察到的粒子形态大小与激光粒度仪粒径测定一致。研磨20.5h后混悬液中氟维司群固体为8μm左右球状物。采用处方2以及最小的研磨珠研磨后3小时后粒径达最小,再延长时间研磨,粒径不仅不减小反而增加。
[0089]
表2实施例1混悬液中不同时间研磨得到组合物中氟维司群的粒径分布(体积加权)
[0090][0091][0092]
实施例2
[0093]
表3实施例2和3混悬注射液处方表
[0094][0095]
按表3处方2的用量配制称原辅料。稀释剂组成(以稀释剂的总重量计,w/w%):甘露醇2.95%,0.122%磷酸二氢钠、0.58%磷酸氢二钠,余量为水,ph7.4。将初混悬液加入1.5倍体积的0.3mm锆珠放置于研磨罐中进行研磨,研磨12小时,得到氟维司群药物组合物。研磨采用球磨仪进行,行星式球磨仪参数设置:固定参数:公转盘直径约191mm,自转杯直径约71mm,自转杯高度约70mm,自转杯容量100ml,公转盘转速10r/min自转速度:720r/min。
[0096]
采用纳米粒度仪测定(nicomp particle sizing systems,参数设置:分散介质:水;分散介质折射率:1.333;黏度:0.933cp;温度:23℃,光强设定值:300khz)测定粒径。采用偏振光显微镜观察研磨4h和研磨终点12h的粒径形态。
[0097]
所述研磨12h后混悬液中氟维司群固体粒子的粒径分布数据如表4和图3所示。所述的研磨4h、12h后混悬液中氟维司群固体粒子的粒径形态分别见图4和图5。研磨4h、12h后混悬液中氟维司群固体粒子分别为小于2微米和小于1微米的粒子。
[0098]
表4混悬液中氟维司群的粒径分布(体积加权)
[0099][0100][0101]
实施例3
[0102]
按表3处方3的用量配制称原辅料。稀释剂组成(以稀释剂的总重量计,w/w%):甘露醇2.95%,0.122%磷酸二氢钠、0.58%磷酸氢二钠,余量为水,ph7.4。将初混悬液加入1.5倍体积的0.3mm锆珠放置于研磨罐中进行研磨,研磨4小时,得到氟维司群药物组合物。研磨采用球磨仪进行,行星式球磨仪参数设置:固定参数:公转盘直径约191mm,自转杯直径约71mm,自转杯高度约70mm,自转杯容量100ml,公转盘转速10r/min自转速度:720r/min。
[0103]
所述的研磨后混悬液中氟维司群固体粒子的粒径形态见图6。
[0104]
结果显示,与处方2截然不同的是,研磨4h后混悬液中氟维司群固体粒子为5~15um块状聚集物。
[0105]
实施例4
[0106]
表5实施例4和混悬注射液处方表
[0107][0108]
按表5处方4和5的用量配制称原辅料。稀释剂组成(以稀释剂的总重量计,w/w%):甘露醇2.95%,0.122g磷酸二氢钠、0.58g磷酸氢二钠,余量为水,ph7.4。将初混悬液加入1.5倍体积的0.3mm锆珠放置于研磨罐中进行研磨,研磨17小时,得到氟维司群药物组合物。研磨采用球磨仪进行,行星式球磨仪参数设置:固定参数:公转盘直径约191mm,自转杯直径约71mm,自转杯高度约70mm,自转杯容量100ml,公转盘转速10r/min自转速度:720r/min。
[0109]
采用纳米粒度仪测定(nicomp particle sizing systems,参数设置:分散介质:水;分散介质折射率:1.333;黏度:0.933cp;温度:23℃,光强设定值:300khz)测定粒径。
[0110]
所述处方4和5研磨17h后混悬液中氟维司群固体粒子的粒径分布数据如表4,表6、图7和图8所示。
[0111]
表6处方4和处方5的高斯分布平均粒径
[0112][0113]
实施例5
[0114]
表7实施例5处方6和处方7混悬注射液处方表
[0115][0116][0117]
按表7处方用量配制称原辅料,加入1.5倍体积的锆珠放置于研磨罐中进行研磨,其中处方6和7分别采用0.3mm和0.6mm锆珠,研磨时间分别为21小时和25小时,得到氟维司群药物组合物。研磨采用球磨仪进行,行星式球磨仪参数设置:固定参数:公转盘直径约191mm,自转杯直径约71mm,自转杯高度约70mm,自转杯容量100ml,公转盘转速10r/min自转速度:720r/min。
[0118]
采用纳米粒度仪测定(nicomp particle sizing systems,参数设置:分散介质:水;分散介质折射率:1.333;黏度:0.933cp;温度:23℃,光强设定值:300khz)测定粒径。所述处方6和7研磨后混悬液中氟维司群固体粒子的粒径分布数据如表4、图9和图10所示。
[0119]
采用扫描电镜(fei,型号f50)观察形态大小。扫描电镜电压10kv,束流2.0测试。所述处方6和7研磨后混悬液中氟维司群固体粒子的电镜照片见图11和图12所示。均观察到小于1μm的不规则块状粒子。
[0120]
按照ep10.0方法检测氟维司群有关物质。有关物质结果见表8。结果显示,自制混悬液有关物质单杂和总杂均低于上市对比制剂,表明质量较优。
[0121]
表8实施例5(处方6和7)制剂与对比制剂的有关物质结果
[0122][0123]
注:nd表示未检出;
[0124]
*
为氟维司群的降解产物;
[0125]
6-keto fulvestrant(6-酮氟维司群)、6,7-fulvestrant(6,7-氟维司群)、fulvestrantβ-isomer(氟维司群β异构体)、fulvestrant sulphone(氟维司群砜)、fulvestrant bromo analogue(氟维司群溴类似物)、fulvestrant extended(氟维司群扩展)、fulvestrant sterol dimer(氟维司群甾醇二聚体)。
[0126]
实施例6
[0127]
将实施例5所得的处方6和处方7制剂,用稀释剂稀释至50mg/ml。稀释剂组成为:1.62%吐温20、0.2%羧甲基纤维素钠、2.29%甘露醇、0.09%无水磷酸二氢钠、0.42%无水磷酸氢二钠。
[0128]
将稀释后的处方6(g2)和处方7(g3)氟维司群混悬液、上市对比制剂氟维司群注射剂faslodex(g1,50mg/ml,德国vetter pharma-fertigung gmbh&co kg,批号:rh832,有效期2024年2月)按氟维司群15mg/kg(给药体积0.3ml/kg)以及未稀释的处方7氟维司群混悬液按氟维司群30mg/kg(g4,给药体积0.11ml/kg)大腿外侧肌肉注射给予雄性wistar大鼠,spf级动物,189~200g,6~8周龄(北京维通利华实验动物技术有限公司,质量合格证号110011200110944286,使用许可证号syxk(苏)2018-0034),每组3只。
[0129]
给药后进行临床观察,给药第一天(d1)观察2次:给药前和给药后当天下午,此后每天观察1次,总45天。临床观察包括皮肤、被毛、眼、耳、鼻、口腔、胸部、腹部、泌尿生殖部、四肢等部位,以及呼吸、运动、泌尿、排便和行为改变和给药部位肌肉刺激反应等。并且,在给药前(0h,d-1)、d1给药后1、3、7、24h,d4(72h)、d7(144h)、d11(240h)、d15(336h)、d20(456h)、d25(576h)、d30(696h)、d35(816h)、d40(936h)和d45(1056h)采集血样,进行生物分析和采用winnonlin 8.1版本的非房室模型计算各组的药代动力学参数tmax,cmax,auc(0-t),auc(0-∞),t1/2,mrt,cl、vz等。
[0130]
给药d45后,解剖动物并对给药部位进行组织病理学检查,观察炎症反应和药物残留。各剂量组所有受试动物临床观察、体重、给药部位刺激观察、给药部位大体解剖均未见异常,给药部位未见炎症和药物残留,组织病理学检查未见与给予供试品相关的异常。
[0131]
大鼠给予15mg/kg和30mg/kg剂量氟维司群混悬液下药代动力学参数见表9,以及图13、14、15、16和17。结果显示:wistar大鼠单次肌肉注射给予15mg/kg给药制剂后,cmax从大到小依次为:g1>g3>g2;药物浓度-时间曲线下面积aucinf_obs从大到小依次为:g1>g3>g2;auclast从大到小依次为:g1>g3>g2;药物末端消除半衰期t1/2_z从大到小依次为:g1>g3>g2;清除率cl_obs从大到小依次为:g2>g3>g1;平均驻留时间mrtinf_obs从大到小依次为:g3>g2>g1;分布容积vz_obs从大到小依次为:g2>g3>g1。以上结果表明自制混悬液缓释效果优于上市对比制剂。上市对比制剂达峰时间tmax大于自制混悬液,表明混悬液能更加迅速起效。
[0132]
wistar大鼠单次肌肉注射给予批号为20201221-1的给药制剂后,15mg/kg和30mg/kg剂量下药代参数比较,氟维司群的血浆暴露量(auclast)增加低于剂量的增加,mrt无差异,说明高浓度高剂量混悬剂给药后的药物持续稳定缓释,不会引起药物突释。
[0133]
表9大鼠给予15mg/kg和30mg/kg剂量氟维司群制剂下药代动力学参数
[0134][0135]
表9(续)
[0136]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1