坐珠达西在抑制幽门螺杆菌感染引发胃黏膜炎症中的应用的制作方法
1.本发明涉及生物医药技术领域,尤其涉及坐珠达西在抑制幽门螺杆菌感染引发胃黏膜炎症中的应用。
背景技术:
2.幽门螺杆菌(helicobacterpylori,hp)是一种寄生于胃粘膜的革兰氏阴性菌,是慢性消化系统疾病中常见的病菌,可感染胃部导致胃溃疡的发生,严重者可恶化成胃癌,严重威胁患者的健康和生命。幽门螺杆菌与消化性溃疡、消化系统肿瘤、消化道黏膜相关的淋巴组织淋巴瘤均密切相关,被世界卫生组织列为胃癌的ⅰ类致癌原。在我国,hp平均感染率约58.07%。
3.随着我国中医学的发展,中医研究者发现使用中药可有效地治疗幽门螺杆菌。藏医临床研究表明,藏药通过每日口服坐珠达西治疗颇瓦木布(胃溃疡),有效率高达90%,治疗久麻木布(十二指溃疡),愈合率81%,hp清除率15%。坐珠达西始载于《医学千万舍利》,具有疏肝、健胃、清热、愈溃疡、消肿功效,用于“木布”病迁延不愈,胃脘嘈杂、食物中毒以及陈旧内科疾病等。
4.目前,坐珠达西抗幽门螺杆菌感染引发的胃黏膜炎症及其机制不清楚。
技术实现要素:
5.本技术为了解决上述技术问题提供坐珠达西在抑制幽门螺杆菌感染引发胃黏膜炎症中的应用。
6.本技术通过下述技术方案实现:
7.坐珠达西在抑制幽门螺杆菌感染引发胃黏膜炎症中的应用。
8.进一步的,所述应用包括逆转幽门螺杆菌感染导致的胃黏膜损伤和减轻幽门螺杆菌感染导致的胃黏膜炎症。
9.优选地,所述幽门螺杆菌为标准菌株。
10.进一步的,所述胃黏膜炎症的病理程度与炎症因子的表达量相关。
11.优选地,所述炎症因子包括tnf-α、il-1α、il-6、il-8、pge2、nod1。
12.进一步的,tnf-α、il-1α、il-8和nod1的检测方法是real-time pcr。
13.进一步的,il-1α、il-6和pge2的检测方法是elisa法。
14.坐珠达西在制备抑制幽门螺杆菌感染引发胃黏膜炎症的药物中的应用。
15.优选地,所述坐珠达西的使用剂量为0.083g/kg或0.166g/kg。
16.进一步的,所述药物还包括药学上可接受的辅料。
17.与现有技术相比,本技术具有以下有益效果:
18.本发明在动物实验中,小鼠胃黏膜组织he病理染色显示hp感染后胃黏膜损伤,坐珠达西可在一定程度上逆转hp感染所致的胃黏膜损伤。与hp感染组比较,加坐珠达西后il-8、nod1的mrna水平显著降低,elisa结果显示il-1α、il-6、pge2在加药组显著降低,坐珠达
西可在一定程度上减轻hp感染所致的胃黏膜炎症。
附图说明
19.此处所说明的附图用来提供对本技术实施方式的进一步理解,构成本技术的一部分,并不构成对本发明实施方式的限定。
20.图1中a是本发明的动物实验环境图,b是动物实验控制系统界面图,c是饲养盒及垫料示意图;
21.图2中a是小鼠饲养示意图,b是小鼠灌胃示意图;
22.图3中a是小鼠解剖图,b是小鼠胃部示意图,c是小鼠取血示意图;
23.图4中a是预试验中阴性对照组小鼠胃黏膜组织hp免疫组化染色示意图,b是预试验中hp感染组小鼠胃黏膜组织hp免疫组化染色示意图;
24.图5中a是预试验中各组小鼠胃黏膜组织il-1α的real-time pcr检测示意图,b是预试验中各组小鼠胃黏膜组织il-8的real-time pcr检测示意图,c是预试验中各组小鼠胃黏膜组织tnf-α的real-time pcr检测示意图,d是预试验中各组小鼠胃黏膜组织nod1的real-time pcr检测示意图;
25.图6是预试验中各组小鼠血清ros水平示意图;
26.图7中a是预试验中各组小鼠血清il-1α的elisa试剂盒检测示意图,b是预试验中各组小鼠血清il-6的elisa试剂盒检测示意图,c是预试验中各组小鼠血清pge2的elisa试剂盒检测示意图;
27.图8中a是正式试验中阴性对照组小鼠胃黏膜组织hp免疫组化染色示意图,b是正式试验中hp感染组小鼠胃黏膜组织hp免疫组化染色示意图,c是正式试验中hp感染后药物治疗组(给药7天,剂量0.083g/kg)小鼠胃黏膜组织hp免疫组化染色示意图,d是正式试验中hp感染后药物治疗组(给药7天,剂量0.166g/kg)小鼠胃黏膜组织hp免疫组化染色示意图,e是正式试验中hp感染后药物治疗组(给药14天,剂量0.166g/kg)小鼠胃黏膜组织hp免疫组化染色示意图;
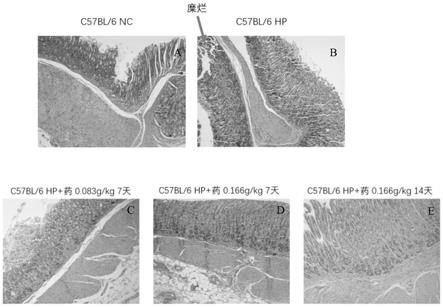
28.图9中a是正式试验中阴性对照组小鼠胃黏膜组织he病理染色示意图,b是正式试验中hp感染组小鼠胃黏膜组织he病理染色示意图,c是正式试验中hp感染后药物治疗组(给药7天,剂量0.083g/kg)小鼠胃黏膜组织he病理染色示意图,d是正式试验中hp感染后药物治疗组(给药7天,剂量0.166g/kg)小鼠胃黏膜组织he病理染色示意图,e是正式试验中hp感染后药物治疗组(给药14天,剂量0.166g/kg)小鼠胃黏膜组织he病理染色示意图;
29.图10中a是正式试验中各组小鼠胃黏膜组织il-1α的real-time pcr检测示意图,b是正式试验中各组小鼠胃黏膜组织il-8的real-time pcr检测示意图,c是正式试验中各组小鼠胃黏膜组织tnf-α的real-time pcr检测示意图,d是正式试验中各组小鼠胃黏膜组织nod1的real-time pcr检测示意图;
30.图11是正式试验中各组小鼠血清ros水平示意图;
31.图12中a是正式试验中各组小鼠血清il-1α的elisa试剂盒检测示意图,b是正式试验中各组小鼠血清il-6的elisa试剂盒检测示意图,c是正式试验中各组小鼠血清pge2的elisa试剂盒检测示意图。
具体实施方式
32.为使本技术的目的、技术方案和有益效果更加清楚,下面将结合实施方式中的附图,对本发明实施方式中的技术方案进行清楚、完整地描述。显然,所描述的实施方式是本发明一部分实施方式,而不是全部的实施方式。通常在此处附图中描述和示出的本发明实施方式的组件可以以各种不同的配置来布置和设计。
33.hp是人胃壁的寄生菌,不容易在动物繁殖,简单高效并能模拟人类感染病理过程的hp感染动物模型是研究常用的感染模型。可用来建立模型的动物种类繁多,对于hp感染动物模型来讲,其动物选择必须满足以下条件:
①
动物来源充足,操作经济简单;
②
胃肠道没有同属细菌的定植和繁殖;
③
能充分模拟人类感染hp的组织病理学特征;
④
感染持续时间够长,易于开展长期或较长期的观察;
⑤
纯系动物,易控制各种处理因素;
⑥
模型可重复性强,便于国际间对比和交流。小鼠是目前药效学试验最常用的啮齿类动物。因为该动物与人类具有大致相似的解剖生理和代谢特点,而且具有遗传背景清楚、体积小、消耗药量少、对药物的反应比较稳定、个体差异较小、以及易繁殖和饲养等优点,是目前国内外公认的用于药效学实验的动物类型。对幽门螺杆菌的感染动物模型构建较为成熟,是研究幽门螺杆菌感染及相关胃炎常用的动物模型。因此,本发明采用小鼠进行现代药理学实验,阐明藏药坐珠达西抗幽门螺杆菌的作用及其机制,形成藏药治疗幽门螺杆菌相关疾病的新方法、新技术和新方案,为扩大藏药的临床应用奠定基础。本发明采用的动物实验通过北京大学生物医学伦理委员会实验动物福利伦理分会的审查批准,批准号la2019343。
34.实施例一预试验
35.1.试验材料
36.(1)试验对象:spf级c57bl/6小鼠36只,雄性,6周龄,生产许可证号scxk(京)2017-0005,由中国食品药品检定研究院(大兴)动物资源中心提供。动物实验环境如图1所示,采用恒温恒湿spf(specific pathogen free)级动物实验室。小鼠采用cp-3型小鼠饲养笼,垫料为玉米芯垫料,喂食spf大小鼠维持饲料,饮用实验动物饮用水(图2a)。
37.表1动物体重信息表
38.购入动物体重及年龄给药时动物体重及年龄16g~20g(约6周龄)27g~32g(约12周龄)
39.(2)菌种:北京大学第三医院实验室存有的国际标准幽门螺杆菌(hp)ss1菌株。
40.(3)供试品及溶媒:坐珠达西成品药丸(1g/丸),坐珠达西的使用剂量为0.166g/kg,根据幽门螺杆菌根除治疗方案的常见治疗周期进行设置,给药7天、14天;溶媒为无菌pbs缓冲液。
41.表2供试品配制信息表
42.给药剂量称取(g)配制体积(ml)浓度(g干膏粉/ml)0.166g/kg1680mg168ml10mg/ml
43.(4)仪器和试剂
44.表3主要仪器信息表
[0045][0046][0047]
表4主要试剂信息表
[0048][0049][0050]
2.试验方法
[0051]
(1)幽门螺杆菌菌株培养
[0052]
国际标准幽门螺杆菌(hp)ss1菌株,可以直接复苏,用于实验。复苏方法:将冻存菌株在哥伦比亚选择性固体培养基、37℃、微需氧环境下(10%co2,5%o2,85%n2)复苏,培养48~72h后收集细菌。液体培养方法:将复苏后的细菌收集后加入至高压灭菌后的布氏肉汤培养液,微需氧环境下,37℃、110rpm恒温摇床中24~48h。培养的具体时间根据接种量大小而定。
[0053]
(2)幽门螺杆菌感染动物模型造模
[0054]
spf级c57小鼠12小时光照和12小时暗室饲养环境。hp复苏、培养,用无菌注射器抽
取无菌生理盐水冲洗hp培养板,收集hp,比浊法调整菌悬液量为1
×
108cfu/ml。用抗生素清除鼠胃内杂菌,进行预处理,后给予每只小鼠灌胃hp菌悬液0.5ml,隔天1次,共5次。每次灌胃前禁食禁水24h,灌胃4h后进食,之后正常饲养(图2b)。
[0055]
(3)试验分组
[0056]
1组-阴性对照组(12只);
[0057]
2组-hp感染组(12只);
[0058]
5组-hp感染+药物治疗组(6只),给药坐珠达西7天(坐珠达西给药剂量:0.166g/kg,溶于pbs);
[0059]
6组-hp感染+药物治疗组(6只),给药坐珠达西14天(坐珠达西给药剂量:0.166g/kg,溶于pbs)。
[0060]
(4)分组动物处理情况
[0061]
1)1组:自由进食水。
[0062]
2)2组、5组、6组:灌胃接种hp,3
×
108cfu/ml,0.5ml/只,隔天1次,共5次。每次灌胃前禁食禁水24h,灌胃4h后进食,之后正常饲养。
[0063]
3)动物正常饲养5周。末次灌胃后第5周,处死第一批小鼠。证明感染成功。
[0064]
第一批处死:阴性对照组(6只);hp感染组(6只)。
[0065]
4)药物治疗组,每日灌胃药物1次,连续7~14天。灌胃后30分钟内禁食水,之后正常饲养。末次给药后禁食不禁水24h。处死第二批小鼠。
[0066]
第二批处死:阴性对照组(6只);hp感染组(6只);hp感染+药物治疗组(每组各6只)。
[0067]
(5)预试验各组病理检测
[0068]
如图3所示,取胃进行大体观察、h&e染色明确病理类型、ws染色明确hp感染情况。探讨藏药处理对hp相关胃粘膜疾病的治愈作用以及对hp根除的治疗效果。收集小鼠胃黏膜组织,液氮环境下研磨hp感染的动物胃粘膜组织,用trizol法提取组织总rna进行real-time pcr,测定胃组织中与炎症、氧化应激相关的分子表达,包括炎症因子tnf-α、il-1α、il-6、il-8等。收集小鼠血清,用elisa法检测小鼠血清中ros水平及il-1α、il-6、pge2等。
[0069]
3.试验结果
[0070]
(1)hp免疫组化染色
[0071]
如图4所示,小鼠胃黏膜组织hp免疫组化染色显示:hp感染c57bl/6小鼠模型构建成功(10x)(nc:negative control,阴性对照组;hp:幽门螺杆菌感染组),表明已成功构建hp感染的小鼠动物模型。
[0072]
(2)real-time pcr检测胃黏膜组织的炎症因子
[0073]
如图5所示,il-1α在1组/6组间、2组/6组间有差异,加药后il-1α降低,但降低到比正常1组还低。1组/2组间未发现差异。
[0074]
il-8在1组/2组有区别,hp感染后明显升高。加药后与hp感染组相比,il-8有降低趋势,但差异未见统计学意义。
[0075]
tnf-α在1组/2组有区别,hp感染后明显升高。但加药后未见降低趋势。
[0076]
nod1在1组/2组有区别,hp感染后明显升高。加药7天组nod1降低。
[0077]
(3)血清活性氧(ros)检测试剂盒检测血清中ros水平
[0078]
如图6所示,1组/2组间比较,hp感染后有轻微升高趋势,但差异无统计学意义。加药14天组(6组)ros较2组降低。
[0079]
(4)elisa试剂盒检测血清中的炎症因子
[0080]
如图7所示,il-1α在2组比1组高,但差异未见统计学意义(p=0.057)。5组、6组均比2组低,差异有统计学意义。
[0081]
il-6在2组和1相比有升高,但差异无统计学意义。5组、6组均比2组低,差异有统计学意义。
[0082]
pge2在2组比1组高,但差异未见统计学意义(p=0.093)。5组、6组均比2组低,差异有统计学意义。
[0083]
实施例二正式试验
[0084]
1.试验材料
[0085]
(1)试验对象:spf级c57bl/6小鼠30只,雄性,6周龄,生产许可证号scxk(京)2017-0005,由中国食品药品检定研究院(大兴)动物资源中心提供。动物实验环境和饲养情况同实施例一。
[0086]
表5动物体重信息表
[0087]
购入动物体重及年龄给药时动物体重及年龄16g~20g(约6周龄)35g~40g(约19周龄)
[0088]
(2)菌种:同实施例一。
[0089]
(3)供试品及溶媒:坐珠达西成品药丸(1g/丸),坐珠达西的使用剂量为0.083g/kg、0.166g/kg,治疗周期、溶媒同实施例一。
[0090]
表6供试品配制信息表
[0091]
给药剂量称取(g)配制体积(ml)浓度(g干膏粉/ml)0.083g/kg152.72mg23ml6.64mg/ml0.166g/kg863.2mg65ml13.28mg/ml
[0092]
(4)仪器和试剂:同实施例一。
[0093]
2.试验方法
[0094]
(1)幽门螺杆菌菌株培养:同实施例一。
[0095]
(2)幽门螺杆菌感染动物模型造模:同实施例一。
[0096]
(3)试验分组
[0097]
1组-阴性对照组(6只);
[0098]
2组-hp感染组(6只);
[0099]
6组-hp感染+药物治疗组(6只),给药坐珠达西7天(坐珠达西给药剂量:0.083g/kg,溶于pbs);
[0100]
7组-hp感染+药物治疗组(6只),给药坐珠达西7天(坐珠达西给药剂量:0.166g/kg,溶于pbs);
[0101]
8组-hp感染+药物治疗组(6只),给药坐珠达西14天(坐珠达西给药剂量:0.166g/kg,溶于pbs)。
[0102]
(4)分组动物处理情况
[0103]
1)1组:自由进食水。2组、6组、7组和8组:灌胃接种hp,3
×
108cfu/ml,0.5ml/只,隔
天1次,共5次。每次灌胃前禁食禁水24h,灌胃4h后进食,之后正常饲养。
[0104]
2)动物正常饲养12周。末次灌胃后第12周,处死第一批小鼠。证明感染成功。
[0105]
第一批处死:阴性对照组(3只);hp感染组(3只)。
[0106]
3)药物治疗组,每日灌胃药物1次,连续7~14天。灌胃后30分钟内禁食水,之后正常饲养。末次给药后禁食不禁水24h。处死第二批小鼠。
[0107]
第二批处死:阴性对照组(3只);hp感染组(3只);hp感染+药物治疗组(每组各6只)。
[0108]
(5)预试验各组病理检测:同实施例一。
[0109]
3.试验结果
[0110]
(1)hp免疫组化染色
[0111]
如图8所示,小鼠胃黏膜组织hp免疫组化染色显示:hp感染c57bl/6小鼠模型构建成功(10x),表明已成功构建hp感染的小鼠动物模型。
[0112]
(2)胃黏膜病理组织学检查
[0113]
如图9所示,小鼠胃黏膜组织he病理染色显示:hp感染后胃黏膜损伤,坐珠达西可在一定程度上逆转hp感染所致的胃黏膜损伤(10x)。
[0114]
(3)real-time pcr检测胃黏膜组织的炎症因子
[0115]
如图10所示,2组与1组比较,il-1α明显升高,p=0.008;6组/7组/8组与2组比较,无差异(8组有降低趋势)。
[0116]
2组与1组比较,il-8明显升高,p=0.008;8组与2组比较,降低,差异有统计学意义,p=0.032。
[0117]
tnf-α在1组/2组未见区别。加药后未见降低趋势。
[0118]
2组与1组比较,nod1有升高趋势,但差异无统计学意义。加药6组/8组与2组比较,nod1有降低趋势,但差异无统计学意义。
[0119]
(4)血清活性氧(ros)检测试剂盒检测血清中ros水平
[0120]
如图11所示,1组/2组间比较,hp感染后有升高趋势,差异无统计学意义。加药组未见降低趋势。
[0121]
(5)elisa试剂盒检测血清中的炎症因子
[0122]
如图12所示,il-1α在2组比1组明显升高,p<0.001,6组/7组/8组与2组比较,明显降低,差异有统计学意义。
[0123]
il-6在2组比1组明显升高,p=0.001,7组/8组与2组比较,明显降低,差异有统计学意义。
[0124]
pge2在2组比1组明显升高,p<0.001,6组/7组/8组与2组比较,明显降低,差异有统计学意义。
[0125]
综上所述,通过两次动物实验和数据的统计学分析,结果表明:与单纯hp感染相比,坐珠达西治疗hp感染后,胃黏膜的炎症程度降低,坐珠达西对短时间(7天动物感染)hp感染时的胃黏膜组织中的炎症因子mrna表达有明显抑制作用,在长时间(14天动物感染)hp感染时,坐珠达西对血清中的炎症因子表达有明显抑制作用。提示藏药坐珠达西能有效控制hp引发的炎症反应。
[0126]
以上的具体实施方式,对本技术的目的、技术方案和有益效果进行了进一步详细
说明,所应理解的是,以上仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1