一种含白芍总苷的组合物、自微乳制剂及其制备方法和应用
1.本发明属于医药技术领域,具体涉及一种含白芍总苷的组合物、自微乳制剂及其制备方 法和应用。
背景技术:
2.类风湿关节炎(ra)是一种病因未明的慢性、以炎性滑膜炎为主的系统性疾病。服用糖 皮质激素及多种抗风湿药物治疗后能够达到临床缓解的比例仍然不足30%。经过2种及以上 的改善病情的抗风湿药物(dmards)正规治疗6个月,病情仍不能达到临床缓解或低疾病 活动度,或反复发作的这部分病人被称为难治性ra病人,目前没有有效的治疗药物,医生 主要是通过增加抗风湿药物的剂量或者联合不同靶点药物进行治疗,但是毒性也显著增加了。
3.最近的临床研究发现,atp结合盒式蛋白家族的成员p-糖蛋白(p-gp),在难治性和/ 或高疾病活性的类风湿关节炎患者的淋巴细胞或滑膜细胞上高表达。此外,抑制或减少p-gp 的表达可以克服难治性类风湿关节炎的药物抵抗和改善疾病活性。因此,通过调节p-gp克服 耐药性是治疗难治性类风湿关节炎的一种潜在的策略。
4.白芍总苷(tgp)在治疗类风湿关节炎和红斑狼疮方面具有一定的治疗效果,而且没有 显著的副作用。然而,芍药苷(白芍总苷的主要活性成分)的绝对生物利用度仅为3%-4%, 导致类风湿关节炎患者口服后白芍总苷后起效缓慢,临床效果差异大。目前针对白芍总苷的 药物传输系统,也无法提高类风湿关节炎的治疗效果。
5.因此,亟需提供一种含白芍总苷的药物制剂,能够提高白芍总苷的生物利用度,有效提 高类风湿关节炎的治疗效果。
技术实现要素:
6.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种含白 芍总苷的组合物、自微乳制剂,能够提高白芍总苷的生物利用度,有效提高类风湿关节炎的 治疗效果。
7.本发明第一方面提供了一种含白芍总苷的组合物。
8.具体的,一种含白芍总苷的组合物,包含白芍总苷和川陈皮素。
9.优选的,所述芍总苷和所述川陈皮素的质量比为(1-3):1。
10.本发明第二方面提供了一种含白芍总苷的自微乳制剂。
11.具体的,一种含白芍总苷的自微乳制剂,包含所述含白芍总苷的组合物、油相、表面活 性剂和助表面活性剂。
12.优选的,所述油相选自丙二醇单辛酸酯(cap 90)、二辛酸癸酸丙二醇酯(labrafil pg)、 单亚油酸甘油酯(maisine)、单油酸甘油酯(peceol)、中链甘油三酯(labrafac lipophilewl1349)、亚油酰聚氧乙烯(6)甘油酯(labrafil m2125cs)、油酰聚氧乙烯甘油酯(labrafilm1944cs)或单月桂酸丙二醇酯(lauroglycol 90)中的至少一种。进一步优选
的,所述油相 为丙二醇单辛酸酯。
13.优选的,所述表面活性剂选自聚氧乙烯蓖麻油(el35)、吐温、辛酸癸酸聚乙二醇甘油 酯(labrasol)或丙二醇单月桂酸甘油酯(lfcc)中的一种。
14.优选的,所述吐温为吐温20(tween 20、p20)或吐温80(tween80、p80)。
15.优选的,所述助表面活性剂选自聚乙二醇400(peg)、丙二醇双癸酸酯(lpg)、丙二醇 单乙基醚(thp)、丙二醇单月桂酸甘油酯(l 90)、丙二醇单月桂酸甘油酯(lfcc)、亚油酸聚乙 醇-6甘油酯(wl1349)、亚油酸聚乙二醇甘油酯(m2125cs)、油酸聚乙二醇甘油酯(m1944cs) 或丙二醇(pol)中的一种。
16.进一步优选的,所述助表面活性剂选自聚乙二醇400(peg)或丙二醇单乙基醚(thp)。
17.优选的,所述含白芍总苷的自微乳制剂,包含所述含白芍总苷的组合物、丙二醇单辛酸 酯、聚氧乙烯蓖麻油(el35)和聚乙二醇400(peg)。
18.优选的,所述含白芍总苷的自微乳制剂,包含所述含白芍总苷的组合物、丙二醇单辛酸 酯、聚氧乙烯蓖麻油(el35)和丙二醇单乙基醚(thp)。
19.采用由丙二醇单辛酸酯、聚氧乙烯蓖麻油和聚乙二醇400,或丙二醇单辛酸酯、聚氧乙 烯蓖麻油和丙二醇单乙基醚组成的纳米自微乳给药系统,能够有效提高川陈皮素和白芍总苷 配的生物利用度,从而提高类风湿关节炎的治疗效果。
20.优选的,在所述含白芍总苷的自微乳制剂中,所述油相的质量百分比为1%-19%;进一 步优选的,在所述含白芍总苷的自微乳制剂中,所述油相的质量百分比为8%-19%;更优选 的,在所述含白芍总苷的自微乳制剂中,所述油相的质量百分比为10%-17%。
21.优选的,在所述含白芍总苷的自微乳制剂中,所述表面活性剂与所述助表面活性剂的质 量比为(2-5):1;进一步优选的,在所述含白芍总苷的自微乳制剂中,所述表面活性剂与所 述助表面活性剂的质量比为(2-4):1;更优选的,在所述含白芍总苷的自微乳制剂中,所述 表面活性剂与所述助表面活性剂的质量比为(2.5-3.5):1。
22.优选的,所述含白芍总苷的自微乳制剂的浊点大于70℃。所述含白芍总苷的自微乳制剂 具有较高的浊点,其在常温或体温下均具有良好的稳定性。
23.本发明第三方面提供了一种含白芍总苷的自微乳制剂的制备方法。
24.具体的,一种含白芍总苷的自微乳制剂的制备方法,包括以下步骤:
25.将所述白芍总苷和所述川陈皮素溶解于溶剂中,然后加入所述油相、所述表面活性剂和 所述助表面活性剂,混合,去除所述溶剂,得到所述含白芍总苷的自微乳制剂。
26.优选的,所述溶剂为醇;进一步优选的,所述溶剂为乙醇。
27.本发明第四方面提供了一种含白芍总苷的组合物或自微乳制剂的应用。
28.具体的,所述含白芍总苷的组合物在制备抗风湿药物中的应用。
29.具体的,所述含白芍总苷的自微乳制剂在制备抗风湿药物中的应用。
30.一种抗风湿要药物,包含所述含白芍总苷的组合物或所述含白芍总苷的自微乳制剂。 川陈皮素(n),(3',4',5,6,7,8-六甲氧基黄酮,c
21h22
o8),是一种从柑橘皮中分离出的多甲基 黄酮,具有抗炎、抗癌、抗氧化、心血管保护和抗代谢紊乱作用。川陈皮素不仅具有抑制p-gp 的功能,增加了p-gp过表达的癌细胞和肿瘤中化疗药物的含量。而且研究发明川陈皮素还可 以增强大鼠对芍药苷的吸收。本发明利用川陈皮素作为p-gp的抑制剂,用于增
强tgp的生 物利用度,和克服p-gp过度表达淋巴细胞的耐药,能够提高类风湿关节炎的治疗效果。
31.基于溶解性、兼容性和伪三元相图研究,通过对油相、表面活性剂和第二便面活性剂的 控制,制备的自微乳制剂(尤其是由丙二醇单辛酸酯、聚氧乙烯蓖麻油和聚乙二醇400,或 丙二醇单辛酸酯、聚氧乙烯蓖麻油和丙二醇单乙基醚组成的纳米自微乳给药系统)具有优异 的效果。药代动力学数据表明,与白芍总苷单用相比,口服本发明提供的自微乳制剂能够提 高芍药苷的生物利用度435.04%。体外在体肠灌流和caco2研究数据表明,川陈皮素抑制芍 药苷的外排转运,而发明提供的自微乳制剂进一步增加了芍药苷的渗透性。在佐剂关节炎aia 模型上,低剂量甲氨蝶呤无明显治疗效果,但是发明提供的自微乳制剂可改善关节炎(aia) 大鼠的足肿胀、炎症细胞因子分泌和骨破坏。与正常淋巴细胞相比,aia大鼠淋巴细胞高表 达p-gp,而且mtx或tgp抗炎作用消失;而发明提供的自微乳制剂增加了aia大鼠淋巴细 胞和p-gp过表达的人thp-1细胞中芍药苷含量,从而逆转耐药和增强抗炎作用。在机制方面, 发明提供的自微乳制剂通过抑制aia大鼠淋巴细胞中的磷酸化akt和hif-1α通路来抑制 p-gp的蛋白质表达。
32.相对于现有技术,本发明的有益效果如下:
33.本发明通过使用川陈皮素和白芍总苷配合使用,并采用纳米乳化给药系统制得自微乳制 剂。所制备的自微乳制剂能够显著提高白芍总苷的溶解度和生物利用度,抑制p-gp作用增加 淋巴细胞的药物浓度,进而提高治疗难治性类风湿关节炎的疗效。
附图说明
34.图1为不同纳米自微乳给药系统的伪三元相图;
35.图2为实施例3和实施例9制备的含白芍总苷的自微乳制剂的粒径图;
36.图3为实施例9制备的含白芍总苷的自微乳制剂的透射电镜图(tem);
37.图4为不同稀释倍数下自微乳制剂的粒径分布;
38.图5为实施例3和实施例9制备的含白芍总苷的自微乳制剂中tgp的体外累积释放曲线;
39.图6为实施例3和实施例9制备的含白芍总苷的自微乳制剂在体外肠道灌注模型中对十 二指肠、空肠、回肠和结肠的渗透性图;
40.图7为芍药苷双向表观渗透性图;
41.图8为芍药苷的外排率图;
42.图9大鼠口服cep、cet、tgp+n、tgp后芍药苷的平均血药浓度-时间曲线图;
43.图10为thp1细胞或thp1-p-gp细胞中芍药苷的细胞内浓度;
44.图11为各组thp-1细胞中il-6、tnf-α、il-1β的mrna表达水平;
45.图12为各组thp-1-p-gp细胞中il-6、tnf-α、il-1β的mrna表达水平;
46.图13为aia大鼠淋巴细胞中p-gp的表达图;
47.图14为大鼠的外周血中表达p-糖蛋白(p-gp)的淋巴细胞的百分比图;
48.图15为从aia大鼠中分离的淋巴细胞对mtx和tgp的耐药性研究图;
49.图16为不同抑制剂对lps诱导产生的il-6、tnf-α和il-1β的抑制作用图;
50.图17为后足水肿体积曲线图;
51.图18为关节炎评分图;
52.图19为后爪的组织学代表性图、关节肿胀图、大鼠足部的x-ray ct图和aia大鼠用苏 木精和伊红染色的病理图;
53.图20为不同组中血清炎性细胞因子(il-6、tnf-α和il-1β)的变化图;
54.图21为p-gp、磷酸化akt、总akt和hif1-α在大鼠分离淋巴细胞中的蛋白表达;
55.图22为p-gp的相对蛋白表达;
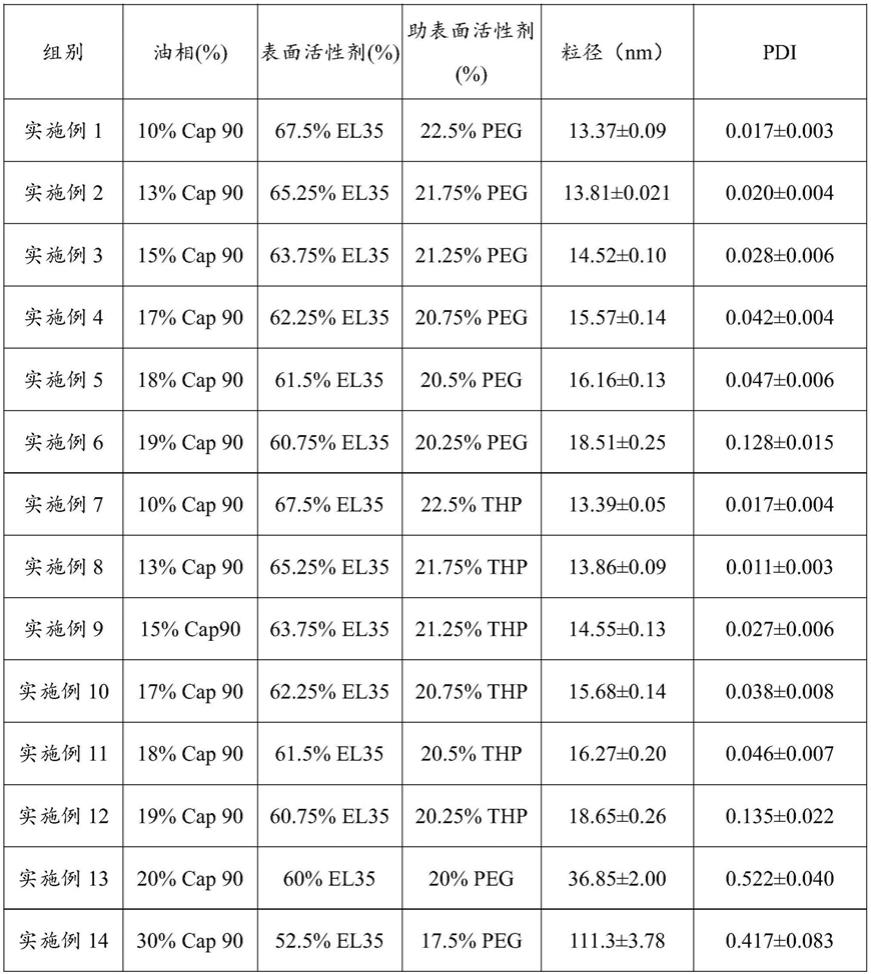
56.图23为hif1-α的相对蛋白表达;
57.图24为磷酸化akt/总akt的相对蛋白表达;
58.图25为cet、tgp、川陈皮素与白芍总苷共同给药(tgp+n)的aia大鼠淋巴细胞中 芍药苷的细胞内含量图。
具体实施方式
59.为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。 需要指出的是,以下实施例对本发明要求的保护范围不构成限制作用。
60.以下实施例中白芍总苷(tgp,含45.29%的芍药苷和10.58%的芍药内酯苷)购自宁波益 翠健生物科技有限公司;芍药苷(纯度≥98.0%)、川陈皮素(纯度≥98.0%)、芍药内酯苷(纯 度≥98.0%)、聚氧乙烯蓖麻油el35(el 35)、维拉帕米尔(ver)、吐温20(tween 20、 p20)、吐温80(tween80、p80)、聚乙二醇400(peg)、丙二醇(pol)购自于大连美 伦生物技术有限公司;甲氨蝶呤购自上海tci;甲酸购自fisher scientific;丙二醇单辛酸酯 (cap 90)、丙二醇双癸酸酯(lpg)、亚油酸聚乙醇-6甘油酯(wl1349)、亚油酸聚乙二醇甘 油酯(m2125cs)、油酸聚乙二醇甘油酯(m1944cs)、丙二醇单月桂酸甘油酯(l 90)、丙二醇单 月桂酸甘油酯(lfcc)、辛酸癸酸聚乙二醇甘油酯(labrasol)、丙二醇单乙基醚(thp)、单亚油 酸甘油酯(maisine)、单油酸甘油酯(peceol)购自france gattefoss
é
。hplc级甲醇购自默克公 司。il-6的elisa套件购买于r&d systems,tnf-α和il-1β购买于invitrogen thermo fisherscientific公司。akt、hif-1α和p-gp的主要抗体购买于cell signaling technology。其他化 学品和试剂均为分析级。
61.caco-2和人类单核细胞thp-1细胞系均来自atcc(细胞-中国细胞资源中心)。thp 1-p-gp细胞系过表达p-gp是通过将含有人类abcb1(mdr1,p-gp)基因的质粒转移到thp-1 细胞系中而形成的。caco-2细胞的培养条件为37℃,5%的二氧化碳和dmem培养基培养。 thp-1和thp1-p-gp的培养条件为温度37℃,5%二氧化碳,1640培养基培养。
62.实施例1-24
63.实施例1-24提供了含白芍总苷的自微乳制剂,其具体配方见表1所示。
64.实施例1-24中含白芍总苷的自微乳制剂的制备方法,包括以下步骤:
65.将(800g)白芍总苷和(350g)川陈皮素准确称量到500ml圆底烧瓶中,并通过超声 处理1小时溶解在100ml乙醇中。随后将选定的油相、表面活性剂和助表面活性剂加入到药 物溶液中,充分混合;然后将所得混合制剂通过旋转蒸发器在60℃真空下处理2小时,除去 乙醇,得到含白芍总苷的自微乳制剂。
66.对比例1-2提供了含白芍总苷的自微乳制剂,其具体配方见表1所示。
67.对比例1-2中含白芍总苷的自微乳制剂的制备方法,包括以下步骤:
68.将(800g)白芍总苷和(350g)川陈皮素准确称量到500ml圆底烧瓶中,并通过超声 处理1小时溶解在100ml乙醇中。随后将选定的油相和表面活性剂到药物溶液中,充分混合; 然后将所得混合制剂通过旋转蒸发器在60℃真空下处理2小时,除去乙醇。
69.表1
70.[0071][0072]
产品效果测试
[0073]
1.构建微乳的伪三元相图
[0074]
研究在没有白芍总苷和川陈皮素的情况下的snedds(纳米自微乳给药系统)的自乳化 区域。先制备表面活性剂el35和助表面活性剂(thp或peg)的混合物,再与适量的cap 90 以1:9到9:1(w/w)的比例混合来构建伪三元相图。表面活性剂和助表面活性剂(km)的比例 设置为1:1、2:1和3:1。图1为不同纳米自微乳给药系统的伪三元相图。图1中a代表表面活 性剂el35和助表面活性剂peg的比例(km)为1:1的伪三元相图,图1中b代表表面活性 剂el35和助表面活性剂thp的比例(km)为1:1的伪三元相图;图1中c代表表面活性剂 el35和助表面活性剂peg的比例(km)为2:1的伪三元相图,图1中d代表表面活性剂el35 和助表面活性剂thp的比例(km)为2:1的伪三元相图;图1中e代表表面活性剂el35和 助表面活性剂peg的比例(km)为3:1的伪三元相图,图1中f代表表面活性剂el35和助 表面活性剂thp的比例(km)为3:1的伪三元相图。
[0075]
由图1可知,随着km的增加,纳米乳液的面积增加。snedds中el35/peg或el35/thp 的比例为3:1时,效果最佳。
[0076]
2.含白芍总苷的自微乳制剂的体外评价
[0077]
(1)粒径和多分散指数(pdi)
[0078]
测试实施例1-24和对比例1-2制备的含白芍总苷的自微乳制剂的粒径和pdi。使用(马尔 文)激光粒度仪malvern zetasizer nano zs90(malvern instruments ltd.,
malvern,uk)在25℃ 下检测自微乳制剂的粒径和多分散指数(pdi)。测试结果见表1。
[0079]
由表1可知,当油相的百分比低于19%时,自微乳制剂的粒径在13.37-18.65nm之间并 且pdi值低于0.14。但是,如果油的百分比≥20%,pdi迅速增加到0.2以上,同时粒径增加 到100nm左右。粒径和pdi越小,snedds系统就越稳定。因此,实施例1-12制备的含白 芍总苷的自微乳制剂更稳定,药物生物利用度更高。
[0080]
如表1所示,当油相的百分比为15%,el35与peg或thp的km=3:1时(即实施例3 和实施例9),效果最佳。其中,在实施例3提供的含白芍总苷的自微乳制剂中,白芍总苷 和川陈皮素的最大载药量分别为64.95mg/g和30.56mg/g。在实施例9提供的含白芍总苷的 自微乳制剂中,白芍总苷和川陈皮素的最大载药量分别为63.85mg/g和30.71mg/g。
[0081]
图2为实施例3和实施例9制备的含白芍总苷的自微乳制剂的粒径图。在图2中,横坐 标为粒径,纵坐标为强度,图2中的cet代表实施例9制备的含白芍总苷的自微乳制剂,cep 代表实施例3制备的含白芍总苷的自微乳制剂。由图2可知,cet的平均粒径为14.55
±
0.13 nm,cep的平均粒径为14.52
±
0.10nm。此外,cep的pdi值为0.028
±
0.006,cet的pdi 值为0.027
±
0.006,远低于0.5,表明自微乳制剂粒径分布均匀。
[0082]
(2)zeta电位
[0083]
将实施例3和实施例9制备的含白芍总苷的自微乳制剂稀释100倍,使用(马尔文)激光 粒度仪malvern zetasizer nano zs90(malvern instruments ltd.,malvern,uk)测试其zeta 电位。经测试实施例9制备的含白芍总苷的自微乳制剂(cet)的zeta电位为-1.44
±
0.14mv, 实施例3制备的含白芍总苷的自微乳制剂(cep)的zeta电位为-1.73
±
0.06mv。由此可见, 以上自微乳制剂为纳米尺寸的透明乳液。
[0084]
(3)透射电子显微镜(tem)
[0085]
将实施例9制备的含白芍总苷的自微乳制剂(cet)用去离子水稀释后,滴在涂有碳膜 的铜网上,自然晾干。用2%w/v磷钨酸溶液染色阴性后,干燥后的样品在透射电子显微镜(feitecnai g2 20,美国)下观察自微乳制剂的形态。图3为实施例9制备的含白芍总苷的自微乳 制剂的tem图。由图3可知,实施例9制备的含白芍总苷的自微乳制剂在外观上具有球形小 球,并且在清晰的环境中均匀分布;没有观察到药物沉淀或聚结,表明重构分散体的稳定性。 此外,乳液尺寸约为20nm,基本与上述粒径结果一致。
[0086]
(4)热力学稳定性
[0087]
在不同条件下进行热力学稳定性研究,包括加热(45℃、48h)、冷藏(4℃、48h)、 离心(3500rpm、0.5h)和冷冻(-20℃、48h)、常温(25℃、48h)。在加热、离心和冻融 循环后的热力学稳定性测试中,实施例3和实施例9制备的含白芍总苷的自微乳制剂(cep 和cet)均显示出良好的稳定性,没有相分离。
[0088]
(5)浊点分析
[0089]
将实施例3和实施例9制备的含白芍总苷的自微乳制剂(cep和cet)用去离子水稀释 100倍,在37℃温和搅拌,然后逐渐升高温度。当浑浊突然出现时,记录温度作为浊点。该 实验平行进行三次。胃肠道中的相分离对药物吸收有负面影响,为避免药物制剂在胃肠道中 发生相分离,药物制剂的浊点应在37℃以上。经测试,实施例3和实施例9制备的含白芍总 苷的自微乳制剂(cep和cet)的浊点分别为74℃和77℃,表明它们在体温下是稳定的。
[0090]
(6)稀释对自微乳制剂稳定性的影响
[0091]
由于稀释介质可能会影响自微乳制剂的自乳化稳定性,并导致药物沉淀,因此通过以不 同倍数稀释来模拟体内逐渐稀释条件,测试自微乳制剂(cep和cet)。将实施例3和实施 例9制备的含白芍总苷的自微乳制剂(cep和cet)用去离子水稀释至10、20、50、100、 500和1000倍来评估稀释对微乳制剂稳定性的影响。使用(马尔文)激光粒度仪malvernzetasizer nano zs90在25℃下测定稀释的自微乳制剂的粒径。图4为不同稀释倍数下自微乳 制剂的粒径分布,在图4中,横坐标为稀释倍数,纵坐标为粒径。由图4可知,稀释10-1000 倍后,实施例3和实施例9制备的含白芍总苷的自微乳制剂(cep和cet)的粒径在10-20nm 范围内。此外,进一步测试,在12小时后,两种自微乳制剂没有观察到相分离或药物沉淀, 表明这两种自微乳制剂在水稀释后是稳定的。
[0092]
(7)体外药物释放测试
[0093]
自微乳制剂的体外药物释放是通过透析方法进行的,具体的,将实施例3和实施例9制 备的含白芍总苷的自微乳制剂(cep和cet)放入活化的透析膜(mwco 7000da,viskase,usa)中,并浸入900ml含有0.1%p 80(w/v)的释放介质(pbs,ph 7.4)中,在100rpm 和37
±
0.5℃下测试。在12h内按预定时间间隔取出释放介质(1ml),然后加入等体积的 释放介质。稀释后通过uplc-ms/ms测定芍药苷的浓度。图5为实施例3和实施例9制备的 含白芍总苷的自微乳制剂的tgp的体外累积释放曲线。在图5中,横坐标为时间,纵坐标为 累积释放量,图5中tgp曲线为单独的白芍总苷药物,cep曲线为实施例3制备的含白芍总 苷的自微乳制剂,cet曲线为实施例9制备的含白芍总苷的自微乳制剂。由图5可知,实施 例3和实施例9制备的含白芍总苷的自微乳制剂中芍药苷tgp,在4小时内从制剂中的累积 释放超过95%。由于自微乳制剂的粒径小,药物物释放的表面积更大,所以两种制剂中芍药 苷的释放速率均远高于单独的白芍总苷药物。
[0094]
3.大鼠肠道灌注研究
[0095]
sprague-dawley(sd)大鼠(250
±
20g)每笼饲养6只,并在25
±
2℃的12小时光/暗循环室 中适应性饲养7天。sd大鼠在实验前过夜禁食,自由饮水。动物研究均经广州中医药大学动 物护理和使用委员会批准(no#zyyl20150807)。大鼠禁食24h,自由饮水后,随机分为四 组(n=6):tgp(只含白芍总苷)、tgp+n(含白芍总苷和川陈皮素)、cep(实施例3制 备的含白芍总苷的自微乳制剂)和cet(实施例9制备的含白芍总苷的自微乳制剂)组。在 用硫喷妥钠(50mg/kg)麻醉后,在腹部中线切开以暴露小肠。四个肠部位包括十二指肠、空 肠、回肠和结肠,分离并插管。37℃生理盐水冲洗30分钟后,将含有目标药物或制剂的灌注 液(四组均为40mg/l tgp)连接到每个肠道,并使用灌注泵通过四个肠段的每个部分进行灌 注,流速为0.167ml/min,在2小时内从出口套管收集灌注液样品并通过uplc-ms/ms进行 分析。在四个肠段中计算芍药苷的有效渗透系数(p*eff)。
[0096]
图6为为实施例3和实施例9制备的含白芍总苷的自微乳制剂在体外肠道灌注模型中对 十二指肠、空肠、回肠和结肠的渗透性图。在图6中a代表对十二指肠的渗透性,b代表对 空肠的渗透性,c代表对回肠的渗透性,d代表对结肠的渗透性。其中,横坐标分别代表tgp、 tgp+n、cep和cet组,纵坐标均为有效渗透系数。
[0097]
由图6可知,实施例3和实施例9制备的含白芍总苷的自微乳制剂(cep和cet)在四 个肠段(十二指肠、空肠、回肠和结肠)中都显著增加了tgp(芍药苷)的吸收,p《0.001。 此外,cet在增加tgp通透性方面表现出比cep更高的功效。tgp(芍药苷)在十二指肠 的有效渗
透率最高(peff=0.110
±
0.018
×
10-4
cm/s),在结肠的渗透率最低(peff=0.090
±
0.012
ꢀ×
10-4
cm/s)的四个肠段。以芍药苷为指数的计算tgp在spip模型中的吸收率,实施例3和 实施例9制备的含白芍总苷的自微乳制剂(cep和cet)分别为3.36
±
0.30%和4.08
±
0.62%, 均高于单独给药的tgp(2.24%)。
[0098]
4.caco-2细胞的体外转运研究
[0099]
通过评估目标化合物或制剂从顶端绒毛面a(apical,相当于肠腔侧)到基底面b (basolateral,相当于肠内壁侧)(ap-bl)或从基底侧到顶端侧(bl-ap)的渗透性,研究了实施 例3和实施例9制备的含白芍总苷的自微乳制剂(cep和cet)在caco-2单层细胞模型上的 转运。在转运研究之前,将培养基替换为预热的汉克斯平衡盐溶液(hbss)。对于端绒毛面a 到基底面b(ap-bl)转运研究,外侧为0.5ml含测试药物的汉克斯平衡盐溶液,另一侧为 1.5ml空白汉克斯平衡盐溶液。对于基底面b到端绒毛面a(bl-ap)转运研究,基底侧为 1.5ml含测试药物的汉克斯平衡盐溶液,顶端为0.5ml空白汉克斯平衡盐溶液。在30、60、 90和120分钟的时间点收集来自ap(bl-ap)或bl(ap-bl)侧溶液的样品,然后补充等体积 的空白汉克斯平衡盐溶液。对样品进行uplc-ms/ms分析来测定芍药苷。
[0100]
以典型的p-gp抑制剂维拉帕米(ver)作为阳性对照,探讨了白芍总苷(tgp)、川陈 皮素(n)、cep和cet对tgp(芍药苷)在caco-2单层细胞上转运的影响。图7为芍药苷双 向表观渗透性图。在图7中,横坐标分别代表白芍总苷(tgp)、川陈皮素(n)、维拉帕米(ver)、 cep和cet组,纵坐标为双向表观渗透性。papp(a-b)代表芍药苷的papp值在顶端绒毛 面a到基底面b渗透;papp(b-a)代表芍药苷的papp值从基底面b到顶端绒毛面a方向 渗透。图8为芍药苷的外排率图,在图8中,横坐标分别代表白芍总苷(tgp)、川陈皮素 (n)、维拉帕米(ver)、cep和cet组,纵坐标为外排率。有图7、8可知,芍药苷的papp (b-a)远高于papp(a-b),芍药苷的外排率为3.98
±
0.46%。p-gp诱导的外排减少了tgp的吸 收,维拉帕米显著抑制tpg的外排,降低外排率至1.18
±
0.15%,并增加了tgp从a到b的 转运,表明抑制p-gp介导的外排可以增强肠道对tgp的吸收。
[0101]
n(川陈皮素)与tgp(白芍总苷)的联合给药将芍药苷的外排率降低到1.06
±
0.10,并 显著增加了芍药苷从a到b的转运。值得注意的是,川陈皮素在抑制p-gp方面比维拉帕米 更有效。cet的外排率降低至0.56
±
0.03,cep的外排比降至0.88
±
0.10,表明实施例3和实 施例9制备的含白芍总苷的自微乳制剂(cep和cet)均抑制了p-gp诱导的外排。此外, cep和cet表现出比n(川陈皮素)与tgp(白芍总苷)联合给药更高的渗透性。cet的 papp(ab)值与tgp组相比增加了4.67
±
0.20倍,与n(川陈皮素)与tgp(白芍总苷)共同 给药组相比增加了2.04
±
0.09倍,表明cet制剂不仅抑制了p-gp,同时也显著增加了肠细胞 对芍药苷的渗透性。
[0102]
5.药代动力学研究
[0103]
将大鼠随机分为四组(n=6):tgp(150mg/kg)、tgp(150mg/kg)+n(100mg/kg)、 cep和cet组。口服后,分别于0.083、0.25、0.5、1、2、3、4、6、8、10、12h尾静脉取 血100μl。血浆样品在uplc-ms/ms测量前储存在-80℃。采用das 2.0软件计算药代动力 学参数,包括平均停留时间(mrt
(0-t)
)、最大血浆浓度(c
max
)、达到最大血浆浓度的时间 (t
max
)、半衰期(t1/2z),血浆浓度-时间曲线下到最后一次或无穷大时间(auc
(0-t)
或auc
(0-∞)
), increased auc a
(增加的曲线下面积)和清除率(clz/f)。结果见表2所示。
[0104]
表2给药后芍药苷的药代动力学参数表
[0105][0106]
*p《0.05,**p《0.01,***p《0.00与tgp组相比;#p《0.05;##p《0.01,###p《0.001与tgp+n组相比。
[0107]
图9大鼠口服cep、cet、tgp+n、tgp后芍药苷的平均血药浓度-时间曲线图,在图9 中,横坐标为时间,纵坐标为平均血药浓度,图9中曲线分别代表cep、cet、tgp+n、tgp 组。由表2和图9可知,大鼠给予tgp后,芍药苷的t
max
(0.5h),平均c
max
约为282.17
±
76.26 ng/ml,表明tgp吸收快但吸收较差。cep、cet以及tgp+n都显著提高了芍药苷的吸收。 如表2所示,给予cet和cep后芍药苷的auc
0-t
比单独使用tgp增加了4.35和3.96倍, 表明cep、cet可以增加芍药苷的生物利用度。且,给予cep和cet后,芍药苷的血浆半 衰期t
1/2z
也比tgp组增加了6.14和3.96倍。此外,cet组和cep组芍药苷的clz/f分别降 低到16.01%和25.65%。由此可见,本发明提供的含白芍总苷的自微乳制剂提高了芍药苷的 生物利用度,提示纳米自微乳给药系统可以改善芍药苷的治疗效果并增加治疗的持续时间。
[0108]
6.过表达p-gp的thp-1细胞的摄取研究
[0109]
淋巴细胞和成纤维细胞样滑膜细胞上p-糖蛋白(p-gp)的高表达是难治性类风湿性关节 炎患者对抗风湿药物抵抗的主要原因之一。
[0110]
为了研究cet是否可以通过抑制p-gp的外排来逆转耐药,构建了一种过度表达p-gp的 人thp-1细胞系(简称thp-1-p-gp)。p-gp(p-糖蛋白)过表达的thp-1细胞(记为thp1-p-gp) 和thp1细胞接种在6孔板中(106个细胞/孔),rpmi 1640培养基含有100nm pma(丙 二醇甲醚醋酸酯),培养24小时。添加含有tgp、tgp+n、tgp+ver、cep或的培养基并 孵育4小时,在thp-1和thp-1-p-gp细胞中的给药剂量为:tgp(芍药苷10μm)、维拉 帕米(ver 2μm)、甲氨蝶呤(mtx 2.5μm)和川陈皮素(n 2μm)。4小时后,去除上 清液并用冷pbs缓冲液洗涤附着的细胞3次,然后用1%v/v triton x-100(聚乙二醇辛基苯 基醚)溶液裂解。然后在每个细胞裂解液中加入甲醇,将混合物在4℃、14000rpm下离心20 分钟。对上清液进行uplc-ms/ms分析以定量芍药苷。
[0111]
与敏感的thp-1细胞相比,评估thp-1-p gp细胞中tgp的细胞积累(以芍药苷的含量 表示)。图10为thp1-p-gp细胞中芍药苷的细胞内浓度,在图10中,横坐标为thp-1细胞 或thp-1-p-gp细胞中,添加含有tgp、tgp+n、tgp+ver、cep的各组,纵坐标为细胞中 芍药苷
的含量。图11为各组thp-1细胞中il-6、tnf-α、il-1β的mrna表达水平,在图 11中,从左往右依次为thp-1细胞中il-6、tnf-α、il-1β的mrna表达水平,横坐标代 表添加lps(脂多糖)、mtx(甲氨蝶呤)、tgp、tgp+n和cet组,纵坐标代表mrna 的相对表达水平(relative mrna level)。数据表示为平均值
±
sd。*p《0.05,**p《0.01, ***p《0.001vs.lps刺激的细胞,###p《0.001,与正常细胞相比。图12为各组thp-1-p-gp 细胞中il-6、tnf-α、il-1β的mrna表达水平,在图12中,从左往右依次为thp-1细胞 中il-6、tnf-α、il-1β的mrna表达水平,横坐标代表添加lps(脂多糖)、mtx(甲氨 蝶呤)、tgp、tgp+n和cet组,纵坐标代表mrna的相对表达水平(relative mrna level)。
[0112]
由图10-12可知,与thp-1细胞相比,thp-1-p gp细胞中芍药苷的含量显著降低 (-34.05%),表明p-gp高表达导致药物流出增加,细胞内药物浓度降低。tgp和 mtx可以抑制thp-1细胞中lps诱导的炎症因子tnf-α、il-1β和il-6mrna表 达的增加;但是,在相同剂量,它们在thp-1-p-gp细胞没有任何抗炎作用,即表明 thp-1-p-gp细胞对tgp和mtx产生耐药作用。图11和图12,证实了对mtx和tgp
[0113]
维拉帕米(一种p-gp的特异性抑制剂)和川陈皮素的存在增加了thp-1-p gp细胞中tgp (芍药苷)的细胞内浓度,表明p-gp参与了tgp的外排。与tgp浓度增加作用相一致,川 陈皮素或维拉帕米组共同给药组可以显著抑制thp-1-p-gp细胞中的细胞因子 (-23.66-44.36%)。相比之下,川陈皮素单独使用没有增强tgp在敏感thp-1细胞中的抗炎作 用,表明川陈皮素是通过抑制转运蛋白p-gp发挥增效作用的。
[0114]
此外,在thp-1-p gp细胞中使用cep和cet可以增加tgp在细胞内积累,比单独的 tgp高2.53
±
0.05和3.56
±
0.15倍。我们发现,给予相同剂量的tgp时,cet在thp-1-p-g 细胞中的tgp含量高于敏感的thp-1细胞,表明它不仅抑制了外排,也增强了tgp进入淋 巴细胞,达到了增加淋巴细胞转运的目的。因此,cet显著抑制了thp-1-p-gp细胞和敏感 thp-1细胞中的细胞因子。
[0115]
总之,本发明提供的含白芍总苷的自微乳制剂显著增加了耐药thp-1-p-gp细胞和敏感 thp-1细胞的细胞内药物浓度,从而增强了抗炎作用。
[0116]
7.rt-pcr
[0117]
细胞用100nm pma预处理24小时,用不同的药物孵育22小时,然后用lps(10ng/ml) 刺激2小时。处理后,用trizol试剂(invitrogentm)收集细胞,然后加入氯仿,在4℃下 以12,700rpm离心20分钟。向上清液中加入异丙醇(400ul)并在-40℃下冷冻30分钟。以 12,700rpm离心40分钟后,将沉淀的rna悬浮在1ml 75%乙醇中,并在4℃下以12,700rpm 离心5分钟。cdna的合成按照cdna合成试剂盒(accurate biotechnology)说明书进行。 引物序列如下:
[0118]
tnf-α引物对,其核苷酸序列分别如seq id no.1-2所示;
[0119]
il-1β引物对,其核苷酸序列分别如seq id no.3-4所述;
[0120]
il-6引物对,其核苷酸序列分别如seq id no.5-6所述;
[0121]
β-actin引物对,其核苷酸序列分别如seq id no.7-8所述。
[0122]
8.佐剂性关节炎大鼠模型和对aia大鼠淋巴细胞的耐药性研究
[0123]
进一步研究实施例9制备的含白芍总苷的自微乳制剂cet在大鼠佐剂诱发关节炎(aia) 模型中的抗关节炎作用,该模型通过将完全弗氏佐剂注射到左后爪的足底表而诱
发。首先, 为了建立难治性类风湿关节炎动物模型,评估了aia大鼠淋巴细胞中p-gp的表达。
[0124]
通过注射完全弗氏佐剂诱导大鼠佐剂性关节炎(aia)。将含有热灭活结核分枝杆菌的 矿物油100μl注射到sd大鼠(100-120g)左后爪的足底。然后在注射后第9天将大鼠随机 分为7组(n=6),包括正常组、模型组、mtx 0.5mg/kg组(mtx-l,0.5mg/kg/3天)、mtx 7.6mg/kg(mtx-h,7.6mg/kg/周)、tgp(150mg/kg/天)、tgp(150mg/kg/天)+n(100 mg/kg/天)和cet(含tgp 150mg/kg/天+n 100mg/kg/天)。每三天测量体重、足体积和关 节炎指数评分。关节炎严重程度根据传统方法用临床评分进行分级。在治疗后第30天,处死 大鼠,并通过苏木精和伊红(h&e)染色和ct扫描进行组织学检查以观察骨侵蚀。使用大 鼠血清测定炎症细胞因子,包括tnf-α、il-6、il-1β。
[0125]
为了研究淋巴细胞p-gp表达,根据试剂说明书(ficoll-paque premium,ge healthcarebio-sciences ab)制备大鼠淋巴细胞,并通过流式细胞仪进行鉴定。收集血液淋巴细胞(2
×
105个细胞)并与apc/cyanine7抗大鼠cd45、apc抗大鼠cd3和mdr pe抗体在4℃下孵育 30分钟,然后悬浮在pbs中进行流式细胞术分析。此外,为了研究逆转耐药效果,根据先前 描述的方法从对照组和aia模型组大鼠中分离淋巴细胞。在包含10%胎牛血清(fbs)的rpmi 1640培养基中重新悬浮后,将淋巴细胞与测试化合物和1μg/ml lps一起孵育36小时。在实 验结束时,使用台盼蓝染料排除法检测细胞活力(≥90%)。36小时后,收集淋巴细胞并以 500g离心10分钟。用上清液分析包括tnf-α、il-6、il-1β在内的细胞因子,同时用沉淀物 测定细胞内芍药苷含量。
[0126]
图13为aia大鼠淋巴细胞中p-gp的表达图,在图13中,各小图分别代表正常组(control)、 模型组(model)、mtx-l组、mtx-h组、tgp组、tgp+n组和cet组,各小图中横坐标均 为p-糖蛋白的表达(p-glycoprotein),纵坐标为淋巴细胞(cd3+)。
[0127]
图14为大鼠的外周血中表达p-糖蛋白(p-gp)的淋巴细胞的百分比图,横坐标为对照组 (control)、模型组(model)、mtx-l组、mtx-h组、tgp组、tgp+n组和cet组,纵坐 标为表达p-糖蛋白(p-gp)的淋巴细胞的百分比(p-gp positive of cd
3+
)。
[0128]
图15为aia大鼠中分离的淋巴细胞对mtx和tgp的耐药性图,图15中a代表mtx 和tgp对lps诱导产生的il-6的影响,其中,横坐标分别代表加或不加mtx、tgp和lps, 纵坐标为il-6的含量。图15中b代表mtx和tgp对lps诱导产生的tnf-α的影响,其中, 横坐标分别代表加或不加mtx、tgp和lps,纵坐标为tnf-α的含量。图15中c代表mtx 和tgp对lps诱导产生的il-1β影响,其中,横坐标分别代表加或不加mtx、tgp和lps, 纵坐标为il-1β的含量。图15中,contrl代表正常组,model为模型组。
[0129]
图16为不同抑制剂对lps诱导产生的il-6、tnf-α和il-1β的抑制作用图;图16中a 代表不同抑制剂对lps诱导产生的il-6的影响,其中,横坐标分别代表加mtx、tgp、tgp+n、 cet,纵坐标为il-6的含量。图16中b代表不同抑制剂对lps诱导产生的tnf-α的影响, 其中,横坐标分别代表加mtx、tgp、tgp+n、cet,纵坐标为tnf-α的含量。图16中c 代表不同抑制剂对lps诱导产生的il-1β影响,其中,横坐标分别代表加mtx、tgp、tgp+n、 cet,纵坐标为il-1β的含量。图13-16中所有数据均以平均值
±
sd表示。*p《0.01,**p《0.01, ***p《0.001与lps刺激的细胞相比,###p《0.001,与未刺激的细胞相比。
[0130]
首先,评估aia大鼠淋巴细胞中p-gp的表达。由图13-14可知,与从正常大鼠中分离
的 淋巴细胞(1.80
±
0.65%)相比,aia大鼠外周血中p-gp表达的淋巴细胞(11.97
±
3.57%,p《0.001) 显著增加。高剂量mtx治疗(mtx h,7.6mg/kg/周)显示出显著的疗效,控制了aia大鼠 的关节炎症状,降低关节炎评分(2.33
±
2.16,p《0.001)。与用高剂量mtx治疗的大鼠相 比,接受低剂量mtx治疗(mtx l,8.48
±
1.48%)的aia大鼠具有相对较高的p-gp过表 达淋巴细胞百分比(2.27
±
0.85%,p《0.001)。这些数据表明我们的ra动物模型对mtx 和tgp产生了耐药性,这与aia大鼠淋巴细胞中p-gp的高表达有关。
[0131]
由图15可知,在从aia大鼠中分离的淋巴细胞中,mtx(10μm)和tgp(10μm)不 能抑制lps诱导的炎性细胞因子包括tnf-α、il-1β和il-6的表达。然而,在相同剂量下, mtx和tgp对正常大鼠腹膜淋巴细胞显示出明确的抗炎作用。这些证实了aia大鼠中p-gp 过表达的淋巴细胞具有对mtx和tgp的耐药性性。
[0132]
最后评估p-gp抑制剂n和cet制剂是否可以克服aia大鼠淋巴细胞中p-gp诱导的耐 药,由图13、14、16可知,p-gp抑制剂n和tgp共同给药后aia大鼠中p-gp过表达的淋 巴细胞适度减少(5.77
±
0.47%)。与对aia大鼠p-gp过表达淋巴细胞的抑制作用一致,我 们发现n增强了tgp的抗炎作用(p《0.05)。在给予cet制剂后,aia大鼠中p-gp过表 达淋巴细胞的百分比(3.26
±
0.83%,p《0.001)与tgp组(9.17
±
2.64%)相比显著减少。 而cet显著抑制了炎症细胞因子(tnf-α、il-6、il-1β)的表达并成功逆转了aia大鼠p-gp 过表达淋巴细胞对tgp的耐药(p《0.01)。
[0133]
9.cet增强aia大鼠的抗关节炎作用
[0134]
比较cet,tgp+n,与单独的tgp的抗关节炎作用。图17为后足水肿体积曲线图,在 图17中,横坐标为时间,纵坐标为后足水肿体积,图17中曲线分别代表对照组(control)、 模型组(model)、mtx-l组(低剂量)、mtx-h组(高剂量)、tgp组、tgp+n组和cet 组。图18为关节炎评分图,图18中,横坐标为时间,纵坐标为关节炎评分,图18中曲线分 别代表对照组(control)、模型组(model)、mtx-l组(低剂量)、mtx-h组(高剂量)、 tgp组、tgp+n组和cet组。图19为后爪的组织学代表性图、关节肿胀图、小鼠足部的x-ray ct图和aia大鼠用苏木精和伊红染色的病理图,图19中,从上至下的a、b、c分别 代表关节肿胀图,小鼠足部的x-ray ct图和aia大鼠用苏木精和伊红染色的病理图,从左往 右依次为对照组(control)、模型组(model)、mtx-l组(低剂量)、mtx-h组(高剂量)、 tgp组、tgp+n组和cet组。图20为不同组中血清炎性细胞因子(il-6、tnf-α和il-1β) 的变化图,在图20中,从左往右依次代表炎性细胞因子il-6、tnf-α和il-1β的变化图,图 20中,横坐标均为对照组(control)、模型组(model)、mtx-l组(低剂量0.5mg/kg/3day)、 tgp组、tgp+n组、cet组和mtx-h组(高剂量7.6mg/kg/周),纵坐标依次为炎性细胞 因子il-6、tnf-α和il-1β的含量。所有数据均以平均值
±
sd表示。*p《0.05,**p《0.01, ***p《0.001与模型组相比;###p《0.001,与对照组相比。
[0135]
由图17-20可知,从造模第9天开始aia大鼠右后爪的关节炎评分(11.67
±
0.52,p《0.001) 和后爪水肿比正常大鼠急剧增加,这与形态观察一致。mtx-l组(单独使用时mtx 0.5mg/kg/3 天)和tgp组都没有明显的抗关节炎作用。治疗27天后,cet明显抑制aia大鼠的肿胀和 减少关节炎评分(5.50
±
2.26,p《0.001),其效果优于tgp和n的组合(8.67
±
2.80,p《0.05)。 此外,cet治疗显示出显著的抗炎作用。
[0136]
与正常大鼠相比,aia大鼠关节的x-ray ct图表明aia大鼠关节缝隙变窄和严重的
骨 侵蚀。cet组和mtx-h治疗均显示出对关节的显着保护作用并改善骨侵蚀。此外,组织学 结果表明,cet治疗抑制了免疫细胞的浸润和关节内的炎症。所有这些结果表明,cet增强 了抗关节炎作用,可预防对tgp和mtx耐药的aia大鼠的炎症和骨破坏。
[0137]
10.蛋白质印迹分析
[0138]
为了探索cet制剂的逆转耐药和抗炎作用的潜在机制,从aia大鼠的外周血中分离出 的淋巴细胞,用于测定细胞内芍药苷浓度以及p-gp的蛋白质印迹分析。
[0139]
用含有蛋白酶和磷酸酶抑制剂(roche life science,usa)的ripa缓冲液裂解细胞。将 等量的蛋白质加载到sds-page上并印迹到甲醇活化的pvdf膜(millipore,darmstadt, germany)上。在室温下与含有5%(w/v)牛血清白蛋白的封闭溶液在tbst缓冲液(10mm tris, ph 7.4,0.9%nacl和0.1%tween20)中孵育,然后将膜与一抗和二抗分别孵育。
[0140]
图21为p-gp、磷酸化akt、总akt和hif1-α在大鼠分离淋巴细胞中的蛋白表达,在 图21中,从左往右依次为对照组(control)、模型组(model)、mtx组、tgp组、tgp+n组 和cet组,从上至下依次为磷酸化akt(p-akt)、总akt(akt)、gapdh(甘油醛-3
‑ꢀ
磷酸脱氢酶,内参)、p-gp(p-糖蛋白)、hif1-α(缺氧诱导因子)和gapdh(甘油醛-3
‑ꢀ
磷酸脱氢酶,内参)。图22为p-gp的相对蛋白表达,在图22中,横坐标为对照组(control)、 模型组(model)、mtx l组、tgp组、tgp+n组和cet组,纵坐标为p-gp的相对蛋白表达。 图23为hif1-α的相对蛋白表达,在图23中,横坐标为对照组(control)、模型组(model)、 mtx l组、tgp组、tgp+n组和cet组,纵坐标为hif1-α的相对蛋白表达。图24磷酸化 akt/总akt的相对蛋白表达,在图24中,横坐标为对照组(control)、模型组(model)、 mtx l组、tgp组、tgp+n组和cet组,纵坐标为磷酸化akt/总akt的相对蛋白表达。 图25为cet、tgp、川陈皮素与白芍总苷共同给药(tgp+n)的aia大鼠淋巴细胞中芍药 苷的细胞内含量图,在图25中,横坐标依次代表tgp组、川陈皮素与白芍总苷共同给药组 (tgp+n)和cet组,纵坐标为细胞中芍药苷的含量。所有数据均以平均值
±
sd表示。* p《0.05,**p《0.01,***p《0.001与模型组相比;#p《0.05,##p《0.01,###p《0.001与对照组 相比。
[0141]
由图21-25可知,aia大鼠分离的淋巴细胞中p-gp的蛋白表达显着高于正常大鼠组 (1.61
±
0.31倍,p《0.05)。p-gp的表达受肿瘤中缺氧诱导因子-1-α(hif-1α)的调控,而通过 抑制hif-1α,可以下调p-gp逆转结肠癌的耐药性。此外,hif-α在控制免疫细胞代谢和功能 方面起着关键作用。通过与正常大鼠的淋巴细胞相比,aia大鼠淋巴细胞中hif-1α的水平显 著增加(3.45
±
0.24倍,p《0.001)。cet治疗对aia大鼠(p《0.001)和联合治疗组(tgp+n)(p《0.001) 淋巴细胞中hif-1α和p-gp的表达有显着抑制作用。
[0142]
此外,磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶(pi3k/akt)通路的激活在诱导癌症耐药 性中起关键作用,其可以调节p-gp的表达和功能。aia大鼠淋巴细胞中所表现的磷酸化akt 增加,观察到pi3k/akt通路的异常激活,这也可能有助于aia大鼠中p-gp的过度表达。cet 制剂或tgp与n的组合可以抑制了aia大鼠淋巴细胞中akt的磷酸化(p《0.001)。值得 注意的是,cet治疗的大鼠和n与tgp共同治疗的aia大鼠中分离的淋巴细胞中芍药苷的 细胞内浓度分别高3.20
±
0.23倍(p《0.001)和1.94
±
0.28倍(p《0.01)。数据表明,cet或n 通过下调aia大鼠淋巴细胞中的pi3k/akt和hif1-α通路,逆转了p-gp调节的耐药性,导 致细胞内药物浓度增加和抗关节炎作用,而cet效果更优。
[0143]
以上测试中,实施例1-2、4-8、10-12制备的自微乳制剂的效果与实施例3、9类似,实 施例3、9效果最优,而实施例13-24制备的自微乳制剂劣于实施例1-12。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1