对人类CD19具有专一性的抗体药剂和其用途的制作方法
对人类cd19具有专一性的抗体药剂和其用途
1.本技术是申请日为2016年10月11日、申请号为“201680025409.6”、名称为“对 人类cd19具有专一性的抗体药剂和其用途”的发明专利申请的分案申请。
2.相关申请案的交叉参考
3.本技术案要求2015年10月13日提交的美国临时专利申请案第62/240,624号的权 益,其以全文引用的方式并入本文中。
4.序列表
5.本发明参考以名是“eti-2015-11_st25.txt”的.txt文件形式以电子方式提交的序列 表。所述.txt文件创建于2016年10月5日且大小是178,524个字节。所述序列表的全部 内容以引用的方式并入本文中。
技术领域
6.本发明一般涉及对人类cd19具有专一性的抗体药剂和其用途。
背景技术:
7.随着基于抗体的技术的出现,在过去十年里,研发新颖的基于抗体的疗法来治疗癌 症已吸引了极大关注。实际上,多种形式(例如嵌合、人类化、人类、放射性标记、药物 结合、多专一性等)继续经研发且一些已经在癌症治疗中显示显著前景。一份2015年清 单报道接近二十四种治疗性抗体药剂已经在美国或欧洲获得上市许可或正在经审查用 于各种癌症适应症(参见珍妮斯赖克特(janice m.reichert),phd,赖克特生物技术咨询有 限责任公司(reichert biotechnology consulting llc),2015年5月26日)。特别有效抗体 药剂的研发仍然是挑战。
技术实现要素:
8.本发明尤其提供专一性结合cd19,具体地说人类cd19的人类抗体药剂、多专一 性结合剂(例如双专一性抗体)和嵌合抗原受体。在一些实施例中,与一或多种参考人类 抗体药剂、多专一性结合剂和/或嵌合抗原受体相比,所提供的人类抗体药剂、多专一性 结合剂和嵌合抗原受体显示对原生形式(例如在细胞表面上表达)的人类cd19的较高专 一性。在一些实施例中,所提供的人类抗体药剂、多专一性结合剂(例如双专一性抗体) 和嵌合抗原受体克服与用现有技术(例如工程改造的非人类动物、噬菌体呈现、由鼠来源 的抗体产生的人类化抗体等)研发的基于抗体的抗cd19疗法相关的次佳选择性。在一些 实施例中,所提供的人类抗体药剂、多专一性结合剂(例如双专一性抗体)和嵌合抗原受 体有效介导以cd19表达为特征的癌细胞(例如淋巴瘤和/或白血病)的杀死。
9.虽然本文深入讨论使用含有人类序列(即包括人类cdr序列的人类重链和轻链可变 区序列)的抗体药剂的实施例,本发明还提供非人类抗体药剂。在一些实施例中,非人类 抗体药剂包含来自如本文所描述的抗体药剂的人类cdr序列和非人类构架序列。在一 些实施例中,非人类构架序列包括可用于使用一或多个如本文所描述的人类cdr序列 产生合成
重链和/或轻链可变区的任何序列,包括例如哺乳动物,例如小鼠、大鼠、兔、 猪、牛(例如母牛、公牛、水牛)、鹿、绵羊、山羊、鸡、猫、狗、雪貂、灵长类动物(例 如狨猴、恒河猴)等。在一些实施例中,所提供的抗体药剂包括通过将如本文所描述的一 或多个人类cdr序列移植到非人类构架序列(例如小鼠或鸡构架序列)上产生的抗体药 剂。在许多实施例中,所提供的抗体药剂是人类抗体药剂(例如人类单克隆抗体或其片段、 人类抗原结合蛋白质或多肽、人类多专一性结合剂[例如人类双专一性抗体]、具有人类 免疫球蛋白多肽的一或多种结构组分的人类多肽)。
[0010]
在一些实施例中,本发明提供专一性结合人类cd19的抗体药剂,其中所述抗体药 剂包含重链cdr1(hc-cdr1)、重链cdr2(hc-cdr2)和重链cdr3(hc-cdr3),和轻 链cdr1(lc-cdr1)、轻链cdr2(lc-cdr2)和轻链cdr3(lc-cdr3),
[0011]
其中所述hc-cdr1包含g-x
1-x
2-f-x
3-s-x
4-x5(seq id no:291),且其中x1是f、 g、y或v,x2是s或t,x3是s或t,x4是n或y,且x5是a、w或y;
[0012]
其中所述hc-cdr2包含i-x
6-p-x
7-x
8-x
9-x
10-t(seq id no:292),且其中x6是s、 d或y,x7是e、s、g或i,x8是d、f或v,x9是g或s,且x
10
是k、e、y、d或 t;
[0013]
其中所述lc-cdr1包含s-s-n-x
11-g-x
12-x
13-x
14
(seq id no:293)或n-i-g-s-x
15-s (seq id no:294),且其中x
11
是i或v,x
12
是n、s或t,x
13
是n、h或k,x
14
是y、 a或t,且x
15
是k或e;和/或
[0014]
其中所述lc-cdr2包含x
16-x
17-x
18
(seq id no:295),且其中x
16
是d、e、s、r 或y,x
17
是n或d,且x
18
是n、y、s或d。
[0015]
在一些实施例中,本发明提供专一性结合人类cd19的人类抗体药剂,其中所述人 类抗体药剂包含一或多个各自具有与一或多个选自表2的重链cdr至少50%(例如至少 约55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%) 一致的序列的重链cdr,和/或一或多个各自具有与一或多个选自表3的轻链cdr至少 50%(例如至少约55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、 98%或99%)一致的序列的轻链cdr。
[0016]
在一些实施例中,人类抗体药剂包含各自具有与seq id no:73、seq id no:74和 seq id no:75中所示的重链cdr1、重链cdr2和重链cdr3中的每一个至少95%一致 的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有与seq id no:181、seq idno:182和seq id no:183中所示的轻链cdr1、轻链cdr2和轻链cdr3中的每一个 至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0017]
在一些实施例中,人类抗体药剂包含各自具有与seq id no:76、seq id no:77和 seq id no:78中所示的重链cdr1、重链cdr2和重链cdr3中的每一个至少95%一致 的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有与seq id no:184、seq idno:185和seq id no:186中所示的轻链cdr1、轻链cdr2和轻链cdr3中的每一个 至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0018]
在一些实施例中,人类抗体药剂包含各自具有与seq id no:79、seq id no:80和 seq id no:81中所示的重链cdr1、重链cdr2和重链cdr3中的每一个至少95%一致 的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有与seq id no:187、seq idno:188和seq id no:189中所示的轻链cdr1、轻链cdr2和轻链cdr3中的每一个 至少95%一致的序列的轻链
id no:213中所示的轻链cdr1、轻链cdr2和轻链cdr3中的 每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0027]
在一些实施例中,人类抗体药剂包含各自具有与seq id no:106、seq id no:107 和seq id no:108中所示的重链cdr1、重链cdr2和重链cdr3中的每一个至少95% 一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有与seq id no:214、 seq id no:215和seq id no:216中所示的轻链cdr1、轻链cdr2和轻链cdr3中的 每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0028]
在一些实施例中,人类抗体药剂包含各自具有与seq id no:109、seq id no:110 和seq id no:111中所示的重链cdr1、重链cdr2和重链cdr3中的每一个至少95% 一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有与seq id no:217、 seq id no:218和seq id no:219中所示的轻链cdr1、轻链cdr2和轻链cdr3中的 每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0029]
在一些实施例中,人类抗体药剂包含各自具有与seq id no:112、seq id no:113 和seq id no:114中所示的重链cdr1、重链cdr2和重链cdr3中的每一个至少95% 一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有与seq id no:220、 seq id no:221和seq id no:222中所示的轻链cdr1、轻链cdr2和轻链cdr3中的 每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0030]
在一些实施例中,人类抗体药剂包含各自具有与seq id no:115、seq id no:116 和seq id no:117中所示的重链cdr1、重链cdr2和重链cdr3中的每一个至少95% 一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有与seq id no:223、 seq id no:224和seq id no:225中所示的轻链cdr1、轻链cdr2和轻链cdr3中的 每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0031]
在一些实施例中,人类抗体药剂包含各自具有与seq id no:118、seq id no:119 和seq id no:120中所示的重链cdr1、重链cdr2和重链cdr3中的每一个至少95% 一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有与seq id no:226、 seq id no:227和seq id no:228中所示的轻链cdr1、轻链cdr2和轻链cdr3中的 每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0032]
在一些实施例中,人类抗体药剂包含各自具有与seq id no:121、seq id no:122 和seq id no:123中所示的重链cdr1、重链cdr2和重链cdr3中的每一个至少95% 一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有与seq id no:229、 seq id no:230和seq id no:231中所示的轻链cdr1、轻链cdr2和轻链cdr3中的 每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0033]
在一些实施例中,人类抗体药剂包含seq id no:73、seq id no:74和seq id no:75 的重链cdr和seq id no:181、seq id no:182和seq id no:183的轻链cdr。
[0034]
在一些实施例中,人类抗体药剂包含seq id no:76、seq id no:77和seq id no:78 的重链cdr和seq id no:184、seq id no:185和seq id no:186的轻链cdr。
[0035]
在一些实施例中,人类抗体药剂包含seq id no:79、seq id no:80和seq id no:81 的重链cdr和seq id no:187、seq id no:188和seq id no:189的轻链cdr。
[0036]
在一些实施例中,人类抗体药剂包含seq id no:82、seq id no:83和seq id no:
84 的重链cdr和seq id no:190、seq id no:191和seq id no:192的轻链cdr。
[0037]
在一些实施例中,人类抗体药剂包含seq id no:85、seq id no:86和seq id no:87 的重链cdr和seq id no:193、seq id no:194和seq id no:195的轻链cdr。
[0038]
在一些实施例中,人类抗体药剂包含seq id no:88、seq id no:89和seq id no:90 的重链cdr和seq id no:196、seq id no:197和seq id no:198的轻链cdr。
[0039]
在一些实施例中,人类抗体药剂包含seq id no:91、seq id no:92和seq id no:93 的重链cdr和seq id no:199、seq id no:200和seq id no:201的轻链cdr。
[0040]
在一些实施例中,人类抗体药剂包含seq id no:94、seq id no:95和seq id no:96 的重链cdr和seq id no:202、seq id no:203和seq id no:204的轻链cdr。
[0041]
在一些实施例中,人类抗体药剂包含seq id no:97、seq id no:98和seq id no:99 的重链cdr和seq id no:205、seq id no:206和seq id no:207的轻链cdr。
[0042]
在一些实施例中,人类抗体药剂包含seq id no:100、seq id no:101和seq idno:102的重链cdr和seq id no:208、seq id no:209和seq id no:210的轻链cdr。
[0043]
在一些实施例中,人类抗体药剂包含seq id no:103、seq id no:104和seq idno:105的重链cdr和seq id no:211、seq id no:212和seq id no:213的轻链cdr。
[0044]
在一些实施例中,人类抗体药剂包含seq id no:106、seq id no:107和seq idno:108的重链cdr和seq id no:214、seq id no:215和seq id no:216的轻链cdr。
[0045]
在一些实施例中,人类抗体药剂包含seq id no:109、seq id no:110和seq idno:111的重链cdr和seq id no:217、seq id no:218和seq id no:219的轻链cdr。
[0046]
在一些实施例中,人类抗体药剂包含seq id no:112、seq id no:113和seq idno:114的重链cdr和seq id no:220、seq id no:221和seq id no:222的轻链cdr。
[0047]
在一些实施例中,人类抗体药剂包含seq id no:115、seq id no:116和seq idno:117的重链cdr和seq id no:223、seq id no:224和seq id no:225的轻链cdr。
[0048]
在一些实施例中,人类抗体药剂包含seq id no:118、seq id no:119和seq idno:120的重链cdr和seq id no:226、seq id no:227和seq id no:228的轻链cdr。
[0049]
在一些实施例中,人类抗体药剂包含seq id no:121、seq id no:122和seq idno:123的重链cdr和seq id no:229、seq id no:230和seq id no:231的轻链cdr。
[0050]
在一些实施例中,本发明提供与包含以下的人类抗体药剂竞争结合cd19的人类抗 体药剂:(a)seq id no:73、seq id no:74和seq id no:75的重链cdr和seq idno:181、seq id no:182和seq id no:183的轻链cdr;(b)seq id no:76、seq idno:77和seq id no:78的重链cdr和seq id no:184、seq id no:185和seq idno:186的轻链cdr;(c)seq id no:79、seq id no:80和seq id no:81的重链cdr 和seq id no:187、seq id no:188和seq id no:189的轻链cdr;(d)seq id no:82、 seq id no:83和seq id no:84的重链cdr和seq id no:190、seq id no:191和seqid no:192的轻链cdr;(e)seq id no:85、seq id no:86和seq id no:87的重链cdr 和seq id no:193、seq id no:194和seq id no:195的轻链cdr;(f)seq id no:88、 seq id no:89和seq id no:90的重链cdr和seq id no:196、seq id no:197和seqid no:198的轻链cdr;(g)seq id no:91、seq id no:92和seq id no:93的重链cdr 和seq id no:199、seq id no:200和seq id no:201的轻链cdr;(h)seq id no:94、 seq id no:95和seq id no:96的重链cdr和seq id no:202、seq id no:203和seqid no:
少95%一致的序列的轻链可变区。
[0061]
在一些实施例中,人类抗体药剂包含具有与seq id no:8中出现的重链可变区序列 至少95%一致的序列的重链可变区,和具有与seq id no:8中出现的轻链可变区序列至 少95%一致的序列的轻链可变区。
[0062]
在一些实施例中,人类抗体药剂包含具有与seq id no:10中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:10中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0063]
在一些实施例中,人类抗体药剂包含具有与seq id no:12中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:12中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0064]
在一些实施例中,人类抗体药剂包含具有与seq id no:14中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:14中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0065]
在一些实施例中,人类抗体药剂包含具有与seq id no:16中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:16中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0066]
在一些实施例中,人类抗体药剂包含具有与seq id no:18中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:18中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0067]
在一些实施例中,人类抗体药剂包含具有与seq id no:20中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:20中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0068]
在一些实施例中,人类抗体药剂包含具有与seq id no:22中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:22中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0069]
在一些实施例中,人类抗体药剂包含具有与seq id no:24中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:24中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0070]
在一些实施例中,人类抗体药剂包含具有与seq id no:26中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:26中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0071]
在一些实施例中,人类抗体药剂包含具有与seq id no:28中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:28中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0072]
在一些实施例中,人类抗体药剂包含具有与seq id no:30中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:30中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0073]
在一些实施例中,人类抗体药剂包含具有与seq id no:32中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:32中出现的轻链可变区序 列
至少95%一致的序列的轻链可变区。
[0074]
在一些实施例中,人类抗体药剂包含具有与seq id no:34中出现的重链可变区序 列至少95%一致的序列的重链可变区,和具有与seq id no:34中出现的轻链可变区序 列至少95%一致的序列的轻链可变区。
[0075]
在一些实施例中,人类抗体药剂包含seq id no:2、seq id no:4、seq id no:6、 seq id no:8、seq id no:10、seq id no:12、seq id no:14、seq id no:16、seq idno:18、seq id no:20、seq id no:22、seq id no:24、seq id no:26、seq id no:28、 seq id no:30、seq id no:32和seq id no:34中的任一个中出现的重链和轻链可变区 序列。
[0076]
在一些实施例中,本发明提供专一性结合人类cd19的人类抗体药剂,其中与亲本 (或参考)人类抗体药剂相比,所述人类抗体药剂包含一或多种氨基酸取代,且其中所述 人类抗体药剂包含(a)seq id no:124、seq id no:125和seq id no:126的重链cdr 和seq id no:232、seq id no:233和seq id no:234的轻链cdr;(b)seq id no:127、 seq id no:128和seq id no:129的重链cdr和seq id no:235、seq id no:236和 seq id no:237的轻链cdr;(c)seq id no:130、seq id no:131和seq id no:132 的重链cdr和seq id no:238、seq id no:239和seq id no:240的轻链cdr;(d)seqid no:133、seq id no:134和seq id no:135的重链cdr和seq id no:241、seq idno:242和seq id no:243的轻链cdr;(e)seq id no:136、seq id no:137和seq idno:138的重链cdr和seq id no:244、seq id no:245和seq id no:246的轻链cdr; (f)seq id no:139、seq id no:140和seq id no:141的重链cdr和seq id no:247、 seq id no:248和seq id no:249的轻链cdr;(g)seq id no:142、seq id no:143 和seq id no:144的重链cdr和seq id no:250、seq id no:251和seq id no:252 的轻链cdr;(h)seq id no:145、seq id no:146和seq id no:147的重链cdr和seqid no:253、seq id no:254和seq id no:255的轻链cdr;(i)seq id no:148、seq idno:149和seq id no:150的重链cdr和seq id no:256、seq id no:257和seq idno:258的轻链cdr;(j)seq id no:151、seq id no:152和seq id no:153的重链cdr 和seq id no:259、seq id no:260和seq id no:261的轻链cdr;(k)seq id no:154、 seq id no:155和seq id no:156的重链cdr和seq id no:262、seq id no:263和 seq id no:264的轻链cdr;(l)seq id no:157、seq id no:158和seq id no:159的 重链cdr和seq id no:265、seq id no:266和seq id no:267的轻链cdr;(m)seqid no:160、seq id no:161和seq id no:162的重链cdr和seq id no:268、seq idno:269和seq id no:270的轻链cdr;(n)seq id no:163、seq id no:164和seq idno:165的重链cdr和seq id no:271、seq id no:272和seq id no:273的轻链cdr; (o)seq id no:166、seq id no:167和seq id no:168的重链cdr和seq id no:274、 seq id no:275和seq id no:276的轻链cdr;(p)seq id no:169、seq id no:170 和seq id no:171的重链cdr和seq id no:277、seq id no:278和seq id no:279 的轻链cdr;(q)seq id no:172、seq id no:173和seq id no:174的重链cdr和seqid no:280、seq id no:281和seq id no:282的轻链cdr;(r)seq id no:175、seq idno:176和seq id no:177的重链cdr和seq id no:283、seq id no:284和seq idno:285的轻链cdr;或(s)seq id no:178、seq id no:179和seq id no:180的重链 cdr和seq id no:286、seq id no:287和seq id no:288的轻链cdr。在某些实施 例中,与如本文所描述的亲本(或参考)抗体药剂相比,如本文所描述的抗体药剂包含1-5 种氨基酸取代。
[0077]
在一些实施例中,人类抗体药剂包含在选自由10、16、25、34、52、54、68、69、 72、75、93、95和其组合组成的群组的氨基酸位置中的任一个处包含一或多种氨基酸取 代的轻链可变区。在某些实施例中,一或多种氨基酸取代包括v10m、k16e、s25n、 v34i、d52n、l54q、n68t、t69m、l72m、s75n、s93t、d95e、d95g或其组合。
[0078]
在一些实施例中,人类抗体药剂包含在选自由3、12、16、17、25、26、32、63、 69、97、102、106、108、109、113、116、117和其组合组成的群组的氨基酸位置中的 任一个处包含一或多种氨基酸取代的重链可变区。在某些实施例中,一或多种氨基酸取 代包括q3r、k12e、e16g、s17f、s25a、g26a、y32f、s63f、t69a、a97v、t102s、 m106l、y108n、d109e、q113l、l116m、m117l或其组合。
[0079]
在一些实施例中,人类抗体药剂包含具有氨基酸取代s75n的轻链可变区。在一些 实施例中,人类抗体药剂包含具有氨基酸取代t69m的轻链可变区。在一些实施例中, 人类抗体药剂包含具有氨基酸取代d52n和d95e的轻链可变区。在一些实施例中,人 类抗体药剂包含具有氨基酸取代v10m和d95g的轻链可变区。在一些实施例中,人类 抗体药剂包含具有氨基酸取代s93t的轻链可变区和具有氨基酸取代s17f和t69a的重 链可变区。在一些实施例中,人类抗体药剂包含具有氨基酸取代n68t的轻链可变区和 具有氨基酸取代s17f和y108n的重链可变区。在一些实施例中,人类抗体药剂包含具 有氨基酸取代s63f的重链可变区。在一些实施例中,人类抗体药剂包含具有氨基酸取 代q3r、y32f和a97v的重链可变区。在一些实施例中,人类抗体药剂包含具有氨基 酸取代k16e的轻链可变区。在一些实施例中,人类抗体药剂包含具有氨基酸取代m117l 的重链可变区。
[0080]
在一些实施例中,人类抗体药剂包含具有氨基酸取代l72m的轻链可变区,和具有 氨基酸取代s25a的重链可变区。在一些实施例中,人类抗体药剂包含具有氨基酸取代 t102s和l116m的重链可变区。在一些实施例中,人类抗体药剂包含具有氨基酸取代 s25n和v34i的轻链可变区,和具有氨基酸取代k12e和d109e的重链可变区。在一些 实施例中,人类抗体药剂包含具有氨基酸取代e16g的重链可变区。在一些实施例中, 人类抗体药剂包含具有氨基酸取代l54q的轻链可变区,和具有氨基酸取代m106l的重 链可变区。在一些实施例中,人类抗体药剂包含具有氨基酸取代s25n的轻链可变区。 在一些实施例中,人类抗体药剂包含具有氨基酸取代g26a和q113l的重链可变区。在 一些实施例中,人类抗体药剂包含具有氨基酸取代l54q的轻链可变区。在一些实施例 中,人类抗体药剂包含具有氨基酸取代t102s的重链可变区。
[0081]
在一些实施例中,氨基酸取代选自表8。
[0082]
在一些实施例中,本发明提供专一性结合人类cd19的人类抗体药剂,其中与亲本 (或参考)人类抗体药剂相比,所述人类抗体药剂包含一或多种氨基酸取代(例如1-5种氨 基酸取代),且其中所述人类抗体药剂包含seq id no:36、seq id no:38、seq id no:40、 seq id no:42、seq id no:44、seq id no:46、seq id no:48、seq id no:50、seq idno:52、seq id no:54、seq id no:56、seq id no:58、seq id no:60、seq id no:62、 seq id no:64、seq id no:66、seq id no:68、seq id no:70和seq id no:72中的 任一个中出现的重链和轻链可变区序列。在某些实施例中,亲本(或参考)抗体药剂包含 seq id no:30或seq id no:32的hcvr和lcvr。
[0083]
在一些实施例中,人类抗体药剂是人类单克隆抗体或其片段。
[0084]
在一些实施例中,人类抗体药剂是包含变异fc区的人类单克隆抗体。在一些实施 例中,与亲本(或参考)fc区相比,变异fc区包含一或多种氨基酸取代。在一些实施例 中,与包含野生型(或亲本或参考)fc区的亲本人类单克隆抗体相比,人类单克隆抗体包 含变异糖基化模式。在一些实施例中,人类单克隆抗体是igg1、igg2、igg3或igg4抗 体。在某些实施例中,人类单克隆抗体是igg1。
[0085]
在一些实施例中,人类抗体药剂与治疗剂或检测剂结合。
[0086]
在一些实施例中,人类抗体药剂与细胞毒性剂或部分结合。
[0087]
在一些实施例中,人类抗体药剂与放射性同位素结合。
[0088]
在一些实施例中,人类抗体药剂是或包含免疫球蛋白、fab、f(ab')2、fd、fv、单链 fv(scfv)或dab。在某些实施例中,人类抗体药剂是或包含scfv。在一些实施例中,scfv 包含连接序列。在一些实施例中,scfv与治疗剂或检测剂结合。在一些实施例中,scfv 是嵌合抗原受体的一部分。
[0089]
在一些实施例中,本发明提供如本文所描述的人类抗体药剂用于疗法或诊断。
[0090]
在一些实施例中,本发明提供如本文所描述的人类抗体药剂用于治疗、预防或改善 以cd19表达为特征的疾病。
[0091]
在一些实施例中,本发明提供如本文所描述的人类抗体药剂用于治疗、预防或改善 癌症。
[0092]
在一些实施例中,本发明提供抗体-药物结合物,其包含如本文所描述的人类抗体药 剂的一个抗原结合位点(或多个抗原结合位点),和细胞毒性剂或部分。
[0093]
在一些实施例中,细胞毒性剂或部分是或包含单甲基奥瑞他汀(auristatin)e (mmae)、单甲基奥瑞他汀f(mmaf)或美登素(maytansine)。
[0094]
在一些实施例中,本发明提供双专一性抗体,其包含来自(或基于)如本文所描述的 人类抗体药剂的第一抗原结合位点,和第二抗原结合位点。
[0095]
在一些实施例中,第一和/或第二抗原结合位点是选自由免疫球蛋白分子、scfv、 scfab、fab、fv和其组合组成的群组。在一些实施例中,第一和第二抗原结合位点经配 置使得其形成单个多肽链。在一些实施例中,第一和第二抗原结合位点是scfv。在一些 实施例中,第一和第二抗原结合位点由肽连接子连接。在一些实施例中,第二抗原结合 位点连接到第一抗原结合位点的c端。在一些实施例中,第二抗原结合位点连接到第一 抗原结合位点的n端。
[0096]
在一些实施例中,第一抗原结合位点由免疫球蛋白分子构成且第二抗原结合位点由 scfv、scfab、fab或fv构成。
[0097]
在一些实施例中,第二抗原结合位点结合选自由以下组成的群组的免疫细胞:t细 胞、nk细胞、b细胞、树突状细胞、单核细胞、巨噬细胞、嗜中性白血球、间叶干细 胞和神经干细胞。在一些实施例中,第二抗原结合位点结合t细胞上的cd3。
[0098]
在一些实施例中,本发明提供双专一性t细胞接合单克隆抗体,其包含如本文所描 述的人类抗体药剂的抗原结合位点。
[0099]
在一些实施例中,本发明提供双专一性抗体,其由专一性结合cd19的第一scfv 和专一性结合t细胞上的cd3的第二scfv构成,其中第一scfv包含seq id no:2、seqid no:4、seq id no:6、seq id no:8、seq id no:10、seq id no:12、seq id no:14、 seq id no:16、
seq id no:18、seq id no:20、seq id no:22、seq id no:24、seq idno:26、seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、 seq id no:38、seq id no:40、seq id no:42、seq id no:44、seq id no:46、seq idno:48、seq id no:50、seq id no:52、seq id no:54、seq id no:56、seq id no:58、 seq id no:60、seq id no:62、seq id no:64、seq id no:66、seq id no:68、seq idno:70和seq id no:72中的任一个。
[0100]
在一些实施例中,第一scfv的n端连接到第二scfv的c端。在一些实施例中,第 一scfv的c端连接到第二scfv的n端。
[0101]
在一些实施例中,第一scfv的n端经由连接序列连接到第二scfv的c端。在一些 实施例中,第一scfv的c端经由连接序列连接到第二scfv的n端。
[0102]
在一些实施例中,本发明提供如本文所描述的双专一性抗体用于疗法或诊断。
[0103]
在一些实施例中,本发明提供如本文所描述的双专一性抗体用于治疗、预防或改善 以cd19表达为特征的疾病。
[0104]
在一些实施例中,本发明提供嵌合抗原受体,其包含如本文所描述的人类抗体药剂 的抗原结合位点。在一些实施例中,嵌合抗原受体包含如本文所描述的人类抗体药剂的 抗原结合位点且更包含天然细胞受体的跨膜域和/或细胞内信号传导域。在某些实施例 中,天然细胞受体是t细胞受体(tcr)。在一些实施例中,嵌合抗原受体包含如本文所 描述的人类抗体药剂的抗原结合位点且更包含跨膜域和细胞内信号传导域,所述细胞内 信号传导域包含cd3(例如cd3ζ)细胞内信号传导序列和cd28细胞内信号传导序列。
[0105]
在一些实施例中,嵌合抗原受体的抗原结合位点是或包含scfv。
[0106]
在一些实施例中,如本文所描述的嵌合抗原受体的抗原结合位点是或包含v
l
区。 在某些实施例中,v
l
区包含以下的轻链cdr:(a)seq id no:181、seq id no:182和 seq id no:183;(b)seq id no:184、seq id no:185和seq id no:186;(c)seq idno:187、seq id no:188和seq id no:189;(d)seq id no:190、seq id no:191和seqid no:192;(e)seq id no:193、seq id no:194和seq id no:195;(f)seq id no:196、 seq id no:197和seq id no:198;(g)seq id no:199、seq id no:200和seq idno:201;(h)seq id no:202、seq id no:203和seq id no:204;(i)seq id no:205、 seq id no:206和seq id no:207;(j)seq id no:208、seq id no:209和seq idno:210;(k)seq id no:211、seq id no:212和seq id no:213;(l)seq id no:214、 seq id no:215和seq id no:216;(m)seq id no:217、seq id no:218和seq idno:219;(n)seq id no:220、seq id no:221和seq id no:222;(o)seq id no:223、 seq id no:224和seq id no:225;(p)seq id no:226、seq id no:227和seq idno:228;(q)seq id no:229、seq id no:230和seq id no:231;(r)seq id no:232、 seq id no:233和seq id no:234;(s)seq id no:235、seq id no:236和seq idno:237;(t)seq id no:238、seq id no:239和seq id no:240;(u)seq id no:241、 seq id no:242和seq id no:243;(v)seq id no:244、seq id no:245和seq idno:246;(w)seq id no:247、seq id no:248和seq id no:249;(x)seq id no:250、 seq id no:251和seq id no:252;(y)seq id no:253、seq id no:254和seq idno:255;(z)seq id no:256、seq id no:257和seq id no:258;(ab)seq id no:259、 seq id no:260和seq id no:261;(ac)seq id no:262、seq id no:263和seq idno:264;(ad)seq id no:265、seq id no:266和seq id no:267;(ae)seq id no:268、 seq id no:269和seq id no:270;(af)seq id no:271、seq id no:272和
seq id no:52、seq id no:54、seq id no:56、seq id no:58、seq id no:60、seq idno:62、seq id no:64、seq id no:66、seq id no:68、seq id no:70和seq id no:72。
[0108]
在一些实施例中,本发明提供如本文所描述的嵌合抗原受体用于疗法或诊断。
[0109]
在一些实施例中,本发明提供如本文所描述的嵌合抗原受体用于治疗、预防或改善 以cd19表达为特征的疾病。
[0110]
在一些实施例中,本发明提供表达如本文所描述的嵌合抗原受体(或抗体药剂或双专 一性抗体)的免疫效应细胞。在一些实施例中,免疫效应细胞是t细胞(例如细胞毒性t 细胞、辅助t细胞或自然杀手t细胞)或nk细胞。
[0111]
在一些实施例中,本发明提供如本文所描述的免疫效应细胞用于疗法或诊断。
[0112]
在一些实施例中,本发明提供如本文所描述的免疫效应细胞用于治疗、预防或改善 以cd19表达为特征的疾病。
[0113]
在一些实施例中,本发明提供全部或部分编码如本文所描述的人类抗体药剂、双专 一性抗体的多肽链或双专一性抗体或嵌合抗原受体的经分离核酸分子。在一些实施例 中,经分离核酸序列包括经密码子优化的序列。
[0114]
在一些实施例中,经分离核酸序列是或包含以下中的任一个中出现的序列:seq idno:1、seq id no:3、seq id no:5、seq id no:7、seq id no:9、seq id no:11、seqid no:13、seq id no:15、seq id no:17、seq id no:19、seq id no:21、seq id no:23、 seq id no:25、seq id no:27、seq id no:29、seq id no:31、seq id no:33、seq idno:35、seq id no:37、seq id no:39、seq id no:41、seq id no:43、seq id no:45、 seq id no:47、seq id no:49、seq id no:51、seq id no:53、seq id no:55、seq idno:57、seq id no:59、seq id no:61、seq id no:63、seq id no:65、seq id no:67、 seq id no:69和seq id no:71。
[0115]
在一些实施例中,本发明提供包含如本文所描述的经分离核酸分子的载体。在一些 实施例中,载体是重组、表达、lent病毒或反转录病毒载体。
[0116]
在一些实施例中,本发明提供包含载体或核酸分子,或表达如本文所描述的抗体药 剂、双专一性抗体或嵌合抗原受体的细胞。在一些实施例中,细胞选自细菌、酵母、昆 虫或哺乳动物细胞。在一些实施例中,细胞是哺乳动物淋巴细胞(例如人类淋巴细胞)。
[0117]
在一些实施例中,本发明提供包含如本文所描述的人类抗体药剂、双专一性抗体、 嵌合抗原受体、经分离核酸分子、载体或细胞的试剂盒。
[0118]
在一些实施例中,本发明提供用于诊断罹患cd19相关疾病或有其素因的个体,或 用于提供个体的病状的预后的试剂盒,所述试剂盒包含用于检测来自测试个体的样品中 存在的cd19的浓度的检测构件,其中检测构件包含各自任选地衍生的如本文所描述的 人类抗体药剂、如本文所描述的双专一性结合剂、如本文所描述的嵌合抗原受体或如本 文所描述的免疫效应细胞的抗原结合位点,其中样品中cd19的存在指示个体罹患cd19 相关疾病。
[0119]
在一些实施例中,本发明提供包含如本文所描述的经分离核酸分子的疫苗。
[0120]
在一些实施例中,本发明提供包含如本文所描述的人类抗体药剂、双专一性抗体或 嵌合抗原受体的组合物。在某些实施例中,如本文所描述的组合物的人类抗体药剂或双 专一性抗体与细胞毒性剂或部分结合。
[0121]
在一些实施例中,本发明提供包含如本文所描述的人类抗体药剂、双专一性抗体、 嵌合抗原受体或表达嵌合抗原受体的免疫细胞(或其群体),且更包含医药学上可接受的 载剂或稀释剂的医药组合物。
[0122]
在一些实施例中,本发明提供产生如本文所描述的人类抗体药剂、双专一性抗体或 嵌合抗原受体(或表达嵌合抗原受体的细胞)的方法,其包含在培养基中在允许表达人类 抗体药剂、双专一性抗体或嵌合抗原受体(或表达嵌合抗原受体的细胞)的条件下培养如 本文所描述的细胞,且自培养基分离人类抗体药剂、双专一性抗体或嵌合抗原受体(或表 达嵌合抗原受体的细胞)的步骤。
[0123]
在一些实施例中,本发明提供治疗个体的以cd19表达为特征的医学病状的方法, 其包含向所述个体投与治疗有效量的如本文所描述的人类抗体药剂、双专一性抗体、嵌 合抗原受体(或表达嵌合抗原受体的免疫效应细胞)、核酸分子或载体的步骤。
[0124]
在一些实施例中,以cd19表达为特征的医学病状是b细胞淋巴瘤、急性淋巴母细 胞白血病、慢性淋巴细胞白血病、伯基特淋巴瘤(burkitt lymphoma)、非霍奇金氏淋巴瘤 (non-hodgkin's lymphoma)或急性骨髓性白血病。
[0125]
在一些实施例中,以cd19表达为特征的医学病状是类风湿性关节炎(ra)、全身性 红斑性狼疮症(sle)、糖尿病或硬皮病。
[0126]
在一些实施例中,本发明提供治疗癌症的方法,所述方法包含向个体投与如本文所 描述的人类抗体药剂、双专一性抗体、嵌合抗原受体(或表达嵌合抗原受体的免疫效应细 胞)、核酸分子或载体的步骤。
[0127]
在一些实施例中,本发明提供抑制肿瘤生长的方法,所述方法包含使肿瘤细胞与双 专一性抗体(或如本文所描述的人类抗体药剂、如本文所描述的嵌合抗原受体或如本文所 描述的免疫效应细胞、如本文所描述的核酸分子或如本文所描述的载体)接触的步骤,所 述双专一性抗体由基于如本文所描述的人类抗体药剂的第一抗原结合位点和结合免疫 细胞的第二抗原结合位点构成,接触在足以使得观察到肿瘤细胞杀死(或双专一性抗体结 合的免疫细胞抑制肿瘤细胞生长)的条件和时间下进行。
[0128]
在一些实施例中,本发明提供杀死肿瘤细胞的方法,所述方法包含使肿瘤细胞与双 专一性抗体(或如本文所描述的人类抗体药剂、如本文所描述的嵌合抗原受体或如本文所 描述的免疫效应细胞、如本文所描述的核酸分子或如本文所描述的载体)接触的步骤,所 述双专一性抗体由基于如本文所描述的人类抗体药剂的第一抗原结合位点和结合免疫 细胞的第二抗原结合位点构成,接触在足以使得观察到肿瘤细胞生长抑制(或双专一性抗 体结合的免疫细胞介导肿瘤细胞的杀死)的条件和时间下进行。
[0129]
在一些实施例中,本发明提供诊断个体的以cd19表达为特征的医学病状的方法, 所述方法包含投与如本文所描述的抗体药剂(或如本文所描述的双专一性抗体或嵌合抗 原受体),且测量所述抗体药剂(或双专一性抗体或嵌合抗原受体)与所述个体中的表达cd19的细胞的结合的步骤。
[0130]
在诊断医学病状的方法的一些实施例中,所述方法更包含测量所述个体的一或多个 细胞的一或多种活性的步骤。在某些实施例中,一或多种活性包括细胞生长和/或细胞凋 亡。
[0131]
在一些实施例中,本发明提供由基于如本文所描述的人类抗体药剂的第一抗原结
合 位点和结合免疫细胞的第二抗原结合位点构成的双专一性抗体用于抑制肿瘤生长。
[0132]
在一些实施例中,本发明提供由基于如本文所描述的人类抗体药剂的第一抗原结合 位点和结合免疫细胞的第二抗原结合位点构成的双专一性抗体用于杀死肿瘤细胞。
[0133]
在一些实施例中,免疫细胞是t细胞或nk细胞。
[0134]
在一些实施例中,第一和第二抗原结合位点是scfv。
[0135]
在一些实施例中,第二抗原结合位点结合t细胞上的cd3。
[0136]
在一些实施例中,本发明提供引导t细胞杀死表达cd19的标靶细胞的方法,所述 方法包含使一或多个表达cd19的标靶细胞与一或多个t细胞和/或双专一性抗体(或如 本文所描述的人类抗体药剂、如本文所描述的嵌合抗原受体或如本文所描述的免疫效应 细胞)接触的步骤,所述双专一性抗体包含如本文所描述的人类抗体药剂的第一抗原结合 位点和结合t细胞上的cd3的第二抗原结合位点,接触在足以使得双专一性抗体结合 的t细胞介导表达cd19的标靶细胞的杀死的条件和时间下进行。在某些实施例中,第 一和第二抗原结合位点是scfv。
[0137]
在一些实施例中,本发明提供由基于如本文所描述的人类抗体药剂的第一抗原结合 位点和结合t细胞上的cd3的第二抗原结合位点构成的双专一性抗体用于引导t细胞 杀死表达cd19的标靶细胞。
[0138]
在各种实施例中,连接序列是或包含(g4s)n序列。在一些实施例中,n等于1、2、3、 4、5、6、7、8、9、10或更多。
[0139]
在各种实施例中,连接序列是或包含srggggsggggsggggslema(seq idno:289)。
[0140]
在各种实施例中,cd19是人类cd19。
[0141]
在一些实施例中,本发明提供如本文所描述的人类抗体药剂、双专一性抗体或嵌合 抗原受体(或表达嵌合抗原受体的免疫效应细胞)用于治疗或检测与cd19表达相关的病 状的用途。
[0142]
在一些实施例中,本发明提供如本文所描述的人类抗体药剂、双专一性抗体或嵌合 抗原受体(或表达嵌合抗原受体的免疫效应细胞)在制造用于药物的药剂中的用途。
[0143]
在一些实施例中,本发明提供如本文所描述的人类抗体药剂、双专一性抗体或嵌合 抗原受体(或表达嵌合抗原受体的免疫效应细胞)在制造用于诊断测试或分析的药剂中的 用途。
[0144]
在一些实施例中,本发明提供如本文所描述的人类抗体药剂、双专一性抗体或嵌合 抗原受体(或表达嵌合抗原受体的免疫效应细胞)在制造用于诊断或治疗癌症的药剂中的 用途。
[0145]
在一些实施例中,本发明提供如本文所描述的人类抗体药剂、双专一性抗体或嵌合 抗原受体(或表达嵌合抗原受体的免疫效应细胞)在制造用于诊断或治疗以cd19表达为 特征的医学病状的药剂中的用途。
附图说明
[0146]
本文中包括的由以下诸图构成的图式仅出于说明的目的而非限制。
[0147]
图1显示对于所选抗cd19人类抗体药剂,对人类cd19的代表性噬菌体克隆结合。 图1a显示重组人类cd19-fc的代表性噬菌体克隆结合(以od
450
)。图1b显示在细胞表 面表达
要求书的范围内的各种修改。
[0167]
一般来说,除非另外明确指示,否则本文所用的术语是根据其在所属领域中所理解 的含义。以下提供某些术语的明确定义;所属领域的技术人员将从上下文了解这些和其 它术语在具体情况下在本说明书通篇中的含义。
[0168]
为了使本发明可更易于理解,首先在下文对某些术语进行定义。以下术语和其它术 语的额外定义贯穿本说明书阐述。
[0169]
投药:如本文所用,术语“投药”是指向个体或系统(例如向细胞、器官、组织、生 物体或其相关组分或一组组分)投与组合物。一般技术人员将了解投药途径可例如视组合 物投与的个体或系统、组合物的性质、投药目的等而变化。举例来说,在某些实施例中, 向动物个体(例如向人类)投与可以是支气管(包括通过支气管滴注)、经颊、经肠、皮间、 动脉内、皮内、胃内、肝内、髓内、肌肉内、鼻内、腹膜内、鞘内、瘤内、静脉内、室 内、经粘膜、经鼻、经口、经直肠、皮下、舌下、局部、气管(包括通过气管内滴注)、 经皮、经阴道和/或玻璃体。在一些实施例中,投药可涉及间歇性给药。在一些实施例中, 投药可涉及持续给药(例如灌注)持续至少所选时间段。
[0170]
亲和力:如所属领域中已知,“亲和力”是具体配位体与其搭配物的结合的紧密性 的量度。亲和力可以不同方式测量。在一些实施例中,亲和力通过定量分析测量。在一 些这类实施例中,结合搭配物浓度可固定成超过配位体浓度以模拟生理条件。或者或另 外,在一些实施例中,结合搭配物浓度和/或配位体浓度可变化。在一些这类实施例中, 亲和力可在可比条件(例如浓度)下与参考物进行比较。
[0171]
亲和力成熟(或亲和力成熟抗体):如本文所用,是指在其一或多个cdr(或在一些 实施例中,构架区)中具有一或多种变化的抗体,与不具有这些变化的亲本抗体相比,所 述变化引起抗体对抗原的亲和力改良。在一些实施例中,亲和力成熟抗体将对标靶抗原 具有纳摩尔或甚至皮摩尔的亲和力。亲和力成熟抗体可通过所属领域中已知的多种程序 中的任一个产生。马克思(marks)等人,1992,生物技术(biotechnology)10:779-783描述通 过vh和v
l
域改组的亲和力成熟。cdr和/或构架残基的随机突变诱发由以下描述:巴 尔巴斯(barbas)等人,1994,美国科学院院刊(proc.nat.acad.sci.,u.s.a.)91:3809-3813; 希尔(schier)等人,1995,基因学(gene)169:147-155;伊尔顿(yelton)等人,1995.免疫学 杂志(j.immunol.)155:1994-2004;杰克逊(jackson)等人,1995,免疫学杂志 154(7):3310-9;和霍金斯(hawkins)等人,1992,分子生物学杂志(j.mol.biol.) 226:889-896。具有改良的结合特性的结合剂的选择由蒂(thie)等人,2009,分子生物学方 法(methods mol.bio.)525:309-22描述。
[0172]
药剂:如本文所用,可指任何化学类别的化合物或实体,包括(例如)多肽、核酸、 糖、脂质、小分子、金属或其组合。在一些实施例中,药剂是或包含天然产物,因为其 在自然界中发现和/或从自然界获得。在一些实施例中,药剂是或包含一或多种人造实体, 因为其经由人工操作来设计、工程改造和/或产生和/或在自然界中未发现。在一些实施 例中,药剂可以经分离或纯形式利用;在一些实施例中,药剂可以粗物质形式利用。在 一些实施例中,以集合或库的形式提供潜在药剂,例如其可经筛选以鉴定或表征其内的 活性剂。可根据本发明利用的药剂的一些具体实施例包括小分子、抗体、抗体片段、适 体、核酸(例如sirna、shrna、dna/rna混合物、反义寡核苷酸、核糖核酸酶)、肽、 肽模拟物等。在一些实施
例中,药剂是或包含聚合物。在一些实施例中,药剂不是聚合 物和/或基本上不含任何聚合物。在一些实施例中,药剂含有至少一个聚合部分。在一些 实施例中,药剂缺乏或基本上不含任何聚合部分。
[0173]
改善:如本文所用,是指预防、减少或缓和个体的病况,或改良病况。改善包括(但 不要求)疾病、病症或病状(例如辐射损伤)的完全恢复或完全预防。
[0174]
氨基酸:如本文所用,术语“氨基酸”在其最广泛意义上是指可并入多肽链中的任 何化合物和/或物质。在一些实施例中,氨基酸具有通式结构h2n-c(h)(r)-cooh。在一 些实施例中,氨基酸是天然存在的氨基酸。在一些实施例中,氨基酸是合成氨基酸;在 一些实施例中,氨基酸是d-氨基酸;在一些实施例中,氨基酸是l-氨基酸。“标准氨基 酸”是指通常发现于天然存在的肽中的二十种标准l-氨基酸中的任一种。“非标准氨基酸
”ꢀ
是指除标准氨基酸以外的任何氨基酸,不管其以合成方式制备或获自天然来源。如本文 所用,“合成氨基酸”涵盖经化学修饰的氨基酸,包括(但不限于)盐、氨基酸衍生物(如 酰胺)和/或取代物。氨基酸,包括肽中的羧基和/或氨基端氨基酸,可通过甲基化、酰胺 化、乙酰化、保护基和/或用可改变肽的循环半衰期而不会不利地影响其活性的其它化学 基团进行的取代来修饰。氨基酸可参与二硫键。氨基酸可包含一或多个翻译后修饰,如 与一或多个化学实体(例如甲基、乙酸酯基、乙酰基、磷酸酯基、甲酰基部分、类异戊二 烯基、硫酸酯基、聚乙二醇部分、脂质部分、碳水化合物部分、生物素部分等)结合。术 语“氨基酸”可与“氨基酸残基”互换使用,且可指游离氨基酸和/或肽的氨基酸残基。 将从使用术语的上下文显而易见其是指游离氨基酸或肽的残基。
[0175]
动物:如本文所用是指动物界的任何成员。在一些实施例中,“动物”是指任一性 别且处于任何发育阶段的人类。在一些实施例中,“动物”是指任何发育阶段的非人类 动物。在某些实施例中,非人类动物是哺乳动物(例如啮齿动物、小鼠、大鼠、兔、猴、 狗、猫、羊、牛、灵长类动物和/或猪)。在一些实施例中,动物包括(但不限于)哺乳动物、 鸟类、爬行动物、两栖动物、鱼类、昆虫和/或蠕虫。在一些实施例中,动物可以是转殖 基因动物、基因工程改造动物和/或克隆。
[0176]
抗体:如本文所用,具有其在技术中理解的含义且是指专一性结合于具体抗原的免 疫球蛋白(ig)。如一般技术人员所已知,自然界中产生的抗体通常由四个多肽链,两个 重(h)链和两个轻(l)链构成。各重链和轻链由可变区(本文中分别缩写是hcvr或vh和 lcvr或v
l
)和恒定区构成。重链的恒定区包含ch1、ch2和ch3域(和在igm和ige的 情况下,任选地存在的ch4域)。轻链的恒定区由一个域c
l
构成。vh和v
l
区更含有高 变区,称为互补决定区(cdr),穿插有称为构架区(fr)的更保守区。每个vh和v
l
由从 氨基端到羧基端按以下顺序排列的三个cdr和四个fr构成:fr1、cdr1、fr2、cdr2、 fr3、cdr3、fr4。免疫球蛋白分子可具有任何类型(例如igm、igd、igg、iga和ige)、 类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或子类。
[0177]
抗体药剂:如本文所用,术语“抗体药剂”是指专一性结合于具体抗原的药剂。在 一些实施例中,所述术语涵盖任何具有足以赋予专一性结合的免疫球蛋白结构元件的多 肽。在各种实施例中,适合的抗体药剂可包括(但不限于)单克隆抗体、多克隆抗体、人 类化抗体、灵长类化抗体、嵌合抗体、人类抗体、双专一性或多专一性抗体、单域抗体 (例如鲨鱼单域抗体(例如ignar或其片段))、结合抗体(即与其它蛋白质、放射性标记、 细胞毒素结合
或融合的抗体)、小模块免疫药物(“smipstm”)、单链抗体、骆驼科动物 抗体、抗体片段等。在一些实施例中,所述术语可指订书肽。在一些实施例中,所述术 语可指抗体样结合肽模拟物。在一些实施例中,术语可指抗体样结合骨架蛋白质。在一 些实施例中,术语可指单功能抗体或阿德奈汀(adnectin)。在许多实施例中,抗体药剂是 或包含氨基酸序列包括一或多个由所属领域的技术人员识别为互补决定区(cdr)的结构 元件的多肽;在一些实施例中,抗体药剂是或包含氨基酸序列包括至少一个与在参考抗 体(例如亲本抗体)中发现的cdr基本上一致的cdr(例如至少一个重链cdr和/或至少 一个轻链cdr)的多肽。在一些实施例中,所包括的cdr与参考cdr基本上一致,其 中其在序列上相同或如与参考cdr相比含有1-5个之间的氨基酸取代。在一些实施例中, 所包括的cdr与参考cdr基本上一致,其中其显示与参考cdr的至少85%、86%、 87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100% 序列一致性。在一些实施例中,所包括的cdr与参考cdr基本上一致,其中其显示与 参考cdr的至少96%、96%、97%、98%、99%或100%序列一致性。在一些实施例中, 所包括的cdr与参考cdr基本上一致,其中如与参考cdr相比所包括的cdr内的至 少一个氨基酸缺失、添加或经取代,否则所包括的cdr具有与参考cdr一致的氨基酸 序列。在一些实施例中,所包括的cdr与参考cdr基本上一致,其中如与参考cdr 相比所包括的cdr内的1-5个氨基酸缺失、添加或经取代,否则所包括的cdr具有与 参考cdr一致的氨基酸序列。在一些实施例中,所包括的cdr与参考cdr基本上一 致,其中如与参考cdr相比所包括的cdr内的至少一个氨基酸经取代,否则所包括的 cdr具有与参考cdr一致的氨基酸序列。在一些实施例中,所包括的cdr与参考cdr 基本上一致,其中如与参考cdr相比所包括的cdr内的1-5个氨基酸经取代,否则所 包括的cdr具有与参考cdr一致的氨基酸序列。在一些实施例中,抗体药剂是或包含 氨基酸序列包括由所属领域的技术人员识别为免疫球蛋白可变域的结构元件的多肽。在 一些实施例中,抗体药剂是具有与免疫球蛋白-结合域同源或基本上同源的结合域的多肽 蛋白质。在一些实施例中,抗体药剂是或包含多肽,其包括在具体参考抗体链(例如重链 和/或轻链)中发现的所有cdr。
[0178]
抗体组分:如本文所用,是指专一性结合于抗原决定基或抗原且包括一或多个免疫 球蛋白结构特征的多肽元件(可以是完整多肽,或较大多肽的一部分,如本文所描述的融 合多肽)。一般来说,抗体组分是氨基酸序列包括抗体结合区(例如抗体轻链或可变区或 其一或多个互补决定区(“cdr”),或抗体重链或可变区或其一或多个cdr,任选地在 一或多个构架区存在下)所特有的元件的任何多肽。在一些实施例中,抗体组分是或包含 全长抗体。在一些实施例中,抗体组分小于全长但包括至少一个结合位点(包含至少一个, 且优选至少两个具有已知抗体“可变区”的结构的序列)。在一些实施例中,术语“抗体 组分”涵盖任何具有与免疫球蛋白-结合域同源或基本上同源的结合域的蛋白质。在具体 实施例中,所包括的“抗体组分”涵盖具有显示与免疫球蛋白-结合域的至少99%一致 性的结合域的多肽。在一些实施例中,所包括的“抗体组分”是具有显示与免疫球蛋白
ꢀ‑
结合域(例如参考免疫球蛋白-结合域)的至少70%、75%、80%、85%、90%、95%或98% 一致性的结合域的任何多肽。所包括的“抗体组分”可具有与在天然来源中发现的抗体 (或其一部分,例如其抗原结合部分)一致的氨基酸序列。抗体组分可以是单专一性、双 专一性或多专一性。抗体组分可包括任何免疫球蛋白类别所特有的结构元件,所述类别 包括以下人类类别中的任一种:igg、igm、iga、igd和ige。已显示抗体的抗原结合功 能可由全长抗体的片段来进行。
这类抗体实施例也可以是双专一性、双重专一性或多专 一性形式;专一性结合于两个或多于两个不同抗原。术语抗体的“抗原结合部分”内涵 盖的结合片段的实例包括(i)fab片段,其是由vh、v
l
、ch1和c
l
域组成的单价片段; (ii)f(ab')2片段,其是包含两个在铰链区由二硫桥键连接的fab片段的二价片段;(iii)由vh和ch1域组成的fd片段;(iv)由抗体单臂的vh和v
l
域组成的fv片段,(v)dab片 段(沃德(ward)等人,1989,自然(nature)341:544-546),其包含单一可变域;和(vi)经分离 的互补决定区(cdr)。此外,虽然fv片段的两个域vh和v
l
由各别基因编码,但其可 使用重组方法通过合成连接子接合,所述连接子能够将其制成vh和v
l
区配对形成单价 分子的单一蛋白质链(称为单链fv(scfv);参见例如伯德(bird)等人,1988,科学(science) 242:423-426;和赫斯顿(huston)等人,1988,美国科学院院刊85:5879-5883)。在一些实 施例中,如本文所描述的“抗体组分”是或包含这类单链抗体。在一些实施例中,“抗 体组分”是或包含双功能抗体。双功能抗体是二价双专一性抗体,其中vh和v
l
域在单 一多肽链上表达,但使用过短而使在同一链上的两个域之间不配对的连接子,进而迫使 域与另一链的互补域配对且产生两个抗原结合位点(参见例如霍利格(holliger,p.)等人, 1993,美国科学院院刊90:6444-6448;波利亚克(poljak,r.j.)等人,1994,结构学 (structure)2:1121-1123)。这类抗体结合部分在所属领域中已知(孔特曼(kontermann)和杜 贝尔(dubel)编,抗体工程(antibody engineering),2001,施普林格出版公司 (springer-verlag).纽约(new york).第790页isbn 3-540-41354-5)。在一些实施例中, 抗体组分是或包含单链“线抗体”,其包含一对串联fv区段(v
h-ch1-v
h-ch1),所述区 段连同互补轻链多肽一起形成一对抗原结合区(萨帕塔(zapata)等人,1995,蛋白质工程 (protein eng.)8(10):1057-1062;和美国专利第5,641,870号)。在一些实施例中,抗体组 分可以具有嵌合、人类化或人类抗体所特有的结构元件。一般来说,人类化抗体是人类 免疫球蛋白(接受者抗体),其中来自接受者的互补决定区(cdr)的残基经具有所要专一 性、亲和力和能力的来自非人类物种(供体抗体)(如小鼠、大鼠或兔)的cdr的残基置换。 在一些实施例中,抗体组分可具有人类抗体所特有的结构元件。在一些实施例中,抗体 组分可包括于嵌合分子中,所述嵌合分子更包含一或多个其它多肽或多肽片段(例如信号 传导组分、跨膜组分等)。
[0179]
抗体片段:如本文所用,“抗体片段”包括完整抗体的一部分,如抗体的抗原结合 或可变区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;三功能抗体;四功能抗 体;线抗体;单链抗体分子;和由抗体片段形成的多专一性抗体中包括的含cdr部分。 所属领域的技术人员应了解术语“抗体片段”不暗示且不限于任何具体产生模式。抗体 片段可经由使用任何合适方法产生,包括(但不限于)裂解完整抗体、化学合成、重组产 生等。
[0180]
抗体多肽:如本文所用,可互换使用的术语“抗体多肽”或“抗体”或“其抗原结 合片段”指能够结合于抗原决定基的多肽。在一些实施例中,抗体多肽是全长抗体,且 在一些实施例中,小于全长但包括至少一个结合位点(包含至少一个,且优选至少两个具 有抗体“可变区”的结构的序列)。在一些实施例中,术语“抗体多肽”涵盖任何具有与 免疫球蛋白-结合域同源或基本上同源的结合域的蛋白质。在具体实施例中,“抗体多肽
”ꢀ
涵盖具有显示与免疫球蛋白-结合域的至少99%一致性的结合域的多肽。在一些实施例 中,“抗体多肽”是具有显示与免疫球蛋白-结合域,例如参考免疫球蛋白-结合域的至少 70%、80%、85%、90%或95%一致性的结合域的任何蛋白质。所包括的“抗体多肽”可 具有与在天然来源中
且通常两个是或包含抗体组分。多种不同双专一性抗体结构在所属领域中已知。在一些 实施例中,双专一性抗体中是或包含抗体组分的各结合部分包括vh和/或v
l
区;在一 些这类实施例中vh和/或v
l
区是在具体单克隆抗体中发现的这些区。在一些实施例中, 当双专一性抗体含有两个抗体组分-结合部分时,各自包括来自不同单克隆抗体的vh和 /或v
l
区。
[0184]
双专一性结合剂:如本文所用,是指具有两个各别结合部分,其中的每一个结合不 同标靶的多肽药剂。在一些实施例中,双专一性结合剂是单一多肽;在一些实施例中, 双专一性结合剂是或包含多种肽,其在一些这类实施例中可例如通过交联彼此共价结 合。在一些实施例中,双专一性结合剂的两个结合部分识别同一标靶(例如抗原)的不同 位点(例如抗原决定基);在一些实施例中,其识别不同标靶。在一些实施例中,双专一 性结合剂能够同时结合于两个具有不同结构的标靶。
[0185]
载剂:如本文所用,是指与组合物一起投与的稀释剂、佐剂、赋形剂或媒剂。在一 些例示性实施例中,载剂可包括无菌液体,如水和油,包括石油、动物、植物或合成来 源的油,如花生油、大豆油、矿物油、芝麻油等。在一些实施例中,载剂是或包括一或 多种固体组分。
[0186]
cdr:如本文所用,是指抗体可变区内的互补决定区。重链和轻链的可变区中各自 存在三个cdr,对于每个可变区,所述cdr命名是cdr1、cdr2和cdr3。“一组cdr
”ꢀ
或“cdr组”是指一组三个或六个在能够结合抗原的单一可变区中出现的cdr或能够 结合抗原的同源重链和轻链可变区的cdr。cdr的边界已视系统而不同地界定,其中 数种在所属领域中已知(例如kabat、chothia、imgt等)。
[0187]
嵌合抗原受体(car):本发明的抗体药剂(包括单链可变片段(scfv))可用于制备嵌合 抗原受体,其制备和使用在所属领域中大体上已知。嵌合抗原受体(car)通常是含有scfv 或其它抗体药剂的抗原结合域,连接到免疫细胞(例如t细胞或nk细胞)信号传导域的 人工构筑的混合蛋白质或多肽。car的特征包括其以mhc限制(在tcr-模拟抗体的情 况下)或非mhc限制(在针对细胞表面蛋白质的抗体的情况下)方式,利用单克隆抗体的 抗原结合特性重新引导免疫细胞(例如t细胞或nk细胞)对所选标靶的专一性和反应性 的能力。非mhc限制抗原识别给予表达car的免疫细胞(例如t细胞或nk细胞)识别 与抗原处理无关的抗原的能力,因此略过肿瘤逃避的主要机制。
[0188]
嵌合抗原受体(car)疗法(或授受细胞疗法):如本文所用,是指使用嵌合抗原受体 用于治疗性处理,包括(例如)用于授受细胞疗法。授受细胞疗法是治疗性方法,其通常 包括分离和离体扩增和/或处理免疫细胞(例如nk细胞或t细胞)且随后向患者投与这些 细胞例如以便治疗癌症。投与的细胞可以是自体或同种异体。细胞可经处理来以已知方 式中的任一种表达嵌合抗原受体,包括(例如)通过使用rna和dna转染、病毒转导、 电穿孔,其皆是所属领域中已知的技术。
[0189]
相当:如本文所用,是指两种或多于两种药剂、实体、情况、病状组等可彼此不一 致但充分类似以允许在其之间进行比较以使得可基于观察的差异或类似性合理地得出 结论。在一些实施例中,相当病状组、情形、个体或群体的特征在于多个基本上一致的 特征和一个或少数不同特征。一般技术人员将在上下文中理解在任何给定情形中两种或 多于两种这类药剂、实体、情况、病状组等视为相当所需要的一致性程度。举例来说, 一般技术人员应了解,当通过保证在不同情形组、个体或群体下或在所述情况下获得的 结果或观察的
现象中的差异由变化的这些特征的变化引起或表明所述变化的合理结论 的足够数目和类型的基本上一致特征表征时,情形组、个体或群体彼此相当。
[0190]
对照:如本文所用,是指所属领域中理解的如下含义:“对照”是结果与其比较的 标准物。通常,对照用于通过分离变量以便得出关于这类变量的结论来强化实验的完整 性。在一些实施例中,对照是与测试反应或分析同时进行以提供比较的反应或分析。如 本文所用,“对照”可指“对照抗体”。“对照抗体”可以是如本文所描述的人类、嵌合、 人类化、cdr移植、多专一性或双专一性抗体;与本文所描述不同的抗体;抗体片段或 抗体组分;或亲本抗体。在一个实验中,应用“测试”(即测试的变量)。在第二实验中, 不应用“对照”(测试的变量)。在一些实施例中,对照是历史对照(即先前进行的测试或 分析的对照,或先前已知的量或结果)。在一些实施例中,对照是或包含印刷或以其它方 式保存的记录。对照可以是阳性对照或阴性对照。
[0191]
对应于:如本文所用,表示氨基酸残基在相关多肽中的位置/一致性。一般技术人员 将了解出于简单性的目的,多肽中的残基通常使用典型编号系统基于参考相关多肽命 名,以使得“对应于”位置190处的残基的氨基酸例如无需实际上是具体氨基酸链中的 第190个氨基酸,而是对应于在参考多肽中的190处发现的残基;一般技术人员容易了 解如何鉴定“对应”氨基酸。
[0192]
检测实体/检测剂:如本文所用,是指可检测的任何元件、分子、官能团、化合物、 片段或部分。在一些实施例中,单独提供或利用检测实体。在一些实施例中,检测实体 与另一药剂结合(例如与其接合)提供和/或利用。检测实体的实例包括(但不限于):各种 配位体、放射性核种(例如3h、
14
c、
18
f、
19
f、
32
p、
35
s、
135
i、
125
i、
123
i、
64
cu、
187
re、 111
in、
90
y、
99
mtc、
177
lu、
89
zr等)、荧光染料(关于专一性例示性荧光染料,参见以下)、 化学发光剂(如吖啶酯、稳定二氧杂环丁烷等)、生物发光剂、光谱可解析无机荧光半导 体纳米晶(即量子点)、金属纳米粒子(例如金、银、铜、铂等)纳米簇、顺磁金属离子、酶 (关于酶的具体实例,参见以下)、比色标签(如染料、胶态金等)、生物素、洋地黄毒苷、 半抗原和可获得免疫血清或单克隆抗体的蛋白质。
[0193]
效应功能:如本文所用,指由抗体fc区与fc受体或配位体的相互作用引起的生物 化学事件。效应功能包括(但不限于)抗体依赖性细胞介导的细胞毒性(adcc)、抗体依赖 性细胞介导的吞噬作用(adcp)和补体介导的细胞毒性(cmc)。在一些实施例中,效应功 能是在结合抗原的后操作的功能,独立于抗原结合操作的功能,或两者。
[0194]
效应细胞:如本文所用,是指介导一或多种效应功能的免疫系统细胞。在一些实施 例中,效应细胞可包括(但可不限于)以下中的一或多个:单核细胞、巨噬细胞、嗜中性 白血球、树突状细胞、嗜伊红血球、肥大细胞、血小板、大颗粒淋巴细胞、兰格汉氏细 胞(langerhans'cell)、自然杀手(nk)细胞、t淋巴细胞、b淋巴细胞且可来自任何生物体, 包括(但不限于)人类、小鼠、大鼠、兔和猴。
[0195]
工程改造:如本文所用,一般指已经人工处理的方面。举例来说,在一些实施例中, 当两个或多于两个不以自然界中的顺序连接在一起的序列经人工处理以在工程改造聚 核苷酸中彼此直接连接时,所述聚核苷酸可视为经“工程改造”。在一些这类具体实施 例中,工程改造聚核苷酸可包含发现本质上与第一编码序列可操作结合但不与第二编码 序列可操作结合,通过人工连接以使得其与第二编码序列可操作地结合的调节序列。或 者或另
术人员在阅读本发明后应理解这类术语不仅指具体个体细胞,而且指这类细胞的后代。 由于某些修饰可能因突变或环境影响而于后代中发生,所述子代可能实际上不与亲本细 胞相同,但仍包括于如本文中所用的术语“宿主细胞”的范围内。在一些实施例中,宿 主细胞包括选自适用于表达外源dna(例如重组核酸序列)的生物界中的任一种的原核 和真核细胞。例示性细胞包括以下的这些:原核细胞和真核细胞(单细胞或多细胞)、细 菌细胞(例如大肠杆菌(e.coli)、芽孢杆菌属(bacillus spp.)、链霉菌属等(streptomyces spp.) 的菌株)、分枝杆菌细胞、真菌细胞、酵母细胞(例如酿酒酵母(s.cerevisiae)、粟酒裂殖 酵母(s.pombe)、巴斯德毕赤酵母(p.pastoris)、甲醇毕赤酵母(p.methanolica)等)、植物细 胞、昆虫细胞(例如sf-9、sf-21、感染杆状病毒的昆虫细胞、粉纹夜蛾(trichoplusia ni) 等)、非人类动物细胞、人类细胞或细胞融合物,如融合瘤或四源杂交瘤(quadroma)。在 一些实施例中,宿主细胞是人类、猴、猿、仓鼠、大鼠或小鼠细胞。在一些实施例中, 宿主细胞是真核且选自以下细胞:cho(例如cho kl、dxb-11cho、veggie-cho)、 cos(例如cos-7)、视网膜细胞、vero、cv1、肾脏(例如hek293、293ebna、msr 293、 mdck、hak、bhk)、hela、hepg2、wi38、mrc 5、colo205、hb 8065、hl-60(例 如bhk21)、jurkat、daudi、a431(表皮)、cv-1、u937、3t3、l细胞、c127细胞、sp2/0、 ns-0、mmt 060562、塞特利氏细胞(sertoli cell)、brl 3a细胞、ht1080细胞、骨髓瘤 细胞、肿瘤细胞和来源于前述细胞的细胞系。在一些实施例中,宿主细胞包含一或多种 病毒基因,例如表达病毒基因的视网膜细胞(例如per.c6tm细胞)。
[0201]
人类抗体:如本文所用,意图包括具有自人类免疫球蛋白序列产生(或组装)的可变 和恒定区的抗体。在一些实施例中,即使其氨基酸序列例如在一或多个cdr且具体地 说cdr3中包括不由人类生殖系免疫球蛋白序列(例如包括序列变异体,例如其可能(最 初)已经通过活体外随机或位点专一性突变诱发或通过活体内体细胞突变引入)编码的残 基或元件,抗体(或抗体组分)可仍视为“人类”。
[0202]
人类化:如所属领域中已知,术语“人类化”常用于指如下抗体(或抗体组分),其 氨基酸序列包括来自在非人类物种(例如小鼠)中产生的参考抗体的vh和v
l
区序列,而 且包括相对于参考抗体的在这些序列中的修饰,所述修饰意图使其更“像人类”,即更 类似于人类生殖系可变序列。在一些实施例中,“人类化”抗体(或抗体组分)是免疫专一 性地结合于相关抗原且具有基本上具有如人类抗体的氨基酸序列的构架(fr)区,和基本 上具有如非人类抗体的氨基酸序列的互补决定区(cdr)的抗体。人类化抗体基本上包含 所有至少一个且通常两个可变域(fab、fab'、f(ab')2、fabc、fv),其中所有或基本上所 有cdr区对应于非人类免疫球蛋白(即,供体免疫球蛋白)的cdr区且所有或基本上所 有构架区是具有人类免疫球蛋白共同序列的构架区。在一些实施例中,人类化抗体还包 含至少一部分免疫球蛋白恒定区(fc),通常至少一部分人类免疫球蛋白恒定区。在一些 实施例中,人类化抗体含有轻链以及至少重链的可变域。抗体还可以包括重链恒定区的 ch1、铰链、ch2、ch3和任选地,ch4区。在一些实施例中,人类化抗体仅含有人类化 v
l
区。在一些实施例中,人类化抗体仅含有人类化vh区。在某些实施例中,人类化抗 体含有人类化vh和v
l
区。
[0203]
亲水性:如本文所用,术语“亲水性”和/或“极性”是指与水混合或容易地溶解于 水中的趋势。
[0204]
疏水性:如本文所用,术语“疏水性”和/或“非极性”是指排斥水、不与水组合或 不
能容易地溶解于水中的趋势。
[0205]
改良、增加或减少:如本文所用,或其语法等效物,指示相对于基线测量值的值, 如在开始本文中描述的治疗之前同一个体的测量值,或在不存在本文中描述的治疗的情 况下对照个体(或多名对照个体)的测量值。“对照个体”是罹患与治疗个体相同的形式的 疾病或损伤的个体。
[0206]
活体外:如本文所用,是指在人工环境中,例如在试管或反应容器中,在细胞培养 物中等,而非在多细胞生物体内发生的事件。
[0207]
活体内:如本文所用,是指在多细胞生物体(如人类和非人类动物)内发生的事件。 在基于细胞的系统的情况下,所述术语可用于指在活细胞(相较于例如活体外系统)内发 生的事件。
[0208]
经分离:如本文所用,是指如下物质和/或实体:已经(1)与最初产生时与其结合的 至少一些组分分离(无论在自然界中和/或在实验环境中),和/或(2)通过人工经设计、产 生、制备和/或制造。经分离物质和/或实体可与约10%、约20%、约30%、约40%、约 50%、约60%、约70%、约80%、约90%、约91%、约92%、约93%、约94%、约95%、 约96%、约97%、约98%、约99%或多于99%的与其最初结合的其它组分分离。在一些 实施例中,经分离药剂是约80%、约85%、约90%、约91%、约92%、约93%、约94%、 约95%、约96%、约97%、约98%、约99%或大于约99%纯。如本文所用,如果物质 基本上不含其它组分,那么其是“纯的”。在一些实施例中,如所属领域的技术人员将 理解,在已与某些其它组分(如一或多种载剂或赋形剂(例如缓冲剂、溶剂、水等)组合之 后,物质可仍视为“经分离”或甚至“纯的”;在这类实施例中,物质的分离或纯度% 在不包括这类载剂或赋形剂的情况下计算。仅给出一个实例,在一些实施例中,当a)藉 助于其衍生起源或来源,不与在自然界中在其天然状态中伴随其的组分中的一些或全部 结合;b)其基本上不含与在自然界中产生其的物种相同的物种的其它多肽或核酸;c)由 来自不是在自然界中产生其的物种的细胞或其它表达系统的组分表达或另外与所述组 分结合时,自然界中存在的生物聚合物(如多肽或聚核苷酸)视为“经分离”。因此,举例 来说,在一些实施例中,化学合成或在与在自然界中产生其的系统不同的细胞系统中合 成的多肽视为“经分离”多肽。或者或另外,在一些实施例中,已经受一或多种纯化技 术的多肽可在其已与a)在自然界中与其结合;和/或b)在最初产生时与其结合的其它组 分分离的程度上视为“经分离”多肽。
[0209]
kd:如本文所用,是指结合剂(例如抗体药剂或其结合组分)自其与其搭配物(例如抗 体药剂或其结合组分结合的抗原决定基)的复合物解离的常数。
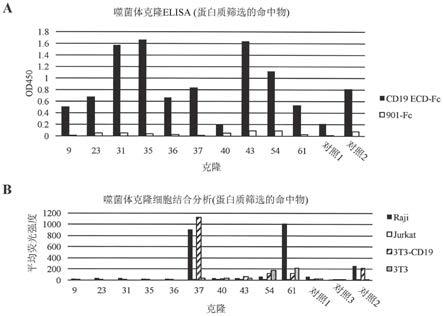
[0210]k离
:如本文所用,是指用于将结合剂(例如抗体药剂或其结合组分)自其与其搭配物 (例如抗体药剂或其结合组分结合的抗原决定基)的复合物解离的解离速率常数。
[0211]k合
:如本文所用,是指用于将结合剂(例如抗体药剂或其结合组分)与其搭配物(例如 抗体药剂或其结合组分结合的抗原决定基)结合的结合速率常数。
[0212]
连接子:如本文所用,用以指多元件多肽的将不同元件彼此连接的部分。举例来说, 一般技术人员了解结构包括两个或多于两个功能或组织域的多肽通常包括在将其彼此 连接的域之间的一段氨基酸。在一些实施例中,包含连接子元件的多肽具有通式s1-l-s2 的整体结构,其中s1和s2可相同或不同且表示通过连接子彼此结合的两个域。在一些 实施例中,连接子长度是至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、 17、18、19、20、
21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100或更多个氨基酸。在一些实施例中,连接子的 特征在于其趋向于不采用刚性三维结构,而是向多肽提供柔性。可适当地在工程改造多 肽(例如融合多肽)时使用的多种不同连接子元件在所属领域中已知(参见例如霍利格等 人,1993,美国科学院院刊90:6444-6448;波利亚克等人,1994,结构学(structure) 2:1121-1123)。
[0213]
多价结合剂(或多专一性结合剂):如本文所用,指能够结合于两种或多于两种可在 同一分子上或在不同分子上的抗原的结合剂。在一些实施例中,如本文所描述的多价结 合剂经工程改造以具有两个或多于两个抗原结合位点,且通常不是天然存在的蛋白质。 如本文所描述的多价结合剂指能够结合两个或多于两个相关或不相关标靶的结合剂。多 价结合剂可由单一抗体组分的多个复本或不同抗体组分的多个复本构成。这类结合剂能 够结合于两种或多于两种抗原且是四价或多价结合剂。多价结合剂可另外包含治疗剂, 如免疫调节剂、毒素或rna酶。在一些实施例中,如本文所描述的多价结合剂能够同 时结合于至少两个具有不同结构的标靶,例如两种不同抗原、同一抗原上的两个不同抗 原决定基或半抗原和/或抗原或抗原决定基。在许多实施例中,本发明的多价结合剂是经 工程改造以具有如本文所描述的多价结合剂的特征的蛋白质。本发明的多价结合剂可以 是单专一性(能够结合一种抗原)或多专一性(能够结合两种或多于两种抗原),且可由两个 重链多肽和两个轻链多肽构成。在一些实施例中,每个结合位点由每个抗原结合位点, 具有总共六个参与抗原结合的cdr的重链可变域和轻链可变域构成。
[0214]
核酸:如本文所用,在其最广泛意义上,是指任何可并入寡核苷酸链中的化合物和 /或物质。在一些实施例中,核酸是经由磷酸二酯键并入或可并入寡核苷酸链中的化合物 和/或物质。如将从上下文了解,在一些实施例中,“核酸”是指个别核酸残基(例如核苷 酸和/或核苷);在一些实施例中,“核酸”是指包含个别核酸残基的寡核苷酸链。在一些 实施例中,“核酸”是或包含rna;在一些实施例中,“核酸”是或包含dna。在一些 实施例中,核酸是、包含一或多个天然核酸残基或由一或多个天然核酸残基组成。在一 些实施例中,核酸是、包含一或多种核酸类似物或由一或多种核酸类似物组成。在一些 实施例中,核酸类似物与核酸的不同在于其不利用磷酸二酯主链。举例来说,在一些实 施例中,核酸是、包含一或多种“肽核酸”或由一或多种“肽核酸”组成,所述肽核酸 在所属领域中已知且在主链中具有肽键而非磷酸二酯键,视为在本发明的范围内。或者 或另外,在一些实施例中,核酸具有一或多个硫代磷酸酯和/或5'-n-氨基磷酸酯键而非 磷酸二酯键。在一些实施例中,核酸是、包含一或多种天然核苷(例如腺苷、胸苷、鸟苷、 胞嘧啶核苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞嘧啶核苷)或由一或多种天 然核苷组成。在一些实施例中,核酸是、包含一或多种核苷类似物(例如2-氨基腺苷、 2-硫代胸苷、肌苷、吡咯并-嘧啶、3-甲基腺苷、5-甲基胞嘧啶核苷、c-5丙炔基-胞嘧啶 核苷、c-5丙炔基-尿苷、2-氨基腺苷、c5-溴尿苷、c5-氟尿苷、c5-碘尿苷、c5-丙炔基
ꢀ‑
尿苷、c5-丙炔基-胞嘧啶核苷、c5-甲基胞嘧啶核苷、2-氨基腺苷、7-脱氮腺苷、7-脱氮 鸟苷、8-侧氧基腺苷、8-侧氧基鸟苷、0(6)-甲基鸟嘌呤、2-硫代胞嘧啶核苷、甲基化碱 基、插入碱基和其组合)或由一或多种核苷类似物组成。在一些实施例中,如与天然核酸 中的这些糖相比,核酸包含一或多种经修饰的糖(例如2'-氟核糖、核糖、2'-脱氧核糖、 阿拉伯糖和己糖)。在一些实施例中,核酸具有编码功能性基因产物(如rna或蛋白质) 的核苷酸序列。在一些实施例中,核酸包括一或多个内含子。在一
些实施例中,核酸通 过以下中的一或多个制备:自天然来源分离、通过基于互补模板聚合进行酶合成(活体内 或活体外)、在重组细胞或系统中复制和化学合成。在一些实施例中,核酸长度是至少3、 4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、 85、90、95、100、110、120、130、140、150、160、170、180、190、200、225、250、 275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、 1500、2000、2500、3000、3500、4000、4500、5000或更多个残基。在一些实施例中, 核酸是单股;在一些实施例中,核酸是双股。在一些实施例中核酸具有包含至少一个元 件的核苷酸序列,所述元件编码对多肽编码的序列或是所述序列的补体。在一些实施例 中,核酸具有酶活性。
[0215]
可操作地连接:如本文所用,是指所描述的组分处于准许其以其预期方式作用的关 系中的并接。“可操作地连接”至编码序列的控制序列是以使编码序列的表达在与控制 序列相容的条件下实现的方式接合。“可操作地连接”的序列包括与相关基因相邻的表 达控制序列和以反式起作用或在一定距离起作用以控制所述相关基因的表达控制序列。 如本文所用,术语“表达控制序列”是指实现所接合的编码序列的表达和加工所需的聚 核苷酸序列。表达控制序列包括适当转录起始、终止、启动子和强化子序列;有效rna 加工信号,如剪接和聚腺苷酸化信号;使细胞质mrna稳定的序列;增强翻译效率的序 列(即科扎克共同序列(kozak consensus sequence));增强蛋白质稳定性的序列;和必要时 增强蛋白质分泌的序列。这类控制序列的性质视宿主生物体而不同。举例来说,在原核 细胞中,这类控制序列大体上包括启动子、核糖体结合位点和转录终止序列,而在真核 生物中,这类控制序列通常包括启动子和转录终止序列。术语“控制序列”意图包括其 存在对表达和加工来说至关重要的组分,且还可包括其存在有利的额外组分,例如前导 序列和融合搭配物序列。
[0216]
肽:术语“肽”是指通过肽键或经修饰肽键彼此接合的两个或多于两个氨基酸。在 具体实施例中,“肽”是指长度是小于约100个氨基酸、小于约50个氨基酸、小于20 个氨基酸或小于10个氨基酸的多肽。
[0217]
生理条件:如本文所用,具有其在所属领域中理解的参考细胞或生物体生存和/或再 生的条件的含义。在一些实施例中,所述术语是指可在自然界中存在的用于生物体或细 胞系统的外部或内部环境条件。在一些实施例中,生理条件是存在于人类或非人类动物 身体内的这些条件,尤其存在于手术部位处和/或内的这些条件。生理条件通常包括例如 20-40℃的温度范围、1的大气压、6-8的ph、1-20mm的葡萄糖浓度、常压水准下的氧 浓度和如在地球上遇到的重力。在一些实施例中,实验室中的条件经处理和/或维持在生 理条件下。在一些实施例中,在生物体中遇到生理条件。
[0218]
多肽:如本文所用,是指氨基酸的任何聚合链。在一些实施例中,多肽具有自然界 中存在的氨基酸序列。在一些实施例中,多肽具有在自然界中不存在的氨基酸序列。在 一些实施例中,多肽具有经工程改造的氨基酸序列,因为其经由人工操作设计和/或产生。 在一些实施例中,多肽可包含天然氨基酸、非天然氨基酸或两者或由天然氨基酸、非天 然氨基酸或两者组成。在一些实施例中,多肽可仅包含天然氨基酸或仅包含非天然氨基 酸或仅由天然氨基酸或仅由非天然氨基酸组成。在一些实施例中,多肽可包含d-氨基酸、 l-氨基酸或两者。在一些实施例中,多肽可仅包含d-氨基酸。在一些实施例中,多肽可 仅包含l-氨基酸。在一些实施例中,多肽可包括一或多个侧基或其它修饰,例如在多肽 的n端、在多肽
的c端修饰或连接到一或多个氨基酸侧链,或其任何组合。在一些实施 例中,这类侧基或修饰可选自由以下组成的群组:乙酰化、酰胺化、脂质化、甲基化、 聚乙二醇化等,包括其组合。在一些实施例中,多肽可以是环状和/或可包含环状部分。 在一些实施例中,多肽不是环状和/或不包含任何环状部分。在一些实施例中,多肽是线 性。在一些实施例中,多肽可以是或包含订书多肽。在一些实施例中,术语“多肽”可 附加到参考多肽、活性或结构的名称;在这些情况下其在本文中用于指共有相关活性或 结构的多肽且因此可视为同一多肽类别或家族的成员。对于各这类类别,本发明提供和 /或所属领域的技术人员将知道在氨基酸序列和/或功能已知的类别内的例示性多肽;在 一些实施例中,这类例示性多肽是多肽类别的参考多肽。在一些实施例中,一种多肽类 别或家族的成员与所述类别的一种参考多肽显示显著序列同源性或一致性,共有共同序 列基元(例如特征序列元件),和/或共有共同活性(在一些实施例中在相当水准或在指定范 围内);在一些实施例中,是与所述类别内的所有多肽。举例来说,在一些实施例中,一 种成员多肽显示与一种参考多肽的序列同源性或一致性的整体程度是至少约30至40%, 且通常大于约50%、60%、70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、 98%、99%或更大和/或包括至少一个区(即在一些实施例中可以是或包含特征序列元件的 保守区)显示极高序列一致性,通常大于90%或甚至95%、96%、97%、98%或99%。这 一保守区通常涵盖至少三到四个且通常多达20或更多个氨基酸;在一些实施例中,保 守区涵盖至少一个具有至少2、3、4、5、6、7、8、9、10、11、12、13、14、15或更 多个相邻氨基酸的片段。在一些实施例中,适用多肽可包含亲本多肽的片段或由亲本多 肽的片段组成。在一些实施例中,适用多肽可包含多个片段或由多个片段组成,各片段 发现在同一亲本多肽中的相互空间排列与在相关多肽中所发现不同(例如在亲本中直接 连接的片段可能在相关多肽中空间分离或反之亦然,和/或片段可以与亲本中不同的顺序 存在于相关多肽中),因此相关多肽是亲本多肽的衍生物。
[0219]
预防(prevent或prevention):如本文所用,当与疾病、病症和/或病状的发生结合使 用时,是指降低发生所述疾病、病症和/或病状的风险和/或延迟所述疾病、病症或病状 的一或多种特征或症状的发作。当疾病、病症或病状的发作已经延迟预定时间段时,预 防可视为完成。
[0220]
重组体:如本文所用,意图指通过重组方式设计、工程改造、制备、表达、产生或 分离的多肽(例如本文所述的抗体或抗体组分,或多专一性结合剂),如使用转染到宿主 细胞中的重组表达载体表达的多肽,从重组、组合人类多肽库分离的多肽(霍根布姆 (hoogenboom h.r.),1997,tib技术(tib tech.)15:62-70;阿扎茨(azzazy h.)和海史密斯 (highsmith w.e.),2002,临床生物化学(clin.biochem.)35:425-45;加维隆多(gavilondoj.v.)和拉里克(larrick j.w.),2002,生物技术29:128-45;霍根布姆(hoogenboom h.)和查 恩斯(chames p.),2000,现代免疫学(immunol.today)21:371-8),从人类免疫球蛋白基因 转基因的动物(例如小鼠)分离的抗体(参见例如泰勒(taylor,l.d.)等人,1992,核酸研究 (nucl.acids res.)20:6287-95;凯勒曼(kellermann s-a.)和格林(green l.l.),2002,生物技 术新观点(curr.opin.biotechnol.)13:593-7;利特尔(little,m.)等人,2000,现代免疫学 21:364-70;穆菲(murphy,a.j.)等人,2014,美国科学院院刊111(14):5153-8),或通过涉 及所选序列元件相互剪接的任何其它方式制备、表达、产生或分离的多肽。在一些实施 例中,在自然界中发现这类所选序列元件中的一或多个。在一些实施例中,
这类所选序 列元件中的一或多个经计算机设计。在一些实施例中,一或多个这类所选序列元件由例 如来自天然或合成来源的已知序列元件的突变诱发(例如活体内或活体外)产生。举例来 说,在一些实施例中,重组抗体多肽由在相关源生物体(例如人类、小鼠等)的生殖系中 发现的序列构成。在一些实施例中,重组抗体具有由突变诱发(例如活体外或活体内,例 如在转基因动物中)产生的氨基酸序列,以使得重组抗体的vh和v
l
区的氨基酸序列是 尽管源自生殖系vh和v
l
序列且与其相关,但并非活体内在生殖系抗体谱系内天然存在 的序列。
[0221]
参考物:如本文所用,描述标准物、对照或如本文所描述与其进行比较的其它合适 参考物。举例来说,在一些实施例中,参考物是标准或对照药剂、动物、个体、群体、 样品、序列、一系列步骤、一组条件或值,相关药剂、动物、个体、群体、样品、序列、 一系列步骤、一组条件或值与其进行比较。在一些实施例中,参考物基本上与相关测试 或测定同时测试和/或测定。在一些实施例中,参考物是任选地在有形介质中体现的历史 参考物。通常,如所属领域的技术人员将理解,参考物在与相关评估中利用的这些条件 相当的条件下测定或表征。
[0222]
专一性结合:如本文所用,是指结合剂在发生结合的环境中区别可能的搭配物的能 力。当存在其它潜在标靶时与一种具体标靶相互作用的结合剂称为“专一性结合”于与 其相互作用的标靶。在一些实施例中,专一性结合通过检测或测定结合剂与其搭配物之 间的结合程度来评估;在一些实施例中,专一性结合通过检测或测定结合剂-搭配物复合 物的解离程度来评估;在一些实施例中,专一性结合通过检测或测定结合剂竞争其搭配 物与另一实体之间的替代相互作用的能力来评估。在一些实施例中,通过在一系列浓度 下进行这类检测或测定来评估专一性结合。在一些实施例中,通过测定同源与非同源标 靶之间的结合亲和力差异评估专一性结合。举例来说,结合剂对同源标靶的结合亲和力 可以是对非同源标靶的结合亲和力的约3倍、4倍、5倍、6倍、7倍、8倍、9倍、10 倍或更多倍。
[0223]
专一性:如所属领域中已知,“专一性”是具体配位体将其结合搭配物与其它潜在 结合搭配物区分的能力的量度。
[0224]
个体:如本文所用,意指任何哺乳动物,包括人类。在本发明的某些实施例中,个 体是成人、青年或婴儿。在一些实施例中,使用术语“个体(individual)”或“患者”且 意图可与“个体(subject)”互换。本发明还涵盖医药组合物的投与和/或子宫内治疗方法 的性能。
[0225]
基本上:如本文所用,术语“基本上”是指显示相关特征或特性的全部或接近全部 界限或程度的定性病状。生物技术中的一般技术人员应理解,生物和化学现象很少(如果 曾有)进行完全和/或继续进行到完全或实现或避免绝对结果。因此本文中使用术语“基 本上”以获得许多生物和化学现象中所固有的完整性的潜在缺乏。
[0226]
基本上序列同源性:如本文所用,片语“基本上同源性”是指氨基酸或核酸序列之 间的比较。如一般技术人员将了解,如果两个序列在对应位置中含有同源残基,则其大 体上视为“基本上同源”。同源残基可以是一致残基。替代地,同源残基可以是具有适 当类似的结构和/或功能特性的不一致残基。举例来说,如一般技术人员所众所周知,某 些氨基酸通常分类是“疏水性”或“亲水性”氨基酸,和/或分类是具有“极性”或“非 极性”侧链。用一种氨基酸取代另一相同类型可通常视为“同源”取代。典型氨基酸分 类如下概述:
[0227][0228][0229]
如所属领域中所众所周知,氨基酸或核酸序列可使用多种算法中的任一种比较,包 括这些可在市售计算机程序中获得的算法,如用于核苷酸序列的blastn,和用于氨基 酸序列的blastp、有间隙的blast和psi-blast。例示性这类程序描述于以下中: 阿特休尔(altschul)等人,1990,分子生物学杂志,215(3):403-410;阿特休尔等人,1996, 酶学方法(meth.enzymology)266:460-480;阿特休尔等人,1997,核酸研究 25:3389-3402;巴克斯范尼斯(baxevanis)等人,生物信息:基因和蛋白质分析的实践指导(bioinformatics:a practical guide to the analysis of genes and proteins),威利出版社 (wiley),1998;和米塞纳(misener),等人,(编),生物信息学方法和协议(bioinformaticsmethods and protocols)(分子生物学中的方法(methods in molecular biology),第132卷), 胡马纳出版社(humana press),1999。除鉴定同源序列以外,上文所提及的程序通常提供 同源性程度的指示。在一些实施例中,如果两个序列的对应残基中的至少50%、至少55%、 至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少 91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、 至少99%或更多在相关残基片段上同源,则其视为基本上同源。在一些实施例中,相关 片段是完整序列。在一些实施例中,相关片段是至少10、至少15、至少20、至少25、 至少30、至少35、至少40、至少45、至少50、至少55、至少60、至少65、至少70、 至少75、至少80、至少85、至少90、至少95、至
述术语是指当根据治疗给药方案向罹患或易患疾病、病症和/或病状的群体投与时足以治 疗所述疾病、病症和/或病状的量。在一些实施例中,治疗有效量是降低疾病、病症和/ 或病状的一或多种症状的发生率和/或严重性,和/或延迟其发作的量。一般技术人员将 了解术语“治疗有效量”实际上不需要在具体个体中实现成功治疗。确切来说,治疗有 效量可以是当向需要这类治疗的患者投与时在显著数目的个体中提供具体所需药理学 反应的所述量。在一些实施例中,提及治疗有效量可以是提及如在一或多种具体组织(例 如受疾病、病症或病状影响的组织)或流体(例如血液、唾液、血清、汗液、泪液、尿液 等)中测量的量。一般技术人员将了解,在一些实施例中,治疗有效量的具体药剂或疗法 可以单次剂量配制和/或投与。在一些实施例中,治疗有效的药剂可以多个剂量,例如作 为给药方案的一部分配制和/或投与。
[0234]
转形:如本文所用,是指将外源dna引入宿主细胞中的任何方法。转形可在天然 或人工条件下使用所属领域中众所周知的各种方法来进行。转形可依赖于将外来核酸序 列插入原核或真核宿主细胞中的任何已知方法。在一些实施例中,基于转形的宿主细胞 选择具体转形方法,且可包括(但不限于)病毒感染、电穿孔、配对、脂质体转染。在一 些实施例中,“转形”细胞是稳定转形,因为插入的dna能够作为自主复制质体或作为 宿主染色体的一部分进行复制。在一些实施例中,转形细胞短暂表达引入的核酸持续有 限时段。
[0235]
治疗:如本文所用,术语“治疗(treatment)”(以及“治疗(treat/treating)”)在其最广泛 意义上是指部分或完全减轻、改善、缓解、抑制具体疾病、病症和/或病状的一或多种症 状、特征和/或病因、延迟其发作、降低其严重性和/或降低其发生率的任何物质(例如所 提供组合物)投与。在一些实施例中,这类治疗可向不显示相关疾病、病症和/或病状的 征象的个体和/或仅显示疾病、病症和/或病状的早期征象的个体投与。或者或另外,在 一些实施例中,治疗可向显示相关疾病、病症和/或病状的一或多种已确立征象的个体投 与。在一些实施例中,治疗可以是对已诊断为罹患相关疾病、病症和/或病状的个体的治 疗。在一些实施例中,治疗可以是对已知具有一或多种在统计学上与相关疾病、病症和 /或病状发展风险增加相关的易感性因素的个体的治疗。
[0236]
变异体:如本文所用,术语“变异体”是指显示与参考实体的显著结构一致性,但 与参考实体结构上的不同之处在于与参考实体相比,一或多个化学部分的存在或水准的 实体。在许多实施例中,变异体还在功能上与其参考实体不同。一般来说,具体实体是 否恰当地视为参考实体的“变异体”是基于其与参考实体的结构一致性的程度。如所属 领域的技术人员将了解,任何生物或化学参考实体都具有某些特征结构元件。根据定义, 变异体是共有一或多种这类特征结构元件的不同化学实体。仅给出一些实例,多肽可具 有由多个在线性或三维空间中具有相对于彼此的指定位置和/或促成具体生物功能的氨 基酸构成的特征序列元件,核酸可具有由多个在线性或三维空间中具有相对于彼此的指 定位置的核苷酸残基构成的特征序列元件。举例来说,变异体多肽可因氨基酸序列中的 一或多种差异和/或共价连接于多肽主链的化学部分(例如碳水化合物、脂质等)中的一或 多种差异而不同于参考多肽。在一些实施例中,变异体多肽显示与参考多肽至少85%、 86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%或99%的总 体序列一致性。或者或另外,在一些实施例中,变异体多肽并不与参考多肽共有至少一 种特征序列元件。在一些实施例中,参考多肽具有一或多种生物活性。在一些实施例中, 变异体多肽共有参考多
肽的生物活性中的一或多种。在一些实施例中,变异体多肽缺乏 参考多肽的生物活性中的一或多种。在一些实施例中,变异体多肽与参考多肽相比显示 一或多种生物活性水准降低。在许多实施例中,如果相关多肽的氨基酸序列与亲本或参 考多肽的氨基酸序列一致但在具体位置有少量序列变化,则相关多肽视为所述亲本的
ꢀ“
变异体”。通常,与亲本相比,变异体中少于20%、15%、10%、9%、8%、7%、6%、 5%、4%、3%、2%的残基经取代。在一些实施例中,与亲本相比,变异体具有10、9、 8、7、6、5、4、3、2或1个经取代的残基。变异体通常具有极少数目(例如少于5、4、 3、2或1个)的经取代功能残基(即参与具体生物活动的残基)。此外,如与亲本相比,变 异体通常具有不超过5、4、3、2或1个插入或缺失,且通常不具有插入或缺失。此外, 任何添加或缺失通常少于约25、约20、约19、约18、约17、约16、约15、约14、约 13、约10、约9、约8、约7、约6,且通常少于约5、约4、约3或约2个残基。在一 些实施例中,亲本或参考多肽是在自然界中发现的多肽。如一般技术人员将理解,具体 相关多肽的多种变异体可通常在自然界中发现,尤其当相关多肽是感染物多肽时。
[0237]
载体:如本文所用,是指能够输送其已连接的另一核酸的核酸分子。一种载体类型 是“质体”,其是指可接合额外dna区段的环形双股dna环。另一类型的载体是病毒 载体,其中额外dna区段可接合到病毒基因组中。某些载体能够在引入其的宿主细胞 中自主复制(例如,具有细菌复制起点的细菌载体和游离型哺乳动物载体)。其它载体(例 如非游离型哺乳动物载体)在引入宿主细胞中后可整合到宿主细胞的基因组中,且由此与 宿主基因组一起复制。另外,某些载体能够导引其可操作地连接的基因的表达。这类载 体在本文中称为“表达载体”。
[0238]
野生型:如本文所用,术语“野生型”具有其在所属领域中所了解的含义,是指具 有如自然界中在“正常”(相对于突变、变异、患病、更改等来说)状态或情况下所发现 的结构和/或活性的实体。一般技术人员将了解,野生型基因和多肽常常以多种不同形式 (例如,对偶基因)存在。
[0239]
本发明部分地基于以下认识:可将对cd19,具体地说人类cd19具有较高专一性 的人类抗体药剂(例如人类单克隆抗体)制成具有与原生形式的(即形成是在细胞表面上 表达)cd19的优选结合。另外,与优先结合于重组或固定形式的cd19(例如盘结合 cd19)的抗体药剂相比,这类人类抗体药剂大体上与较好活体内特性相关。本发明还基 于以下认识:由未处理谱系研发的人类抗体药剂可能在一些实施例中不提供对临床相关 抗原决定基具有专一性的人类抗体药剂。仅给出一个实例,本发明特别显示本文中描述 的抗cd19人类抗体药剂,具体地说,使用由从自体免疫疾病个体获得的序列产生的抗 体库研发的人类抗体药剂显示与在细胞表面上表达的cd19的结合,但在融合蛋白的情 况下不与重组人类cd19结合。因此,所提供的人类抗体药剂可在一些实施例中以对天 然人类cd19而非潜在地具有极少治疗相关性到无治疗相关性的非天然形式的人类cd19的较高专一性为特征。
[0240]
本发明尤其显示结合在数种癌细胞系和初级人类b细胞的表面上表达的人类cd19 的多专一性结合剂(例如双专一性抗体)的成功产生。具体地说,本发明特别提供以cd19
‑ꢀ
专一性方式结合数种癌细胞系且介导高效标靶细胞溶解的多专一性结合剂(例如双专一 性抗体)。这类多专一性结合剂的特征在于在细胞毒性分析中的高专一性和性能。
[0241]
本发明还显示嵌合抗原受体(car)的成功产生,其是使用所提供的人类抗体药剂和 随后在转导t细胞中表达,由此产生工程改造的car-t细胞(car-t)。具体地说,本发 明
提供专一性识别在各种癌细胞系的表面上表达的人类cd19的car-t。如本文所描述, 所提供的抗cd19 car-t显示在一些实施例中,优于由其它抗cd19抗体组分产生的 car-t的高效标靶细胞杀死。另外,如本文所描述,所提供的抗cd19 car-t有效从植 入有人类淋巴瘤异种移植物的动物根除肿瘤。因此,本发明至少在一些实施例中,包涵 研发对天然人类cd19具有较高专一性的人类抗体药剂用于癌症诊断和治疗,且提供抗 体组分来源以产生用于人类的多专一性结合剂和表达car的免疫细胞。
[0242]
cd19
[0243]
分化簇19或cd19是在b细胞,具体地说许多除浆细胞外的b细胞谱系上表达的 跨膜糖蛋白。cd19还在许多恶性b细胞上表达。在调节抗原-bcr相互作用的刺激临限 值中cd19在b细胞表面上充当共受体。cd19还与细胞表面上的其它分子(如cd21、 cd81和cd82)相互作用。cd19的活化(即细胞质域的磷酸化)触发涉及各种激酶(例如 src-家族)的各种信号转导路径且引起各种免疫细胞过程。cd19已牵涉各种癌症和自体 免疫疾病。实际上,cd19已作为研发用于治疗癌症的基于抗体的疗法的标靶被频繁研 究(参见例如汉默(hammer),2012,mabs 4:5,571-577;赖克特(reichert,j.m.)和迪莫莱(e. dhimolea),2012,今日药物发现(drug discovery today)17(17/18):954-963;苏雷什 (suresh,t.)等人,2014,血液学杂志(j.hematol.)7:58);然而,大多数这类基于抗体的疗 法是鼠抗体的人类化和/或嵌合形式。理想地,全人类抗体药剂对于治疗人类患者来说优 选。人类cd19的氨基酸序列在以下阐述(信号序列加底线)。
[0244][0245][0246]
抗cd19抗体药剂
[0247]
虽然抗cd19抗体已知且已显示作为治疗剂用于在人类中治疗癌症和自体免疫病症 的前景,但许多是鼠来源。在这种情形下使用人类抗体药剂尤其优选,因为其降低对所 投与抗体的免疫反应的可能性。因此,本发明提供全人类抗体药剂(例如人类单克隆抗体 和其片段),其由显示对人类cd19的较高专一性,且在一些实施例中克服与非人类来源 (例如鼠)抗体的现有人类化和/或嵌合形式相关的限制的人类b细胞库研发。
[0248]
本发明提供基于投与抗cd19人类抗体药剂(例如单克隆抗体)和在一些实施例中, 具有结合人类cd19的第一抗原结合位点和结合免疫细胞(例如t细胞)的第二抗原结合 位点的多专一性结合剂(例如双专一性抗体)来治疗cd19相关疾病、病症和病状和相关 恶性病的方法和组合物。
[0249]
本发明特别提供结合人类cd19,且尤其结合于其天然形式(即在细胞表面上表达) 的某些人类抗体序列,以及某些亲和力成熟的抗体序列。举例来说,本文中尤其例示的 是包括含有本文中描述的序列元件的多肽的人类抗体药剂(例如全长抗体、其片段、单链 抗体、双专一性抗体或如本文所描述或另外在所属领域中已知的其它抗体药剂形式)。
[0250]
结合人类cd19的例示性人类抗体药剂(例如scfv)呈现在表1中(轻链可变区序列 (dna和氨基酸)呈现为粗体文字;重链可变区序列(dna和氨基酸)呈现为斜体文字;连 接序列呈现为加底线文字)。
[0251]
表1
[0252]
[0253]
[0254]
[0255]
[0256]
[0257]
[0258]
[0259]
[0260]
[0261]
[0262]
[0263]
[0264]
[0265]
[0266]
[0267]
65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%)一致的序列。
[0272]
在各种实施例中,根据本发明的抗cd19人类抗体药剂由重链和轻链可变区构成, 其中轻链可变区具有与表1中出现的轻链可变区基本上一致或一致的序列。
[0273]
在各种实施例中,根据本发明的抗cd19人类抗体药剂由重链和轻链可变区构成, 所述重链可变区具有与表1中出现的重链可变区至少约50%(例如至少约55%、60%、 65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%)一致的序列,且 所述轻链可变区具有与表1中出现的轻链可变区至少约50%(例如至少约55%、60%、 65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%)一致的序列。
[0274]
在各种实施例中,根据本发明的抗cd19人类抗体药剂由重链和轻链可变区构成, 所述重链可变区具有与表1中出现的重链可变区基本上一致或一致的序列,且所述轻链 可变区具有与表1中出现的轻链可变区基本上一致或一致的序列。
[0275]
在各种实施例中,根据本发明的抗cd19人类抗体药剂由选自表1中出现的重链和 轻链可变区序列的重链和轻链可变区构成。
[0276]
在各种实施例中,根据本发明的抗cd19人类抗体药剂是或包含单链可变片段 (scfv),所述scfv包含与表1中出现的scfv至少约50%(例如至少约55%、60%、65%、 70%、75%、80%、85%、90%、95%、96%、97%、98%或99%)一致的序列。
[0277]
在各种实施例中,根据本发明的抗cd19人类抗体药剂是或包含单链可变片段 (scfv),所述scfv包含与表1中出现的scfv基本上一致或一致的序列。
[0278]
在各种实施例中,根据本发明的抗cd19人类抗体药剂是或包含单链可变片段 (scfv),所述scfv选自表1。
[0279]
可通过任何可用方式产生所提供的抗体药剂,包括抗体和/或其特征部分,或编码其 的核酸。举例来说,用于抗体产生的方案由哈洛(harlow)和兰尼(lane),抗体:实验室手 册(antibodies:a laboratory manual),(1988)描述。产生抗体(例如单克隆抗体和/或多克隆 抗体)的技术是所属领域中众所周知。应了解各种动物物种可用于产生免疫血清,包括兔、 小鼠、大鼠、仓鼠、天竺鼠或山羊。动物的选择可根据处理的容易性、成本或血清的所 需要决定,如所属领域的技术人员将已知。应了解抗体药剂还可以转基因地经由产生转 殖相关免疫球蛋白重链和轻链序列的哺乳动物或植物(例如转殖人类免疫球蛋白重链和 轻链基因的转殖基因啮齿动物)来产生。结合哺乳动物中的转殖基因产生,抗体可在山羊、 母牛或其它哺乳动物的乳汁中产生且从其回收(参见例如美国专利第5,827,690号、第 5,756,687号、第5,750,172号和第5,741,957号;其以全文引用的方式并入本文中)。通 常,抗体可在小鼠、大鼠、天竺鼠、仓鼠、骆驼、骆马、鲨鱼或其它合适宿主中产生。 替代地,抗体可在鸡中制得,产生igy分子(谢德(schade)等人,1996,altex 13(5):80-85)。 在一些实施例中,适用于本发明的抗体是类人灵长类动物抗体。举例来说,在狒狒中产 生治疗学上适用的抗体的通用技术可见于例如国际专利申请公开案第1991/11465号中 和洛斯曼(losman)等人,1990,国际癌症杂志(int.j.cancer)46:310中。在一些实施例中, 单克隆抗体可使用融合瘤方法制备(米尔斯坦(milstein)和奎洛(cuello),1983,自然 305(5934):537-40)。在一些实施例中,单克隆抗体还可通过重组方法制得(参见例如美国 专利第4,166,452号)。
[0280]
许多与通过b细胞永生化产生单克隆抗体相关的困难可通过在大肠杆菌(或酵母)
(luck),“单克隆抗体的遗传操作(genetic manipulation of monoclonal antibodies)”,单克 隆抗体:制备、工程改造和临床应用(monoclonal antibodies:production,engineering andclinical application),里特(ritter)等人,编,第166-179页,剑桥大学出版社(cambridgeuniversity press)1995;和沃德等人,“基因操作和抗体表达(genetic manipulation andexpression of antibodies)”,单克隆抗体:原理和应用(monoclonal antibodies:principlesand applications),白芝(birch)等人,编,第137-185页,威利里斯公司(wiley-liss,inc.) 1995)。
[0284]
人类抗体可使用各种技术产生,包括噬菌体呈现库(霍根布姆等人,1991,分子免疫 学(mol.immunol.)28(9):1027-37;马克思(marks)等人,1991,分子生物学杂志 222(3):581-97)和人类单克隆抗体的制备(雷斯菲尔德(reisfeld)和塞尔(sell),1985,癌症 幸存者(cancer surv.)4(l):271-90)。类似地,可采用将人类ig基因引入内源ig基因已经 部分或完全失活的转殖基因动物中来合成人类抗体(参见例如费什维尔德(fishwild)等人, 1996,自然生物技术14(7):845-51;伦贝格(lonberg)等人,1994,自然368(6474):856-9; 伦贝格和胡萨尔(huszar),1995,国际免疫学评论(int.rev.immunol.)13:65-93;泰勒 (taylor,l.d.)等人,1992,核酸研究20:6287-95;凯勒曼(kellermann s-a.)和格林(greenl.l.),2002,生物技术新观点13:593-7;利特尔等人,2000,现代免疫学21:364-70;穆 菲等人,2014,美国科学院院刊111(14):5153-8)。在攻击后,观察人类抗体产生。在一 些实施例中,抗cd19人类抗体通过使经工程改造以制造对人类cd19的抗原攻击反应 的人类抗体的非人类动物免疫制得。
[0285]
可例如通过利用经工程改造以表达本发明抗体编码核酸的宿主细胞系统产生所提 供的人类抗体药剂(包括抗体和/或特征部分)。或者或另外,可部分或完全地通过化学合 成(例如使用自动化肽合成仪或基因合成编码抗体药剂的核酸)制备所提供的人类抗体药 剂。
[0286]
可使用任何合适载体表达相关人类抗体药剂。多种载体(例如病毒载体)在所属领域 中已知;已引入这类载体的细胞(或这类细胞的后代)可如所属领域中已知培养(例如使用 持续或分批进料培养系统)。在一些实施例中,细胞可经基因工程改造;基因工程改造细 胞表达工程改造多肽(例如抗体药剂多肽,如本文所描述)的技术是所属领域中众所周知 (参见例如奥苏伯尔(ausabel)等人,编,1990,分子生物学现代方法(current protocols inmolecular biology)(威利公司(wiley),纽约(new york)))。
[0287]
在一些实施例中,所提供的人类抗体药剂可视需要使用过滤、离心和/或多种色谱技 术(如hplc或亲和性色谱法)纯化。在一些实施例中,所提供的人类抗体药剂的片段通 过包括用酶(如胃蛋白酶或番木瓜蛋白酶)消化的方法和/或通过经由化学还原裂解二硫 键获得。
[0288]
在一些实施例中,如本文所描述,所提供的人类抗体药剂可以是或包括例如多克隆 抗体;单克隆抗体或其抗原结合片段;经修饰抗体,如亲和力成熟的抗体、变异抗体(例 如与参考抗体相比具有一或多种氨基酸取代)或其片段(例如fab'、fab、f(ab')2);或生物 合成抗体,例如单链抗体、单域抗体(dab)、fv、单链fv(scfv)、多专一性结合剂(例如 双专一性抗体)、嵌合抗原受体(car)等。
[0289]
应了解所提供的人类抗体药剂可以使得改良抗体药剂的特征和/或活性的方式经
opin. drug discov.)5(1):95-111;和美国专利第8,080,415号和第8,084,222号;其皆以引用的 方式并入本文中)。在一些实施例中,本发明提供多专一性结合剂,其具有包含变异fc 区的人类抗cd19抗体组分。在一些实施例中,所提供的多专一性结合剂包括如与可衍 生组分的亲本抗体相比,显示变异糖基化(例如经去糖基化)的抗体组分。
[0295]
在一些实施例中,本发明提供和/或利用包含变异fc区(即相对于合适参考fc,fc 区包括一或多种添加、缺失和/或取代)的抗体或抗体药剂,其特征在于相对于参考fc, 改变(例如增加和/或减少)效应功能和/或对fcr的亲和力增强或减弱。这些变异在技术 人员的技术内。
[0296]
因此,本发明尤其提供包含以较大亲和力结合于一或多种fcγr的变异fc区的抗体 药剂和多专一性结合剂(例如抗体药剂)。这类药剂优选地如下文所讨论更有效地介导效 应功能。在一些实施例中,本发明提供包含以较弱亲和力结合于一或多种fcγr的变异 fc区的抗体药剂和多专一性结合剂(例如双专一性抗体)。减少或消除效应功能在某些情 况下是理想的,例如在作用机制涉及阻断或拮抗但不杀死携带标靶抗原的细胞的抗体的 情况下。另外,在一些实施例中,当制备如下文所讨论的双专一性抗体时,消除效应功 能是理想的。减少或消除效应功能将在效应功能将阻断效应细胞中的fcγr活化受体的 自体免疫疾病(这种类型的功能将存在于宿主细胞中)的情况下理想的。一般来说,可将 增加的效应功能导向到表达外来抗原的肿瘤和细胞;在一些实施例中,可导向效应功能 离开肿瘤细胞。
[0297]
根据本发明使用的fc变异体可与其它fc修饰组合,包括(例如)改变效应功能的修 饰。本发明包括组合如本文所描述的fc变异体与其它fc修饰以在抗体或fc融合物中 提供附加、协同或新颖特性。在一些这类实施例中,fc变异体可增强与其组合的修饰的 表型。举例来说,如果fc变异体与已知以比包含野生型fc区的类似分子高的亲和力结 合fcγriiia的突变体组合,则与突变体的组合引起fcγriiia亲和力的较大倍数增强。
[0298]
在一些实施例中,根据本发明,将如本文所描述的fc变异体并入抗体或fc融合体 中以产生将一或多种fc糖型(即与一或多种碳水化合物共价连接的一或多种fc多肽)包 含到包含fc区的分子中的工程改造药剂,其中糖型的碳水化合物组成与包含fc区的母 体分子化学地不同。
[0299]
在一些实施例中,如本文所描述的多专一性结合剂(例如抗体药剂)可包括显示变异 糖基化的fc变异体和/或可在缺乏糖基化的细胞系中表达使得产生与合适参考fc区(例 如亲本fc区)或在不缺乏糖基化的细胞系中表达的fc区相比,缺乏糖基化的药剂fc区。
[0300]
在一些实施例中,根据本发明利用的抗体可相对于结合于相关抗原(例如cd19)的合 适参考抗体具有经修饰糖基化位点,优选地其不改变抗体的功能,例如对抗原的结合活 性。如本文所用,“糖基化位点”包括抗体中寡糖(即含有两种或多于两种连接在一起的 单糖的碳水化合物)将专一性和共价连接的任何专一性氨基酸序列。寡糖侧链通常经由n 或o-键连接到抗体的主链。n连接的糖基化是指寡糖部分连接到天冬酰胺残基的侧链。 o连接的糖基化是指寡糖部分连接到羟基氨基酸,例如丝氨酸、苏氨酸。举例来说,缺 乏某些寡糖(包括海藻糖和末端n-乙酰基葡糖胺)的fc糖型可在特别cho细胞中产生且 显示增强的adcc效应功能。
[0301]
在一些实施例中,本发明涵盖通过添加或删除糖基化位点来修改如本文所描述的
重链可变区和/或seq id no:10中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:10中出现的免疫球蛋白重链可变区和seq id no:10中出 现的免疫球蛋白轻链可变区的抗体。
[0309]
在一些实施例中,本发明的人类抗体药剂包括seq id no:12中出现的免疫球蛋白 重链可变区和/或seq id no:12中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:12中出现的免疫球蛋白重链可变区和seq id no:12中出 现的免疫球蛋白轻链可变区的抗体。
[0310]
在一些实施例中,本发明的人类抗体药剂包括seq id no:14中出现的免疫球蛋白 重链可变区和/或seq id no:14中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:14中出现的免疫球蛋白重链可变区和seq id no:14中出 现的免疫球蛋白轻链可变区的抗体。
[0311]
在一些实施例中,本发明的人类抗体药剂包括seq id no:16中出现的免疫球蛋白 重链可变区和/或seq id no:16中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:16中出现的免疫球蛋白重链可变区和seq id no:16中出 现的免疫球蛋白轻链可变区的抗体。
[0312]
在一些实施例中,本发明的人类抗体药剂包括seq id no:18中出现的免疫球蛋白 重链可变区和/或seq id no:18中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:18中出现的免疫球蛋白重链可变区和seq id no:18中出 现的免疫球蛋白轻链可变区的抗体。
[0313]
在一些实施例中,本发明的人类抗体药剂包括seq id no:20中出现的免疫球蛋白 重链可变区和/或seq id no:20中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:20中出现的免疫球蛋白重链可变区和seq id no:20中出 现的免疫球蛋白轻链可变区的抗体。
[0314]
在一些实施例中,本发明的人类抗体药剂包括seq id no:22中出现的免疫球蛋白 重链可变区和/或seq id no:22中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:22中出现的免疫球蛋白重链可变区和seq id no:22中出 现的免疫球蛋白轻链可变区的抗体。
[0315]
在一些实施例中,本发明的人类抗体药剂包括seq id no:24中出现的免疫球蛋白 重链可变区和/或seq id no:24中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:24中出现的免疫球蛋白重链可变区和seq id no:24中出 现的免疫球蛋白轻链可变区的抗体。
[0316]
在一些实施例中,本发明的人类抗体药剂包括seq id no:26中出现的免疫球蛋白 重链可变区和/或seq id no:26中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:26中出现的免疫球蛋白重链可变区和seq id no:26中出 现的免疫球蛋白轻链可变区的抗体。
[0317]
在一些实施例中,本发明的人类抗体药剂包括seq id no:28中出现的免疫球蛋白 重链可变区和/或seq id no:28中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:28中出现的免疫球蛋白重链可变区和seq id no:28中出 现的免疫球蛋白轻链可变区的抗体。
[0318]
在一些实施例中,本发明的人类抗体药剂包括seq id no:30中出现的免疫球蛋白 重链可变区和/或seq id no:30中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:30中出现的免疫球蛋白重链可变区和seq id no:30中出 现的免疫球蛋白轻链可变区的抗体。
[0319]
在一些实施例中,本发明的人类抗体药剂包括seq id no:32中出现的免疫球蛋白 重链可变区和/或seq id no:32中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:32中出现的免疫球蛋白重链可变区和seq id no:32中出 现的免疫球蛋白轻链可变区的抗体。
[0320]
在一些实施例中,本发明的人类抗体药剂包括seq id no:34中出现的免疫球蛋白 重链可变区和/或seq id no:34中出现的免疫球蛋白轻链可变区。在一些实施例中,人 类抗体药剂是包括seq id no:34中出现的免疫球蛋白重链可变区和seq id no:34中出 现的免疫球蛋白轻链可变区的抗体。
[0321]
具体例示性实施例-具体氨基酸取代
[0322]
在一些实施例中,本发明的人类抗体药剂包括在氨基酸位置3、12、16、17、25、 26、32、63、69、97、102、106、108、109、113、116、117和其组合中的任一个处包 含一或多种氨基酸取代的免疫球蛋白重链可变区。在一些实施例中,本发明的人类抗体 药剂包括在构架和/或cdr区中包含至少一种和最多五种氨基酸取代的免疫球蛋白重链 可变区。
[0323]
在一些实施例中,本发明的人类抗体药剂包括在选自由seq id no:2、4、6、8、 10、12、14、16、18、20、22、24、26、28、30、32和34组成的群组的seq id no. 中出现,且在氨基酸位置3、12、16、17、25、26、32、63、69、97、102、106、108、 109、113、116、117和其组合中的任一个处更包含一或多种氨基酸取代的免疫球蛋白重 链可变区。
[0324]
在一些实施例中,本发明的人类抗体药剂包括包含一或多种选自由q3r、k12e、 e16g、s17f、s25a、g26a、y32f、s63f、t69a、a97v、t102s、m106l、y108n、 d109e、q113l、l116m、m117l和其组合组成的群组的取代的免疫球蛋白重链可变区。
[0325]
在一些实施例中,本发明的人类抗体药剂包括与参考免疫球蛋白重链可变区相比包 含一或多种取代的免疫球蛋白重链可变区,且所述免疫球蛋白重链可变区具有seq idno:36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70和 72中的任一个中出现的序列。
[0326]
在一些实施例中,本发明的人类抗体药剂包括在氨基酸位置10、16、25、34、52、54、68、69、72、75、93、95和其组合中的任一个处包含一或多种氨基酸取代的免疫球 蛋白轻链可变区。在一些实施例中,本发明的人类抗体药剂包括在构架和/或cdr区中 包含至少一种和最多五种氨基酸取代的免疫球蛋白轻链可变区。
[0327]
在一些实施例中,本发明的人类抗体药剂包括在选自由seq id no:2、4、6、8、 10、12、14、16、18、20、22、24、26、28、30、32和34组成的群组的seq id no. 中出现,且在氨基酸位置10、16、25、34、52、54、68、69、72、75、93、95和其组 合中的任一个处更包含一或多种氨基酸取代的免疫球蛋白轻链可变区。
[0328]
在一些实施例中,本发明的人类抗体药剂包括包含一或多种选自由v10m、k16e、 s25n、v34i、d52n、l54q、n68t、t69m、l72m、s75n、s93t、d95e、d95g和其 组合组成的群组的取代的免疫球蛋白轻链可变区。
[0329]
在一些实施例中,本发明的人类抗体药剂包括与参考免疫球蛋白轻链可变区相比包 含一或多种取代的免疫球蛋白轻链可变区,且所述免疫球蛋白轻链可变区具有seq idno:36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70和 72中的任一个中出现的序列。
[0330]
在一些实施例中,本发明的人类抗体药剂包括在构架和/或cdr区中一起包含至少 一种和最多五种氨基酸取代的免疫球蛋白重链和轻链可变区。
[0331]
本发明尤其显示本发明的抗cd19人类抗体药剂中这类氨基酸取代的存在相对于亲 本人类抗体药剂,增加人类抗体药剂对人类cd19的结合亲和力和/或专一性。即,将这 类氨基酸取代引入抗cd19人类抗体药剂中改良其对cd19,且尤其对天然cd19(即在 细胞表面上表达)的结合亲和力。
[0332]
所属领域的技术人员知道多种在所属领域中已知用于实现这类引入或用于另外制 备、提供或制造含有这类序列的多肽的技术。就此来说适用的例示性技术例如提供于格 林和桑布鲁克,分子克隆:实验室手册,冷泉港实验室出版社2012中。
[0333]
具体例示性实施例-专一性cdr
[0334]
如所属领域中大体上已知,单克隆抗体由两条重链和两条轻链制成,各自包含可变 区和恒定区。重链可变区通常包含三个cdr,其在本文中标识是hcdr1、hcdr2和 hcdr3,由构架区侧接(参见例如威廉保罗(william e.paul),基础免疫学(fundamentalimmunology)(第7版),利平科特威廉姆斯和威尔金斯出版社(lippincott williams& wilkins)2013)。轻链可变区通常包含三个互补决定区(cdr),其在本文中标识是lcdr1、 lcdr2和lcdr3,由构架区侧接。
[0335]
本发明提供包括表2(hcdr)和3(lcdr)中所示的呈任何可能组合的cdr的人类抗 体药剂。举例来说(其不意指限制),本发明包括人类抗体药剂,其包括分别是seq idno:73、seq id no:74、seq id no:75、seq id no:181、seq id no:182和seq idno:183的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3。
[0336]
具有所需cdr和/或构架区的抗体的制造在所属领域中大体上已知且描述于例如斯 托赫尔(strohl)和斯托赫尔(strohl),治疗性抗体工程改造(therapeutic antibodyengineering),伍德海德出版有限公司(woodhead publishing limited)2012中。
[0337]
表2
[0338]
[0339]
[0340][0341]
表3
[0342]
[0343]
[0344][0345]
在各种实施例中,本发明的人类抗体药剂包括表2中出现的hcdr中的至少一个和 /或表3中出现的lcdr中的至少一个。
[0346]
在各种实施例中,本发明的人类抗体药剂包括表2中出现的hcdr中的至少两个和 /或表3中出现的lcdr中的至少两个。
[0347]
在各种实施例中,本发明的人类抗体药剂包括表2中出现的任何三个hcdr和/或 表3中出现的任何三个lcdr。
[0348]
在各种实施例中,本发明的人类抗体药剂包括表2中出现的一组三个hcdr和/或 表3中出现的一组对应三个lcdr。
[0349]
在各种实施例中,本发明的人类抗体药剂包括三个hcdr,所述三个hcdr各自具 有与表2中出现的三个hcdr至少约50%(例如至少约55%、60%、65%、70%、75%、 80%、85%、90%、95%、96%、97%、98%或99%)一致的序列。
[0350]
在各种实施例中,本发明的人类抗体药剂包括三个lcdr,所述三个lcdr各自具 有与表3中出现的三个lcdr至少约50%(例如至少约55%、60%、65%、70%、75%、 80%、85%、90%、95%、96%、97%、98%或99%)一致的序列。
[0351]
在各种实施例中,本发明的人类抗体药剂包括三个hcdr和三个lcdr,所述三个hcdr各自具有与表2中出现的三个hcdr至少约50%(例如至少约55%、60%、65%、 70%、75%、80%、85%、90%、95%、96%、97%、98%或99%)一致的序列,且所述三 个lcdr各自具有与表3中出现的三个lcdr至少约50%(例如至少约55%、60%、65%、 70%、75%、80%、85%、90%、95%、96%、97%、98%或99%)一致的序列。
二结合组分各由以不同专一性为特征的抗体组分构成。在许多实施例中,抗体组分是选 自表1。
[0371]
在各种实施例中,根据本发明的双专一性结合剂包含第一结合组分和第二结合组 分。在各种实施例中,根据本发明的双专一性结合剂包含第一结合组分、第二结合组分 和连接到第一和第二结合组分两者(例如位于第一与第二结合组分之间)的连接子。
[0372]
在各种实施例中,如本文所描述的第一和/或第二结合组分包含或是抗体组分。在各 种实施例中,如本文所描述的第一和/或第二结合组分包含连接序列或经由连接序列连 接。
[0373]
在一些实施例中,连接子长度是至少2、3、4、5、6、7、8、9、10、11、12、13、 14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、 45、50、55、60、65、70、75、80、85、90、95、100或更多个氨基酸。在一些实施例 中,连接子的特征在于其趋向于不采用刚性三维结构,而是向多肽(例如第一和/或第二 结合组分)提供柔性。在一些实施例中,基于赋予双专一性结合剂的具体特性(如聚集减 少和/或稳定性增加),在本文中描述的双专一性结合剂中采用连接子。在一些实施例中, 本发明的双专一性结合剂包含g4s连接子。在某些实施例中,本发明的双专一性结合剂 包含(g4s)n连接子,其中n是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15 或更大。
[0374]
在一些实施例中,如本文所描述的第一和/或第二结合组分是或包含免疫球蛋白(例 如igg)。在一些实施例中,如本文所描述的第一和/或第二结合组分是或包含抗体片段(例 如scfv)。在一些实施例中,如本文所描述的第一结合组分是或包含抗体片段且第二结 合组分是或包含免疫球蛋白。在一些实施例中,如本文所描述的第一结合组分是或包含 免疫球蛋白且第二结合组分是或包含抗体片段。在某些实施例中,第一结合组分是免疫 球蛋白且第二结合组分是抗体片段。在某些实施例中,第一结合组分是igg且第二结合 组分是scfv。
[0375]
在某些实施例中,根据本发明的双专一性结合剂包含第一和第二scfv。在某些实施 例中,第一scfv连接到第二scfv的c端。在某些实施例中,第二scfv连接到第一scfv 的c端。在某些实施例中,scfv经由连接序列彼此连接。在某些实施例中,scfv在无 连接序列的情况下彼此连接。
[0376]
在一些实施例中,本发明的双专一性结合剂包括两个不同重链或重链可变区和两个 不同轻链或轻链可变区。
[0377]
在一些实施例中,本发明的双专一性结合剂具有两种专一性,其中的一者结合人类 cd19且另一者结合t细胞上的cd3(例如cd3γ、cd3δ、cd3ε、cd3ζ等)。
[0378]
在一些实施例中,本发明的双专一性结合剂包含一或多个序列与表1中出现的一或 多个序列至少约50%(例如至少约55%、60%、65%、70%、75%、80%、85%、90%、 95%、96%、97%、98%或99%)一致。
[0379]
在一些实施例中,本发明的双专一性结合剂包含一或多个序列与表1中出现的一或 多个序列基本上一致或一致。
[0380]
在各种实施例中,如本文所描述的双专一性结合剂的第一结合组分包含一或多个 hcdr和一或多个lcdr,所述一或多个hcdr各自具有与表2中出现的一或多个hcdr 至少50%(例如50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、 93%、94%、95%、
96%、97%、98%、99%或更多)一致的序列,且所述一或多个lcdr 各自具有与表3中出现的一或多个lcdr至少50%(例如50%、55%、60%、65%、70%、 75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更 多)一致的序列。
[0381]
在各种实施例中,如本文所描述的双专一性结合剂的第一结合组分包含三个hcdr 和三个lcdr,所述三个hcdr各自具有与表2中出现的三个hcdr至少50%(例如 50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、 96%、97%、98%、99%或更多)一致的序列,且所述三个lcdr各自具有与表3中出现 的三个lcdr至少50%(例如50%、55%、60%、65%、70%、75%、80%、85%、90%、 91%、92%、93%、94%、95%、96%、97%、98%、99%或更多)一致的序列。
[0382]
在各种实施例中,如本文所描述的双专一性结合剂的第一结合组分包含一组三个 hcdr和一组三个lcdr,所述组三个hcdr各自具有与表2中出现的一组三个hcdr 至少50%(例如50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、 93%、94%、95%、96%、97%、98%、99%或更多)一致的序列,且所述组三个lcdr各 自具有与表3中出现的一组三个lcdr至少50%(例如50%、55%、60%、65%、70%、 75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更 多)一致的序列。
[0383]
在各种实施例中,如本文所描述的双专一性结合剂的第一结合组分包含表2中出现 的一组三个hcdr和表3中出现的一组三个lcdr。
[0384]
在各种实施例中,如本文所描述的双专一性结合剂的第一结合组分包含具有与表1 中出现的抗体组分至少50%(例如50%、55%、60%、65%、70%、75%、80%、85%、 90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多)一致的序列的抗 体组分。
[0385]
在各种实施例中,如本文所描述的双专一性结合剂的第一结合组分包含具有与表1 中出现的抗体组分基本上一致或一致的序列的抗体组分。
[0386]
在各种实施例中,如本文所描述的双专一性结合剂的第二结合组分包含结合t细胞 的抗体组分。可用作如本文所描述的双专一性结合剂的第二结合组分的标靶的例示性t 细胞标记物包括cd3(例如cd3γ、cd3δ、cd3ε、cd3ζ等)、cd4、cd8、cd28、ox40 (tnfrsf4或cd134)、gitr(tnfrsf18或cd357)、cd137(tnfrsf9或4-1bb)、cd27 (tnfrsf7)、cd40l(tnfsf5或cd154)、hvem(tnfrsf14或cd270)等。在一些实 施例中,如本文所描述的双专一性结合剂的第二结合组分包含结合cd3的抗体组分。在 某些实施例中,如本文所描述的双专一性结合剂的第二结合组分包含结合cd3ε的抗体 组分。可在本发明的双专一性结合剂中采用的例示性抗cd3抗体组分在所属领域中已知 且可见于例如以下中:劳特利奇(routledge)等人,1991,欧洲免疫学杂志(eur.j. immunol.)21:2717-25;阿代尔(adair)等人,1994,人类抗体融合瘤(hum.antibodieshybridomas)5:41-7;诺曼(norman)等人,2000,临床移植(clin.transplant.) 70(12):1707-12;夏特诺德(chatenoud),2003,自然免疫学综述(nat.rev.immunol.) 3(2):123-32;奇德尔(cheadle),2006,分子疗法的当前观点(curr.opin.mol.ther.) 8(1):62-8;赫罗尔德(herold)等人,2009,临床免疫学(clin.immunol.)132:166-73;海斯 (heiss)和丸和(murawa),2010,国际癌症杂志127(9):2209-21;基穆伦(keymeulen)等人, 2010,糖尿病学(diabetologia),53:614-23;西尔克(silke)和吉尔(gires),2011,分子抗体 (mabs),3(1):31-7;乔菲(cioffi,m.)等人,2012,临床癌症研究(clin.cancer res.) 18:465-474;迪安(dean)等人,2012,瑞士医学周刊
(swiss med.wkly.)142:w13711;拉布 瑞金(labrijn)等人,2013,美国科学院院刊110(13):5145-50;波特尔(portell)等人,2013, 临床药理学(clin.pharmacol.)5:5-11;美国专利第7,112,324号、第7,575,923号、第 8,076,459号、第8,101,722号,其皆以全文引用的方式并入本文中。
[0387]
替代地,现有非人类(例如鼠)抗cd3抗体组分提供抗体组分的有价值的来源以在本 发明的双专一性结合剂中使用(参见例如embl寄存号a22259.1 gl641464中的鼠okt3 轻链和embl寄存号a22261.1 gl21727144下的鼠okt3重链)。虽然这类非人类抗体 组分适用,但其人类化形式在治疗人类个体中优选,因为其尤其降低对所投与抗体(或双 专一性结合剂)的免疫反应的可能性。制备人类化抗体的方法在所属领域中大体上已知。
[0388]
嵌合抗原受体
[0389]
本发明还提供嵌合抗原受体,其包含如本文所描述的人类抗体药剂和/或多专一性结 合剂。car可通过所属领域中已知的方法构筑(参见例如国际专利申请公开案第 2012/079000号、第2013/126726号、第2015/177789号和第2015/080981号;美国专利 申请公开案第2012/0213783a1号、美国专利第7,446,179号和第5,912,172号;米龙 (milone,m.c.)等人,2009,分子疗法(mol.therapy)17(8):1453-64;科金迪夫 (kochenderfer,j.n.)等人,2010,血液学(blood)116(19):3875-86;2011,新英格兰医学杂 志(n.engl.j.med.)365(20):1937-9;格鲁普(grupp,s.a.)等人,2013,新英格兰医学杂志 368(16):1509-18;罗马斯(romas,c.a.)等人,2014,癌症杂志(cancer j.)20(2):112-18;辛 格(singh,h.)等人,2014,免疫学综述(immunol.rev.)257(1):181-90;藤原(fujiwara,h.), 2014,药学(pharmaceuticals)7:1049-68;莫德(maude,s.l.)等人,2015,血液学 125(26):4017-23;其皆以引用的方式并入本文中)。免疫效应细胞(例如t细胞、nk细胞 等)可经工程改造以表达含有如本文所描述的抗体组分的嵌合抗原受体,由此产生克服由 癌细胞采用以逃避检测的免疫系统的监督机制的抗肿瘤免疫效应细胞。在一些实施例 中,本发明提供表达嵌合抗原受体的免疫细胞,所述嵌合抗原受体包含如本文所描述的 人类抗体药剂或多专一性结合剂的一或多个抗原结合位点。在一些实施例中,免疫细胞 包括经工程改造以表达本文中描述的人类抗体药剂的抗原结合位点的t细胞。在一些实 施例中,抗原结合位点是或包含如本文所描述的抗体组分。
[0390]
在一些实施例中,免疫细胞包括作为人类受体和/或经人工而工程改造(例如包括一 或多种氨基酸取代)的嵌合抗原受体。在一些实施例中,嵌合抗原受体包含一种、两种、 三种、四种、五种或更多种组分(例如抗体组分、结合组分、信号传导组分等)。在一些 实施例中,嵌合抗原受体包含跨膜组分和/或细胞内信号传导组分。在一些实施例中,嵌 合抗原受体包含产自于表达所述嵌合抗原受体的免疫细胞的组分(例如天然免疫细胞受 体)。在一些实施例中,嵌合抗原受体包含t细胞受体(tcr)多肽的一或多种跨膜和/或一 或多种细胞内组分。
[0391]
如本文所用,术语“t细胞受体”或“tcr”是指由在t细胞表面上配对的αβ或γδ 链构成的杂二聚受体。各α、β、γ和δ链由两个ig样域构成:经由tcr的cdr赋予抗 原识别的可变域(v),接着通过连接肽和跨膜(tm)区锚定到细胞膜的恒定域(c),其又连 接到细胞质序列/细胞内组分。tm区与cd3信号传导设备的恒定次单位结合。tcr v 域中的每一个具有三个cdr。这些cdr与结合于主要组织相容性复合物(pmhc)编码的 蛋白质的抗原肽之间的复
合物相互作用(例如参见戴维斯和比约克曼,1988年,《自然》 334:395-402;戴维斯等人,1998年,《免疫学年鉴》(annu.rev.immunol.)16:523-44;穆 菲肯尼思,《珍氏免疫生物学》(janeway's immunobiology.)第8版。纽约:加兰科学(newyork:garland science),泰勒弗朗西斯集团(taylor&francis group,llc),2012年出版, 第5和6章)。tcr v域和cdr序列通常极不同于抗体v域和cdr序列。
[0392]
在一些实施例中,所提供的嵌合抗原受体(car)由第一和第二多肽的杂二聚体构成, 第一多肽包含如本文所描述的抗cd19重链可变区和tcrγ链的tm区,且第二多肽包 含如本文所描述的抗cd19轻链可变区和tcrδ链的tm区。在一些实施例中,car杂 二聚体的第一多肽包含如本文所描述的抗cd19重链可变区和tcrδ链的tm区,且第 二多肽包含如本文所描述的抗cd19轻链可变区和tcrγ链的tm区。在一些实施例中, 所提供的嵌合抗原受体包含tcrαβ链的tm区。在一些实施例中,所提供的嵌合抗原 受体包含tcr的细胞内域。在具体实施例中,所提供的嵌合抗原受体包含tcr的tm 区和细胞内区两者。
[0393]
在一些实施例中,如本文所描述的嵌合抗原受体的组分促进免疫细胞与cd19
+
细胞 的结合。在一些实施例中,如本文所描述的嵌合抗原受体包含作为或基于如本文所描述 的抗体药剂的抗体组分。在一些实施例中,如本文所描述的嵌合抗原受体包含结合人类 cd19的抗体组分,且进一步全部或部分包含一或多个细胞质信号传导域,和全部或部 分包含一或多个共刺激分子。在一些实施例中,如本文所描述的嵌合抗原受体的抗体组 分是或包含scfv;在某些实施例中,scfv选自表1。
[0394]
标靶
[0395]
本发明尤其涵盖以下认识:多专一性结合剂(和/或嵌合抗原受体),且尤其双专一性 结合剂(如双专一性抗体)尤其适用于和/或有效促进细胞杀死。具体地说,本发明显示专 一性结合于标靶细胞相关抗原决定基(例如癌细胞上的cd19)和淋巴细胞相关抗原决定 基(例如t细胞表面蛋白质)两者的多专一性结合剂的活性可以是用于b细胞相关疾病和 恶性病的有效免疫疗法。
[0396]
举例来说,在本发明的一些实施例中,多专一性结合剂专一性结合于肿瘤细胞相关 抗原决定基和t细胞抗原决定基。根据这类实施例,多专一性结合剂可促进药剂与其标 靶抗原决定基中的一个或两个的结合和/或可增强如由标靶t细胞介导的标靶肿瘤细胞 的杀死。仅给出另一实例,在本发明的一些实施例中,嵌合抗原受体结合癌细胞上的 cd19。根据这类实施例,在嵌合抗原受体与其标靶抗原决定基接合之后,免疫细胞可促 进cd19
+
细胞的杀死。
[0397]
在一些实施例中,将杀死的标靶细胞包括例如表达cd19的细胞(例如淋巴瘤或白血 病细胞)。一般技术人员将知道如本文所描述的多专一性结合剂合乎需要地结合的在这类 细胞上的合适标靶抗原决定基。
[0398]
在一些实施例中,可介导如本文所描述的标靶细胞的杀死的淋巴细胞包括t细胞(例 如cd8
+
t细胞)、自然杀手(nk)细胞、巨噬细胞、粒细胞和抗体依赖性细胞毒性细胞。 一般技术人员将知道如本文所描述的多专一性结合剂合乎需要地结合的在这类淋巴细 胞上的合适标靶抗原决定基。代表性这类抗原决定基可在抗原上发现,如igg的fc受 体(例如fcγriib)、cd1d、cd3(例如cd3γ、cd3δ、cd3ε、cd3ζ等)、cd4、cd7、cd8、 cd13、cd14、cd16、cd27、cd28、cd31、cd38、cd40l、cd56、cd68、mac-1/mac-3、 il-2ra、ox40、gitr、hvem、ly49和
合剂可以可溶多肽或以包涵体形式从细胞回收,从其中其可通过8m盐酸胍和透析定量 地提取。为了进一步纯化本发明的人类抗体药剂和/或多专一性结合剂,可使用常规离子 交换色谱法、疏水性相互作用色谱、逆相色谱法或凝胶过滤。本发明的人类抗体药剂和 /或多专一性结合剂还可以在从真核或原核细胞分泌之后从改良性培养基回收。
[0407]
可通过所属领域中已知的方法获得在免疫细胞表面上表达的嵌合抗原受体。通常, 将携带编码嵌合抗原受体多肽的核酸序列的表达载体转形成宿主细胞以用于表达。如上 文所描述,这类宿主细胞可以是细胞系或初级人类细胞分离物,如来自pbmc的t细胞。 表达载体还可以包括编码信号肽和/或跨膜域和/或信号传导域的序列以使得嵌合抗原受 体的表达靶向细胞膜。这类信号肽是所属领域的技术人员已知。通过所属领域中已知的 方法将编码嵌合抗原受体多肽的表达载体引入宿主细胞中,所述方法包括例如dna转 染、电穿孔、转染和感染(例如用病毒,如腺病毒或逆转录病毒)。
[0408]
在一些实施例中,编码如本文所描述的嵌合抗原受体的核酸分子提供在t细胞中的 表达,由此产生嵌合抗原受体t细胞(car-t)。编码嵌合抗原受体的核酸分子可包括于 一或多个载体(例如慢病毒或逆转录病毒载体)中以便在宿主免疫效应细胞(如t细胞)中 表达。例示性免疫细胞包括t细胞、自然杀手(nk)细胞、细胞毒性t淋巴细胞(ctl)和 调节t细胞。产生编码嵌合抗原受体的核酸分子和包括这类嵌合抗原受体的t细胞的方 法在所属领域中已知(参见例如迪尔(till,b.g.)等人,2008,血液学112(6):2261-71;布伦 特扬斯(brentjens,r.)等人,2010,分子疗法18(4):666-8;摩根(morgan,r.a.)等人,2010, 分子疗法18(4):843-51;帕克(park,t.s.)等人,2011,生物科技趋势(trends biotechnol.) 29(11):550-7;格鲁普等人,2013,新英格兰医学杂志368(16):1509-18;韩(han,e.q.)等 人,2013,血液学与肿瘤学杂志(j.hematol.oncol.)6:47;wo 2012/079000、wo2013/126726;和美国专利申请公开案第2012/0213783号)。
[0409]
结合物
[0410]
在所属领域中已知数种用于将治疗或检测剂与抗体药剂连接或结合的技术。一些连 接技术涉及使用连接到抗体的金属螯合络合物,其利用例如有机螯合剂,如二亚乙三胺 五乙酸酐(dtpa);亚乙三胺四乙酸;n-氯-对甲苯磺酰胺;和/或四氯-3α-6α-二苯基甘脲
ꢀ‑
3(参见例如美国专利第4,472,509号和第4,938,948号)。所提供的人类抗体药剂还可以 在偶合剂(如戊二醛或过碘酸盐)存在下与酶反应。带有荧光素标记物的结合物例如在这 些偶合剂存在下或通过与异硫氰酸盐反应来制备。
[0411]
在一些实施例中,如本文所描述的人类抗体药剂与酬载实体结合。在一些实施例中, 酬载实体是或包含治疗剂;在一些实施例中,酬载实体是或包含检测剂。
[0412]
保护基
[0413]
本发明的人类抗体药剂(或多专一性结合剂或嵌合抗原受体)可提供有所属领域中已 知的保护基。不希望受任何具体理论束缚,添加保护基在一些实施例中,可改良添加其 的多肽或肽的一或多种特性,如稳定性和/或功效。在一些实施例中,本文中描述的人类 抗体药剂(或多专一性结合剂或嵌合抗原受体)可带有一或多个(例如一个、两个、三个、 四个、五个或超过五个)保护基。保护基可偶合到如本文所描述的人类抗体药剂(或多专 一性结合剂或嵌合抗原受体)的多肽或多肽链的n端和/或c端。适用于根据本发明的用 途的保护基包括以引用的方式并入本文中的美国临时专利申请案第62/131,128号中描述 的这些
保护基。
[0414]
治疗剂
[0415]
治疗剂可以是或包含任何类别的化学实体,包括(例如)(但不限于)蛋白质、碳水化 合物、脂质、核酸、小有机分子、非生物聚合物、金属、离子、放射性同位素等。在一 些实施例中,根据本发明使用的治疗剂可具有与治疗癌症的一或多种症状或病因有关的 生物活性。在一些实施例中,根据本发明使用的治疗剂可具有与调节免疫系统和/或增强 t细胞介导的细胞毒性有关的生物活性。在一些实施例中,根据本发明使用的治疗剂具 有一或多种其它活性。
[0416]
在一些实施例中,结合治疗剂是放射性同位素、药物结合物、纳米粒子、免疫毒素 或任何其它治疗酬载。
[0417]
检测剂
[0418]
检测剂包含例如由于其具体功能特性和/或化学特征而可使用分析检测的任何部分。 这类试剂的非限制性实例包括酶、放射性标记、半抗原、荧光标记、磷光分子、化学发 光分子、发色团、发光分子、光亲和性分子、着色粒子或配位体(如生物素)。
[0419]
许多检测剂在所属领域中已知,用于将其连接到抗体的系统也是已知的(参见例如美 国专利第5,021,236号、第4,938,948号和第4,472,509号)。这类检测剂的实例尤其包括 顺磁离子、放射性同位素、荧光染料、nmr可检测物质、x射线显影剂。举例来说, 在一些实施例中,顺磁离子是以下中的一或多个:铬(iii)、锰(ii)、铁(iii)、铁(ii)、钴(ii)、 镍(ii)、铜(ii)、钕(iii)、钐(iii)、镱(iii)、钆(iii)、钒(ii)、铽(iii)、镝(iii)、钬(iii)、铒(iii)、 镧(iii)、金(iii)、铅(ii)和/或铋(iii)。
[0420]
放射性同位素可以是以下中的一或多个:锕-225、砹-211、铋-212、碳-14、铬-51、 氯-36、钴-57、钴-58、铜-67、铕-152、镓-67、氢-3、碘-123、碘-124、碘-125、碘-131、 铟-111、铁-59、铅-212、镏-177、磷-32、镭-223、镭-224、铼-186、铼-188、硒-75、硫
ꢀ‑
35、锝-99m、钍-227、钇-90和锆-89。放射性标记的人类抗体药剂可根据所属领域中众 所周知的技术产生。举例来说,单克隆抗体可通过与碘化钠和/或碘化钾和化学氧化剂(如 次氯酸钠)或酶氧化剂(如乳过氧化酶)接触而碘化。所提供的人类抗体药剂可通过配位体 交换方法用鎝-99m标记,例如通过用亚锡溶液还原高鎝酸盐,将还原的鎝螯合到葡聚糖 凝胶管柱上且将抗体施加到这一管柱上。在一些实施例中,使用直接标记技术,例如通 过培育高鎝酸盐、还原剂(如sncl2)、缓冲溶液(如邻苯二甲酸钠-钾溶液)和抗体来标记 所提供的人类抗体药剂。在一些实施例中,所提供的人类抗体药剂可结合于中间官能团。 中间官能团通常用于将以金属离子形式存在的放射性同位素结合于抗体。放射性同位素 可通过例如剂量测定法来检测。
[0421]
荧光标记尤其可以是或可包含以下中的一或多个:alexa 350、alexa 430、amca、 bodipy 630/650、bodipy 650/665、bodipy-fl、bodipy-r6g、bodipy-tmr、 bodipy-trx、级联蓝(cascade blue)、cy3、cy5,6-fam、异硫氰酸荧光素、hex、6-joe、 俄勒冈绿(oregon green)488、俄勒冈绿500、俄勒冈绿514、太平洋蓝(pacific blue)、 reg、如果丹明绿(rhodamine green)、如果丹明红、肾造影剂(renographin)、rox、 tamra、tet、四甲基如果丹明和/或德克萨斯红(texas red)。
[0422]
在一些实施例中,结合检测剂是诊断或显影剂。
[0423]
筛选、检测和治疗方法
[0424]
本发明的人类抗体药剂、多专一性结合剂和/或嵌合抗原受体也可用于活体外或活体 内筛选方法中,其中需要检测和/或测量一或多个细胞的一或多种活性(例如细胞凋亡或 细胞生长)。筛选方法是所属领域中众所周知的且包括无细胞分析、基于细胞的分析和动 物分析。活体外分析可以是固态或可溶标靶分子检测可以所属领域中已知的多种方式实 现,包括使用能够鉴定与标靶分子(例如细胞表面抗原)结合的人类抗体药剂、多专一性 结合剂或嵌合抗原受体的标记或可检测基团。可检测标记可与使用本发明的人类抗体药 剂、多专一性结合剂或嵌合抗原受体的分析结合使用。
[0425]
本发明的人类抗体药剂、多专一性结合剂和/或嵌合抗原受体显示对cd19的高亲和 力和/或专一性的能力使其在治疗学上适用于有效地靶向表达cd19的细胞(例如淋巴瘤 或白血病细胞)。因此,在一些实施例中,可能需要增加人类抗体药剂或多专一性结合剂 对一种标靶抗原(例如cd19)而非也由多专一性结合剂结合的另一标靶抗原(或在人类单 克隆抗体的情况下,fc受体)的亲和力。举例来说,在肿瘤杀死的情况下,某些病状可 受益于对肿瘤抗原(例如cd19)而非对能够介导肿瘤杀死的细胞(例如t细胞)表面上的抗 原的亲和力增加。因此,可有益的是经由使用如本文所描述的人类抗体药剂、多专一性 结合剂或嵌合抗原受体增加具有表达肿瘤抗原的肿瘤的患者中人类抗体药剂、多专一性 结合剂或嵌合抗原受体对肿瘤抗原的结合亲和力和/或专一性。
[0426]
本发明提供如本文所描述的作为治疗剂的人类抗体药剂、多专一性结合剂和/或嵌合 抗原受体,其用于治疗具有肿瘤的患者,所述肿瘤表达能够由其结合的抗原。这类人类 抗体药剂、多专一性结合剂和/或嵌合抗原受体可用于治疗人类或动物身体的方法中或诊 断方法中。
[0427]
在一些实施例中,所提供的人类抗体药剂、多专一性结合剂或嵌合抗原受体适用于 药物中。在一些实施例中,所提供的人类抗体药剂、多专一性结合剂或嵌合抗原受体适 用(例如作为预防剂)于治疗或预防cd19相关疾病或恶性病。在一些实施例中,所提供 的人类抗体药剂、多专一性结合剂或嵌合抗原受体适用于治疗显示与cd20相关疾病或 恶性病相关或关联的负面后果(例如低效内化)的患者。在一些实施例中,所提供的人类 抗体药剂、多专一性结合剂或嵌合抗原受体适用于治疗应用,例如在罹患或易罹患cd19 相关疾病或恶性病的个体中。
[0428]
投药
[0429]
本发明提供向需要治疗的个体投与有效量的在本文中描述的治疗活性剂(例如人类 抗体药剂、多专一性结合剂或嵌合抗原受体)的方法。
[0430]
如本文所描述的人类抗体药剂、多专一性结合剂或嵌合抗原受体可经由所属领域中 已知的用于治疗性递送药剂的各种方法投与,如蛋白质或核酸可用于治疗性递送人类抗 体药剂、多专一性结合剂或嵌合抗原受体或编码本发明的人类抗体药剂、多专一性结合 剂或嵌合抗原受体的核酸以杀死个体的标靶细胞或抑制其生长,例如细胞转染、基因疗 法、用递送媒剂或医药学上可接受的载剂直接投与、通过提供包含编码本发明的人类抗 体药剂、多专一性结合剂或嵌合抗原受体的核酸的重组细胞来间接递送。
[0431]
各种递送系统已知且可用于投与本发明的人类抗体药剂、多专一性结合剂或嵌合抗 原受体,例如囊封在脂质体、微粒、微囊、能够表达所述抗体药剂、多专一性结合剂或 嵌
剂量单位的步骤。
[0439]
本发明的医药组合物可以散装、以单一单位剂量和/或以多个单一单位剂量形式制 备、封装和/或出售。如本文所用,“单位剂量”是包含预定量的活性成分的医药组合物 的个别量。活性成分的量通常等于将向个体投与的活性成分的剂量和/或这一剂量的适宜 部分,如这一剂量的一半或三分之一。
[0440]
本发明的医药组合物中活性成分、医药学上可接受的赋形剂和/或任何其它成分的相 对量将视治疗的个体的身分、体型和/或病状且进一步视将投与组合物的途径而变化。举 例来说,组合物可包含0.1%与100%(w/w)之间的活性成分。
[0441]
医药配制物可另外包含医药学上可接受的赋形剂,其如本文所用,包括任何和所有 适合于所需具体剂型的溶剂、分散介质、稀释剂或其它液体媒剂、分散或悬浮助剂、表 面活性剂、等张剂、增稠或乳化剂、防腐剂、固体粘结剂、润滑剂等。雷明顿药物科学 与实践(remington's the science and practice of pharmacy),第21版,热纳罗(a.r. gennaro)(利平科特威廉姆斯和威尔金斯公司(lippincott,williams&wilkins),马里兰州 巴尔的摩(baltimore,md),2006)公开在配制医药组合物中使用的各种赋形剂和用于其制 备的已知技术。除非任何常规赋形剂介质与物质或其衍生物不相容(如通过产生任何非所 需生物效果或另外以有毒方式与医药组合物的任何其它组分相互作用),其使用涵盖在本 发明的范围内。
[0442]
在一些实施例中,医药学上可接受的赋形剂是至少95%、至少96%、至少97%、至 少98%、至少99%或100%纯。在一些实施例中,赋形剂经批准在人类中使用。在一些 实施例中,赋形剂经批准用于兽医用途。在一些实施例中,赋形剂经美国食品与药物管 理局(the united states food and drug administration)批准。在一些实施例中,赋形剂是医 药级。在一些实施例中,赋形剂满足美国药典(united states pharmacopoeia;usp)、欧洲 药典(european pharmacopoeia;ep)、英国药典(british pharmacopoeia)和/或国际药典 (international pharmacopoeia)的标准。
[0443]
在制造医药组合物中使用的医药学上可接受的赋形剂包括(但不限于)惰性稀释剂、 分散和/或成粒剂、表面活性剂和/或乳化剂、崩解剂、粘结剂、防腐剂、缓冲剂、润滑 剂和/或油。这类赋形剂可任选地包括于医药配制物中。根据配制者的判断,赋形剂(如 可可脂和栓剂蜡、着色剂、涂布剂、甜味剂、调味剂和/或芳香剂)可存在于组合物中。
[0444]
在一些实施例中,所提供的医药组合物包含一或多种医药学上可接受的赋形剂(例如 防腐剂、惰性稀释剂、分粉剂、表面活性剂和/或乳化剂、缓冲剂等)。在一些实施例中, 医药组合物包含一或多种防腐剂。在一些实施例中,医药组合物不包含防腐剂。
[0445]
在一些实施例中,医药组合物以可冷冻和/或冻结的形式提供。在一些实施例中,医 药组合物以无法冷冻和/或冻结的形式提供。在一些实施例中,在复原之后复原溶液和/ 或液体剂型可储存某一时间段(例如2小时、12小时、24小时、2天、5天、7天、10 天、2周、一个月、两个月或更长)。在一些实施例中,储存基于抗体的组合物大于指定 时间引起基于抗体的实体降解。
[0446]
在投与之前液体剂型和/或复原溶液可包含颗粒物质和/或变色。在一些实施例中, 如果变色或混浊和/或如果颗粒物质在过滤之后仍然存在,则不应使用溶液。
[0447]
配制和/或制造药剂中的一般考虑因素可见于例如雷明顿药物科学与实践第21
版, 利平科特威廉姆斯和威尔金斯公司,2005中。
[0448]
试剂盒
[0449]
本发明进一步提供医药封装或试剂盒,其包含一或多个填充有至少一种如本文所描 述的人类抗体药剂、多专一性结合剂(例如双专一性抗体)或嵌合抗原受体(或嵌合抗原受 体免疫效应细胞)的容器。试剂盒可用于任何可适用的方法,包括(例如)在诊断上。任选 地与这类容器相关的可以是呈由管理药剂或生物产品的制造、使用或销售的政府机构规 定的形式的说明,所述说明反映(a)经所述机构批准制造、使用或销售以用于人类投与, (b)使用说明,或这两种。
[0450]
本发明的其它特征在例示性实施例的以下描述中将变得显而易知,所述例示性实施 例是为了说明本发明而给出且不意图对其进行限制。本文中引用的所有专利和非专利文 献以全文引用的方式并入本文中。
[0451]
实例
[0452]
提供以下实例以便向一般技术人员描述如何产生和使用本发明的方法和组合物,且 不意图限制本发明人视为其发明的内容的范围。除非另外指示,否则温度以摄氏度指示, 且压力是或接近大气压。
[0453]
实例1.产生和选择对人类cd19具有专一性的人类抗体药剂
[0454]
本实例显示对人类cd19具有专一性的人类抗体药剂的产生。具体地说,本实例显 示专一性结合原生形式的人类cd19的人类单链可变片段(scfv)的产生。使用从正常供 体和/或自体免疫疾病供体研发的未处理或半合成人类抗体库研发本文中描述的人类抗 体药剂且基于对人类cd19的高专一性经由在于细胞表面表达的呈其天然构形的人类 cd19上淘选来选择。因此,这类人类抗体药剂提供抗体组分的有价值的来源以便尤其 构筑可另外从在自然界中发现的谱系缺失的全长igg、多专一性结合剂和嵌合抗原受体。
[0455]
简单来说,研发抗人类cd19抗体药剂的例示性概述阐述在表4中。方法以鉴定来 自eureka alpha
tm
噬菌体库的人类cd19专一性和生物活性抗体药剂开始。前几种抗 体药剂候选物经历亲和力成熟以产生具有对标靶癌细胞的改良的结合亲和力和较好细 胞毒性的抗体药剂。
[0456]
在优瑞科生物技术公司(eureka therapeutics)构筑的名为alpha
tm
噬菌体库的人类 scfv抗体噬菌体呈现库的集合(分集=10
×
10
10
)用于选择对人类cd19具有专一性的人类 抗体药剂。alpha
tm
噬菌体库包括由完全未处理人类重链和轻链谱系组成的未处理库, 和含有完全未处理人类轻链谱系和具有完全随机分布的重链cdr3区的半合成重链的半 合成库。未处理抗体谱系选殖于健康供体的pbmc和脾或自体免疫疾病供体(如全身性 红斑性狼疮症和类风湿性关节炎)的pbmc。scfv库在对重组人类cd19 ecd-fc融合蛋 白和包括raji和3t3-cd19细胞的人类cd19阳性细胞(下文描述)进行淘选中使用。对 于蛋白质淘选,将fc融合蛋白直接涂布于96孔盘上且与人类scfv噬菌体库混合。在 用pbs缓冲液延长洗涤之后,溶离结合克隆且用于感染大肠杆菌xl1-blue。对于细胞 淘选,首先将3t3-cd19或raji细胞与人类scfv噬菌体库混合。在用pbs延长洗涤之 后,快速离心具有结合scfv抗体噬菌体的细胞。结合的克隆接着经溶离且用于感染大 肠杆菌xl1-blue细胞。噬菌体克隆在细菌中表达和经纯化。进行三到四轮淘选以富集 专一性结合人类cd19的胞外区的scfv噬菌体克隆。
[0457]
如表5(alpha
tm
噬菌体呈现概述)中所示,当在淘选步骤中包括蛋白质淘选且针对 重组人类cd19 ecd-fc融合蛋白的elisa结合用作初级噬菌体克隆筛选方法时,在从 淘选富集噬菌体池筛选762个噬菌体克隆之后仅单一独特抗体克隆经鉴定是细胞-表面 人类cd19结合剂。本发明人随后仅进行细胞淘选且在facs分析中使用人类cd19阳 性细胞系作为初级筛选方法。从使用这一淘选操作筛选的690个克隆鉴定结合细胞表面 人类cd19的七个其它独特克隆。
[0458]
对于elisa分析,分别用人类cd19 ecd-fc或阴性对照901-fc涂布标准elisa 盘。在经涂布盘中培育来自富集噬菌体呈现淘选池的个别噬菌体克隆。噬菌体克隆的结 合通过hrp结合的抗m13抗体检测且使用hrp底物显影。在450nm处读取吸光度。 鉴定多个人类cd19 elisa-专一性噬菌体克隆且例示性克隆显示于图1a中。在筛选的 762个噬菌体克隆当中,如通过elisa分析所测定,认为85个独特抗体克隆是hcd19 专一性。
[0459]
随后通过流式细胞测量术使用人类cd19-阳性raji和3t3-hcd19细胞系和人类 cd19阴性jurkat和3t3细胞系测试elisa-阳性噬菌体克隆的细胞-表面人类cd19结合 (图1b)。细胞首先用纯化scfv噬菌体克隆染色,接着与小鼠抗m13单克隆抗体混合, 且最后与r-pe结合的马抗小鼠igg(vector labs)混合。各染色步骤在30-60分钟之间于 冰上进行且细胞在染色之间洗涤两次。一个独特克隆37经鉴定是专一性结合人类cd19
+ raji和3t3-cd19细胞且不结合hcd19-jurkat和3t3(图1b)。
[0460]
在不利用elisa结合筛选的情况下针对细胞表面人类cd19结合直接测试仅通过细 胞淘选选择噬菌体克隆的第二筛选的命中物。如图2中所示,例示性克隆4、5和6显示 对raji细胞的专一性结合,而克隆7也显示对raji-cd19基因剔除细胞的一些可检测结 合。
[0461]
如本实例中所示,人类cd19抗体的噬菌体淘选效率极低,因为在从初级筛选鉴定 的1452个个别噬菌体克隆当中仅鉴定八个专一性和独特(依据序列)克隆。由自体免疫疾 病未处理库产生一个克隆(37),且由从正常供体b细胞制成的未处理或半合成人类抗体 库产生七个其它克隆。
[0462]
表4
[0463][0464]
表5
[0465]
[0466][0467]
实例2.使用人类cd19抗体药剂产生双专一性抗体构筑体
[0468]
本实例显示使用对人类cd19具有专一性的人类scfv片段构筑多专一性结合剂。具 体地说,本实例特别显示构筑具有结合原生形式(在细胞表面上表达)的人类cd19的第 一抗原结合位点和结合t细胞上的cd3的第二抗原结合位点的双专一性抗体。因此, 本发明实例说明在一些实施例中,使用含有如本文所描述的抗体组分的多专一性结合 剂,可导引t细胞杀死表达人类cd19的标靶细胞。
[0469]
使用人类cd19-专一性噬菌体克隆的scfv序列产生双专一性抗体。使用在n端包 含人类cd19-专一性噬菌体克隆的v
l-v
h scfv序列且在c端包含抗人类cd3ε小鼠单克 隆scfv的单链形式构筑双专一性抗体(例如参见布里斯科文(brischwein,k.)等人,分子 免疫学43:1129-1143,2006)。通过金唯智公司(genewiz)或金斯瑞公司(genscript)合成编 码人类cd19 scfv和抗人类cd3εscfv的dna片段且使用标准重组dna技术次选殖到 哺乳动物表达载体pqd-t(优瑞科生物技术公司(eureka therapeutics,inc.))中。六组胺标 签插入c端以用于纯化和检测。hek293细胞用双专一性抗体表达载体转染且培养七天 以用于双专一性抗体产生。通过fplc akta系统使用histrap hp管柱(通用电气医疗集 团(ge healthcare))从hek293细胞上清液纯化双专一性抗体。hek293细胞培养物经澄 清且在低咪唑浓度(20mm)下装载到管柱上,且随后等度高咪唑浓度溶离缓冲液(500 mm)用于溶离结合的双专一性抗体。在非还原条件下通过凝胶电泳测量经纯化人类 cd19双专一性抗体的分子量。蛋白质(4μg)与2.5μl nupage lds样品缓冲液(赛默飞 世尔公司(life technologies),np0008)混合且通过去离子水使其达到10μl。加热样品到 70℃持续10分钟且装载到凝胶上。在180v下进行凝胶电泳1小时。在凝胶上观察到 呈主要物质的对应于双专一性抗体的条带(约55kd)(图3)。
[0470]
综合来说,本实例显示具有对在细胞表面上表达(即原生形式)的人类cd19具有专 一性的第一抗原结合位点和对cd3具有专一性的第二抗原结合位点的双专一性分子的 成功构筑。这类双专一性分子的进一步表征描述于以下实例中。
[0471]
实例3.人类cd19双专一性抗体的表征
[0472]
本实例显示所选双专一性分子的cd19结合概况。具体地说,本实例特别描述在溶 液中所选双专一性抗体分子对重组人类cd19(即人类cd19 ecd-fc)的结合概况。
[0473]
与重组人类cd19 ecd-fc融合蛋白结合.使用fortebio octet测试鉴定为对细胞表面 人类cd19具有专一性的结合剂的噬菌体克隆在溶液中与重组人类cd19 ecd-fc融合蛋 白的结合。将经生物素标记的人类cd19 ecd-fc融合蛋白(5μg/ml)装载到抗生蛋白链 菌素生物感测器上。在洗掉过量抗原之后,在10μg/ml下在pbs缓冲液中测试双专一 性抗体的结合和解离。识别细胞表面表达的人类cd19的测试克隆中没有一个显示与重 组人类cd19 ecd-fc融合蛋白(包括克隆37,其是elisa-阳性克隆)的结合。图4显示 例示性克隆和bl19(比较抗cd19双专一性抗体)的octet hcd19结合资料。因此,本发 明人推论与天然人类cd19(即在细胞表面上)以及elisa-盘结合人类cd19相比,重组 hcd19蛋白质可具有不同结构构形。用重组人类cd19涂布elisa盘可迫使形成模拟天 然hcd19但具有极低效率的某
一构形。85个人类cd19 elisa-专一性抗体克隆中仅一 个显示对细胞-表面人类cd19的专一性。用表达人类cd19的细胞进行细胞淘选产生更 多对细胞表面表达的人类cd19具有专一性的阳性抗体克隆。
[0474]
与初级人类b细胞结合.通过用percp-结合的抗人类cd20抗体、apc-标记的抗人 类cd3抗体和抗cd19双专一性抗体将人类pbmc共染色来测试人类b细胞的抗cd19 抗体结合。在用pbs缓冲液进行一轮短暂洗涤之后,向混合物中添加fitc-标记的抗 his标签抗体作为二级抗体以检测双专一性抗体。对于流式细胞测量术分析,通过阳性 cd20染色和阴性cd3染色分选人类b细胞(参见图5a中的方框)。评估抗cd19双专 一性抗体识别在这些cd20
+
cd3-细胞上表达的人类cd19的能力。
[0475]
通过fitc通道中的平均荧光强度(mfi)测量抗cd19与cd20
+
cd3-细胞的结合的水 准。如表6中所示,阴性对照双专一性抗体(nc-et901)不结合人类b细胞。相比之下, 测试的所有抗人类cd19双专一性抗体克隆均识别人类b细胞且显示正结合信号。
[0476]
t细胞杀死分析.使用ldh细胞毒性分析(普洛麦格公司(promega))来分析肿瘤细胞 毒性。人类t细胞(澳赛尔斯公司(allcells))或来自全血的ficoll纯化细胞(太平洋血液中 心(blood centers of the pacific))用cd3/cd28 dynabeads(英杰公司(invitrogen))根据制 造商的说明活化和扩增。活化t细胞在具有10%fbs加100u/ml il-2的rpmi1640培 养基中培养和维持,且在活化后第7-14天使用。通过facs分析,t细胞是》99%cd3
+
。 活化t细胞和标靶细胞以5:1比率与双专一性抗体共培养16小时。通过在培养物上清 液中测量ldh活性测定细胞毒性。
[0477]
如图5b中所示,基于克隆4、5和6的在0.2μg/ml下的双专一性抗体分子以人类 cd19-专一性方式有效介导癌细胞的杀死。此外,基于克隆37的双专一性抗体分子显示 对cd19阴性细胞系(jurkat和thp-1)的一些可检测杀死。在scfv的情况下,通过流式 细胞测量术,克隆37未显示与jurkat细胞的结合(图1b)。
[0478]
表6
[0479][0480]
实例4.抗人类cd19抗体药剂的亲和力成熟
[0481]
本实例显示抗人类cd19抗体药剂的亲和力成熟。具体地说,本实例特别显示通过 将随机突变并入所选抗人类cd19抗体药剂(克隆4、5和6)中接着筛选和表征抗体变异 体来产生一系列抗体变异体。
[0482]
产生变异噬菌体库.编码抗人类cd19 scfv的dna使用genemorph ii随机突变诱发 试剂盒(安捷伦科技有限公司(agilent technologies))根据制造商的说明经受随机突变诱 发。在突变诱发之后,将dna序列选殖到表达scfv的噬菌粒载体中以构建变异抗体噬 菌
体库。单独地构建各抗人类cd19专一性克隆的突变库。每个突变库含有约5
×
108个 独特噬菌体克隆。平均来说,与每个scfv序列,在1到4个核苷酸突变范围内的亲本 抗人类cd19克隆相比,变异克隆具有两个核苷酸突变。在亲本克隆4、5和6上构建三 个库(表7)。与各别亲本克隆相比的在所选亲和力成熟抗人类cd19抗体药剂的vh和v
l
区中的例示性突变阐述在表8中。
[0483]
测试来自富集噬菌体淘选池的名为变异克隆的个别噬菌体克隆与其各别亲本克隆 相比,与细胞表面人类cd19的增强的结合。如图6a中所示,多个变异噬菌体克隆专 一性识别人类cd19阳性癌细胞系,包括raji和jeko-1细胞。克隆中没有一个显示与人 类cd19阴性细胞系(如raji-cd19 k.o.或jurkat细胞)的结合。值得注意的是,多个克隆 显示与各别亲本克隆相比,与raji和jeko-1细胞的结合增强。
[0484]
进行竞争细胞-结合分析以比较与亲本克隆相比,变异克隆的结合亲和力(图6b)。 简单来说,将变异噬菌体克隆与已与其对应亲本双专一性抗体克隆一起预培育的raji 细胞混合,接着用抗m13小鼠抗体和pe结合的抗小鼠抗体染色。
[0485]
与其亲本克隆相比,变异克隆5-1、5-3、5-4、5-9、5-13和6-1显示改良的标靶结 合。在亲本克隆双专一性抗体存在下,这些噬菌体克隆显示与亲本噬菌体克隆,克隆5 或6相比,与raji细胞的结合增加。通过双专一性抗体滴定流式细胞测量术获得抗体结 合亲和力的较准确测量值(参见下表9)。
[0486]
表7
[0487][0488]
表8
[0489]
[0490]
实例5.基于抗人类cd19抗体药剂变异体的双专一性抗体分子的产生和表征
[0491]
本实例显示使用对人类cd19具有专一性的变异人类scfv片段构筑多专一性结合 剂。具体地说,本实例特别显示构筑具有结合原生形式(在细胞表面上表达)的人类cd19 的第一抗原结合位点和结合t细胞上的cd3的第二抗原结合位点的双专一性抗体。因 此,本发明实例说明在一些实施例中,使用含有如本文所描述的抗体组分的多专一性结 合剂,可导引t细胞杀死表达人类cd19的标靶细胞。
[0492]
产生变异克隆双专一性抗体.如实例2中所描述产生来源于亲和力改良的变异抗体 克隆的双专一性抗体。大多数克隆在sds-page上以》90%纯度显示单一条带(图7a)。
[0493]
变异双专一性抗体的结合亲和力测定.亲本抗体和其衍生物(变异克隆)均不识别重 组人类cd19,尽管其均结合于细胞表面表达的人类cd19。因此本发明人经由抗体滴定 流式细胞测量术使用人类cd19阳性癌细胞测定与亲本抗体相比,变异克隆的相对结合 亲和力(表9)。
[0494]
将连续稀释浓度下的双专一性抗体克隆与相同量的raji细胞混合。基于流式细胞测 量术结合信号计算抗体ec
50
和表观kd。如表9中所示,除克隆5-4的外,许多基于亲 本克隆5的变异克隆显示略微增加的亲和力(较低ec
50
和表观kd)。对于基于亲本克隆6 的变异克隆,克隆6-1和6-4还显示与其各别亲本克隆相比,增加的亲和力(较低ec
50
和表观kd)。
[0495]
t细胞杀死分析.使用ldh细胞毒性分析(普洛麦格公司)测定肿瘤细胞毒性。人类t 细胞用cd3/cd28 dynabeads(英杰公司)根据制造商的说明活化和扩增。活化t细胞在 具有10%fbs加100u/ml il-2的rpmi1640培养基中培养和维持,且在活化后第7-14 天使用。通过facs分析,t细胞是》99%cd3
+
。活化t细胞和标靶细胞以5:1比率与 双专一性抗体共培养16小时。通过在培养物上清液中测量ldh活性测定细胞毒性(图 7b)。
[0496]
如图8中所示,测试的变异克隆维持如其亲本抗体的最初结合专一性。对于图11 中所示的细胞杀死分析,例示性变异克隆与克隆37(用作阳性对照双专一性抗体,因为 这一克隆显示对人类cd19-阴性细胞、raji-cd19 k.o.、jurkat和thp-1的可检测的非专 一性细胞毒性)一起测试。与其各别亲本克隆相比,测试的多个变异克隆显示对人类cd19 阳性细胞系(raji和jeko-1)中的一个或两个的相等或增加的细胞杀死效率。
[0497]
表9
[0498][0499]
实例6.表达抗人类cd19嵌合抗原受体的t细胞(car-t)的表征
[0500]
本实例显示使用先前实例中描述的抗人类cd19抗体药剂构筑嵌合抗原受体(car)。 具体地说,本实例特别显示构筑包括cd19人类抗体药剂的抗原结合位点且在t细胞表 面上表达的car。另外,由t细胞表达的car在针对人类淋巴瘤异种移植模型的细胞 毒性分析中采用。因此,本发明实例说明在一些实施例中,使用包括来自本文中描述的 人类抗体药剂的抗原结合位点的car适用于杀死表达人类cd19的标靶细胞(例如淋巴 瘤)。
[0501]
人类cd19转导的t细胞的活体外细胞毒性.通过用car载体转染293t细胞产生 含有人类cd19专一性嵌合抗原受体(car)的慢病毒。人类t细胞用于在用cd3/cd28 珠粒(英杰公司)刺激一天之后在100u/ml下的il-2存在下进行转导。将 浓缩慢病毒涂覆到含t细胞的经retronectin(塔卡拉公司(takara))涂布的6孔盘持续72 小时。使用ldh细胞毒性分析进行转导t细胞(cd19/car-t细胞)的功能评估。效应比 标靶细胞比率是5:1。代表性结果阐述在图8中。
[0502]
如图8中所示,三个基于变异抗体克隆(克隆5-3、5-9和5-13)的car显示与亲本 克隆5相比,对raji和jeko-1细胞系的癌细胞杀死效率显著增加。这一实验中使用的效 应比标靶比率是5:1。如由人类cd19阴性细胞(raji-cd19 k.o.和jurkat)的杀死的低水准 所指示,杀死专一性确认为cd19-专一性。另外,使用本文中描述的人类抗体药剂产生 的表达car的t细胞显示与用其它抗cd19抗体(bl19、fmc63)产生的car-t类似或 较高的细胞杀死效率。
[0503]
在类似实验中,使用一大组cd19阳性和阴性癌细胞系测试人类cd19 car-t(上文 所描述)。简单来说,用所选编码抗cd19抗体的car模拟转导(模拟)或转导初级t细 胞。通过facs使用抗myc抗体分析转导t细胞以检测car构筑体的细胞外域中的myc
‑ꢀ
标签。
[0504]
结果显示由如上文所描述的人类抗体药剂产生的抗cd19 car-t细胞具有约80%转 导效率(图9,顶部)。在5:1的效应比标靶比率下测试car-t细胞专一性杀死表达cd19 的癌细胞的能力。如图9(底部)中所示,测试的表达两种抗cd19克隆的car-t细胞专 一性杀死
小鼠中在cd19-阳性人类淋巴瘤异种移植物模型中测试例示性car-t细胞(基于克隆 5-9)的活体内抗肿瘤活性。简单来说,从比较生物科技公司(comparative biosciences, inc.)(加利福尼亚州森尼维尔(sunnyville,california)94085)购买raji-luc-gfp细胞且在 rpmi培养基+10%fbs和1%l-谷氨酰胺中在37℃下在潮湿氛围中在5%co2下培养。 在用编码荧火虫荧光素酶(luc)和绿色荧光蛋白的双重报道基因稳定转染(其产生可活体 内使用生物发光成像追踪的细胞)之后,从cd19-阳性伯基特淋巴瘤细胞系raji衍生 raji-luc-gfp细胞。从杰克逊实验室(jackson laboratories)(美国缅因州巴港(bar harbor, me usa)04609)购买nsg小鼠且在实验的前适应至少7天。将raji-luc-gfp细胞再悬浮 于pbs中且经由尾静脉以1
×
106个细胞/100μl/小鼠静脉内(i.v.)植入nsg小鼠中。植入 后五天,使用xenogen ivis成像系统将动物成像以便评估肿瘤负荷。在6.7
×
105个光子 的平均光子发射下基于光子发射将小鼠随机分成三组(每组n=6只小鼠):(i)无处理,(ii) 模拟(来自car-t细胞的相同供体的未转导活化人类t细胞),和(iii)5-9car-t。紧接 在随机化之后在每只小鼠107个t细胞的剂量(对于群组(iii),包含每个剂量6-8
×
106个 car+t细胞)下用模拟或克隆5-9car-t细胞静脉内处理动物,每两周一次持续3个剂 量。在给药之后密切监测动物。一周一次使用xenogen ivis系统进行生物发光成像。将 具有以下状况的动物安乐死且记录为“条件性死亡”:(i)体重损失大于25%初始体重和(ii) 影响小鼠运动的四肢麻痹。代表性结果阐述在图11中。
[0513]
在目前剂量和时程下模拟和5-9car-t细胞均具有良好耐受性(图11)。在整个研究 中未观察到给药相关的不利健康效果。用模拟t细胞处理减缓raji-luc-gfp肿瘤的生长 (p《0.05),然而用car-t 5-9处理显著抑制肿瘤生长(p《0.05;图11,右边)。
[0514]
在类似实验中,在nsg小鼠中在cd19-阳性人类淋巴瘤异种移植物模型(raji)中测 试另一例示性car-t细胞(基于克隆5-13)的活体内抗肿瘤活性。除了仅向每只小鼠投与 一种剂量的抗cd19 car-转导t细胞(5
×
106个基于克隆5-13的car
+
t细胞)外,如上 文针对克隆5-9所描述进行实验。代表性结果阐述在图13中。
[0515]
如图13a中所示,虽然肿瘤在来自媒剂和模拟处理组的小鼠中快速生长,用抗cd19 car 5-13-转导t细胞处理的nsg小鼠显示肿瘤生长抑制。实际上,处理组之间的肿瘤 生长的显著差异早在第11天即可检测(p《0.0001,邓尼特检验(dunnett's test),图13b)。 另外,用抗cd19 car 5-13-转导t细胞处理的nsg小鼠直到植入后45天显示肿瘤消 退。
[0516]
在肿瘤植入后35天,通过静脉内植入5
×
105个raji淋巴瘤细胞再攻击来自抗cd19car 5-13-转导t细胞处理组的三只代表性小鼠以判定抗cd19-car-转导t细胞是否存 留和维持对抗原(cd19)起反应的能力。在注射1
×
106个模拟转导t细胞(在第34天注射) 作为对照后一天向未处理nsg小鼠(即未植入raji淋巴瘤细胞或在先前用t细胞处理的 小鼠,n=2)植入5
×
105个raji淋巴瘤细胞。本发明人推论这类模拟转导t细胞将模拟在 植入raji淋巴瘤细胞之前,小鼠中的低含量循环t细胞的状况。通过荧光素酶活性(如 上文所描述)测量每个组中的肿瘤负荷。代表性结果阐述在图13c中。
[0517]
如图13c中所示,肿瘤在模拟处理组中快速生长。相比之下,用抗cd19 car 5-13
‑ꢀ
转导t细胞预先处理防止在用raji淋巴瘤细胞再攻击的后肿瘤生长(p《0.01)。因此,这 些资料指示甚至在植入后35天时抗cd19-car-转导t细胞存留在这些小鼠中,且维持 对cd19起反应和杀死cd19
+-肿瘤细胞的能力,由此提供对抗复发肿瘤负荷的保护。
[0518]
在另一类似实验中,在nsg小鼠中在cd19阳性人类白血病异种移植物模型 (nalm)中测试例示性car-t细胞(基于克隆5-13)的活体内抗肿瘤活性。在用编码荧火 虫荧光素酶(luc)和绿色荧光蛋白(gfp)的双重报道基因稳定转染,产生可活体内使用生 物发光成像追踪的细胞之后,从cd19-阳性急性淋巴母细胞白血病细胞系nalm-6衍生 nalm-6-luc-gfp细胞(纪念斯隆-凯特琳癌症中心(memorial sloan kettering cancercenter)的埃里克史密斯(eric smith)博士惠赠)。
[0519]
简单来说,在rpmi培养基+10%fbs中在37℃下在潮湿氛围中在5%co2下培养 nalm-6-luc-gfp。从杰克逊实验室(美国缅因州巴港04609)购买nsg小鼠且在实验之前 适应至少三天。将nalm-6-luc-gfp细胞再悬浮于磷酸盐缓冲盐水(pbs)中且经由尾静 脉注射以5
×
105个细胞/100μl/小鼠静脉内(i.v.)植入雌性nsg小鼠中(n=20,6-8周龄)。 在植入后四天时,使用xenogen ivis成像系统将动物成像以用于肿瘤负荷评估。基于光 子发射将nsg小鼠随机分成三组:(i)媒剂(pbs,n=6);(ii)107个模拟转导人类t细胞 (n=6);和(iii)5
×
106个克隆5-13抗cd19 car转导t细胞(car-t 5-13,n=8)。在如上 文所描述植入和给与t细胞或媒剂之后密切监测动物。代表性结果阐述在图14中。
[0520]
如图14,图a和b中所示,媒剂和模拟处理组显示nalm-6肿瘤生长的快速进程。 相比之下,用抗cd19 car-t细胞(基于克隆5-13)处理早在第11天显著(p《0.0001)抑制 且甚至逆转肿瘤生长。这些资料确定car-t 5-13细胞活体内靶向和溶解cd19
+
nalm-6 肿瘤,由此显示本文所提供的呈例示性car形式的抗cd19抗体在多种癌症模型中抑 制肿瘤生长的功效。
[0521]
综合来说,本实例显示基于根据先前实例制得的抗cd19人类抗体药剂的表达嵌合 抗原受体(car)的t细胞的成功产生和使用。另外,这类抗cd19 car-t细胞显示以 cd19-专一性方式对各种癌细胞系进行高效细胞杀死。因此,本文中描述的人类抗体药 剂可用于治疗和诊断各种b细胞疾病和恶性病、尤其以cd19表达为特征的这些疾病。
[0522]
方法
[0523]
从美国典型培养物保藏中心(american type culture collection)获得细胞系raji、 jeko-1、jurkat、thp-1和nih/3t3。raji是cd19阳性伯基特氏淋巴瘤细胞系(atccccl-86)。jeko-1是cd19阳性套细胞淋巴瘤细胞系(atcc crl-3006)。jurkat是由t细 胞白血病衍生的人类t淋巴细胞系,且是cd19阴性。急性单核细胞性白血病细胞系 thp-1也是cd19阴性(atcc tib-202)。nih/3t3是小鼠胚胎纤维母细胞系(atcccrl-1658)。raji-cd19基因剔除细胞系(raji-cd19 k.o.)通过使用市售crispr-cas9载体 (傲锐基因公司(origene))将cd19基因剔除产生。raji-cd19 k.o.细胞通过定序和通过 facs(图12),使用市售小鼠抗人类cd19抗体(百澳兰公司(biolegend))确认为cd19阴 性。通过用表达人类cd19(hcd19)的产生hcd19的细胞表面表达的较高水准的哺乳动 物载体转导nih/3t3细胞系产生3t3-cd19(图12)。在car-t杀死分析中测试的其它 细胞系,如ca46、daudi、hela、hepg2、sk-hep1、mda-mb-231和mcf7,也购自 atcc。在补充有10%fbs的rpmi 1640或dmem中在37℃/5%co2下培养细胞系。
[0524]
针对噬菌体m13的小鼠单克隆抗体购自ge(目录号27-9421-01)。pe标记的抗小鼠 igg二级抗体购自维克特实验室(vector labs)(目录号ei-2007)。pe结合的小鼠抗hcd19 抗体购自百澳兰公司(目录号302208)。901-fc和nc-et901双专一性抗体是分别具有人 类
igg1和双专一性抗体的形式的,在优瑞科生物技术公司产生的阴性对照抗体。抗体 不识别任何人类抗原。fitc标记的抗his抗体购自赛默飞世尔科技公司(thermo fisherscientific)(目录号ma1-81891)以用于检测在c端具有6
×
his标签的双专一性抗体。 percp-结合的抗人类cd20抗体购自bd公司(9目录号302208)以用于检测人类b细胞。
[0525]
重组人类cd19 ecd-fc融合蛋白包括融合到人类igg1的缺乏ch1域和包括铰链区 的fc的人类cd19的细胞外域。hek293(英杰公司)细胞通过脂染胺3000(英杰公司)用 编码人类cd19 ecd-fc融合蛋白的载体转染。通过蛋白质a亲和性色谱法从培养物上 清液纯化融合蛋白。
[0526]
具体列举方面
[0527]
本发明还提供以下经编号方面:
[0528]
1.一种专一性结合人类cd19的人类抗体药剂,其中所述人类抗体药剂包含一或多 个各自具有与一或多个选自表2的重链cdr至少95%一致的序列的重链cdr,和/或一 或多个各自具有与一或多个选自表3的轻链cdr至少95%一致的序列的轻链cdr。
[0529]
2.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:73、seq id no:74和seq id no:75中所示的重链cdr1、重链cdr2和重链cdr3 中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有 与seq id no:181、seq id no:182和seq id no:183中所示的轻链cdr1、轻链cdr2 和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0530]
3.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:76、seq id no:77和seq id no:78中所示的重链cdr1、重链cdr2和重链cdr3 中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有 与seq id no:184、seq id no:185和seq id no:186中所示的轻链cdr1、轻链cdr2 和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0531]
4.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:79、seq id no:80和seq id no:81中所示的重链cdr1、重链cdr2和重链cdr3 中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有 与seq id no:187、seq id no:188和seq id no:189中所示的轻链cdr1、轻链cdr2 和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0532]
5.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:82、seq id no:83和seq id no:84中所示的重链cdr1、重链cdr2和重链cdr3 中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有 与seq id no:190、seq id no:191和seq id no:192中所示的轻链cdr1、轻链cdr2 和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0533]
6.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:85、seq id no:86和seq id no:87中所示的重链cdr1、重链cdr2和重链cdr3 中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有 与seq id no:193、seq id no:194和seq id no:195中所示的轻链cdr1、轻链cdr2 和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0534]
7.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seq
id no:88、seq id no:89和seq id no:90中所示的重链cdr1、重链cdr2和重链cdr3 中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有 与seq id no:196、seq id no:197和seq id no:198中所示的轻链cdr1、轻链cdr2 和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0535]
8.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:91、seq id no:92和seq id no:93中所示的重链cdr1、重链cdr2和重链cdr3 中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有 与seq id no:199、seq id no:200和seq id no:201中所示的轻链cdr1、轻链cdr2 和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0536]
9.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:94、seq id no:95和seq id no:96中所示的重链cdr1、重链cdr2和重链cdr3 中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有 与seq id no:202、seq id no:203和seq id no:204中所示的轻链cdr1、轻链cdr2 和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0537]
10.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:97、seq id no:98和seq id no:99中所示的重链cdr1、重链cdr2和重链cdr3 中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各自具有 与seq id no:205、seq id no:206和seq id no:207中所示的轻链cdr1、轻链cdr2 和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻链cdr3。
[0538]
11.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:100、seq id no:101和seq id no:102中所示的重链cdr1、重链cdr2和重 链cdr3中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和 各自具有与seq id no:208、seq id no:209和seq id no:210中所示的轻链cdr1、 轻链cdr2和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和 轻链cdr3。
[0539]
12.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:103、seq id no:104和seq id no:105中所示的重链cdr1、重链cdr2和重 链cdr3中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和 各自具有与seq id no:211、seq id no:212和seq id no:213中所示的轻链cdr1、 轻链cdr2和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和 轻链cdr3。
[0540]
13.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:106、seq id no:107和seq id no:108中所示的重链cdr1、重链cdr2和重 链cdr3中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和 各自具有与seq id no:214、seq id no:215和seq id no:216中所示的轻链cdr1、 轻链cdr2和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和 轻链cdr3。
[0541]
14.根据方面1所述的人类抗体药剂,其中所述人类抗体药剂包含各自具有与seqid no:109、seq id no:110和seq id no:111中所示的重链cdr1、重链cdr2和重链 cdr3中的每一个至少95%一致的序列的重链cdr1、重链cdr2和重链cdr3,和各 自具有与seq id no:217、seq id no:218和seq id no:219中所示的轻链cdr1、轻 链cdr2和轻链cdr3中的每一个至少95%一致的序列的轻链cdr1、轻链cdr2和轻 链cdr3。
seq id no:92和seq id no:93的重链cdr和seq id no:199、seq id no:200和seqid no:201的轻链cdr。
[0553]
26.根据方面9所述的人类抗体药剂,其中所述人类抗体药剂包含seq id no:94、 seq id no:95和seq id no:96的重链cdr和seq id no:202、seq id no:203和seqid no:204的轻链cdr。
[0554]
27.根据方面10所述的人类抗体药剂,其中所述人类抗体药剂包含seq id no:97、 seq id no:98和seq id no:99的重链cdr和seq id no:205、seq id no:206和seqid no:207的轻链cdr。
[0555]
28.根据方面11所述的人类抗体药剂,其中所述人类抗体药剂包含seq id no:100、 seq id no:101和seq id no:102的重链cdr和seq id no:208、seq id no:209和 seq id no:210的轻链cdr。
[0556]
29.根据方面12所述的的人类抗体药剂,其中所述人类抗体药剂包含seq idno:103、seq id no:104和seq id no:105的重链cdr和seq id no:211、seq idno:212和seq id no:213的轻链cdr。
[0557]
30.根据方面13所述的人类抗体药剂,其中所述人类抗体药剂包含seq id no:106、 seq id no:107和seq id no:108的重链cdr和seq id no:214、seq id no:215和 seq id no:216的轻链cdr。
[0558]
31.根据方面14所述的人类抗体药剂,其中所述人类抗体药剂包含seq id no:109、 seq id no:110和seq id no:111的重链cdr和seq id no:217、seq id no:218和 seq id no:219的轻链cdr。
[0559]
32.根据方面15所述的人类抗体药剂,其中所述人类抗体药剂包含seq id no:112、 seq id no:113和seq id no:114的重链cdr和seq id no:220、seq id no:221和 seq id no:222的轻链cdr。
[0560]
33.根据方面16所述的人类抗体药剂,其中所述人类抗体药剂包含seq id no:115、 seq id no:116和seq id no:117的重链cdr和seq id no:223、seq id no:224和 seq id no:225的轻链cdr。
[0561]
34.根据方面17所述的人类抗体药剂,其中所述人类抗体药剂包含seq id no:118、 seq id no:119和seq id no:120的重链cdr和seq id no:226、seq id no:227和 seq id no:228的轻链cdr。
[0562]
35.根据方面18所述的人类抗体药剂,其中所述人类抗体药剂包含seq id no:121、 seq id no:122和seq id no:123的重链cdr和seq id no:229、seq id no:230和 seq id no:231的轻链cdr。
[0563]
36.一种人类抗体药剂,其与包含以下的人类抗体药剂竞争结合cd19:(a)seq idno:73、seq id no:74和seq id no:75的重链cdr和seq id no:181、seq id no:182 和seq id no:183的轻链cdr;(b)seq id no:76、seq id no:77和seq id no:78的 重链cdr和seq id no:184、seq id no:185和seq id no:186的轻链cdr;(c)seqid no:79、seq id no:80和seq id no:81的重链cdr和seq id no:187、seq idno:188和seq id no:189的轻链cdr;(d)seq id no:82、seq id no:83和seq idno:84的重链cdr和seq id no:190、seq id no:191和seq id no:192的轻链cdr; (e)seq id no:85、seq id no:86和seq id no:87的重链
cdr和seq id no:193、seqid no:194和seq id no:195的轻链cdr;(f)seq id no:88、seq id no:89和seq idno:90的重链cdr和seq id no:196、seq id no:197和seq id no:198的轻链cdr;(g)seq id no:91、seq id no:92和seq id no:93的重链cdr和seq id no:199、seqid no:200和seq id no:201的轻链cdr;(h)seq id no:94、seq id no:95和seq idno:96的重链cdr和seq id no:202、seq id no:203和seq id no:204的轻链cdr; (i)seq id no:97、seq id no:98和seq id no:99的重链cdr和seq id no:205、seqid no:206和seq id no:207的轻链cdr;(j)seq id no:100、seq id no:101和seqid no:102的重链cdr和seq id no:208、seq id no:209和seq id no:210的轻链 cdr;(k)seq id no:103、seq id no:104和seq id no:105的重链cdr和seq idno:211、seq id no:212和seq id no:213的轻链cdr;(l)seq id no:106、seq idno:107和seq id no:108的重链cdr和seq id no:214、seq id no:215和seq idno:216的轻链cdr;(m)seq id no:109、seq id no:110和seq id no:111的重链 cdr和seq id no:217、seq id no:218和seq id no:219的轻链cdr;(n)seq idno:112、seq id no:113和seq id no:114的重链cdr和seq id no:220、seq idno:221和seq id no:222的轻链cdr;(o)seq id no:115、seq id no:116和seq idno:117的重链cdr和seq id no:223、seq id no:224和seq id no:225的轻链cdr; (p)seq id no:118、seq id no:119和seq id no:120的重链cdr和seq id no:226、 seq id no:227和seq id no:228的轻链cdr;或(q)seq id no:121、seq id no:122 和seq id no:123的重链cdr和seq id no:229、seq id no:230和seq id no:231 的轻链cdr。
[0564]
37.根据方面1至36中任一方面所述的人类抗体药剂,其中所述人类抗体药剂更包 含一或多种在重链cdr和/或轻链cdr中的氨基酸取代。
[0565]
38.根据方面37所述的人类抗体药剂,其中所述人类抗体药剂更包含至少一种或最 多五种在重链cdr和/或轻链cdr中的氨基酸取代。
[0566]
39.根据方面38所述的人类抗体药剂,其中所述人类抗体药剂更包含至少一种或最 多三种在重链cdr和/或轻链cdr中的氨基酸取代。
[0567]
40.一种专一性结合人类cd19的人类抗体药剂,其中所述人类抗体药剂包含具有与 表1中出现的重链可变区序列至少95%一致的序列的重链可变区,和具有与表1中出现 的轻链可变区序列至少95%一致的序列的轻链可变区。
[0568]
41.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:2中出现的重链可变区序列至少95%一致的序列的重链可变区,和具有与seq idno:2中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0569]
42.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:4中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:4中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0570]
43.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:6中出现的重链可变区序列至少95%一致的序列的重链可变区,和具有与seq idno:6中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0571]
44.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:8中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:8中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0572]
45.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:10中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:10中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0573]
46.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:12中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:12中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0574]
47.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:14中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:14中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0575]
48.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:16中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:16中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0576]
49.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:18中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:18中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0577]
50.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:20中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:20中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0578]
51.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:22中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:22中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0579]
52.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:24中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:24中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0580]
53.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:26中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:26中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0581]
54.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:28中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:28中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0582]
55.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:30中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:30中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0583]
56.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:32中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:32中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0584]
57.根据方面40所述的人类抗体药剂,其中所述人类抗体药剂包含具有与seq idno:34中出现的重链可变区序列至少95%一致的序列的重链可变区和具有与seq idno:34中出现的轻链可变区序列至少95%一致的序列的轻链可变区。
[0585]
58.根据方面40至57中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 seq id no:2、seq id no:4、seq id no:6、seq id no:8、seq id no:10、seq id no:12、 seq id no:14、seq id no:16、seq id no:18、seq id no:20、seq id no:22、seq idno:24、seq id no:26、seq id no:28、seq id no:30、seq id no:32和seq id no:34 中的任一个中出现的重链和轻链可变区序列。
[0586]
59.一种专一性结合人类cd19的人类抗体药剂,其中所述人类抗体药剂与亲本人类 抗体药剂相比包含一或多种氨基酸取代,且其中所述人类抗体药剂包含(a)seq idno:124、seq id no:125和seq id no:126的重链cdr和seq id no:232、seq idno:233和seq id no:234的轻链cdr;(b)seq id no:127、seq id no:128和seq idno:129的重链cdr和seq id no:235、seq id no:236和seq id no:237的轻链cdr; (c)seq id no:130、seq id no:131和seq id no:132的重链cdr和seq id no:238、 seq id no:239和seq id no:240的轻链cdr;(d)seq id no:133、seq id no:134 和seq id no:135的重链cdr和seq id no:241、seq id no:242和seq id no:243 的轻链cdr;(e)seq id no:136、seq id no:137和seq id no:138的重链cdr和seqid no:244、seq id no:245和seq id no:246的轻链cdr;(f)seq id no:139、seq idno:140和seq id no:141的重链cdr和seq id no:247、seq id no:248和seq idno:249的轻链cdr;(g)seq id no:142、seq id no:143和seq id no:144的重链cdr 和seq id no:250、seq id no:251和seq id no:252的轻链cdr;(h)seq id no:145、 seq id no:146和seq id no:147的重链cdr和seq id no:253、seq id no:254和 seq id no:255的轻链cdr;(i)seq id no:148、seq id no:149和seq id no:150的 重链cdr和seq id no:256、seq id no:257和seq id no:258的轻链cdr;(j)seq idno:151、seq id no:152和seq id no:153的重链cdr和seq id no:259、seq idno:260和seq id no:261的轻链cdr;(k)seq id no:154、seq id no:155和seq idno:156的重链cdr和seq id no:262、seq id no:263和seq id no:264的轻链cdr; (l)seq id no:157、seq id no:158和seq id no:159的重链cdr和seq id no:265、 seq id no:266和seq id no:267的轻链cdr;(m)seq id no:160、seq id no:161 和seq id no:162的重链cdr和seq id no:268、seq id no:269和seq id no:270 的轻链cdr;(n)seq id no:163、seq id no:164和seq id no:165的重链cdr和seqid no:271、seq id no:272和seq id no:273的轻链cdr;(o)seq id no:166、seq idno:167和seq id no:168的重链cdr和seq id no:274、seq id no:275和seq idno:276的轻链cdr;(p)seq id no:169、seq id no:170和seq id no:171的重链cdr 和seq id no:277、seq id no:278和seq id no:279的轻链cdr;(q)seq id no:172、 seq id no:173和seq id no:174的重链cdr和seq id no:280、seq id no:281和 seq id no:282的轻链cdr;(r)seq id no:175、seq id no:176和seq id no:177的 重链cdr和seq id no:283、seq id no:284和seq id no:285的轻链cdr;或(s)seqid no:178、seq id no:179和seq id no:180的重链cdr和seq id no:286、seq idno:287和seq id no:288的轻链cdr。
[0587]
60.根据方面59所述的人类抗体药剂,其中所述人类抗体药剂包含在选自由10、16、 25、34、52、54、68、69、72、75、93、95和其组合组成的群组的氨基酸位置中的任一 个处包含一或多种氨基酸取代的轻链可变区。
[0588]
61.根据方面60所述的人类抗体药剂,其中所述一或多种氨基酸取代包括v10m、 k16e、s25n、v34i、d52n、l54q、n68t、t69m、l72m、s75n、s93t、d95e、d95g 或其组合。
[0589]
62.根据方面59至61中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 在选自由3、12、16、17、25、26、32、63、69、97、102、106、108、109、113、116、 117和其组合组成的群组的氨基酸位置中的任一个处包含一或多种氨基酸取代的重链可 变区。
[0590]
63.根据方面62所述的人类抗体药剂,其中所述一或多种氨基酸取代包括q3r、 k12e、e16g、s17f、s25a、g26a、y32f、s63f、t69a、a97v、t102s、m106l、 y108n、d109e、q113l、l116m、m117l或其组合。
[0591]
64.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代s75n的轻链可变区。
[0592]
65.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代t69m的轻链可变区。
[0593]
66.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代d52n和d95e的轻链可变区。
[0594]
67.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代v10m和d95g的轻链可变区。
[0595]
68.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代s93t的轻链可变区,和具有氨基酸取代s17f和t69a的重链可变区。
[0596]
69.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代n68t的轻链可变区,和具有氨基酸取代s17f和y108n的重链可变区。
[0597]
70.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代s63f的重链可变区。
[0598]
71.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代q3r、y32f和a97v的重链可变区。
[0599]
72.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代k16e的轻链可变区。
[0600]
73.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代m117l的重链可变区。
[0601]
74.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代l72m的轻链可变区,和具有氨基酸取代s25a的重链可变区。
[0602]
75.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代t102s和l116m的重链可变区。
[0603]
76.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代s25n和v34i的轻链可变区,和具有氨基酸取代k12e和d109e的重 链可变区。
[0604]
77.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代e16g的重链可变区。
[0605]
78.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代l54q的轻链可变区,和具有氨基酸取代m106l的重链可变区。
[0606]
79.根据方面59至63中任一方面所述的人类抗体药剂,其中所述人类抗体药剂包含 具有氨基酸取代s25n的轻链可变区。
id no:9、seq id no:11、seq id no:13、seq id no:15、seq id no:17、seq idno:19、seq id no:21、seq id no:23、seq id no:25、seq id no:27、seq id no:29、 seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39、seq idno:41、seq id no:43、seq id no:45、seq id no:47、seq id no:49、seq id no:51、 seq id no:53、seq id no:55、seq id no:57、seq id no:59、seq id no:61、seq idno:63、seq id no:65、seq id no:67、seq id no:69和seq id no:71。
[0627]
100.一种载体,其包含根据方面97至99中任一方面所述的经分离核酸分子。
[0628]
101.一种细胞,其包含根据方面100所述的载体。
[0629]
102.一种试剂盒,其包含根据方面1至93中任一方面所述的人类抗体药剂、根据 方面97至99中任一方面所述的经分离核酸分子、根据方面100所述的载体或根据方面 101所述的细胞。
[0630]
103.一种疫苗,其包含根据方面97至99中任一方面所述的经分离核酸分子。
[0631]
104.一种产生根据方面1至93中任一方面所述的人类抗体药剂的方法,其包含在 培养基中在允许表达人类抗体药剂的条件下培养根据方面101所述的细胞,和从培养基 分离人类抗体药剂的步骤。
[0632]
105.一种组合物,其包含根据方面1至93中任一方面所述的人类抗体药剂。
[0633]
106.根据方面105所述的组合物,其中所述人类抗体药剂结合于细胞毒性剂或部分。
[0634]
107.一种医药组合物,其包含根据方面105或106所述的组合物或根据方面1至93 中任一方面所述的人类抗体药剂,且更包含医药学上可接受的载剂或稀释剂。
[0635]
108.一种治疗个体的以cd19表达为特征的医学病状的方法,其包含向所述个体投 与治疗有效量的根据方面1至93中任一方面所述的人类抗体药剂的步骤。
[0636]
109.根据方面108所述的方法,其中以cd19表达为特征的所述医学病状是b细胞 淋巴瘤、急性淋巴母细胞白血病、慢性淋巴细胞白血病、伯基特淋巴瘤、非霍奇金氏淋 巴瘤或急性骨髓性白血病。
[0637]
110.根据方面108所述的方法,其中以cd19表达为特征的所述医学病状是类风湿 性关节炎(ra)、全身性红斑性狼疮症(sle)、糖尿病或硬皮病。
[0638]
111.一种治疗癌症的方法,所述方法包含向个体投与根据方面1至93中任一方面 所述的人类抗体药剂的步骤。
[0639]
112.一种根据方面1至93中任一方面所述的抗体药剂的用途,其用于治疗或检测 与cd19表达相关的病状。
[0640]
113.一种双专一性抗体,其包含来自根据方面1至93中任一方面所述的人类抗体 药剂的第一抗原结合位点,和第二抗原结合位点。
[0641]
114.根据方面113所述的双专一性抗体,其中第一和第二抗原结合位点是scfv。
[0642]
115.根据方面113所述的双专一性抗体,其中第一抗原结合位点由免疫球蛋白分子 构成且第二抗原结合位点由scfv、scfab、fab或fv构成。
[0643]
116.根据方面113至115中任一方面所述的双专一性抗体,其中第二抗原结合位点 结合选自由以下组成的群组的免疫细胞:t细胞、nk细胞、b细胞、树突状细胞、单 核细胞、巨噬细胞、嗜中性白血球、间叶干细胞和神经干细胞。
no:12、seq id no:14、seq id no:16、seq id no:18、seq id no:20、seq idno:22、seq id no:24、seq id no:26、seq id no:28、seq id no:30、seq id no:32、 seq id no:34、seq id no:36、seq id no:38、seq id no:40、seq id no:42、seq idno:44、seq id no:46、seq id no:48、seq id no:50、seq id no:52、seq id no:54、 seq id no:56、seq id no:58、seq id no:60、seq id no:62、seq id no:64、seq idno:66、seq id no:68、seq id no:70和seq id no:72。
[0662]
135.根据方面127至134中任一方面所述的嵌合抗原受体,其用于疗法或诊断中。
[0663]
136.根据方面127至134中任一方面所述的嵌合抗原受体,其用于治疗、预防或改 善以cd19表达为特征的疾病。
[0664]
137.一种经分离核酸分子,其编码根据方面127至134中任一方面所述的嵌合抗原 受体。
[0665]
138.根据方面137所述的经分离核酸分子,其中所述核酸分子包括经密码子优化的 序列。
[0666]
139.一种免疫效应细胞,其表达根据方面127至134中任一方面所述的嵌合抗原受 体。
[0667]
140.根据方面139所述的免疫效应细胞,其中所述细胞是t细胞或nk细胞。
[0668]
141.根据方面139或140所述的免疫效应细胞,其用于疗法或诊断中。
[0669]
142.根据方面139或140所述的免疫效应细胞,其用于治疗、预防或改善以cd19 表达为特征的疾病。
[0670]
143.一种试剂盒,其包含根据方面127至134中任一方面所述的嵌合抗原受体、根 据方面137或138所述的经分离核酸分子或根据方面139或140所述的免疫效应细胞。
[0671]
144.一种根据方面127至134中任一方面所述的嵌合抗原受体的用途,其用于治疗 或检测与cd19表达相关的医学病状。
[0672]
145.一种抑制肿瘤生长的方法,所述方法包含使肿瘤细胞与双专一性抗体接触的步 骤,所述双专一性抗体由基于根据方面1至93中任一方面所述的人类抗体药剂的第一 抗原结合位点和结合免疫细胞的第二抗原结合位点构成,所述接触在足以使得观察到肿 瘤细胞杀死的条件和时间下进行。
[0673]
146.一种杀死肿瘤细胞的方法,所述方法包含使肿瘤细胞与双专一性抗体接触的步 骤,所述双专一性抗体由基于根据方面1至93中任一方面所述的人类抗体药剂的第一 抗原结合位点和结合免疫细胞的第二抗原结合位点构成,所述接触在足以使得观察到肿 瘤细胞生长抑制的条件和时间下进行。
[0674]
147.根据方面145或146所述的方法,其中所述免疫细胞是t细胞或nk细胞。
[0675]
148.根据方面145至147中任一方面所述的方法,其中第一和第二抗原结合位点是 scfv。
[0676]
149.根据方面148所述的方法,其中第二抗原结合位点结合t细胞上的cd3。
[0677]
150.一种双专一性抗体,其由基于根据方面1至93中任一方面所述的人类抗体药 剂的第一抗原结合位点和结合免疫细胞的第二抗原结合位点构成,其用于抑制肿瘤生 长。
[0678]
151.一种双专一性抗体,其由基于根据方面1至93中任一方面所述的人类抗体药 剂的第一抗原结合位点和结合免疫细胞的第二抗原结合位点构成,其用于杀死肿瘤细 胞。
具有相同名称(但使用序数术语)的另一要素以区分所述权利要求要素。
[0693]
除非明确相反指示,否则如本文在说明书中和在权利要求书中所用的冠词“一(a/an)
”ꢀ
应理解是包含多个指示物。除非相反地指示或另外自上下文显而易见,否则如果一个、 超过一个或所有群组成员存在于、用于给定产物或方法中或以其它方式与给定产物或方 法有关,则在群组的一或多个成员之间包括“或”的权利要求书或描述视为满足。本发 明包括群组中恰好一个成员存在于、用于给定产物或方法中或以其它方式与给定产物或 方法有关的实施例。本发明还包括超过一个或全部群组成员存在于、用于给定产物或方 法中或以其它方式与给定产物或方法有关的实施例。此外,应理解除非另外指示或除非 一般技术人员将显而易见将产生矛盾或不一致,否则视相同基本权利要求书(或相关时, 任何其它权利要求书)而定,本发明涵盖将来自所列权利要求书中的一或多个的一或多个 限制、要素、条项、描述术语等引入另一权利要求书中的所有变化形式、组合和排列。 当要素呈现为清单时(例如以markush组或类似形式),应理解还公开要素的每个子组, 且任何要素可从所述组移除。应理解,一般来说,在本发明或本发明的方面称为包含具 体要素、特征等时,本发明或本发明方面的某些实施例由这类要素、特征等组成或主要 由这类要素、特征等组成。出于简化的目的,本文中这些实施例在每种情况下不具体地 明确地阐述。还应理解本发明的任何实施例或方面可明确从权利要求书排除,不论具体 排除是否在本说明书中叙述。本文中提及的用以描述发明背景和提供关于其实务的其它 细节的出版物、网站和其它参考材料以引用的方式并入本文中。
[0694]
已如此描述本发明的至少一个实施例的数个方面,应了解各种改变、修改和改进将 容易地是所属领域的技术人员显而易见。这类改变、修改和改进意图是本发明的一部分, 且意图在本发明的精神和范围内。因此,前述描述和图式仅作为实例且本发明由以下权 利要求书详细地描述。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1