脐带血浓缩细胞治疗卵巢早衰的细胞治疗剂的制作方法
1.本发明属于生物技术和生物医药领域,涉及使用细胞治疗剂治疗卵巢早衰(premature ovarian failure,pof)的方法。具体地说,本发明涉及从脐带血中快速分离制备脐带血浓缩细胞(脐带血浓缩物)的细胞治疗剂,进而使用此种脐带血浓缩细胞治疗早发性卵巢功能不全和卵巢早衰的方法。使用本发明方法可以有效的提高从脐带血中分离脐带血浓缩细胞的效率,提供一种安全、高效、简捷获得脐带血浓缩细胞制剂用于治疗卵巢早衰和卵巢功能不全例如早发性卵巢功能不全的方法。通过使用自动细胞快速处理系统为本发明目的得以实现。
背景技术:
2.卵巢早衰(premature ovarian failure,pof),是指由于卵巢功能衰竭,导致女性40岁之前闭经、不孕的现象。pof是一种以闭经、不孕、雌激素缺乏、卵泡减少和促性腺激素增高为特征的疾病,并伴有一系列低雌激素症状如:潮热多汗、面部潮红、性欲低下等,严重影响女性的身心健康。此外,pof的女性,患骨质疏松症、心血管疾病和老年痴呆的风险增加。pof是导致女性不孕的重要原因之一。育龄女性pof的发病率约1-3%,且呈上升和年轻化趋势。
3.根据欧洲人类生殖与胚胎学学会的指南(eshre),pof的诊断标准:少经或闭经至少4个月,间隔4周以上的两次fsh水平升高》40iu/l。卵巢早衰病因不明,可能与遗传和自身免疫性疾病、环境因素以及医源性和特发性情况有关,尚无有效的治疗方法。激素替代疗法(hrt)是pof最常见的治疗方法之一,但效果并不理想,而且已被证明会增加静脉血栓、乳腺癌和卵巢癌的风险。pof除了少经、闭经、不孕等症状,还可出现潮热、多汗、焦虑、抑郁、心悸、失眠等更年期症状,可能加快女性衰老,导致骨质疏松、心血管疾病、痴呆症等绝经后疾病,影响女性生活质量和寿命。
4.pof病因复杂,尚未完全阐明,可能与自身免疫应答、感染、遗传因素、化疗、放疗、手术等治疗效果及内分泌功能障碍有关,尚无有效的治疗方法。目前,pof的最常用的治疗方法是激素替代疗法(hormone replacement therapy,hrt)。该疗法虽然对pof的临床症状具有一定的缓解作用,然而,hrt不能从根本上修复受损的卵巢,恢复卵巢功能。此外,研究表明,长期hrt治疗增加心脏病和中风的风险,可能会增加乳腺癌和卵巢癌的风险。因此,需要新的治疗策略来恢复pof患者的卵巢功能。
5.脐带血(umbilical cord blood)是胎儿娩出、脐带结扎并离断后残留在胎盘和脐带中的血液,通常是废弃不用的。近十几年的研究发现,脐带血中含有可以重建人体造血和免疫系统的造血干细胞(hematopoietic stem cells,hscs),可用于造血干细胞移植,治疗80多种疾病。因此,脐带血已成为造血干细胞的重要来源,特别是无血缘关系造血干细胞的来源。也是一种非常重要的人类生物资源。脐带血中含有大量的间充质干细胞(mesenchymal stem cell,mscs),干细胞是生命的种子,它会分化成人体的各种细胞,结出各种不同的果实——血液细胞、神经细胞、骨骼细胞等等。随着科技的发展,医学专家研究
出利用脐带血中的干细胞来治疗疾病的方法。干细胞是具有自我更新、高度增殖和多项分化潜能的细胞群体。这些细胞可以通过分裂维持自身细胞的特性和数量,又可进一步分化为各种组织细胞,从而在组织修复等方面发挥积极作用。近三十年来的医学研究发现,脐带血中含有非常丰富的造血干细胞,可以重建人体造血和免疫系统,可用于造血干细胞移植,治疗血液系统、免疫系统,以及遗传代谢性及先天性疾病。因此,脐带血已成为造血干细胞的重要来源,已经被广泛地应用于临床,是宝贵的人类生物资源。造血干细胞(hematopoietic stem cells,hscs),可以分化为血液循环中的红细胞、白细胞和血小板。间充质干细胞(mesenchymal stem cell,mscs)是一种具有分化形成骨、软骨、脂肪、神经及成肌细胞的多种分化潜能的细胞亚群,mscs通过旁分泌多种生长因子,对hscs起到支持的作用,维持造血微环境的稳定。
6.脐带血浓缩细胞(umbilical cord blood concentrate,ucbc)是将脐带血经过离心、分离后获得的有核细胞的浓缩物。脐带血浓缩细胞(ucbc)中包含富集的造血干细胞(hscs)和间充质干细胞(mscs),以及大量的多种细胞生长因子。hscs可以分化为血液循环中的红细胞、白细胞和血小板。mscs是一种具有分化形成骨、软骨、脂肪、神经及成肌细胞的多种分化潜能的细胞亚群。ucbc中含有血管内皮生长因子(vegf)、血小板衍生生长因子(pdgf)、转化生长因子β(tgf-β)、肝细胞生长因子(hgf)、成纤维细胞生长因子(fgf)、胰岛素样生长因子i(igf-i)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、骨形态发生蛋白(bmp-2,bmp-7)和白细胞介素(il-1,il-6,il-8)等多种生长因子和细胞因子。
7.ucbc具有抗炎、免疫调节特性、促血管生成、促进组织再生修复等作用。临床前和初步临床研究证实,ucbc通过改善卵巢微环境,促进血管生成,促进卵泡发育,增加窦状卵泡数量,促进排卵,从而改善卵巢功能,是治疗pof患者潜在的治疗方法。
8.然而,脐带血在传统上采用手工操作方式以密度梯度离心法进行分离,存在操作复杂、耗时长、易污染、结果重复性差等非常棘手的问题。为此,本领域技术人员期待有一种操作简单、耗时短、不易受到污染、结果可重复性好等一个或者多个方面有益效果的处理脐带血以获得脐带血浓缩物即脐带血浓缩细胞的方法。本领域技术人员还期待提供一种治疗卵巢早衰的方法例如使用脐带血浓缩细胞治疗剂治疗卵巢早衰的方法。
技术实现要素:
9.本发明的目的在于提供一种制备脐带血浓缩细胞制剂的方法,期待该种方法具有操作简单、耗时短、不易受到污染、结果可重复性好等一个或者多个方面的有益效果。已经出人意料地发现,本发明通过使用封闭式的pxp细胞自动分离系统能够实现上述一个或者多个目的,本发明基于此类发现而得以完成。
10.为此,本发明第一方面提供了一种制备脐带血浓缩细胞制剂的方法,其包括如下步骤:
11.(1)提供生物样本脐带血,使其置于含有抗凝剂的无菌袋中备用;
12.(2)取下细胞自动分离系统的输入管上的护帽,将注射器连接到输入管鲁尔锁定接头上,以缓慢而稳定的速度通过血栓过滤器,将抗凝的生物样本转移到一次性无菌分离杯中,沿水平轴摇动混合样本;所述细胞自动分离系统是封闭式的pxp分离系统,其由四个部件组成:a)一次性无菌分离杯、b)控制模块、c)用于传输数据的分离底座、d)datatrak软
件处理系统;
13.(3)将一次性分离杯放入控制模块中,离心前控制模块状态显示为“0”,将分离杯/控制模块组件称重,配平后,放置于可编程的离心机中,并按照如下程序设定离心机的参数:
14.程序号加速减速相对离心力/rcf时间/minp19920008.5p299502p3995002.5p499501p5992500.5p699501
15.(4)启动离心机进行离心,进程如下:
16.4a)p1期使生物样本中的细胞通过离心密度分层在一次性分离杯中分为下中上三个组分:红细胞层、细胞浓缩层、血浆层;
17.4b)p2期使大部分红细胞进入红细胞回收舱;
18.4c)p3期进一步将处理室中的细胞分层,p4期降低离心力以进一步除去红细胞;
19.4d)p5期使细胞浓缩层和血浆进一步分层,至p6期降低离心力,使细胞浓缩层通过输送管转移至回收舱室,血浆保留在中央舱室中;
20.(5)离心完成后,确认控制模块窗口显示“p”即合格状态,从控制模块中取出分离杯,将注射器连接至分离杯与回收舱室连通的输出管上,收集得到的脐带血浓缩细胞制剂。
21.根据本发明第一方面的方法,其中步骤(1)提供的生物样本的体积为20~350ml。
22.根据本发明第一方面的方法,其中步骤(1)中另外抽取1ml样本以备检测。
23.根据本发明第一方面的方法,其中步骤(1)所用抗凝剂为枸橼酸钠溶液。
24.根据本发明第一方面的方法,其中步骤(1)所用抗凝剂为3.6%枸橼酸钠溶液。
25.根据本发明第一方面的方法,其中步骤(1)所用抗凝剂为3.6%枸橼酸钠溶液,其中增补添加0.5mg/ml组氨酸和0.15mg/ml磷脂酰胆碱。
26.根据本发明第一方面的方法,其中步骤(1)所用抗凝剂与生物样本的体积比为1:12。
27.根据本发明第一方面的方法,其中步骤(1)所用抗凝剂的配制方法为:使枸橼酸钠、组氨酸和磷脂酰胆碱加至适量水中,加热至60℃搅拌使溶解,加水至全量,0.22μm微孔滤膜过滤,121℃热压灭菌,即得。
28.根据本发明第一方面的方法,其还包括以下步骤:(6)使分离杯和控制模块置于分离底座上以传输数据并用datatrak软件处理系统处理离心过程中所捕获的数据。
29.进一步的,本发明第二方面提供了一种脐带血浓缩细胞制剂,其是通过包括如下步骤的方法制备得到的:
30.(1)提供生物样本脐带血,使其置于含有抗凝剂的无菌袋中备用;
31.(2)取下细胞自动分离系统的输入管上的护帽,将注射器连接到输入管鲁尔锁定接头上,以缓慢而稳定的速度通过血栓过滤器,将抗凝的生物样本转移到一次性无菌分离杯中,沿水平轴摇动混合样本;所述细胞自动分离系统是封闭式的pxp分离系统,其由四个
部件组成:a)一次性无菌分离杯、b)控制模块、c)用于传输数据的分离底座、d)datatrak软件处理系统;
32.(3)将一次性分离杯放入控制模块中,离心前控制模块状态显示为“0”,将分离杯/控制模块组件称重,配平后,放置于可编程的离心机中,并按照如下程序设定离心机的参数:
33.程序号加速减速相对离心力/rcf时间/minp19920008.5p299502p3995002.5p499501p5992500.5p699501
34.(4)启动离心机进行离心,进程如下:
35.4a)p1期使生物样本中的细胞通过离心密度分层在一次性分离杯中分为下中上三个组分:红细胞层、细胞浓缩层、血浆层;
36.4b)p2期使大部分红细胞进入红细胞回收舱;
37.4c)p3期进一步将处理室中的细胞分层,p4期降低离心力以进一步除去红细胞;
38.4d)p5期使细胞浓缩层和血浆进一步分层,至p6期降低离心力,使细胞浓缩层通过输送管转移至回收舱室,血浆保留在中央舱室中;
39.(5)离心完成后,确认控制模块窗口显示“p”即合格状态,从控制模块中取出分离杯,将注射器连接至分离杯与回收舱室连通的输出管上,收集得到的脐带血浓缩细胞制剂。
40.根据本发明第二方面的脐带血浓缩细胞制剂,其中步骤(1)提供的生物样本的体积为20~350ml。
41.根据本发明第二方面的脐带血浓缩细胞制剂,其中步骤(1)中另外抽取1ml样本以备检测。
42.根据本发明第二方面的脐带血浓缩细胞制剂,其中步骤(1)所用抗凝剂为枸橼酸钠溶液。
43.根据本发明第二方面的脐带血浓缩细胞制剂,其中步骤(1)所用抗凝剂为3.6%枸橼酸钠溶液。
44.根据本发明第二方面的脐带血浓缩细胞制剂,其中步骤(1)所用抗凝剂为3.6%枸橼酸钠溶液,其中增补添加0.5mg/ml组氨酸和0.15mg/ml磷脂酰胆碱。
45.根据本发明第二方面的脐带血浓缩细胞制剂,其中步骤(1)所用抗凝剂与生物样本的体积比为1:12。
46.根据本发明第二方面的脐带血浓缩细胞制剂,其中步骤(2)所用抗凝剂的配制方法为:使枸橼酸钠、组氨酸和磷脂酰胆碱加至适量水中,加热至60℃搅拌使溶解,加水至全量,0.22μm微孔滤膜过滤,121℃热压灭菌,即得。
47.根据本发明第二方面的脐带血浓缩细胞制剂,其还包括以下步骤:(6)使分离杯和控制模块置于分离底座上以传输数据并用datatrak软件处理系统处理离心过程中所捕获的数据。
48.进一步的,本发明第三方面提供了脐带血浓缩细胞制剂在制备用于治疗卵巢早衰的细胞治疗剂中的用途,所述脐带血浓缩细胞制剂是通过包括如下步骤的方法制备得到的:
49.(1)提供生物样本脐带血,使其置于含有抗凝剂的无菌袋中备用;
50.(2)取下细胞自动分离系统的输入管上的护帽,将注射器连接到输入管鲁尔锁定接头上,以缓慢而稳定的速度通过血栓过滤器,将抗凝的生物样本转移到一次性无菌分离杯中,沿水平轴摇动混合样本;所述细胞自动分离系统是封闭式的pxp分离系统,其由四个部件组成:a)一次性无菌分离杯、b)控制模块、c)用于传输数据的分离底座、d)datatrak软件处理系统;
51.(3)将一次性分离杯放入控制模块中,离心前控制模块状态显示为“0”,将分离杯/控制模块组件称重,配平后,放置于可编程的离心机中,并按照如下程序设定离心机的参数:
52.程序号加速减速相对离心力/rcf时间/minp19920008.5p299502p3995002.5p499501p5992500.5p699501
53.(4)启动离心机进行离心,进程如下:
54.4a)p1期使生物样本中的细胞通过离心密度分层在一次性分离杯中分为下中上三个组分:红细胞层、细胞浓缩层、血浆层;
55.4b)p2期使大部分红细胞进入红细胞回收舱;
56.4c)p3期进一步将处理室中的细胞分层,p4期降低离心力以进一步除去红细胞;
57.4d)p5期使细胞浓缩层和血浆进一步分层,至p6期降低离心力,使细胞浓缩层通过输送管转移至回收舱室,血浆保留在中央舱室中;
58.(5)离心完成后,确认控制模块窗口显示“p”即合格状态,从控制模块中取出分离杯,将注射器连接至分离杯与回收舱室连通的输出管上,收集得到的脐带血浓缩细胞制剂。
59.根据本发明第三方面的用途,其中步骤(1)提供的生物样本的体积为20~350ml。
60.根据本发明第三方面的用途,其中步骤(1)中另外抽取1ml样本以备检测。
61.根据本发明第三方面的用途,其中步骤(1)所用抗凝剂为枸橼酸钠溶液。
62.根据本发明第三方面的用途,其中步骤(1)所用抗凝剂为3.6%枸橼酸钠溶液。
63.根据本发明第三方面的用途,其中步骤(1)所用抗凝剂为3.6%枸橼酸钠溶液,其中增补添加0.5mg/ml组氨酸和0.15mg/ml磷脂酰胆碱。
64.根据本发明第三方面的用途,其中步骤(1)所用抗凝剂与生物样本的体积比为1:12。
65.根据本发明第三方面的用途,其中步骤(1)所用抗凝剂的配制方法为:使枸橼酸钠、组氨酸和磷脂酰胆碱加至适量水中,加热至60℃搅拌使溶解,加水至全量,0.22μm微孔滤膜过滤,121℃热压灭菌,即得。
66.根据本发明第三方面的用途,其还包括以下步骤:(6)使分离杯和控制模块置于分离底座上以传输数据并用datatrak软件处理系统处理离心过程中所捕获的数据。
67.进一步的,本发明第四方面提供了治疗卵巢早衰的方法,该方法包括给予有需要的受试者施用包含治疗有效量的脐带血浓缩细胞制剂,所述脐带血浓缩细胞制剂是通过包括如下步骤的方法制备得到的:
68.(1)提供生物样本脐带血,使其置于含有抗凝剂的无菌袋中备用;
69.(2)取下细胞自动分离系统的输入管上的护帽,将注射器连接到输入管鲁尔锁定接头上,以缓慢而稳定的速度通过血栓过滤器,将抗凝的生物样本转移到一次性无菌分离杯中,沿水平轴摇动混合样本;所述细胞自动分离系统是封闭式的pxp分离系统,其由四个部件组成:a)一次性无菌分离杯、b)控制模块、c)用于传输数据的分离底座、d)datatrak软件处理系统;
70.(3)将一次性分离杯放入控制模块中,离心前控制模块状态显示为“0”,将分离杯/控制模块组件称重,配平后,放置于可编程的离心机中,并按照如下程序设定离心机的参数:
71.程序号加速减速相对离心力/rcf时间/minp19920008.5p299502p3995002.5p499501p5992500.5p699501
72.(4)启动离心机进行离心,进程如下:
73.4a)p1期使生物样本中的细胞通过离心密度分层在一次性分离杯中分为下中上三个组分:红细胞层、细胞浓缩层、血浆层;
74.4b)p2期使大部分红细胞进入红细胞回收舱;
75.4c)p3期进一步将处理室中的细胞分层,p4期降低离心力以进一步除去红细胞;
76.4d)p5期使细胞浓缩层和血浆进一步分层,至p6期降低离心力,使细胞浓缩层通过输送管转移至回收舱室,血浆保留在中央舱室中;
77.(5)离心完成后,确认控制模块窗口显示“p”即合格状态,从控制模块中取出分离杯,将注射器连接至分离杯与回收舱室连通的输出管上,收集得到的脐带血浓缩细胞制剂。
78.根据本发明第四方面的方法,其中步骤(1)提供的生物样本的体积为20~350ml。
79.根据本发明第四方面的方法,其中步骤(1)中另外抽取1ml样本以备检测。
80.根据本发明第四方面的方法,其中步骤(1)所用抗凝剂为枸橼酸钠溶液。
81.根据本发明第四方面的方法,其中步骤(1)所用抗凝剂为3.6%枸橼酸钠溶液。
82.根据本发明第四方面的方法,其中步骤(1)所用抗凝剂为3.6%枸橼酸钠溶液,其中增补添加0.5mg/ml组氨酸和0.15mg/ml磷脂酰胆碱。
83.根据本发明第四方面的方法,其中步骤(1)所用抗凝剂与生物样本的体积比为1:12。
84.根据本发明第四方面的方法,其中步骤(1)所用抗凝剂的配制方法为:使枸橼酸
钠、组氨酸和磷脂酰胆碱加至适量水中,加热至60℃搅拌使溶解,加水至全量,0.22μm微孔滤膜过滤,121℃热压灭菌,即得。
85.根据本发明第四方面的方法,其还包括以下步骤:(6)使分离杯和控制模块置于分离底座上以传输数据并用datatrak软件处理系统处理离心过程中所捕获的数据。
86.在本发明上述各种操作步骤中,虽然其描述的具体步骤在某些细节上或者语言描述上与下文具体实施方式部分的制备例中所描述的步骤有所区别,然而,本领域技术人员根据本发明全文的详细公开完全可以概括出以上所述方法步骤。
87.本发明的任一方面的任一实施方案,可以与其它实施方案进行组合,只要它们不会出现矛盾。此外,在本发明任一方面的任一实施方案中,任一技术特征可以适用于其它实施方案中的该技术特征,只要它们不会出现矛盾。下面对本发明作进一步的描述。
88.本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
89.本发明使用pxp自动化细胞快速处理系统,应用自动分离和浓缩的封闭式系统,安全、高效、简捷获得脐带血浓缩细胞制剂的方法,为脐带血浓缩细胞制剂用于治疗pof患者的临床应用奠定了基础。本发明提供的快速分离获得脐带血浓缩细胞制剂的方法,该方法将取自人的脐带血,使用封闭式自动化细胞分离系统,分离获得脐带血浓缩细胞制剂。本发明获得的脐带血浓缩细胞制剂作为治疗卵巢损伤的活性成分,能够促进血管生成、卵泡发育,从而改善卵巢功能。
90.现有的研究业已证实,污染性红细胞与干细胞/祖细胞功能的下降有关,红细胞污染细胞浓缩物被认为会降低细胞治疗的效果。为了更好地发挥细胞治疗的潜力,行业迫切需要能提高靶细胞纯度和污染性红细胞去除率的新处理系统。
91.本发明具体实验中使用的细胞分离系统为自动分离系统,其型号为80065-01,供应商为无锡博雅感知医疗科技有限公司,生产商为美国thermogenesis公司。创新的pxp系统解决了当前市场上现有系统的许多缺陷。pxp系统使临床医生能够在几乎没有红细胞污染的情况下,通常少于起始样本的5%,迅速获得很高的干细胞和祖细胞回收率。
92.pxp系统针对开发和使用细胞治疗技术的临床机构在手术室环境下快速、高效、无菌的细胞处理需求,是一种相当高效的手术室即时系统(point-of-care)产品。作为前沿的自动化细胞快速处理系统,pxp系统不需要细胞分离介质或沉淀剂,可以同时处理多个样本,mnc和cd34+、cd45+细胞回收率高,能够让临床医生在医院外科中心或者诊所实现30分钟之内从生物样品(例如骨髓、脐带血)中高效提取干细胞,并且红细胞的去除率超过90%。此外,该pxp系统还配备了专利的datatrak软件来追踪捕获数据,以方便为客户提供gmp流程控制和报告信息。
93.pxp系统目前已经通过多国卫生部的医疗器械产品注册,这套设备系统的临床应用场景广泛,多用于骨科疾病的细胞疗法,有机构通过pxp系统实现了手术室环境的高效、高质量的自体骨髓干细胞制备,将治疗中心的骨科疾病细胞疗法带上了新的台阶,也为治疗中心争取了长足的竞争力。pxp系统用于处理骨髓提取物,能够实时快速自动化处理骨髓
细胞,确保单个核细胞(mnc)的回收率,能够同时处理多个骨髓单元,并且不需要细胞分离介质或沉淀剂。与上述骨髓干细胞类似,脐带血亦可用于卵巢早衰的治疗。
94.本发明具体试验中使用的pxp系统的优点包括但不限于:稳定优异的mnc(单核细胞)和cd34+、cd45+细胞回收率、30分钟内快速处理脐带血样本、95%以上的红细胞去除率、自动化封闭式无菌系统、快速准确的数据追踪和文档记录、样本处理数据可以通过datatrak软件上传到计算机,提供符合gmp要求的生产记录和报告信息。
95.近期的研究显示,脐带组织和脐血中也含有间充质干细胞并且能成功分离,其中脐血来源的干细胞通常称为造血干细胞。这种来源的间充质干细胞不仅保持了间充质干细胞的生物学特性,而且分离出来的干细胞更原始,有更强的增殖分化能力。其免疫细胞的功能活性低,大大减低了触发免疫反应及引起移植物抗宿主病的风险。潜伏性病毒和微生物的感染及传播几率比较低。采集过程简单,对产妇及新生儿无任何危害及损伤。以上原因足以令脐带间充质干细胞成为骨髓间充质干细胞的理想替代物。
96.基础研究发现,能分化为血管内皮细胞的干细胞类型有血管内皮祖细胞(endothelial progenitor cell,epcs)、骨髓源性单核细胞(bone marrow mononuclear cell,bmmnc)和外周血单核细胞(peripheral blood mononuclear cell,pbmnc)。但这些干细胞受组织来源的限制,提取和扩增的数量有限。致使这种疗法目前尚处于临床前研究阶段。
97.已有实验证明,人cd34
+
细胞(cd34是成熟血管的标志物)可以缓解cli的症状、改善受累肢体的功能和防止截肢。但由于其在脐带沃尔通氏胶(wharton's jelly)中含量仅为5%-10%左右,因此,如何高效地生产该细胞就成为其能否获得广泛应用的重要前提。
98.卵巢早衰(pof)是一种常见的妇科内分泌疾病,影响女性健康。在40岁以前女性的发病率为1%-2%,30岁以前的女性发病率为0.1%。中华医学会妇产科学分会给出的诊断标准为:闭经时间≥4-6个月,两次间隔4周以上卵泡刺激素》40u/l,伴有雌激素降低及绝经症状。pof患者者由于卵巢功能减退及衰竭,激素分泌急剧降低,会引起停经或月经稀发,常伴有潮热、盗汗、烦躁不安、焦虑、骨质疏松、生育能力暂时或永久丧失等症状,威胁到女性的生理健康及心理健康。大部分临床卵巢早衰的具体病因尚不明确,目前认为有遗传性因素、自身免疫性因素、医源性因素、环境因素等几种原因,随着化疗在妇科肿瘤的广泛应用,医源性继发性卵巢早衰的发病率正呈逐渐上升的趋势。针对前述病因,目前治疗卵巢早衰的主要措施包括激素替代治疗、免疫调节、卵巢组织冻存移植、胚胎冻存移植等,这些临床治疗方法可以改善卵巢早衰症状并能促进患者生育,但并不能从根本上恢复卵巢功能,且存在伦理争议及不良反应。因此,探寻一种能够高效、安全地恢复卵巢功能的治疗手段是学界的当务之急。
99.2019年,美国进行的一项研究显示,脐带血干细胞在pof中已显示出令人鼓舞的再生能力。该研究的治疗实验中,18只雌性小鼠平均分成3组,第一组为对照组(只注射磷酸盐缓冲液),第二组为化疗组(给予白消安和环磷酰胺的联合化疗,注射磷酸盐缓冲液),第三组为实验组(在第二组化疗药物的基础上,给予两侧卵巢脐带血干细胞注射),之后评估小鼠体重和激素水平。治疗8周后小鼠的体重数据显示,与第二组化疗之后体重显着减少相比,脐带血干细胞组输注干细胞后体重明显增加。
100.从第4周开始,输注脐带血干细胞组中的促卵泡刺激素(fsh)水平明显升高。fsh是
垂体前叶嗜碱性细胞分泌的一种激素,主要作用为促进卵泡成熟,从而促进卵泡颗粒层细胞增生分化,使得整个卵巢长大。育种实验入组18只雌性小鼠,重复治疗实验的步骤,手术后1周开始,将1只雄性小鼠放在同一笼中。仔细检查所得幼崽是否有异常,并在每组中对每只动物计数。在三个月的试验时间中,输注脐带血干细胞组与对照组小鼠的交配率为100%,化疗组仅为25%。输注脐带血干细胞组幼崽总数为26只,化疗组仅有2只幼崽。输注脐带血干细胞组幼崽总数虽然显著低于对照组,但是受孕率与对照组相当。在这项研究中,发现输注脐带血干细胞后,对小鼠化疗损伤的卵巢有积极地治疗作用。小鼠的体重增加,激素分泌功能良好,并且恢复生育能力。
101.脐带血是胎儿娩出、脐带结扎并离断后残留在胎盘和脐带中的血液,通常是废弃不用的。近十几年的研究发现,脐带血中含有可以重建人体造血和免疫系统的造血干细胞,可用于造血干细胞移植,治疗80多种疾病。因此,脐带血已成为造血干细胞的重要来源,特别是无血缘关系造血干细胞的来源。也是一种非常重要的人类生物资源。脐带血中含有大量的干细胞,干细胞是生命的种子,它会分化成人体的各种细胞,结出各种不同的果实——血液细胞,神经细胞,骨骼细胞等等。随着科技的发达,医学专家研究出利用脐带血中的干细胞来治疗疾病的方法。干细胞是具有自我更新、高度增殖和多项分化潜能的细胞群体。这些细胞可以通过分裂维持自身细胞的特性和数量,又可进一步分化为各种组织细胞,从而在组织修复等方面发挥积极作用。近三十年来的医学研究发现,脐带血中含有非常丰富的造血干细胞(hsc),可以重建人体造血和免疫系统,可用于造血干细胞移植,治疗血液系统、免疫系统,以及遗传代谢性及先天性疾病。因此,脐带血已成为造血干细胞的重要来源,已经被广泛地应用于临床,是宝贵的人类生物资源。
102.21世纪是生物的世纪,细胞治疗作为一种生物治疗手段,为人类疾病的治疗打开了全新的思路。截止2014年5月底,全球已在美国国立卫生院(nih)注册与脐带血相关的临床研究共928项。涉及的脐带血研究所治疗的相关疾病包括:自体免疫疾病:类风湿关节炎、红斑狼疮、多发性硬化症;心脑血管疾病:先天性心脏病、心脏修复和恢复、缺血性中风;神经性疾病:脑性麻痹、缺氧缺血性脑病、自闭症、创伤性脑损伤、脊髓损伤、听力损失、肌萎缩性脊髓侧索硬化症、阿尔茨海默氏病(老年痴呆);恶性疾病:乳癌、肾癌;先天性疾病:杜氏肌营养不良症、becker型肌营养不良、囊性纤维化;其他疾病:i型糖尿病、艾滋病、软骨修复、重症肢体缺血。
103.截至目前,对脐带血中cd34
+
细胞的分离通常采取ficoll分离法、羟乙基淀粉分离法和明胶自然沉降分离法,并在随后用免疫磁珠吸附法(macs)进一步纯化所获得的cd34
+
细胞以获得符合要求的cd34
+
细胞。上述方法直接从人脐带血中分离并纯化原代cd34
+
细胞,鉴于人脐带血的供应量有限,利用上述方法所能获取的cd34
+
细胞的数量也极其有限。
104.脐带血细胞提取物市场是一个新兴市场,经过30年至40年的研究与发展,各种干细胞治疗及相关技术设备渐渐走向商业化。脐带血浓缩细胞制剂、富血小板血浆及干细胞衍生物的出现,正在成为未来医疗的新趋势。随着个性化医学的发展,全球对细胞治疗的临床需要越来越显著,细胞治疗临床应用的放开趋势也愈加明显。随着细胞治疗临床应用的逐渐覆盖,医疗机构对基于自动化技术的新一代细胞处理及制备解决方案的需求会日益剧增,而这些技术平台也将对细胞疗法走向成功产生重要的影响。
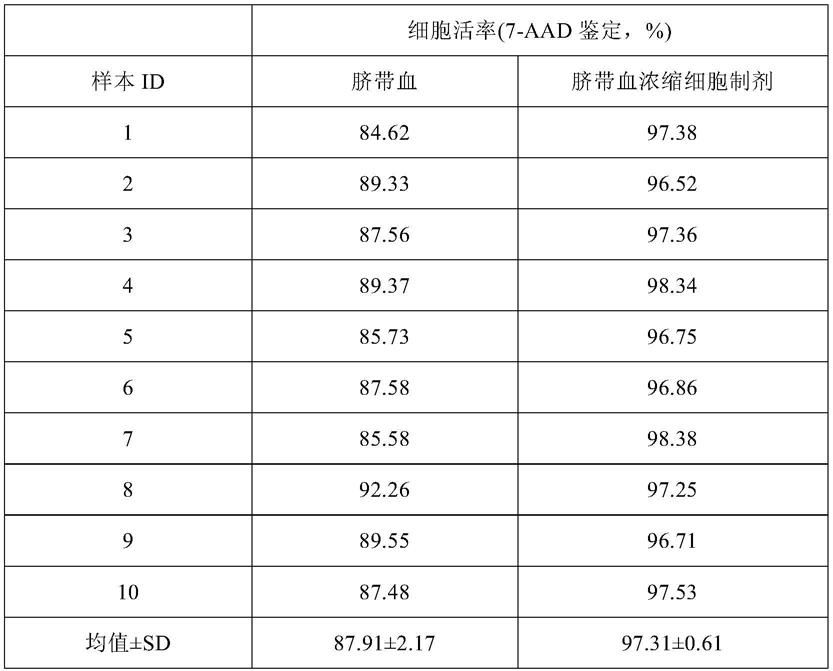
105.本发明通过使用pxp系统进行细胞分离获得了令人满意的效果。
具体实施方式
106.通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细的描述。
107.在本发明中,如未另外说明,具体实验中使用的细胞分离系统为自动分离系统,其在本发明中亦可简称为pxp系统、pxp细胞自动分离系统、pxp自动分离系统、pxp分离系统等。实验中使用的该pxp系统的型号为80065-01,供应商为无锡博雅感知医疗科技有限公司,生产商为美国thermogenesis公司。
108.实施例1:快速分离制备脐带血浓缩细胞制剂(ucbc)
109.(1)提供生物样本脐带血(可以处理20~350ml体积的样本),使其置于含有抗凝剂的无菌袋中备用,另抽取1ml样本以备检测;
110.(2)取下细胞自动分离系统的输入管上的护帽,将注射器连接到输入管鲁尔锁定接头上,以缓慢而稳定的速度通过血栓过滤器,将抗凝的生物样本转移到一次性无菌分离杯中,沿水平轴摇动混合样本;所述细胞自动分离系统是封闭式的pxp分离系统,其由四个部件组成:a)一次性无菌分离杯、b)控制模块、c)用于传输数据的分离底座、d)datatrak软件处理系统;
111.(3)将一次性分离杯放入控制模块中,离心前控制模块状态显示为“0”,将分离杯/控制模块组件称重,配平后,放置于可编程的离心机中,并按照如下程序设定离心机的参数:
112.程序号加速减速相对离心力/rcf时间/minp19920008.5p299502p3995002.5p499501p5992500.5p699501
113.(4)启动离心机进行离心,进程如下:
114.4a)p1期使生物样本中的细胞通过离心密度分层在一次性分离杯中分为下中上三个组分:红细胞层、细胞浓缩层、血浆层;
115.4b)p2期使大部分红细胞进入红细胞回收舱;
116.4c)p3期进一步将处理室中的细胞分层,p4期降低离心力以进一步除去红细胞;
117.4d)p5期使细胞浓缩层和血浆进一步分层,至p6期降低离心力,使细胞浓缩层通过输送管转移至回收舱室,血浆保留在中央舱室中;
118.(5)离心完成后,确认控制模块窗口显示“p”即合格状态,从控制模块中取出分离杯,将注射器连接至分离杯与回收舱室连通的输出管上,收集得到的脐带血浓缩细胞制剂。
119.可选的步骤(6):使分离杯和控制模块置于分离底座上以传输数据并用datatrak软件处理系统处理离心过程中所捕获的数据。本实施例1步骤(1)所用抗凝剂为3.6%枸橼
酸钠溶液,其中增补添加0.5mg/ml组氨酸和0.15mg/ml磷脂酰胆碱,抗凝剂与生物样本的体积比为1:12;抗凝剂的配制方法为:使枸橼酸钠、组氨酸和磷脂酰胆碱加至适量水中,加热至60℃搅拌使溶解,加水至全量,0.22μm微孔滤膜过滤,121℃热压灭菌,即得。本实施例1对收集的10份生物样本人脐带血进行细胞分离制备脐带血浓缩细胞制剂。
120.试验例1:分析脐带血浓缩细胞制剂中mnc回收率
121.使用实施例1的方法,对收集的10份脐带血进行细胞分离,对各分离级分进行细胞检测,分析结果汇总见下表。
122.样本no.分离前体积/ml终体积/ml红细胞去除率/%mnc回收率/%mnc浓缩倍数1178.322.798.396.37.852182.422.198.797.68.253165.621.497.895.87.744176.522.298.897.27.955180.321.697.496.78.356188.423.798.996.37.957195.224.897.697.57.878179.623.198.796.87.779187.422.898.497.18.2210173.620.898.695.78.35平均180.722.598.396.78.03
123.结果显示,平均而言,输入脐带血均值为180.7ml,输出脐带血浓缩细胞制剂均值为22.5ml;单个核细胞(mnc)回收率高达96.7%,红细胞(rbc)去除率高达98.3%;mnc浓度提升8.03倍。可见,使用pxp动分离系统能够以操作简单、耗时短、不易受到污染、结果可重复性好的方式富集骨髓中的mnc,同时去除大部分红细胞。
124.实施例1a:参考实施例1操作制备脐带血浓缩细胞制剂,不同的仅是在抗凝剂中不添加组氨酸,处理5份生物样本得到5份脐带血浓缩细胞制剂。实施例1b:参考实施例1操作制备脐带血浓缩细胞制剂,不同的仅是在抗凝剂中不添加磷脂酰胆碱,处理5份生物样本得到5份脐带血浓缩细胞制剂。实施例1c:参考实施例1操作制备脐带血浓缩细胞制剂,不同的仅是在抗凝剂中既不添加组氨酸也不添加磷脂酰胆碱,处理5份生物样本得到5份脐带血浓缩细胞制剂。对实施例1、实施例1a、实施例1b、实施例1c操作中所得到的血浆层用双蒸水稀释1倍,用分光光度计在540nm处测定吸收度,结果:实施例1=0.031
±
0.007(n=10)、实施例1a=0.273
±
0.042(n=6)、实施例1b=0.244
±
0.034(n=6)、实施例1c=0.296
±
0.036(n=6);另外,平均的红细胞去除率方面,实施例1a=89.6%、实施例1b=92.7%、实施例1c=89.2%,这些结果表明,实施例1a等操作中可能有红细胞破裂导致血浆层颜色变深,进而另外造成红细胞去除率变低,而通过在抗凝剂中添加组氨酸和磷脂酰胆碱能够明显地避免上述问题,这一发现是完全出人意料的。
125.试验例2:脐带血和脐带血浓缩细胞制剂样本中的细胞活率
126.针对试验例1涉及的10个样本进行考察。细胞活率是表示细胞是否具有生物学功能的最直观的指标。骨髓样本采集24-36小时内(t《36小时),使用fc500流式细胞仪,应用7-aad染色法,分析脐带血、脐带血浓缩细胞制剂中的细胞活率。结果汇总见下表。
[0127][0128]
结果表明,pxp系统处理后,脐带血和脐带血浓缩细胞制剂样品平均细胞活率方面,(单因素方差分析显示)脐带血浓缩细胞制剂样本中的细胞活率显著高于脐带血细胞活率。另外,实施例1a、实施例1b、实施例1c操作所得脐带血浓缩细胞制剂细胞活率(%)分别为87.24
±
1.14、89.73
±
1.07、89.81
±
0.87,它们的结果明显比实施例1更差。
[0129]
试验例3:脐带血和脐带血浓缩细胞制剂样本中cd45+、cd34+细胞计数
[0130]
针对试验例1涉及的10个样本进行考察。在fc500流式细胞仪上,应用7-aad染色法,对所有处理前、处理后的骨髓样本中的cd45+和cd34+细胞数量和细胞活率进行了分析,结果见下表。
[0131][0132]
从表中结果可见,pxp系统能够有效富集cd45
+
和cd34
+
细胞,不论是cd45
+
活细胞数量还是cd34
+
活细胞数量,脐带血与脐带血浓缩细胞制剂方面均呈现显著差异,与脐带血相比,脐带血浓缩细胞制剂终产物中的cd45
+
和cd34
+
细胞增加倍数分别为6.6倍和6.3倍,统计学有显著差异(p《0.05)。
[0133]
试验例4:脐带血和脐带血浓缩细胞制剂样本无菌检测
[0134]
针对试验例1涉及的10个样本进行考察。使用革兰氏染色法进行无菌检测,制备脐带血、脐带血浓缩细胞制剂样本的涂片,用甲醇固定,染色后测试,结果见下表。
[0135][0136]
本发明使用pxp系统制备脐带血浓缩细胞制剂的过程具有快速、封闭、全程无菌的特点。
[0137]
试验例5:细胞水平有效性研究
[0138]
本发明使用pxp系统制备的脐带血浓缩细胞制剂是一种细胞制剂的注射液,其中含有多种干细胞成分,包括造血干细胞(hscs),间充质干细胞(mscs),内皮祖细胞(epcs),以及多种细胞因子,如血管内皮生长因子(vegf),基质细胞衍生因子(sdf-1),内皮抑素(entostatin)等,促进新血管生成和内皮细胞迁移。
[0139]
本试验例针对试验例1涉及的10个样本进行考察,通过cfu集落形成能力评价脐带血浓缩细胞制剂的干细胞生物学效力,elisa定量检测脐带血浓缩细胞制剂中富含的细胞因子。
[0140]
5.1、干细胞生物学效力—cfu集落形成实验
[0141]
干细胞生物学效力(potency assays),通过体外cfu集落形成实验,鉴定分析祖/干细胞的集落形成能力,表征脐带血浓缩细胞制剂混合细胞中的细胞干性。采用cfu-h(造血祖/干细胞),cfu-f(基质祖细胞)对脐带血和脐带血浓缩细胞制剂样本中多种干细胞的效能进行了分析,结果见下表:
[0142][0143][0144]
上述结果显示,脐带血浓缩细胞制剂集落形成能力与脐带血相比,cfu-h集落数增加了6.76倍,cfu-f集落数增加了6.96倍。结果表明,pxp系统能够有效地富集脐带血干细胞,同时维持干细胞的生物学效力。
[0145]
5.2、细胞因子定量分析
[0146]
pxp系统制备的脐带血浓缩细胞制剂注射液中含有多种细胞因子。酶联免疫吸附实验(elisa)定量检测分析脐带血和脐带血浓缩细胞制剂样品中,转化生长因子-β(tgf-β)、血管内皮生长因子(vegf)和肝细胞生长因子(hgf)水平,结果见下表。
[0147] 脐带血脐带血浓缩细胞制剂tgf-β(pg/ml)24.1
±
2.3184.2
±
17.4vegf(pg/ml)21.4
±
3.8164.7
±
13.1hgf(pg/ml)189.6
±
23.71047.2
±
41.7
[0148]
结果显示,脐带血浓缩细胞制剂中的tgf-β、vegf和hgf,显著高于脐带血中的tgf-β、vegf和hgf水平(p《0.01),表明pxp系统能够有效地浓缩富集细胞生长因子。
[0149]
试验例6:脐带血浓缩细胞制剂治疗卵巢早衰(pof)的有效性
[0150]
(1)建立pof小鼠模型
[0151]
给8周龄雌性c57bl/6小鼠腹腔注射50mg/kg/day环磷酰胺(ctx),连续腹腔注射15d,每天同一时间注射,建立卵巢早衰(pof)小鼠模型。对照组不做任何处理。pof造模完成后进行脐带血浓缩细胞制剂移植。
[0152]
(2)通过激素水平、卵泡数和生育测试等指标来评估卵巢的储备功能。
[0153]
a.激素水平
[0154]
60只8周龄雌性c57bl/6小鼠,随机分为对照组(n=20)、pof模型组(n=20)、脐带血浓缩细胞制剂治疗组(n=20)。治疗组小鼠,分别于pof建模后第1天,尾静脉注射给予脐带血浓缩细胞制剂200μl(该脐带血浓缩细胞制剂为试验例1涉及的id1号脐带血浓缩细胞制剂样本,必要时用无菌生理盐水稀释制成以cd45
+
细胞计浓度为2x10^7细胞/ml的浓度);pof模型组注射等体积生理盐水。
[0155]
经脐带血浓缩细胞制剂移植后14天和28天,每组分别取10只小鼠,眼眶采血,分离血清,-20℃保存。酶联免疫吸附试验(elisa)分析雌二醇(e2)、促卵泡素(fsh)的水平(具体方法参考相丽论文(相丽,等,人胎盘间充质干细胞移植通过降低超氧化物歧化酶1和解耦联蛋白-2的表达提高卵巢功能,中华生殖与避孕杂志,2018年02期)方法进行),结果见下表。
[0156][0157]
结果显示:与pof模型组相比,脐带血浓缩细胞制剂组小鼠血清中e2水平在28d升高,fsh水平下降,均具有显著性差异(p《0.05)。
[0158]
b.小鼠卵巢组织的卵泡计数
[0159]
脐带血浓缩细胞制剂组移植后移植后28天,每组分别取10只小鼠,处死,取小鼠左
侧卵巢组织于4%多聚甲醛固定,将固定后的组织进行系列酒精脱水,二甲苯透明,石蜡包埋,连续切片,切片厚度5um,进行he染色,显微镜下观察。
[0160]
结果显示:相比于对照组,pof模型组小鼠初级卵泡、次级卵泡和成熟卵泡数量明显减少,闭锁卵泡数量明显增加;脐带血浓缩细胞制剂组治疗后28天,各级卵泡数均有不同程度的恢复,颗粒细胞生长增加,凋亡减少,卵巢上皮细胞形态稳定,初级卵泡、次级卵泡和成熟卵泡数量明显增加,闭锁卵泡数量明显减少。脐带血浓缩细胞制剂组移植后28天各级卵泡计数,与pof组比较有显著差异,具体结果见下表。
[0161] 对照组pof模型组脐带血浓缩细胞制剂组初级卵泡27.42
±
4.5713.25
±
3.6322.86
±
5.37**次级卵泡25.24
±
3.4211.73
±
3.7919.74
±
6.61**成熟卵泡23.81
±
5.1512.81
±
4.5619.37
±
4.06**闭锁卵泡2.86
±
1.336.35
±
1.843.41
±
1.72**
[0162]
与pof模型组比较,**p《0.01。
[0163]
c.小鼠生育能力观察
[0164]
在脐带血浓缩细胞制剂组移植后第28天,将雌雄小鼠按2:1比例合笼饲养,统计小鼠的生育率,并对小鼠的产仔数进行比较,观察脐带血浓缩细胞制剂组移植对小鼠卵巢功能的修复作用,结果显示脐带血浓缩细胞制剂组与pof组比较有显著差异。小鼠产仔数比较结果如下表。
[0165][0166][0167]
根据上文结果可见,脐带血浓缩细胞制剂组移植治疗可明显改善pof小鼠受损卵巢的储备功能,卵泡数增加,雌孕激素升高,小鼠生育力得到恢复,为脐带血浓缩细胞制剂组应用于pof的临床治疗提供了实验依据。
[0168]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1