DNA依赖激酶抑制剂的应用
dna依赖激酶抑制剂的应用
技术领域
1.本发明涉及生物医药领域,具体涉及一种dna依赖激酶(dna-pk) 抑制剂能够激活细胞质dna核酸免疫信号通路cgas-sting和细胞质 rna核酸免疫信号通路rig-i-mavs,通过细胞质核酸免疫通路进行抗病毒治疗和肿瘤免疫治疗中的应用。
背景技术:
2.dna双链断裂(dna double-strand break,dsb)是一种严重的dna 损伤,如果不能够有效修复,会诱发突变,进而引起细胞死亡。非同源末端连接(non-homologous end-joining,nhej)是dna双链断裂的主要修复方式。dna依赖激酶(dna-dependent protein kinase,dna-pk)是nhej 途径的一种关键酶,dna依赖激酶可被dna双链断裂有效激活。1990年, carter首次将这种由dna激活的蛋白激酶命名为dna-pk(carter,t.,et al., a dna-activated protein kinase from hela cell nuclei.mol cell biol,1990. 10(12):p.6460-71.)。
3.dna依赖激酶抑制剂可诱导dna双链断裂灶点γh2ax的产生,降低 nhej频率。2004年,英国制药公司kudos筛选出对dna-pk的抑制剂,命名为nu7441,细胞内ic50值为14nm。nu7441(ku-57788)是一种高度有效的dna-pkcs抑制剂,nu7441抑制dna-pkcs活性。dna-pkcs 是dna修复nhej通路关键酶,因此nu7441能够降低dna修复效率,增强结肠癌对放化疗敏感性(zhao,y.,et al.,preclinical evaluation of a potentnovel dna-dependent protein kinase inhibitor nu7441.cancer res,2006. 66(10):p.5354-62.)。dna-pkcs抑制剂能够抑制细胞dna修复,肿瘤放化疗的理论是药物/射线产生dna损失导致肿瘤细胞死亡,因而dna-pkcs 抑制剂抑制dna修复能够增强肿瘤对放化疗敏感性。但dna-pkcs抑制剂对细胞质核酸介导的免疫信号通路的影响和肿瘤免疫治疗的影响未有报道。
4.先天免疫信号通路cgas-sting在抗dna病毒感染中起关键作用。环鸟嘌呤腺嘌呤合成酶(cyclic gmp-amp synthase,cgas)感知病毒dna 并通过干扰素基因刺激蛋白(stimulator of interferon genes,sting)启动有效的先天免疫反应以产生干扰素,诱导干扰素刺激基因 (interferon-stimulated genes,isgs)抑制病毒感染(sun,l.,et al.,cyclic gmp-amp synthase is a cytosolic dna sensor that activates the type i interferon pathway.science,2013.339(6121):p.786-91.)。
5.cgas-sting通路促进抗肿瘤免疫作用。cgas-sting可促使树突状细胞产生i型干扰素,激活抗原呈递细胞,进而促进cd8+t细胞发挥抗肿瘤效果(woo,s.r.,et al.,sting-dependent cytosolic dna sensing mediatesinnate immune recognition of immunogenic tumors.immunity,2014.41(5):p. 830-42)。cgas-sting免疫信号在肿瘤免疫治疗中显示出重要潜力,寻找 cgas-sting的激动剂显得尤为重要。
6.先天免疫信号通路rig-i-mavs在抗rna病毒感染中起关键作用。维甲酸诱导基因-i(retinoic acid-inducible gene-i,rig-i)感知病毒rna并启动有效的先天免疫反应以产生干扰素。rig-i募集线粒体抗病毒信号 (mitochondrial antiviral signaling,mavs)
蛋白形成朊病毒样聚集体转导 rig-i介导的抗病毒信号以诱导干扰素及isgs产生抑制病毒感染(liu,y., d.olagnier,and r.lin,host and viral modulation of rig-i-mediated antiviralimmunity.front immunol,2016.7:p.662.)。
7.现有研究有关于dna依赖激酶抑制剂影响dna损伤修复和放化疗增敏的相关报道。未见dna依赖激酶抑制剂作用细胞质dna核酸 cgas-sting和rna核酸rig-i-mavs免疫信号的报道,也未见dna依赖激酶抑制剂在病毒治疗和肿瘤免疫治疗的报道。
技术实现要素:
8.本发明的目的在于提供一种dna依赖激酶抑制剂在激活细胞质核酸免疫通路cgas-sting和rig-i-mavs的应用。
9.为实现上述目的,本发明采用技术方案为:
10.一种dna依赖激酶抑制剂的应用,dna依赖激酶抑制剂在调节激活核酸免疫信号通路中的应用。
11.所述dna依赖激酶抑制剂在调节激活细胞质dna核酸免疫信号通路 cgas-sting的蛋白表达中的应用。
12.所述dna依赖激酶抑制剂在调节激活细胞质rna核酸免疫信号通路 rig-i-mavs的蛋白表达中的应用。
13.所述dna依赖激酶抑制剂在通过调节激活细胞质dna核酸免疫信号通路cgas-sting,或,调节激活细胞质rna核酸免疫信号通路 rig-i-mavs中干扰素和/或干扰素刺激基因表达的应用。
14.所述干扰素(ifn)为ⅰ型干扰素。
15.所述dna依赖激酶抑制剂在调节激活细胞质核酸免疫信号通路用于制备治疗和/或预防dna/rna病毒感染疾病药物中的应用。
16.所述dna依赖激酶抑制剂在制备调节激活核酸免疫信号通路,诱导 ifn和/或isgs转录和表达,激活机体适应性免疫反应下的抗肿瘤毒性t细胞和树突状抗原呈递细胞,肿瘤免疫治疗和/或预防肿瘤疾病药物中的应用。
17.所述dna依赖激酶抑制剂为nu7441,其结构式为
18.本发明原理:本发明提供dna依赖激酶抑制剂在病毒治疗中的应用是通过激活抗病毒cgas-sting和rig-i-mavs通路和i型干扰素表达,因而本发明在病毒治疗中的应用对病毒种类没有特别限制。本发明提供dna 依赖激酶抑制剂在肿瘤免疫治疗中的应用是通过激活cgas-sting免疫信号通路,激活下游的抗原呈递细胞和毒性cd8+t细胞数量,进而可利用 dna依赖激酶抑制剂抑制肿瘤生长和转移,同时该抑制作用在各类肿瘤细胞中均具有,因而本发明在肿瘤免疫治疗中的应用中对肿瘤类型没有特别限制。本发明提供了dna依赖激酶抑制剂可用于治疗和/或预防肿瘤等相关疾病免疫治疗药物的应用。
19.与现有dna依赖激酶抑制剂应用范围相比,本发明具有以下有益效果:
20.(1)本发明利用dna依赖激酶抑制剂在激活细胞质核酸免疫通路 cgas-sting和rig-i-mavs的应用。dna依赖激酶抑制剂对抗dna病毒免疫通路cgas-sting和抗rna病毒免疫通路rig-i-mavs有激活作用,通过促进干扰素产生达到治疗和预防dna和rna病毒的目的。明确了dna依赖激酶抑制剂治疗病毒感染疾病的新的作用途径及其治疗机制,为dna依赖激酶抑制剂的临床抗病毒用药提供了依据。
21.(2)本发明提供的利用dna依赖激酶抑制剂在激活肿瘤微环境抗原呈递细胞和毒性cd8+t细胞的应用。本发明动物实验验证,在肿瘤小鼠患者体内,dna依赖激酶抑制剂通过激活cgas-sting免疫信号,进而激活抗原呈递细胞和毒性cd8+t细胞,抑制肿瘤的生长和转移。明确了dna 依赖激酶抑制剂在肿瘤免疫治疗中的新的作用途径及其治疗机制,为dna 依赖激酶抑制剂的肿瘤免疫治疗的临床用药提供了依据。
附图说明
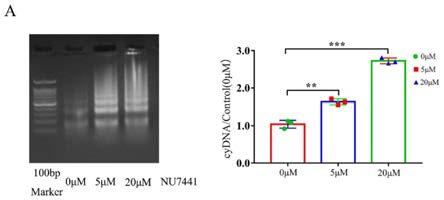
22.图1是本发明实施例提的dna依赖激酶抑制剂nu7441增加细胞质中双链dna(dsdna)含量的凝胶电泳图。人乳腺癌bt-549细胞分别在终浓度为0μm、5μm、20μm的nu7441作用48h后,检测其细胞培养液中 dsdna浓度(**p《0.01,***p《0.001)。
23.图2是本发明实施例提的dna依赖激酶抑制剂nu7441激活先天免疫中的cgas-sting通路与rig-i-mavs通路的蛋白免疫印迹图。图2a是不同浓度nu7441(0、5、20μm)处理bt-549细胞48h后,通过westernblot检测cgas、sting的蛋白水平变化的蛋白质印迹图。图2b是不同浓度nu7441(0、5、20μm)处理bt-549细胞48h后,通过western blot 检测rig-i、mavs、irf3、磷酸化的irf3、磷酸化的nfκb p65亚基的蛋白水平变化的蛋白质印迹图。
24.图3是本发明实施例提的dna依赖激酶抑制剂nu7441增强细胞干扰素(ifn)和干扰素刺激基因(isgs)转录的定量rt-pcr图。(*p《0.05, **p《0.01,***p《0.001,****p《0.0001。)
25.图4是本发明实施例提的dna依赖激酶抑制剂nu7441增强小鼠体内干扰素表达的酶联免疫吸附实验图。通过elisa检测对照组和给药组小鼠血清ifnβ浓度变化(n=5,*p《0.05)。nu7441增强小鼠体内干扰素表达。
26.图5是本发明实施例提的dna依赖激酶抑制剂nu7441增强小鼠脾脏抗原呈递细胞和毒性cd8+t细胞的免疫组化实验图。cd1a为抗原呈递细胞标记物,cd8为cd8+t细胞标记物,免疫组化实验结果显示nu7441增加小鼠脾脏抗原呈递细胞和cd8+t细胞数量。
27.图6是本发明实施例提的dna依赖激酶抑制剂nu7441抑制小鼠体内乳腺癌。在乳腺癌建模小鼠中,腹腔注射nu7441(10mg/kg)抑制原位乳腺癌增长。图6a显示对照组和nu7441处理组小鼠肿瘤体积,图6b显示对照组和nu7441处理组小鼠肿瘤的肿瘤重量和小鼠体重比值(瘤体比)。
28.图7是本发明实施例提的dna依赖激酶抑制剂nu7441抑制乳腺癌 4t1细胞肺转移的免疫组化实验图。在乳腺癌建模小鼠中,腹腔注射nu7441 (10mg/kg)显著抑制乳腺癌的肺转移。图7a褐色细胞为转移到肺部表达乳腺癌特异抗原gata-3的乳腺癌细胞,图7b中为肺组织正常细胞,图7c 为对照组和nu7441处理组乳腺癌转移率的量化柱状图。
具体实施方式
29.下面结合实施例对本发明进行详细说明,以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进,这些都属于本发明的保护范围。
30.本发明采用dna-pkcs抑制剂激活细胞质核酸介导的免疫信号通路和干扰素,进而提供dna-pkcs抑制剂在病毒治疗和肿瘤免疫治疗中的应用; dna依赖激酶抑制剂通过增强sting和干扰素,在抗病毒中的应用。dna 依赖激酶抑制剂通过激活适应性免疫抗肿瘤抗原呈递细胞和抗肿瘤毒性t 细胞,在肿瘤免疫治疗中的应用。
31.进一步,本发明通过细胞实验和动物体内实验发现dna-pkcs抑制剂能够激活cgas-sting免疫通路,激活下游干扰素的表达;通过细胞实验和动物体内实验发现dna依赖激酶抑制剂激活rig-i-mavs免疫信号和下游的干扰素表达。cgas-sting免疫通路为机体免疫系统抑制dna病毒感染的免疫信号通路,rig-i-mavs通路为机体免疫系统抑制rna病毒感染的免疫信号通路,从而dna依赖激酶抑制剂具有潜在的治疗和/或预防 dna和/或rna病毒感染等相关疾病。本发明通过动物体内实验发现 dna-pkcs抑制剂能够激活抗肿瘤抗原呈递细胞和cd8+毒性t细胞,抑制肿瘤的生长和转移,从而dna依赖激酶抑制剂具有潜在的肿瘤免疫治疗应用。
32.下述各实施例中采用的dna依赖激酶抑制剂nu7441为2004年英国制药公司kudos筛选出对dna-pk的抑制剂,nu7441(ku-57788)是一种高度有效的的dna-pkcs抑制剂,(identification of a highly potent and selective dna-dependent protein kinase(dna-pk)inhibitor(nu7441)by screening of chromenone libraries,bioorg med chem lett,2004, 20;14(24):6083-7),其结构式为
33.实施例1:dna依赖激酶抑制剂nu7441激活抗dna病毒cgas-sting 和抗rna病毒rig-i-mavs免疫通路,并增强干扰素的表达。包括如下技术手段和实验步骤:
34.1、细胞培养:
35.人乳腺癌bt-549细胞贴壁生长于含10%胎牛血清、1%青霉素链霉素溶液的rpmi-1640培养基中,于5%的二氧化碳,37℃细胞培养箱中恒温培养。
36.2、细胞质dna抽提
37.bt549细胞,离心收集细胞。用冰浴预冷的磷酸盐缓冲液轻轻重悬沉淀细胞,镜下计数细胞:2
×
107个细胞,低速离心使沉淀细胞成团。加入1ml 线粒体抽提分离液,玻璃匀桨器中混匀30次,保证细胞破碎率在 50%-60%。600g中速离心去除细胞核。高速离心去掉线粒体。上清液中加入相同体积的饱和酚:氯仿:异戊醇(25:24:1)混合溶液,小心吸取上清液加入2倍体积预冷的无水乙醇混合均匀。12000g离心收集沉淀,用 70%乙醇洗涤两次。加入30μl te缓冲液溶解dna。
38.3、琼脂糖凝胶电泳
39.使用tae缓冲液配制2%的琼脂糖凝胶:微波高温加热完全融化琼脂,室温缓慢降温至50℃左右,加入2μl溴化乙锭(eb),倒入制胶槽灌胶冷却凝固。10微升dna样品加入1微升10
×
loading buffer,振荡混匀,每孔加入10微升混匀液。电泳100v,25分钟,在紫外荧光分析仪检测。琼脂糖凝胶电泳结果显示,nu7441能够增加细胞质中游离dna含量(图 1)。
40.4、蛋白质印迹(western blot)
41.取对数生长期的bt-549细胞,加入含nu7441浓度梯度(0、5、20μm) 的培养基培养(rpmi-1640培养基)。加药48h后,收集细胞,加入细胞裂解液(50mm trishcl ph 8.0,1%np-40,150mm nacl,1mm edta),1%pmsf,1%蛋白酶抑制剂,1%磷酸酶抑制剂。冰上裂解细胞30min,每10min漩涡震荡一次,14000g,4℃离心10min,上清即细胞总蛋白,通过qubit 2.0测定蛋白质浓度。蛋白液加入上样缓冲液,沸水浴10min,用10%sds-page凝胶电泳分离。将凝胶转移到0.22μm pvdf膜上,封闭液(4%脱脂奶粉,0.05%triton x-100)封闭2h,一抗4℃过夜孵育。洗膜液(10mm tris(ph 8.0),150mm nacl,0.1%triton x100,0.01%np-40, 溶于ddh2o中)洗膜4次,每次10min,二抗室温孵育2h,洗膜液洗膜4次,每次10min。在膜上滴加适量ecl显色液,使用bio-rad凝胶成像仪曝光显影,观察结果。免疫印迹实验结果显示nu7441增强 cgas-sting和rig-i-mavs通路关键蛋白表达(图2),显示nu7441能够激活这两个抗病毒免疫通路。
42.5、定量rt-pcr
43.bt-549细胞用不同浓度nu7441(0、5、20μm)处理48h后,收集细胞于trizol中,按照trizol说明说提取rna。即细胞加入trizol后,室温静置5min,12000g离心5min,取上清至另一离心管。每毫升trizol 加入200ul氯仿,轻轻吹打混匀,室温静置15min。4℃12000g离心15 min。取上层水相至另一离心管,每毫升trizol加入0.5ml异丙醇,轻轻吹打混匀,室温放置10min。4℃12000g离心10min,弃上清,沉淀即为rna。75%乙醇(depc水配制)洗涤,4℃12000g离心5min,弃上清。室温晾干。用te buffer(depc水配制)溶解rna样品,定量rna 浓度。
44.随后按照反转录试剂盒进行反转录pcr。即加入rna模板2ug,随机引物(0.1μg/μl)1μl,无rna酶水,使三者体积相加为8μl。将三者混匀,65℃孵育5min后,冰浴2min,然后再加入其他反应组分:2
×
ts reaction mix 10μl,transscript rt/ri enzyme mix 1μl,gdna remover 1 μl,共20μl体系。将反转录体系置于25℃10min,42℃30min,85℃ 5s,即得到cdna模板。按照试剂盒说明书进行实时荧光定量pcr。如下配制pcr体系(20μl体系):tb green premix ex taq ii(tli rnaseh plus) 10μl,pcr forward primer(10μm)0.8μl,pcr reverse primer(10μm) 0.8μl,rox reference dye(50x)0.4μl,dna模板1μl,灭菌水7μl。使用两步法pcr扩增标准程序:1)95℃30s,1个循环;2)95℃5s, 60℃30s,40个循环;3)(融解曲线)95℃15s,60℃1min,95℃15 s,1个循环。分析结果。实验中各种引物序列如表1所示。
45.表1:人的引物序列
[0046][0047]
定量rt-pcr结果显示nu7441处理细胞后,细胞内干扰素和干扰素刺激基因转录增强(图3),显示nu7441能够增强干扰素和干扰素刺激基因转录。 6.balb/c雌鼠腹腔注射nu7441。
[0048]
6周龄balb/c雌鼠随机分为两组,每组7只,适应性培养2-3天,按照10mg/kg剂量腹腔注射给药,每天一次,每天称重,连续处理七天后处死,眼球取血,血液4℃过夜静置,3000rpm离心20min,取上清,离心 2-3次,-80℃冷冻保存,后续elisa检测干扰素含量。药物配方:
[0049]
溶剂组:5%dmso+30%peg300+5%tween80+60%ddh2o,
[0050]
加药组:5%dmso(含10mg/ml nu7441)+30%peg300+5%tween80+60% ddh2o。
[0051]
7.酶联免疫吸附实验(elisa)。
[0052]
取商业化检测干扰素酶标板试剂盒(江苏酶标生物科技有限公司)检测血清中干扰素浓度,设空白孔(用于调零),标准孔,待测样品孔(每个加药样品设三个复孔)。在酶标包被板上标准品孔加标准品50μl,待测血清用试剂盒提供的稀释液稀释5倍,待测样品孔加入血清稀释液40μl,再加待测样品10μl。封板膜封板,37℃温育30min,揭去封板膜,甩干液体,每孔加满洗涤液,静置30s,甩干液体,重复洗涤并拍干5次。每孔加酶标试剂50μl,空白孔除外。再次温育及洗涤。拍干后,每孔加50μl 显色剂a,再加50μl显色剂b,混匀,37℃避光10min。每孔加50μl 终止液,终止反应,以空白孔调零,450nm波长测各孔吸光度。以标准品
测得值绘制标准曲线,计算出各个孔的浓度值。在balb/c小鼠中静脉注射 nu7441后,检测血液中干扰素浓度,发现nu7441明显上调干扰素浓度(图 4)。这些结果显示dna依赖激酶抑制剂nu7441激活抗dna病毒 cgas-sting和抗rna病毒rig-i-mavs免疫通路,并增强干扰素的表达,具有潜在抗dna病毒和rna病毒的功能。
[0053]
上述商业化检测干扰素酶标板购自江苏酶标生物科技有限公司商业化试剂盒。
[0054]
实施例2:腹腔注射nu7441增加小鼠脾脏中抗原呈递细胞和毒性 cd8+t细胞含量。
[0055]
1.balb/c雌鼠腹腔注射nu7441。
[0056]
6周龄balb/c雌鼠随机分为两组,每组7只,适应性培养2-3天,按照10mg/kg剂量腹腔注射nu7441给药,每天一次,每天称重,连续处理七天后处死,取脾脏。
[0057]
2.免疫组化实验。
[0058]
腹腔注射nu7441小鼠10日后,处死小鼠,取脾脏pbs清洗后浸泡于 4%组织固定液中,将组织块摆放在石蜡包埋盒中包埋,切片机切片,烘片后用cd8(1:200)和cd1a(1:200)抗体进行免疫组化实验。实验结果显示小鼠脾脏中抗原呈递细胞(cd1a)和毒性cd8+t细胞数量明显增加(图5),显示nu7441能够在激活cgas-sting和rig-i-mavs免疫通路后,进一步通过干扰素的上调影响适应性免疫。抗原呈递细胞是肿瘤免疫治疗中具有关键免疫调节作用的免疫细胞,毒性cd8+t细胞是直接杀灭肿瘤细胞的免疫细胞。这些结果显示dna依赖激酶抑制剂nu7441具有潜在的肿瘤免疫治疗用途。
[0059]
实施例3:腹腔注射nu7441抑制小鼠肿瘤患者乳腺肿瘤的生长和肺转移。
[0060]
1.构建移植乳腺癌小鼠模型。
[0061]
在37℃含5%co2恒温培养箱中培养小鼠乳腺癌4t1细胞,使用 rpmi1640培养基(含10%胎牛血清和1%双抗)。取对数生长期的4t1 细胞培养皿,丢弃培养基;加入5-7ml无血清培养基旋转并丢弃洗涤物;加入1ml 0.25%胰蛋白酶,旋转覆盖整个平板,让胰酶在室温下平板中孵育 3min,使细胞脱落;加入2ml无血清培养基,收获细胞;1500rpm离心3 min,丢弃上清液,用适当体积无血清培养基重悬,细胞计数;细胞悬液与基质胶3:2(v/v)混合,使细胞终含量为5*106/ml;balb/c雌鼠第四乳房垫皮下注射100μl细胞混合液,每两天观察小鼠成瘤情况;3-5天后根据成瘤情况随机分为两组进行后续实验,每天称重,游标卡尺测量肿瘤大小。计算肿瘤体积,公式v=0.52*l*w2。
[0062]
2.移植4t1乳腺癌小鼠腹腔注射nu7441。
[0063]
小鼠种瘤10天后按照10mg/kg剂量腹腔注射nu7441,每天一次,连续处理10天后处死取材,(肿瘤组织取出后称重、拍照留存)。取肺部组织, pbs清洗除去血液和筋膜,浸泡于4%组织固定液中制石蜡切片并用免疫组化检测肺部转移情况。
[0064]
3.免疫组化实验
[0065]
小鼠肺组织块放在乙醇中脱水,摆放在石蜡包埋盒中包埋,切片机切片,石蜡切片,石蜡切片放入60℃的烘箱2h烤片,二甲苯中浸泡脱蜡,梯度乙醇中复水,ddh2o和pbs中冲洗,封闭液封闭片子,用gata-3抗体(1:200)室温孵育1h,pbs冲洗,hrp标记二抗室温孵育1h,pbs冲洗,显色剂显色3分钟,ddh2o充分冲洗,脱水,封片。
[0066]
在balb/c小鼠乳垫中移入小鼠乳腺癌细胞4t1,待肿瘤形成,腹腔注射 dna依赖激酶抑制剂nu7441(10mg/kg),每日一次,连续7日,检查乳腺处肿瘤组织和肿瘤肺部转移,发现静脉注射dna依赖激酶抑制剂nu7441 能够抑制乳腺肿瘤原位生长,并明显抑制乳腺肿瘤
的肺部转移(图6,7)。
[0067]
根据实施例1发现,dna-pk抑制剂nu7441能够增加细胞质的短链 dna的产生(图1),并增强了细胞质核酸免疫信号cgas-sting通路与 rig-i-mavs通路的关键蛋白的表达(图2)。
[0068]
根据实施例1,可得出,nu7441能够激活先天免疫通路cgas-sting 通路与rig-i-mavs通路(图2a、b)。
[0069]
实施例1证明了nu7441能够激活细胞和小鼠体内上述两条通路下游的ifnβ以及isgs(图3、4)。因此,本发明发现,nu7441——dna-pk 的抑制剂,能够在抑制nhej的过程中,产生额外的生物学作用,它可以通过增加胞质dna激活胞质核酸感受器cgas与rig-i,诱导干扰素及isgs 的表达,进而激活机体免疫反应以达到抗病毒的作用。
[0070]
根据实施例2发现,dna-pk抑制剂nu7441能够增加小鼠脾脏中抗原呈递细胞和毒性cd8+t细胞数量(图5)。
[0071]
根据实施例2,证明了nu7441激活先天免疫通路cgas-sting通路与rig-i-mavs通路后,可进一步通过干扰素通路激活适应性免疫中抗原呈递细胞和毒性cd8+t细胞。因此,本发明发现,nu7441——dna-pk 的抑制剂,能够在抑制nhej的过程中,产生额外的生物学作用,它可以通过增加胞质dna激活胞质核酸感受器cgas与rig-i,诱导干扰素,并进一步激活机体适应性免疫,增加脾脏中抗原呈递细胞和毒性cd8+t细胞含量。
[0072]
根据实施例3,发现,dna-pk抑制剂nu7441能够抑制乳腺肿瘤的原位生长,并显著抑制乳腺肿瘤的肺转移(图6、7)。
[0073]
根据实施例3,证明了nu7441激活先天免疫通路cgas-sting通路与rig-i-mavs通路后,进一步通过干扰素通路激活适应性免疫中抗原呈递细胞和毒性cd8+t细胞,这些结论能够应用于肿瘤的免疫治疗中, nu7441单剂能够应用于乳腺肿瘤的免疫治疗。因此,本发明发现, nu7441——dna-pk的抑制剂,能够在抑制nhej的过程中,产生额外的生物学作用,它可以通过增加胞质dna激活胞质核酸感受器cgas与 rig-i,诱导干扰素,并进一步激活机体适应性免疫,增加脾脏中抗原呈递细胞和毒性cd8+t细胞含量,并能够应用于乳腺肿瘤的免疫治疗,在小鼠体内抑制乳腺肿瘤的原位生长和肺转移。
[0074]
根据实施例1和2,dna-pk抑制剂nu7441对先天免疫cgas-sting、 rig-i-mavs和干扰素的促进作用,对适应性免疫中抗原呈递细胞和毒性t 细胞的增强,不依赖于肿瘤的类型。因此,对实施例3中,nu7441通过免疫治疗方式抑制乳腺肿瘤的生长和转移,此结论为实验所用肿瘤细胞为乳腺肿瘤细胞,但nu7441通过免疫方式抑制肿瘤的生长和转移应为泛肿瘤,而不限制于实验中选取的乳腺肿瘤。
[0075]
综上所述,本发明发现:(1)所述药物为增加细胞外dna的含量的药物;(2)所述药物为增加细胞质中dna的含量的药物;(3)所述药物为增强cgas-sting通路与rig-i-mavs通路蛋白表达的药物;(4)所述药物为增强i型干扰素及干扰素刺激基因转录的药物。(5)所述药物为增加适应性免疫抗原呈递细胞和毒性t细胞药物。(6)所述药物为肿瘤免疫治疗药物。本发明的这些结果,首次发现了nu7441能够通过增加胞质dna含量激活先天免疫通路。本发明开拓了dna修复蛋白dna-pk抑制剂 nu7441的新用途,nu7441可以通过增加细胞质中dna的含量激活先天免疫通路cgas-sting以及rig-i-mavs通路的蛋白表达,进而诱导i型干扰素及干扰素刺激基因转录,激活机体的免疫反应,从而起到抗病毒的作用。为病毒感染的
治疗提供了新的策略。并且本发明发现了dna修复蛋白dna-pk抑制剂nu7441的能够激活抗原呈递细胞和毒性cd8+t细胞,抑制肿瘤生长和转移,开拓了dna-pk抑制剂在肿瘤免疫治疗中的新的作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1