一种海藻酸锶纳米微球及其制备方法和应用
一种海藻酸锶纳米微球及其制备方法和应用
1.技术领域
2.本发明属于生物医用材料开发,特别是涉及一种海藻酸锶纳米微球及其制备方法与应用。
3.
背景技术:
4.海藻酸盐是一种由β-d-甘露糖醛酸与α-l-古罗糖醛酸通过1,4-糖苷键连接而成的一类多糖物质,因具有独特的理化性质、良好的生物相容性及可降解性,从而被广泛运用于生物医药领域。海藻酸盐最重要的特性是它能够选择性结合二价阳离子,形成水凝胶或高分子交联支架。钙离子是最常见的阳离子交联剂,其能与海藻酸盐长链分子中的古罗糖醛酸片段交联螯合固化,通过该原理即可在不同条件下制备出纳米或微米级的粒子、胶囊、纤维、水凝胶或支架等。
5.锶是一种人体内的微量元素,它可以提高间充质干细胞内转录因子runx2的表达、促进其向成骨细胞的分化。在促进成骨细胞骨基质蛋白生成的同时,抑制破骨细胞的分化。与钙离子类似,锶离子同样可以激活胞膜上的钙敏感受体(casr),但时效晚于钙离子数小时。研究证明,锶离子结合casr后对于erk1/2的延迟激活效应相较钙离子的即刻作用对于成骨细胞的增殖更为重要。
6.目前,以海藻酸盐-钙离子交联原理为基础,已经衍生出多种不同剂型的海藻酸多聚高分子材料,而锶离子具有较钙离子更强的螯合能力,且在骨组织工程方面拥有优异的促成骨、抗破骨的特性,因此本发明将锶与海藻酸盐相结合,望开发出一类新型海藻酸锶纳米微球,其中锶除了内在促成骨潜力,还可起到交联海藻酸盐的作用,并且避免了传统乳化交联法中有毒交联剂,如戊二醛的使用。同时,海藻酸盐微球可作为药物递送系统,且符合一定粒径大小时,可以与细胞发生相互作用。相关研究报导,粒径在1微米左右的海藻酸盐微球可包封血管内皮生长因子,并将其递送至间充质细胞内、促进细胞的成骨分化。
7.目前微球制备的难点主要有成分交联不均、毒害制剂的使用、微球粒径的控制以及冻干过程对纳米级微球结构的破坏等。
8.
技术实现要素:
9.解决的技术问题:本发明针对现有目前微球制备过程繁杂、粒径过大以及直接冻干导致的纳米微球相互聚集最终难以复溶等问题,提供一种海藻酸锶纳米微球及其制备方法和应用。
10.技术方案:一种海藻酸锶纳米微球的制备方法,步骤为:(a)用超纯水溶解可溶性海藻酸钠制备海藻酸钠水溶液,浓度范围0.1~10 mg/ml;用超纯水溶解六水氯化锶制备氯化锶水溶液,浓度范围0.1-0.4mol/l;(b)将配制好的海藻酸钠水溶液逐滴滴加到油相中,
以600-700rpm的转速搅拌5-6h形成初乳;所述海藻酸钠水溶液与油相的体积比为1:(2~8),所述油相为span80的液体石蜡溶液,span80的体积浓度为1%;(c)将氯化锶水溶液逐滴滴加到步骤(b)形成的初乳中,连续搅拌不少于12h得混悬液;所述氯化锶水溶液与海藻酸钠水溶液体积比为1:(5~20);(d)将步骤(c)中得到的混悬液离心,去除上层液体,沉淀物依次用异丙醇、超纯水洗涤3次,重悬于超纯水中得到浓度为1mg/ml的粒子混悬液,取1ml粒子混悬液加入3ml浓度为10mg/ml的冻干保护剂,进行真空冷冻干燥,即可得到白色的海藻酸锶纳米微球固体。
11.优选的,步骤(a)中海藻酸钠水溶液的浓度为0.6 mg/ml,氯化锶水溶液的摩尔浓度为0.1mol/l。
12.优选的,步骤(b)中海藻酸钠水溶液与油相的体积比为1:2、1:4或1:8。
13.优选的,步骤(c)中氯化锶水溶液与海藻酸钠水溶液的体积比为1:10。
14.优选的,上述冻干保护剂为海藻糖、葡萄糖或麦芽糊精的超纯水溶液,浓度为10mg/ml。
15.上述制备方法制得的海藻酸锶纳米微球。
16.上述海藻酸锶纳米微球在制备创伤愈合、骨缺损材料或药物载体中的应用。
17.有益效果:本发明的有益效果在于:本发明提供了采用反相微乳法制备的一种新型海藻酸锶纳米微球材料,所述材料具有良好的生物相容性,且粒径均一,达到纳米级别,并且通过添加合适的冻干保护剂,克服了纳米级微粒材料在真空、低温等冻干条件下会聚集、无法重新分散的难点。其次,该海藻酸锶纳米微球材料制备条件简便,不含有毒化学成分,其组成成分之一的锶离子更具有促进成骨的功能。该微球的纳米级粒径使细胞可能通过胞吞方式将粒子内化入细胞,使该微球发挥载药功能。
18.附图说明
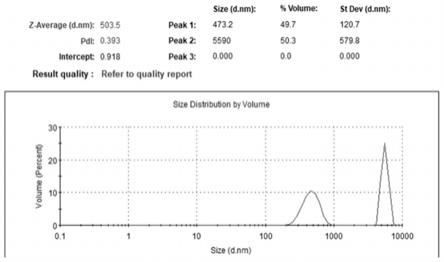
19.图1为实施例1制得的海藻酸锶微球动态光散射粒径分布图;图2为实施例2制得的海藻酸锶微球动态光散射粒径分布图;图3为实施例3制得的海藻酸锶微球动态光散射粒径分布图;图4为实施例1制得的海藻酸锶微球放大40000倍和100000倍的透射电镜照片;图5为实施例4制得的海藻酸锶微球经过冻干获得的白色固体;图6为实施例4制得的海藻酸锶微球经过冻干后的复溶效果图;图7为实施例1、2、3制备得的海藻酸锶微球对mc3t3-e1细胞增殖的影响。
20.具体实施方式
21.下面的实施例可使本专业技术人员更全面地理解本发明,但不以任何方式限制本发明。
22.实施例1(a)取0.06g可溶性海藻酸钠粉末加入100ml超纯水中完全溶解制备成浓度为0.6mg/ml的海藻酸钠水溶液;取0.2666g六水氯化锶粉末加入10ml超纯水中完全溶解制备
成0.1mol/l的氯化锶水溶液;(b)取15ml配制好的海藻酸钠水溶液均匀地逐滴滴加到30ml油相(液体石蜡和体积分数为1% v/v span80的混合溶液)中,以600-700rpm的转速搅拌5-6h形成初乳;(c)取1.5ml氯化锶水溶液均匀地逐滴滴加到步骤(b)形成的初乳中,过夜搅拌,充分乳化、进行固化交联;(d)将步骤(c)中得到的混悬液以10000~12000rpm速度离心5~8min,去除上层液体,沉淀物依次用异丙醇、超纯水充分洗涤3次,离心去除上层洗涤液,将所得沉淀重悬于3ml超纯水中。
23.实施例2(a)取0.06g可溶性海藻酸钠粉末加入100ml超纯水中完全溶解制备成浓度为0.6mg/ml的海藻酸钠水溶液;取0.2666g六水氯化锶粉末加入10ml超纯水中完全溶解制备成0.1mol/l的氯化锶水溶液;(b)取9ml配制好的海藻酸钠水溶液均匀地逐滴滴加到36ml油相(液体石蜡和体积分数为1% v/v span80的混合溶液)中,以600-700rpm的转速搅拌5-6h形成初乳;(c)取0.9ml氯化锶水溶液均匀地逐滴滴加到步骤(b)形成的初乳中,过夜搅拌,充分乳化、进行固化交联;(d)将步骤(c)中得到的混悬液以10000~12000rpm速度离心5~8min,去除上层液体,沉淀物依次用异丙醇、超纯水充分洗涤3次,离心去除上层洗涤液,将所得沉淀重悬于3ml超纯水中。
24.实施例3(a)取0.06g可溶性海藻酸钠粉末加入100ml超纯水中完全溶解制备成浓度为0.6mg/ml的海藻酸钠水溶液;取0.2666g六水氯化锶粉末加入10ml超纯水中完全溶解制备成0.1mol/l的氯化锶水溶液;(b)取5ml配制好的海藻酸钠水溶液均匀地逐滴滴加到40ml油相(液体石蜡和体积分数为1% v/v span80的混合溶液)中,以600-700rpm的转速搅拌5-6h形成初乳;(c)取0.5ml氯化锶水溶液均匀地逐滴滴加到步骤(b)形成的初乳中,过夜搅拌,充分乳化、进行固化交联;(d)将步骤(c)中得到的混悬液以10000~12000rpm速度离心5~8min,去除上层液体,沉淀物依次用异丙醇、超纯水充分洗涤3次,离心去除上层洗涤液,将所得沉淀重悬于3ml超纯水中。
25.将实施例1、实施例2及本实施例制得的海藻酸锶微球混悬液分别进行动态光散射测试,所得结果如图1、2、3所示。从图1~3可以看出,控制其他条件不变,随着海藻酸钠水溶液体积:油相体积的比值减小(1:2至1:8),海藻酸锶微球的粒径不断减小,实施例1中含量49.7%的微球平均粒径为473.2
±
120.7nm,实施例2中100%的微球平均粒径落在268.2
±
33.42nm范围内,而实施3中100%的微球平均粒径为128.6
±
16.01nm。
26.对实施例1中制得的海藻酸锶纳米微球超纯水混悬液进行透射电镜拍摄,如图4所示,微球粒径约分布在200-500nm范围间。
27.实施例4(a)取0.06g可溶性海藻酸钠粉末加入100ml超纯水中完全溶解制备成浓度为
0.6mg/ml的海藻酸钠水溶液;取0.2666g六水氯化锶粉末加入10ml超纯水中完全溶解制备成0.1mol/l的氯化锶水溶液;(b)取10ml配制好的海藻酸钠水溶液均匀地逐滴滴加到80ml油相(液体石蜡和体积分数为1% v/v span80的混合溶液)中(水相:油相=1:8),以600-700rpm的转速搅拌5-6h形成初乳;(c)取1ml氯化锶水溶液均匀地逐滴滴加到步骤(b)形成的初乳中,过夜搅拌,充分乳化、进行固化交联;(d)将步骤(c)中得到的混悬液以10000~12000rpm速度离心5~8min,去除上层液体,沉淀物依次用异丙醇、超纯水充分洗涤3次,离心去除上层洗涤液,将所得沉淀重悬于3ml超纯水中。混合均匀后,各取1ml海藻酸锶微球混悬液,分别加入3ml质量体积分数为1%w/v的海藻糖、葡萄糖、麦芽糊精超纯水溶液并混匀,于-80℃冰箱预冻,24h后进行真空冷冻干燥(-50℃,0.09~0.1mbar,8~12h),将最终得到的白色海藻酸锶纳米微球固体(如图5所示)重新溶于1ml超纯水中,可以成功复溶。洗涤离心去上清后,加超纯水重悬如图6所示,三组微球的复溶效果差异不大,均无出现大量聚集性不溶固体沉淀。
28.实施例5按照实施例1、2、3的方法制备得海藻酸锶纳米微球,配制成等密度(≈1g/ml)的超纯水混悬液,通过cck8法对空白对照组、按照实施例1制得的海藻酸锶纳米微球(组a)、按照实施例2制得的海藻酸锶纳米微球(组b)及按照实施例3制得的海藻酸锶纳米微球(组c)进行细胞活性检测。本实验用的细胞为小鼠胚胎成骨细胞前体细胞(mc3t3-e1细胞)。细胞培养基为含10%的胎牛血清和1%的双抗(青霉素和链霉素的混合液)的αmem培养基,细胞培养箱条件为37℃,co2浓度为5%。
29.调整mc3t3-e1细胞密度为3
×
104个/孔,将细胞接种至12孔板内与海藻酸锶纳米微球共培养,每孔1ml细胞培养液(90%αmem完全培养基+10%海藻酸锶纳米微球混悬液),每组3个复孔。于共培养1d, 3d, 5d后,每孔按照1:10比例加入cck8试剂,微震荡后置于培养箱内,1.5h后吸取各孔液体至96孔板内,于450nm波长处检测光密度值,平行3副孔,重复3次取各组平均值;以空白对照组细胞活性的80%作为有无细胞毒性的分界,结果如图7所示,各组材料均无明显细胞毒性,具有良好的生物相容性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1