一种盐酸昂丹司琼注射液及其制备方法与流程
1.本发明属于药品注射液领域,具体涉及一种盐酸昂丹司琼注射液及其制备方法。
背景技术:
2.盐酸昂丹司琼注射液是一种透明、无色、无热原、无菌的静脉或肌肉注射溶液,是一种5-ht3受体拮抗剂,用于预防与最初的和重复的癌症化疗有关的恶心和呕吐及术后恶心和/或呕吐。
3.现有技术中盐酸昂丹司琼注射液制备方法较多,但都存在一定的问题,例如:
4.现有技术中申请号cn201811567020.1,发明名称:盐酸昂丹司琼和地塞米松的组合物及其制备方法,含有盐酸昂丹司琼、地塞米松、丙二醇、磷酸盐缓冲液和注射用水,它是由如下所述步骤制备而成:(1)在配料罐中加入注射用水,加热后加入盐酸昂丹司琼、地塞米松、丙二醇和磷酸盐缓冲液,搅拌使其溶解; (2)在配料罐中加入盐酸溶液或氢氧化钠溶液以调节ph至6.5-7.5范围内;(3) 在配料罐中加入注射用活性炭,搅拌、回滤后经钛棒过滤器,得到注射液;(4) 将注射液除菌过滤,灌装入玻璃瓶中,封口,进行热压灭菌,得到盐酸昂丹司琼注射液。
5.cn201811567020.1存在以下缺陷:(1)处方中含有丙二醇,可能对血管造成强烈刺激性;(2)制备方法较复杂:该方法需要酸碱调节剂调ph值,制备过程中用了盐酸溶液或氢氧化钠溶液剂调ph值,才能使制得的注射液ph值达到药典规定的范围内;需要加入活性炭过滤,然后经钛棒过滤,才能得到注射液,活性炭作为注射剂中常用吸附剂,起到了相应的除杂、吸附热原作用,但同时,活性炭原材料与生产工艺的多样性、活化机理的不确定性、质量控制的局限性,以及由此而导致引入杂质和不溶性微粒的可能性,都会给活性炭在注射剂中的应用带来风险。国家药品监督管理局颁布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求》中提到为了有效控制热原(细菌内毒素),需加强对原辅包、生产过程等的控制,注射剂生产中建议不使用活性炭;灌装封口后的注射液需进行200-250℃20-30min热压灭菌得到注射液,灭菌温度高,时间长。
6.现有技术中申请号cn201610225573.3,发明名称:盐酸昂丹司琼注射液组合物和制法,含有盐酸昂丹司琼和注射用水,它是由如下所述步骤制备而成:(1) 取处方量的盐酸昂丹司琼原料药,加至适量的注射用水中,搅拌使药物溶解;(2) 向步骤(1)所得溶液中以药液体积计加入0.05~0.2%的针用活性炭,同时添加纸浆,纸浆添加量以纸的干重计为活性炭的40~60%;混合均匀,接着用酸碱调节剂调节药液的ph在6.5~7.5范围内,在室温下搅拌药液30~60分钟;(3) 将步骤(2)所得混合液过滤脱炭,用酸碱调节剂调节药液的ph在3.2~3.75范围内,补加注射用水至处方全量,用酸碱调节剂调节药液的ph在3.25~3.75范围内;所述混合液过滤脱炭是照如下方式操作的:先用滤纸过滤,接着用孔径为 1μm的钛棒过滤,再用0.45μm的聚醚砜滤芯将药液粗滤;(4)将步骤(3)配制的药液除菌过滤,灌装入玻璃瓶中,封口,进行热压灭菌,即得。
7.但cn201610225573.3存在以下缺陷:(1)搅拌时间较长:搅拌溶解过程是在室温下
进行,温度较低,原料溶解难度加大,导致溶解时间延长,产品均一性难以保证;(2)该方法较复杂:a.需要使用酸碱调节剂调ph值:制备过程中使用了两次酸碱调节剂调ph值,才能使该方法制备的注射液ph值达到药典规定范围内;b.需要经过过滤脱碳:先用滤纸过滤,接着用孔径为1μm的钛棒过滤,再用0.45μm的聚醚砜滤芯将药液粗滤,再进行除菌过滤,生产工艺复杂、成本较高,且注射液生产中不建议使用活性炭;c.灌装封口的注射液需经过121℃ 30min热压灭菌,灭菌时间相对较长。
8.现有技术中申请号cn201811561191.3,发明名称:复方盐酸昂丹司琼注射液及其制备方法,含有盐酸昂丹司琼、甘露醇和注射用水,它是由如下所述步骤制备而成:(1)将盐酸昂丹司琼和甘露醇加入配料罐中,加入注射用水;(2) 加入盐酸溶液或氢氧化钠溶液调节ph至4.4-4.5;(3)加入注射用活性炭,依次经过第一次加热搅拌和第二次加热搅拌,得到混合液;其中,第一次加热搅拌的条件包括:温度为30-45℃,时间为10-20min;第二次加热搅拌的条件包括:温度为40-55℃,时间为3-8min;(4)将混合液经微孔滤膜过滤至无菌室中,分装后进行冷冻干燥,随后进行热压灭菌,得到复方盐酸昂丹司琼注射液。
9.但cn201811561191.3存在以下缺陷:(1)需要使用酸碱调节剂调ph值:制备过程中用了盐酸溶液或氢氧化钠溶液调节ph值,才能使制得的注射液ph 值达到药典规定的范围内;(2)此方法较复杂:a.需要先进行冷冻干燥,再进行热压灭菌得到注射液,增加了工艺步骤及工艺关键参数,提高风险的同时增加了生产成本;b.需要加入活性炭加热搅拌两次;c.热压灭菌温度200-250℃过高,耗能较大,导致生产成本过高。
10.为了解决现有技术的不足,本发明提供一种安全、有效、稳定、简便的具有优良药学性质的盐酸昂丹司琼注射液的制备方法,该方法将药液经过两级过滤,过滤后的药液ph稳定在标准要求范围内,且无需用盐酸或氢氧化钠进行调节,且药液澄清,含量均匀稳定,对于制药领域注射剂生产效率、质量起着关键作用。
技术实现要素:
11.本发明的目的是提供一种盐酸昂丹司琼注射液的配方。
12.本发明的另一目的是提供一种盐酸昂丹司琼注射液的制备方法。
13.本发明所述的盐酸昂丹司琼注射液由以下配方组成,盐酸昂丹司琼1~3mg,氯化钠为8~10mg,一水枸橼酸0.3~0.7mg,二水枸橼酸钠0.20~0.30mg,注射用水0.5~1.5ml。
14.优选的,本发明所述的盐酸昂丹司琼注射液由以下配方组成,盐酸昂丹司琼 2.49mg,氯化钠为9.0mg,一水枸橼酸0.5mg,二水枸橼酸钠0.25mg,注射用水1.0ml。
15.本发明所述注射液的制备方法包括以下步骤:
16.1)在预溶罐中加入配制量5%~20%的注射用水,调整水温,加入处方量的氯化钠、一水枸橼酸和二水枸橼酸钠,混合直至溶解;
17.2)在预溶罐中加入配制量5%~20%的注射用水,调整水温,加入处方量的盐酸昂丹司琼,混合至溶解;
18.3)将溶解的辅料和原料在配料罐中混匀,再加入注射用水至处方全量,搅拌;
19.4)在氮气压力不低于0.2mpa下,将药液通过两级0.22μm的过滤器过滤灌装至玻璃小瓶中,压塞,轧盖,采用115℃~128℃10~20min条件湿热灭菌即得。
20.优选的,前述步骤1)所述的水温为40℃~80℃。
21.更优选的,前述步骤1)所述的水温为60℃。
22.优选的,前述步骤2)所述的水温为40℃~80℃。
23.更优选的,前述步骤2)所述的水温为60℃。
24.前述步骤3)搅拌时间为10分钟~30分钟。
25.优选的,前述步骤3)搅拌20分钟。
26.前述步骤4)采用121℃15min条件湿热灭菌即得。
27.本发明优选过滤滤芯为聚偏二氟乙烯材质,药液经二级过滤。
28.有益效果:
29.1.本发明与现有技术相比,具有以下有益效果:
30.本发明药液经过两级过滤,过滤后的药液ph稳定在标准要求范围内,无需用盐酸或氢氧化钠进行调节,且药液澄清,含量均匀稳定。
31.2.通过盐酸昂丹司琼原料药的溶解特性和粒度的研究、溶媒温度对溶解时间的影响研究以及原料和辅料的加料顺序与保留时间的影响研究,大量的研究试验后优选出该生产工艺,分别预溶原辅料后再进行混合,水温只需控制在40-80℃,搅拌时间10-30分钟即可实现溶液均匀性,且该处方工艺无需额外使用酸碱调节剂调节ph至药典标准要求。
32.3.通过过滤研究,经过大量试验验证了0.22μm(pvdf)的滤膜过滤后对盐酸昂丹司琼注射液的质量无影响,且在生产中采用的是两级过滤,更大程度的保证了杂质的去除。该工艺无需加入活性炭除杂、除热源,规避了活性炭无法去除完全或引入杂质或增加不溶性微粒的风险,同时减少了生产工艺步骤,降低了生产成本。
33.4.通过对灭菌条件的研究,经过大量试验证明121℃15min热压灭菌条件下, f0≥12min,且盐酸昂丹司琼注射液的质量未发生改变。该灭菌条件不仅提高了无菌保障和产品质量的稳定性,而且大大降低了生产能耗,节约生产成本。
34.5.本发明将盐酸昂丹司琼注射液放置于60℃稳定性考察箱中,在0月、1月、 2月、3月、6月取样,照usp中昂丹司琼注射液中性状、含量、色谱纯度、有关物质d、ph项下规定进行检测。不同条件组合注射液活性成分昂丹司琼含量均在其标示量的95.0%-105.0%范围内,有关物质d的含量均小于0.12%,其他单杂均小于0.2%,总杂小于0.5%,ph均在3.3-4.0范围内,各项检测结果均符合usp 的标准要求,且加速6个月的数据之间无明显差异,表明全部注射液均具有优异的稳定性。
附图说明
35.图1昂丹司琼注射液稳定性0月有关物质d检测-稀释剂
36.图2昂丹司琼注射液稳定性0月有关物质d检测-对照品溶液
37.图3昂丹司琼注射液稳定性0月有关物质d检测-分离度溶液
38.图4昂丹司琼注射液稳定性0月有关物质d检测-样品溶液
39.图5昂丹司琼注射液稳定性0月含量及色谱纯度检测-稀释剂
40.图6昂丹司琼注射液稳定性0月含量及色谱纯度检测-对照品溶液
41.图7昂丹司琼注射液稳定性0月含量及色谱纯度检测-分离度溶液-1
42.图8昂丹司琼注射液稳定性0月含量及色谱纯度检测-分离度溶液-2
43.图9昂丹司琼注射液稳定性0月含量及色谱纯度检测-样品溶液
具体实施方式
44.下面通过具体实施例,对本发明的技术方案作进一步地具体说明。
45.实施例1
46.配方:盐酸昂丹司琼2.49mg,氯化钠为9.0mg,一水枸橼酸0.5mg,二水枸橼酸钠0.25mg,注射用水1.0ml。
47.实施例2
48.配方:盐酸昂丹司琼1mg,氯化钠为8mg,一水枸橼酸0.3mg,二水枸橼酸钠 0.20mg,注射用水0.5ml。
49.实施例3
50.配方:昂丹司琼3mg,氯化钠为10mg,一水枸橼酸0.7mg,二水枸橼酸钠0.30mg,注射用水1.5ml。
51.实施例1-3按以下实施例任一制备方法制成
52.实施例4
53.1)在预溶罐中加入配制量10%的注射用水,水温为60℃,加入处方量的氯化钠、一水枸橼酸和二水枸橼酸钠,混合直至溶解;
54.2)在预溶罐中加入配制量10%的注射用水,水温为60℃,加入处方量的盐酸昂丹司琼,混合至溶解;
55.3)将溶解的辅料和原料在配料罐中混匀,再加入注射用水至处方全量,搅拌20分钟;
56.4)在氮气压力不低于0.2mpa下,将药液通过两个0.22μm的过滤器过滤灌装至玻璃小瓶中,压塞,轧盖,采用121℃15min条件湿热灭菌即得。
57.实施例5
58.1)在预溶罐中加入配制量5%的注射用水,水温为80℃,加入处方量的氯化钠、一水枸橼酸和二水枸橼酸钠,混合直至溶解;
59.2)在预溶罐中加入配制量5%的注射用水,水温为80℃,加入处方量的盐酸昂丹司琼,混合至溶解;
60.3)将溶解的辅料和原料在配料罐中混匀,再加入注射用水至处方全量,搅拌30分钟;
61.4)在氮气压力不低于0.2mpa下,将药液通过两个0.22μm的过滤器过滤灌装至玻璃小瓶中,压塞,轧盖,采用121℃15min条件湿热灭菌即得。
62.实施例6
63.1)在预溶罐中加入配制量20%的注射用水,水温为40℃,加入处方量的氯化钠、一水枸橼酸和二水枸橼酸钠,混合直至溶解;
64.2)在预溶罐中加入配制量20%的注射用水,水温为40℃,加入处方量的盐酸昂丹司琼,混合至溶解;
65.3)将溶解的辅料和原料在配料罐中混匀,再加入注射用水至处方全量,搅拌10分钟;
66.4)在氮气压力不低于0.2mpa下,将药液通过两个0.22μm的过滤器过滤灌装至玻璃小瓶中,压塞,轧盖,采用121℃15min条件湿热灭菌即得。
67.为了进一步验证本发明的可行性,发明人进行了以下实验,具体如下:
68.实验例1:配方及制备方法来源说明:
69.昂丹司琼注射液,usp的参比制剂(rld)是zofran,美国最初批准的时间:1991年,但zofran现在已经停止生产或销售,zofran说明书明确记载了处方组成,在2ml的单剂量瓶中每1ml水溶液中含有2mg的无水昂丹司琼,9mg的氯化钠,0.5mg一水枸橼酸和0.25mg二水枸橼酸钠;ph为3.3-4.0。申请人应用qbd的理念来研发生产工艺,以确保昂丹司琼注射液的安全性、有效性和质量可控。
70.在整个研发过程中,通过风险评估来确定处方和工艺中潜在的高风险变量,进而确定需要进行哪些研究以增加我们对处方工艺的了解。相应的风险随着我们对产品和工艺的理解与研究不断提高而降低。对于每一个单元操作,均进行风险评估,对识别出的高风险变量进行研究,以确定关键物料属性(cmas)和关键工艺参数(cpps)。因此本发明通过大量的试验,优选出符合质量标准且工艺简单易控的昂丹司琼注射液的制备方法,具体为:
71.1)发明人进行了盐酸昂丹司琼原料药的溶解特性和粒度的研究、溶媒温度对溶解时间的影响研究以及原料和辅料的加料顺序与保留时间的影响研究,大量的研究试验后优选出该生产工艺,分别预溶原辅料后再进行混合,水温只需控制在40-80℃,搅拌时间10-30分钟即可实现溶液均匀性,且该处方工艺无需额外使用酸碱调节剂调节ph至药典标准要求。
72.2)发明人进行了过滤研究,经过大量试验验证了0.22μm(pvdf)的滤膜过滤后对盐酸昂丹司琼注射液的质量无影响,且在生产中采用的是两级过滤,更大程度的保证了杂质的去除。该工艺无需加入活性炭除杂、除热源,规避了活性炭无法去除完全或引入杂质或增加不溶性微粒的风险,同时减少了生产工艺步骤,降低了生产成本。
73.3)发明人进行了灭菌条件的研究,经过大量试验证明121℃15min热压灭菌条件下,f0≥12min,且盐酸昂丹司琼注射液的质量未发生改变。该灭菌条件不仅提高了无菌保障和产品质量的稳定性,而且大大降低了生产能耗,节约生产成本。
74.实验例2工艺筛选试验
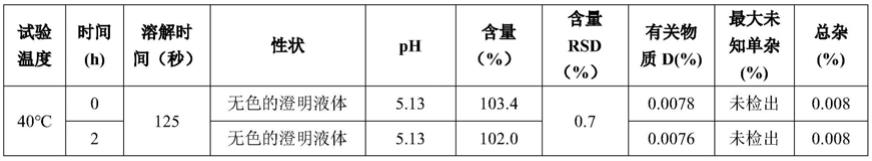
75.1.材料与方法见表1及表2
76.表1仪器及厂家
77.仪器厂家型号电子天平mettler toledoxpe205ph计mettler toledofe20hplcwaterse2695hplcagilent1260
78.表2原辅料来源
79.物料名称生产厂家盐酸昂丹司琼中国台湾神隆股份有限公司氯化钠merck kgaa枸橼酸merck kgaa枸橼酸钠merck kgaa注射用水自制
氮气自制
80.2.溶媒温度对昂丹司琼溶解时间的影响
81.按处方量称取盐酸昂丹司琼在不同温度(40℃,60℃,和80℃)下进行溶解的试验,并放置不同的时间,对溶液的稳定性进行考察,测定其性状、ph、含量、有关物质,结果见表3。
82.表3溶媒温度对昂丹司琼溶解时间的影响结果
[0083][0084][0085]
通过表3可知,盐酸昂丹司琼的溶解性:温度越高,溶解速度越快;性状、 ph、含量、有关物质在40℃、60℃、80℃均无明显变化,有关物质d在80℃时随时间的延长略有增加,说明在40℃-60℃原料能较快溶解,有关物质d也无明显增加,本发明优选温度为60℃。
[0086]
3.搅拌时间筛选实验
[0087]
为确定配料药液的搅拌均匀性,在配料定容完毕后,在搅拌15分钟、20分钟、25分钟取样检测ph值和含量。结果见表4。
[0088]
表4搅拌时间筛选实验结果
[0089]
[0090]
通过以上数据统计可以得出,搅拌15分钟、20分钟、25分钟后所有检测指标均符合规定,本发明优选搅拌时间为20分钟。
[0091]
4.过滤研究
[0092]
用0.22μm(pvdf)的滤膜过滤药液,对药液稳定性进行考察,测定药液过滤前后性状、ph、含量、有关物质,结果见表5。
[0093]
表5过滤研究结果
[0094][0095]
性状、ph、含量、有关物质均无变化。说明聚偏二氟乙烯(0.22μm(pvdf)) 滤膜材质对昂丹司琼注射液无明显影响。经过二级过滤后药液的微生物负荷质量标准要求,需氧菌、霉菌及酵母菌均小于1cfu/100ml。本发明优选过滤滤芯为聚偏二氟乙烯材质,药液经二级过滤。
[0096]
5.灭菌条件研究
[0097]
本发明研究终端灭菌条件对昂丹司琼注射液稳定性的影响,考察121℃/15 min;121℃/20min;121℃/30min;121℃/60min;125℃/20min;125℃/30min; 125℃/60min灭菌条件下药液性状、ph、含量、有关物质,结果见表6。
[0098]
表6灭菌条件研究结果
[0099]
[0100][0101]
从以上结果可知:有关物质d、最大未知单杂、总杂均随灭菌温度的升高和灭菌时间的增加而增加。有关物质d在121℃/30min已经超过质量标准要求,在121℃/15min时f0值已达到22.4分钟,大于标准要求的12分钟。本发明优选灭菌条件为121℃/15min。
[0102]
实验例3稳定性
[0103]
取实施例4的注射液,放置于60℃稳定性考察箱中,在0月、1月、2月、3 月、6月取样,照usp中昂丹司琼注射液中性状、含量、色谱纯度、有关物质d、 ph项下规定进行检测。上文实施例中不同条件组合注射液活性成分昂丹司琼含量均在其标示量的95.0%-105.0%范围内,有关物质d的含量均小于0.12%,其他单杂均小于0.2%,总杂小于0.5%,ph均在3.3-4.0范围内,各项检测结果均符合usp的标准要求,且加速6个月的数据之间无明显差异,表明全部注射液均具有优异的稳定性。稳定性0月的含量及色谱纯度、有关物质d的典型图谱见图 1~图9,表7。
[0104]
表7加速试验稳定性数据
[0105]
[0106][0107]
通过实验例证实,本发明优选工艺如下:
[0108]
1)在预溶罐中加入配制量10%的注射用水,水温为60℃,加入处方量的氯化钠、一水枸橼酸和二水枸橼酸钠,混合直至溶解;
[0109]
2)在预溶罐中加入配制量10%的注射用水,水温为60℃,加入处方量的盐酸昂丹司琼,混合至溶解;
[0110]
3)将溶解的辅料和原料在配料罐中混匀,再加入注射用水至处方全量,搅拌20分钟;
[0111]
4)在氮气压力不低于0.2mpa下,将药液通过两个0.22μm的过滤器过滤灌装至玻璃小瓶中,压塞,轧盖,采用121℃15min条件湿热灭菌即得。
[0112]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作出一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1