一种甜菜碱在改善前列腺癌中的应用
1.本技术涉及医药技术领域,具体涉及一种甜菜碱在改善前列腺癌中的应用。
背景技术:
2.前列腺癌(prostate cancer,pca)是指发生在前列腺的上皮性恶性肿瘤,该类肿瘤为激素依赖型的肿瘤。前列腺癌在我国发病率表现出每年递增的趋势,且发病率增长速度也逐年上升。
3.现有对于前列腺癌的治疗方式包括手术治疗和非手术治疗。由于pca是激素依赖型的肿瘤,对于非手术治疗的患者通常推荐先行雄激素剥夺(adt)治疗,adt治疗是通过药物降低人体内雄激素水平从而抑制pca生长。
4.然而adt治疗初期对激素敏感型pca有较好的效果,但随着时间推移,肿瘤细胞逐渐产生耐药性,最终使激素敏感型pca转换为去势抵抗性前列腺癌(crpc)。化疗是crpc的有效治疗手段之一。多西他赛、卡巴他赛等化疗药物对crpc患者有一定疗效。虽然化疗一定程度上可延缓pca进展,但患者仍会像adt治疗一样对化疗产生耐药性。因此,如何逆转pca化疗耐药性的产生对于延缓crpc患者病情发展已成为近年来的一个研究热点。虽然化疗常作为crpc的医治方法之一,但化疗后产生的多药耐药(mdr)仍不可避免。
技术实现要素:
5.本技术提供一种甜菜碱在改善前列腺癌中的应用,能够通过甜菜碱降低前列腺癌化疗耐药性以改善前列腺癌。
6.第一方面,本技术示出一种甜菜碱在改善前列腺癌中的应用,所述甜菜碱的结构式为:
[0007][0008]
在一些实施例中,所述甜菜碱通过促进前列腺癌化疗耐药细胞凋亡以改善前列腺癌。
[0009]
在一些实施例中,所述甜菜碱通过抑制abcb1转运体的表达以促进前列腺癌化疗耐药细胞凋亡,进而改善前列腺癌。
[0010]
在一些实施例中,所述甜菜碱通过pi3k/akt/nf-κb信号通路下调abcb1转运体的表达以促进前列腺癌化疗耐药细胞凋亡,进而改善前列腺癌。
[0011]
在一些实施例中,所述甜菜碱可以与多西他赛联合使用以改善前列腺癌。
[0012]
在一些实施例中,所述甜菜碱可以与多西他赛联合使用以逆转前列腺癌化疗耐药细胞对多西他赛的耐药性;进而改善前列腺癌。
[0013]
在一些实施例中,所述甜菜碱通过促进前列腺癌化疗耐药细胞凋亡以改善前列腺癌的应用浓度为200~800mmol/l。
[0014]
在一些实施例中,所述甜菜碱通过促进前列腺癌化疗耐药细胞凋亡以改善前列腺癌的应用浓度优选为200mmol/l、300mmol/l、400mmol/l、600mmol/l、800mmol/l的其中一种。
[0015]
第二方面,本技术示出一种甜菜碱在制备改善前列腺癌的药物中的应用,所述药物包括唯一活性成分的甜菜碱以及药学上可接受的辅料;所述药物用于降低前列腺癌化疗耐药性。
[0016]
第三方面,本技术示出一种甜菜碱和多西他赛的药物组合物在制备改善前列腺癌的药物中的应用,所述药物包括甜菜碱和多西他赛的药物组合物以及药学上可接受的辅料,所述药物用于降低前列腺癌化疗耐药性。
[0017]
以上示出的技术方案,能够通过甜菜碱降低前列腺癌化疗耐药性以改善前列腺癌。
附图说明
[0018]
为了更清楚地说明本技术实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0019]
图1示出了根据一些实施例的c4-2b细胞和taxr细胞形态对比图;
[0020]
图2示出了根据一些实施例的不同浓度dtx刺激48h后c4-2b细胞和taxr细胞活性变化结果图;
[0021]
图3示出了根据一些实施例的dtx对c4-2b细胞和taxr细胞集落形成的影响结果图;
[0022]
图4示出了根据一些实施例的c4-2b细胞和taxr细胞abcb1在蛋白和mrna表达水平的对比结果图;
[0023]
图5示出了根据一些实施例的靶向abcb1的sirna转染taxr细胞前后abcb1在蛋白和mrna水平的变化结果图;
[0024]
图6示出了根据一些实施例的cck8法测sirna转染前后taxr细胞经dtx刺激48h后细胞活性的变化结果图;
[0025]
图7示出了根据一些实施例的不同浓度bet刺激taxr细胞48h对细胞活性的影响结果图;
[0026]
图8示出了根据一些实施例的不同浓度bet刺激taxr细胞48h对abcb1蛋白表达的影响结果图;
[0027]
图9示出了根据一些实施例的bet与dtx联合应用48h对taxr细胞数目的影响结果图;
[0028]
图10示出了根据一些实施例的dtx和bet联合作用48h对taxr细胞凋亡的影响结果图;
[0029]
图11示出了根据一些实施例的dtx和bet联合应用48h对taxr细胞周期的影响结果图;
[0030]
图12示出了根据一些实施例的dtx和bet联合应用48h对taxr细胞凋亡相关蛋白表达的影响结果图;
[0031]
图13示出了根据一些实施例的bet与wm联合应用48h对pi3k/akt信号通路相关蛋白表达的影响结果图;
[0032]
图14示出了根据一些实施例的bay和bet联合应用48h对nf-κb信号通路相关蛋白表达的影响结果图。
具体实施方式
[0033]
为使本技术的目的、实施方式和优点更加清楚,下面将结合本技术示例性实施例中的附图,对本技术示例性实施方式进行清楚、完整地描述,显然,所描述的示例性实施例仅是本技术一部分实施例,而不是全部的实施例。
[0034]
基于本技术描述的示例性实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本技术所附权利要求保护的范围。此外,虽然本技术中公开内容按照示范性一个或几个实例来介绍,但应理解,可以就这些公开内容的各个方面也可以单独构成一个完整实施方式。需要说明的是,本技术中对于术语的简要说明,仅是为了方便理解接下来描述的实施方式,而不是意图限定本技术的实施方式。除非另有说明,这些术语应当按照其普通和通常的含义理解。
[0035]
下面对本技术中涉及的专业术语进行解释。
[0036]
本技术中所使用的术语“abcb1转运体”,又称为p糖蛋白(p-gp),p-gp依靠atp能量转运胞内化疗药物到胞外,继而减少化疗药物在胞内的聚集,使药效降低而使化疗失去效应。
[0037]
本技术中所使用的术语“甜菜碱(betaine,bet)”,是枸杞中分离出来的一种低分子物质;其可作为甲基供体且具有抗氧化应激、调节细胞渗透压、抗炎、抗肿瘤、调节nf-κb信号通路、调节一碳代谢等作用。
[0038]
本技术中所使用的术语“多重耐药性(multidrug resistance,mdr)是指肿瘤细胞一旦对某种化疗药物产生耐药性,同时对其他结构上无关、作用机理各异的抗肿瘤药物也产生交叉耐药性。
[0039]
现有的化疗药物(例如多西他赛、卡巴他赛、长春新碱以及阿霉素等)均可以与abcb1相结合而发生药物外排。多项实验证实了多种癌变组织中已检测出多量的abcb1转运体,因此,通过控制abcb1转运体的活性,可能能够逆转多重耐药性。
[0040]
目前临床中已有通过竞争性结合abcb1转运体从而限制abcb1转运体功能的药物,例如维拉帕米(钙通道抑制剂)、环孢素a(免疫抑制剂)等。然而现有的药物存在毒副作用从而限制其在临床上大规模使用。因此,亟待寻找无毒、较少副作用的新的abcb1转运体抑制剂。
[0041]
近年来多项体外实验表明bet可抑制肿瘤生长。而bet是否可以逆转abcb1表达进而起到促进前列腺癌化疗耐药细胞凋亡尚未见报道。将其发展为辅助治疗前列腺癌等疾病的药物具有极高的潜在价值与社会意义。
[0042]
为此,本技术示出的技术方案,提供了一种甜菜碱,用于改善前列腺癌,本技术示出了一种甜菜碱在改善前列腺癌中的应用,所述甜菜碱的结构式为:
[0043][0044]
在一些实施例中,所述甜菜碱通过促进前列腺癌化疗耐药细胞凋亡以改善前列腺癌。
[0045]
在一些实施例中,所述甜菜碱通过抑制abcb1转运体的表达以促进前列腺癌化疗耐药细胞凋亡,进而改善前列腺癌。
[0046]
在一些实施例中,所述甜菜碱通过pi3k/akt/nf-κb信号通路下调abcb1转运体的表达以促进前列腺癌化疗耐药细胞凋亡,进而改善前列腺癌。
[0047]
在一些实施例中,所述甜菜碱可以与多西他赛联合使用以改善前列腺癌。
[0048]
在一些实施例中,所述甜菜碱可以与多西他赛联合使用以逆转前列腺癌化疗耐药细胞对多西他赛的耐药性;进而改善前列腺癌。
[0049]
在一些实施例中,所述甜菜碱通过促进前列腺癌化疗耐药细胞凋亡以改善前列腺癌的应用浓度为200~800mmol/l。
[0050]
在一些实施例中,所述甜菜碱通过促进前列腺癌化疗耐药细胞凋亡以改善前列腺癌的应用浓度优选为200mmol/l、300mmol/l、400mmol/l、600mmol/l、800mmol/l的其中一种。
[0051]
本技术还示出一种甜菜碱在制备改善前列腺癌的药物中的应用,所述药物包括唯一活性成分的甜菜碱以及药学上可接受的辅料;所述药物用于降低前列腺癌化疗耐药性。
[0052]
本技术还示出一种甜菜碱和多西他赛的药物组合物在制备改善前列腺癌的药物中的应用,所述药物包括甜菜碱和多西他赛的药物组合物以及药学上可接受的辅料,所述药物用于降低前列腺癌化疗耐药性。
[0053]
具体实现中,本技术示出了相关实验以证实上述实施例。
[0054]
首先,本技术通过对前列腺癌细胞进行细胞培养,并将甜菜碱对前列腺癌细胞进行干预。
[0055]
具体实验过程如下:
[0056]
本技术的实验材料包括:实验细胞。其中,实验所用的人前列腺癌细胞细胞株c4-2b(人前列腺癌细胞)、taxr(人前列腺癌紫杉醇耐药细胞)均由us california大学davis分校allen c.gao教授惠赠。
[0057]
本技术的实验材料还包括:实验仪器和实验设备。具体如下表1所示:
[0058]
表1:实验仪器和实验设备
[0059]
[0060][0061]
本技术的实验材料还包括:实验试剂。具体如下表2所示:
[0062]
表2:实验试剂
[0063]
[0064][0065]
本技术的实验用相关试剂配置包括:细胞培养基配置;所述细胞培养基配置方法为在细胞间无菌技术下制作的完全培养基,将配制完成后的培养基存放在100ml离心管,过火焰后封口膜封口,放在4℃冰箱中。
[0066]
其中,细胞培养基的配方如下表3所示:
[0067]
表3:
[0068][0069]
本技术的实验用相关试剂配置包括:10mol/l甜菜碱贮存液配置;所述10mol/l甜菜碱贮存液配置方法为使用微量秤称取经辐照灭菌的1.12g甜菜碱粉末,于超净工作台中将其溶于1ml上一步配置的完全培养基中,放在振荡器上震30s,配置成10mol/l的甜菜碱母液。将母液用锡箔纸包裹后存放在4℃冰箱。
[0070]
在本技术的实验过程中,包括以下步骤:
[0071]
步骤s101,前列腺癌细胞(c4-2b和taxr)的培养,包括:
[0072]
步骤s101-1,前列腺癌细胞的复苏;
[0073]
将要复苏的细胞从液氮罐内取出,并快速转运至细胞间已调整好温度的水箱中。快速摇晃细胞使其从冰冻状态融化,放至超净工作台。将细胞悬液移到离心管中,温柔吹打混匀后以900r离心4min,弃上层液后加入新液,吹匀并移至培养瓶。观察细胞无明显异常后将培养瓶置于thermo fisher co2培养箱中进行培养并进行后续实验。
[0074]
步骤s101-2,前列腺癌细胞的传代;
[0075]
从箱内取培养瓶,显微镜下进行观察;若满足传代条件则放到超净工作台上。移液器抽走原培养基弃于废液缸。吸取3ml d-hanks冲洗培养瓶4遍,吸取d-hanks液弃于废液缸。取1500μl胰酶溶液于瓶中消化。盖紧瓶盖消毒后置于co2培养箱中并计时。消化180s后取出并置于镜下查验消化情况,当细胞触手消失,相互之间分离则表明消化完成,抽3ml新
液中和。使用移液管吸细胞悬液后再吹打几遍进行混悬,吹打完成后移入事先准备好的无菌15ml容量尖底离心管中。将15ml容量尖底离心管放到离心机以1100r运行5min,离心完成后移液器吸取上清弃至废液缸。移液器分别吸取完全培养基和含有5nmol/l多西他赛(docetaxel,dtx)的完全培养基轻轻吹打均匀进行重悬,根据需要传代的细胞种类和密度吸取对应的培养基进行稀释。将稀释完成的悬液转移至培养瓶并使其中细胞以一致密度铺于瓶底,放回培养箱。
[0076]
步骤s102,前列腺癌细胞的计数;
[0077]
取出培养箱中细胞,观察生长情况,或者根据前序处理评估细胞生长情况。如果已经进行相应时间和药物处理,且对照组和各处理组细胞生长未形成克隆或团块等情况,则可进行细胞计数。将taxr细胞以同样细胞密度平铺于6cm细胞培养皿中,翌日观察细胞是否已经长在皿上和细胞密度,若细胞已贴壁且密度均一则给与相应刺激。给与对照组更换新的培养基,dtx组给与更换含有20nmol/l dtx的完全培养基,bet组给与更换含有200mmol/lbet的完全培养基,bet+dtx组给与更换含有200mmol/l bet和20nmol/l dtx的完全培养基。孵育2天后取出培养皿,无菌处理后置于操作台上,弃旧液,d-hanks漂4遍,加入1500μl胰酶,消化结束后再加入3ml带有血清的培养基用以终结消化后转运入5ml ep管中。细胞计数仪进行计数。重复4遍,计算均值,此即为该悬液浓度。
[0078]
步骤s103,cck8检测细胞活性实验;
[0079]
取出细胞,镜下观察,若生长很好,处于对数生长期,铺满培养瓶壁60%以上则可进行下一步的操作:
[0080]
步骤s103-1,将c4-2b、taxr、sirna转染实验的taxr ctrl、nc、siab1-1、siab1-2细胞取出培养箱,再用医用酒精擦拭消毒,最后放到工作台内。
[0081]
步骤s103-2,按上述传代的方法给与消化、离心、重悬。以上步骤操作完成后进行细胞计数,具体方法详见步骤s102;
[0082]
步骤s103-3,计数后使每1ml细胞悬液中存在50000个细胞。
[0083]
步骤s103-4,取96孔圆底培养板,在靠近边缘的孔中每孔加入100μl去离子水以排除在培养箱中的液体蒸发的干扰。
[0084]
步骤s103-5,空白对照孔加入培养基。
[0085]
步骤s103-6,将已调整好浓度的细胞悬液铺于板中,每孔加100μl细胞悬液,设置3个以上复孔以避免较大的误差。
[0086]
步骤s103-7,铺板完成后将96孔圆底培养板向多个不同方向晃动以使细胞均匀铺于孔中。
[0087]
步骤s103-8,显微镜下观察细胞铺板的均一性,各孔细胞数差异情况,确定各孔铺板细胞无明显差异后放入培养箱。
[0088]
步骤s103-9,第二天从培养箱取出96孔圆底培养板,给与c4-2b细胞更换含0、0.5、1、2、5、10、20nmol/l dtx的完全培养基;给与taxr和sirna转染实验的taxr ctrl、nc、siab1-1、siab1-2细胞96孔板更换含有0、10、20、25、50、100、200nmol/l dtx的完全培养基;给与taxr细胞更换含有100、200、400、600、800mmol/l bet的完全培养基。每板的空白对照孔培养基也需更换。
[0089]
步骤s103-10,换新液后将96孔圆底培养板放回培养箱,48h后取出并在避光的情
况下给各孔加定量cck8液,箱内孵育。
[0090]
步骤s103-11,120min后将此板放入酶标仪上测450nm处吸光度(od值)并记录数值。细胞相对活性等于实验孔减去空白孔差值od值后再除以对照孔与空开孔的od差值,最后再乘以百分之一百。
[0091]
步骤s104,集落形成实验;
[0092]
取以指数繁殖的c4-2b和taxr细胞,观察生长情况。计算c4-2b和taxr消化后的悬液浓度(方法参照步骤s102),加入新液把细胞悬液浓度调整为200个/ml。将细胞种植于6孔圆底板中,每孔加细胞悬液2500μl,使每孔含有大约500个细胞,摇晃使平均分布。混匀后将6孔板放置于co2培养箱,第二天给与6孔板中的c4-2b细胞换液,更换为含有0、5nmol/l dtx的完全培养基;给与6孔板taxr细胞换液,更换为含有0、5nmol/l dtx的完全培养基。箱内放14d后取出,弃旧液,d-hanks液洗2次,每孔加入1000μl甲醇固定0.5h,弃甲醇后每孔加入1ml 0.5%结晶紫溶液染色,1h后倒掉染色液并使用双蒸水洗去残留颜色。6孔板放于37℃恒温箱烘干,在显微镜下认定不少于50个细胞聚集为一个克隆并记录细胞群落数目,摄像并统计。
[0093]
步骤s105,细胞凋亡实验
[0094]
步骤s105-1,镜下观察taxr细胞,若无异常则进行下一步实验。
[0095]
步骤s105-2,弃旧液,漂洗3遍,胰酶消化后终止,吹匀,计数仪计数,调整细胞密度为2.5
×
102个/μl。
[0096]
步骤s105-3,调整后的混悬液铺于6孔板中,加2000μl细胞悬液到每孔,轻晃以使细胞平均分布。
[0097]
步骤s105-4,第二天细胞已贴壁,分组为对照组(ctrl)组、空白组、fitc组、pi组给与更换新培养基;bet组给与更换含有200mmol/l bet的新培养基;dtx组给与更换含有20nmol/l dtx的新培养基;bet+dtx组给与更换含有200mmol/l bet和20nmol/l dtx的新培养基。之后继续培养48h。
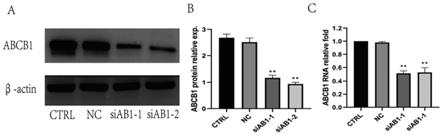
[0098]
步骤s105-5,拿出来6孔圆底板,弃原液,不含edta的胰酶消化,加新培养基终止消化,移液装置使散匀,转移至离心管,400g、4℃,离心5min。
[0099]
步骤s105-6,离心完成后使用冷pbs洗一次,调整细胞浓度至1
×
103个/μl并转移至2ml ep管中。
[0100]
步骤s105-7,调整完成后再以4℃下300g离心6min,弃上清,每管加400μlannexinv结合液并轻柔吹匀。
[0101]
步骤s105-8,暗室中给对照组、fitc组、bet组、dtx组、bet+dtx组每组加试剂盒中的annexin v-fitc溶液5μl并混匀后锡箔纸包裹后孵育1刻钟。
[0102]
步骤s105-9,孵育完成后在暗室里给对照组、pi组、bet组、dtx组、bet+dtx组每组加试剂盒中的pi溶液5μl并混匀,放置于4℃冰箱孵育5min,上机检测凋亡情况。
[0103]
步骤s106,细胞周期实验;
[0104]
细胞铺于6孔板前处理方法同步骤s105。第二天细胞贴壁后,分组为对照组(ctrl)给与更换新培养基;bet组给与更换含有200mmol/l bet的新培养基;dtx组给与更换含有20nmol/l dtx的新培养基;bet+dtx组给与更换含有200mmol/l bet和20nmol/l dtx的新培养基,再培养48h。取6孔板,弃旧液,不含edta胰酶消化,中和,吹混均一,移至离心管,
2000r,离心600s。离心完成后使用pbs进行重悬,并操作细胞计数设备来计数,调整细胞浓度至1000个/μl并转移1ml细胞悬液至2ml离心管中。调整完成后将离心管在4℃下2000r离心5min,弃上清,每管加入500μl 70%乙醇并轻轻吹打混匀,置于﹣20℃冰箱固定6h。到时间后以1000r离心3min,弃上清,pbs洗一遍后1000r离心3min弃上清,每管加入试剂盒中rnasea溶液和pi溶液以1:9体积比配制成的染色工作液500μl进行重悬,轻柔混合均等后用锡箔纸包裹室温保存60min。孵育完成后用相关设备分析细胞周期。
[0105]
步骤s107,sirna实验;
[0106]
本次转染实验设置阴性对照组(nc)即转染入细胞的是无意义的sirna;siab1-1组即第一种干扰abcb1的sirna;siab1-2组即第二种干扰abcb1的sirna。按照厂商说明书将其生产的含有sirna粉末的ep管中加入250μl rnase水配置成可转染的sirna溶液存放于-20℃冰箱。取出taxr细胞,显微镜下观察细胞形态后按照传代方法使用不含青/链霉素的rpmi1640完全培养基将其铺于6孔板中(具体方法参照步骤s101-2)。铺板完成后放置于co2培养箱过夜。将5μl sirna溶液加入245μl optidmem溶液中待用,将7.5μllipofectamine2000溶液加入242.5μl optidmem溶液中,以上两混合溶液再次相互混合并放于冰上孵育5min。孵育完成后将500μl混合液与1500μl不含青/链霉素的rpmi1640完全培养基混合形成可用于转染的2000μl sirna溶液。各孔给与更换相对应的sirna溶液2000μl。将转染操作后的细胞放置于co2培养箱培养48h即完成转染并可进行后续实验如cck8、western blot、pcr等。
[0107]
步骤s108,western-blot实验;
[0108]
步骤s108-1,提取蛋白原液;
[0109]
在c4-2b、taxr细胞长满培养瓶后和taxr细胞经转染48h后即可收取c4-2b、taxr ctrl、nc、siab1-1、siab1-2细胞。taxr细胞给与100、200、300、400mmol/l bet,20nmol/l dtx,20nmol/l dtx加200mmol/l bet,10μmol/l bay11-7082,10μmol/lbay11-7082加200mmol/l bet,100μmol/l渥曼青霉素(wm),100μmol/l渥曼青霉素(wm)加200mmol/l bet刺激48h后收细胞。细胞消化后加入新液以终止消化,移入离心管中后在4℃下以1050r离心600s。离心结束后弃上清加入1ml pbs进行重悬,完成后把上述液体运转至1.5ml ep管中,重新在4℃下3000rpm离心5min并重复2次。离心完成时弃pbs后冻存于﹣80℃冰箱。细胞蛋白裂解液配比如下表4:
[0110]
表4:
[0111][0112]
加入的细胞蛋白裂解液量根据细胞量多少进行调节。添加完裂解液后将离心管在混悬振荡器上剧烈震荡0.5min,再放置在冰面静置5min并再操作上步5次以裂解完全。再4℃下12000r离心6min,把上清移至无酶离心管中,放到﹣80℃冰箱待用。
[0113]
步骤s108-2,bca法蛋白定量;
[0114]
bca工作液量=(样品数+8)
×
200μl。
[0115]
bca工作液配比如下表5:
[0116]
表5:
[0117][0118]
bca工作液配制完成后混匀。
[0119]
在96孔板中按下表6添加对应试剂。
[0120]
表6:
[0121][0122]
各个样品孔加入18μl ddh2o,之后加入相对应的蛋白原液2μl。
[0123]
每个孔内加入0.2ml的bca工作液。
[0124]
将96孔板放置于37℃,0.5h。
[0125]
反应结束后将96孔板放进酶标仪内,使用562nm波长计量各孔的od值。
[0126]
依据od值做出蛋白标准曲线,并推算出相关方程计算出各自孔对应的蛋白浓度。
[0127]
根据蛋白浓度添加相对量的双蒸水使各样品蛋白浓度相同,各样品加入其中的5x上样缓冲液量为各自体积的五分之一。
[0128]
将上步中样品100℃煮9min使其变性,降温后保存于﹣20℃冰箱。
[0129]
步骤s108-3,配制sds-page胶
[0130]
将干净的玻璃板内侧面相对,边缘相互对齐后安装到配胶架上,10%浓度分离胶各项配比如下表7。
[0131]
表7:
[0132][0133]
分离胶配制完成后摇晃均匀,在两玻璃板缝隙的一侧缓缓注入分离胶,避免产生
气泡。分离胶加注到合适位置后沿玻璃板一侧边缘缓缓加入去离子水使去离子水到达玻璃板边缘,依靠去离子水重力使分离胶胶线水平,上述操作完后等待分离胶转变成为固体。然后丢弃去离子水。
[0134]
浓缩胶的配制如下表8:
[0135]
表8:
[0136][0137]
将混合好的浓缩胶沿玻璃板一侧近边缘处注入两玻璃板间隙,此时加注速度应较快以免浓缩胶发生凝结。加注满浓缩胶不要停留,以尽可能快的速度垂直向下插入事先准备好的梳子。配制完成后的胶静置半小时左右使其充分凝固。
[0138]
步骤s108-4,上样与电泳;
[0139]
从﹣20℃冰箱中取出定量好的实验样品,复温后再震荡混匀,将配制好的有sds-page胶的玻璃板插入到电泳槽中,两块玻璃板之间和电泳槽里面都要倒入一定体积的电泳液。轻柔拔出梳子,靠近边缘的两个泳道内加入4μl蛋白marker,中间泳道内加入40μg蛋白。盖上电泳槽盖板并连接电源,先以恒压80v方式进行电泳。待marker各线间分离明显则将电压设置为120v,当蛋白marker到达胶的底部时结束电泳。
[0140]
步骤s108-5,转膜与封闭;
[0141]
电泳结束后将sds-page胶放置于冷的转膜液中。参照蛋白标记物和所需要的蛋白分子质量裁下pvdf膜,浸没在甲醇里5min,然后转移到转膜液里。切胶板切下目的蛋白胶条。使用260ma恒流转膜1h。60min过后取出pvdf膜,放于pbst溶液中在摇床上晃动5min。把pvdf膜放置于事先配制好的含有10%脱脂奶粉封闭液中,封闭2小时。
[0142]
步骤s108-6,抗体孵育与曝光
[0143]
pbst漂洗pvdf膜5遍,每遍10min。一抗稀释比例如下表9。
[0144]
表9:
[0145][0146]
[0147]
将各pvdf膜置于一抗孵育10小时。pbst漂洗4遍,每遍10min。按照1:5000浓度将二抗加入2.5%脱脂奶粉溶液中,放于摇床上孵育2小时。孵育后使用pbst洗4遍,每遍10min。膜上滴加发光工作液后曝光。曝光后的条带使用image j软件分析。
[0148]
步骤s109,qrt-pcr实验;
[0149]
步骤s109-1,提取总rna;
[0150]
取出c4-2b、taxr、siab1-1、siab1-2,丢上层液,用d-hanks液涮4遍,胰酶消化,中和,4℃,3000r离心6min,丢上层液后加入1000μl pbs混合均一传递到1500μl无酶的离心管中,4℃,3000r离心300s,弃上层液。
[0151]
使用axygen公司rna提取试剂盒提取rna。给离心管中加0.3mlr-i缓冲液,移液器吹打混匀。
[0152]
给离心管中加入0.1ml r-ii缓冲液,震荡30s,4℃下12000g离心300s,
[0153]
吸上层液体到新1.5ml离心管中,加0.2ml异丙醇并相互混合。
[0154]
把制备管放到2ml离心管中,将上步所得液转移入制备管,4℃下6000r离心10min。
[0155]
弃滤液后制备管再放回2ml离心管内,制备管中加0.5ml w1a缓冲液,12000r离心60s。
[0156]
弃滤液,把制备管放回2ml离心管,把原配制好的0.7ml w2缓冲液加入制备管中,12000r离心60s,复洗一次。
[0157]
弃滤液,制备管放回2ml离心管,12000r离心60s。
[0158]
把制备管放入未使用的无酶1.5ml离心管中,朝制备管中心滴70μl无酶水。60s后12000r离心60s,洗脱后就是rna。
[0159]
用相关仪器测各个样品rna浓度,a260/a280值位于1.8-2.0之间可用。
[0160]
步骤s109-2,反转录实验;
[0161]
在冰冻的条件下存放实验用到的试剂同时混合相应量的各个试剂,混合平均后马上参照tb green qpcr法运转反转录反应。相关试剂及使用量如下表11。
[0162]
表11:
[0163][0164]
轻柔混合均一化后运转反转录反应,其各项参数为:
[0165]
42℃15min;
[0166]
85℃5s;
[0167]
4℃;
[0168]
步骤s109-3,实时定量pcr;
[0169]
引物使用前根据厂商标注使用标注量的rnase free dh2o进行稀释。实验中使用
的引物序列如下abcb1:forward:5`-attgt caatcc cggat gaccc g aaac-3`;reverse:5`-caatc gtggc gaggc aattg tcgac-3`。gapdh:5`agaa ggct gagg ctat ttg-3`;reverse:5`aggg cgaa agtc ccga gct-3`。
[0170]
按照下表12在冰上配制pcr反应液。
[0171]
表12:
[0172][0173]
扩增条件为:
[0174]
95℃,30s;
[0175]
95℃,5s,40个循环;
[0176]
59℃,35s,40个循环;
[0177]
60℃,15s,40个循环。
[0178]
反应结束后导出数据分析。
[0179]
步骤s1010,数据统计
[0180]
采用spss 23.0统计学软件包进行统计分析,计量资料以均值
±
标准差表示,组间对比采用单因素方差分析或两独立样本t检验分析;计数资料以百分比表示,采用pearsonχ2检验分析。p<0.05表示差异具有统计学意义。
[0181]
上述实施例中实验结果如下:
[0182]
图1示出了c4-2b细胞和taxr细胞形态对比图。显微镜下观察c4-2b细胞和taxr细胞对dtx敏感性及abcb1表达的差异可知,c4-2b与taxr细胞在细胞形态上无明显差别。
[0183]
图2示出了不同浓度dtx刺激48h后c4-2b细胞和taxr细胞活性变化结果图。如图2所示,与对照组(0nmol/l)比较,0.5、1、2、5、10、20nmol/l dtx组c4-2b细胞活性明显下降(图2a,p<0.01),随着dtx浓度升高,细胞活性下降越明显,测得c4-2b细胞对dtx的ic50为1.71nmol/l。与对照组(0nmol/l)比较,10、20、50、100、200nmol/l dtx组taxr细胞活性明显被抑制(图2b,p<0.05,p<0.01),随着dtx浓度增高,细胞活性下降越明显,测得taxr细胞对dtx的ic50为172.3nmol/l。
[0184]
图3示出了dtx对c4-2b细胞和taxr细胞集落形成的影响结果图,如图3所示,给予0nmol/l dtx刺激14d,c4-2b和taxr细胞集落形成数量无差别(p>0.05);但给予5nmol/l dtx刺激,taxr细胞集落形成数量明显多于c4-2b细胞(p<0.01);taxr细胞给予0nmol/l或5nmol/l dtx刺激后,细胞集落形成数量无明显差别(p>0.05)。
[0185]
图4示出了c4-2b细胞和taxr细胞abcb1在蛋白和mrna表达水平的对比结果图。如图4所示,western blot实验中,abcb1在taxr细胞中蛋白表达明显高于c4-2b细胞,差异有
显著性(p<0.01);在pcr实验中taxr细胞中abcb1 mrna的表达远高于c4-2b细胞,差异有显著性(p<0.01)。其中,图4a为c4-2b与taxr细胞的abcb1蛋白条带;图4b为c4-2b与taxr细胞abcb1蛋白表达量的统计学分析;图4c为abcb1分别在c4-2b与taxr细胞中的mrna表达量的统计分析。与c4-2b细胞比较,**p<0.01。
[0186]
图5示出了靶向abcb1的sirna转染taxr细胞前后abcb1在蛋白和mrna水平的变化结果图。如图5所示,下调abcb1表达对taxr细胞dtx耐药的影响为:sirna转染taxr细胞后蛋白表达水平结果显示,nc组abcb1蛋白表达较ctrl组(对照组)无明显变化(图5a、b,p>0.05);siab1-1、siab1-2组abcb1蛋白表达较ctrl组下调,差异有统计学意义(图5a、b,p<0.01)。sirna转染taxr细胞后在mrna表达水平结果显示,nc组abcb1mrna表达较ctrl组无明显变化(图5c,p>0.05);siab1-1、siab1-2组abcb1 mrna表达较ctrl组明显下降,差异有显著性(图5c,p<0.01)。其中,图5a为sirna转染前后taxr细胞abcb1蛋白条带;图5b为sirna转染前后taxr细胞abcb1蛋白条带统计分析;图5c为sirna转染前后taxr细胞abcb1 mrna表达统计分析。需要注意的是,对照组即ctrl组,nc组为阴性对照组,siab1-1、siab1-2组分别用1、2两种靶向abcb1的sirna转染。与对照组相比*p<0.05,**p<0.01。
[0187]
图6示出了cck8法测sirna转染前后taxr细胞经dtx刺激48h后细胞活性的变化结果图。如图6所示,cck8检测sirna转染taxr细胞后dtx刺激48h对细胞活性影响的结果表明,ctrl组对dtx的ic50为172.3nmol/l;nc组对dtx的ic50为167.7nmol/l;siab1-1组对dtx的ic50为27.6nmol/l;siab1-2组对dtx的ic50为25.5nmol/l,其中,ctrl组即对照组,nc组为阴性对照组,siab1-1、siab1-2组分别用1、2两种sirna转染。与0nmol/l dtx相比*p<0.05,**p<0.01。
[0188]
图7示出了不同浓度bet刺激taxr细胞48h对细胞活性的影响结果图。如图7所示,cck8实验结果表明:与对照组(0nmol/l)比较,不同浓度(200、400、600、800mmol/l)的bet对taxr细胞活性有明显的抑制作用(图7,p<0.01)。其中,与对照组相比,*p<0.05,**p<0.01。
[0189]
图8示出了不同浓度bet刺激taxr细胞48h对abcb1蛋白表达的影响结果图。如图8所示,western blot实验表明:与对照组(0mmol/l)比较,200、300、400mmol/l bet组abcb1蛋白表达明显下降,且浓度越高下降越明显,差异有统计学意义(图8a、b,p<0.01)。因200mmol/l bet组taxr细胞活性大于80%,且abcb1蛋白表达明显降低,故选取此浓度作为后续实验浓度。其中,图8a为不同浓度bet刺激taxr细胞后abcb1蛋白条带;图8b为不同浓度bet刺激taxr细胞后abcb1蛋白表达统计分析。与对照组相比,*p<0.05,**p<0.01。
[0190]
在一些实施例中,本技术示出了联合给予bet与dtx对taxr细胞数目、细胞周期、细胞凋亡及相关蛋白表达的影响。
[0191]
图9示出了bet与dtx联合应用48h对taxr细胞数目的影响结果图,如图9所示,细胞计数试验结果表明:dtx组和ctrl组(对照组)细胞数量无明显差异(p>0.05);与ctrl组比较,bet组和bet+dtx组细胞数量明显减少(p<0.05);bet+dtx组与ctrl组、bet组和dtx组比较,细胞数量明显减少(p<0.01)。其中,与ctrl组相比,*p<0.05,**p<0.01;与bet组相比,#p<0.05,##p<0.01;与dtx组相比,&p<0.05,&&p<0.01。
[0192]
图10示出了dtx和bet联合作用48h对taxr细胞凋亡的影响结果图。如图10所示,流式细胞术测细胞凋亡实验结果表明:dtx组和ctrl组凋亡率无明显差异(图10a、b、e,p>
0.05);bet组和bet+dtx组细胞凋亡率较对照组明显升高,差异有显著性(图10c、d、e,p<0.05);bet+dtx组较对照组、bet组和dtx组凋亡率明显升高,差异有显著性(图10a、b、c、d、e,p<0.05)。其中,图10a为ctrl组细胞凋亡图;图10b为dtx组(20nmol/l)细胞凋亡图;图10c为bet组(200mmol/l)细胞凋亡图;图10d为dtx+bet组细胞凋亡图;图10e为dtx和bet联合应用时taxr细胞凋亡率统计分析。与ctrl组相比,*p<0.05;与dtx组相比,#p<0.05;与bet组相比,&p<0.05。
[0193]
图11示出了dtx和bet联合应用48h对taxr细胞周期的影响结果图。如图11所示,流式细胞术测细胞周期实验中,与ctrl组比较,dtx组和的g1、s、g2期比例无明显差异(图10a、b、e,p>0.05),bet和dtx+bet组g1期下降、s期升高(图11a、c、e,p<0.05);与dtx组相比,bet组和bet+dtx组细胞g1期降低、s期升高,差异有显著性(图11b、c、d、e,p<0.05);与bet组相比,bet+dtx组细胞g1期降低、s期升高,差异有显著性(图11c、d、e,p<0.05);说明单独使用bet或bet与dtx联合应用后细胞s期升高,使taxr细胞阻滞于s期。其中图11a为ctrl组细胞周期分布图;图11b为dtx组(20nmol/l)细胞周期分布图;图11c为bet组(200mmol/l)细胞周期分布图;图11d为dtx+bet组细胞周期分布图;图11e为dtx和bet联合应用时taxr细胞周期统计分析。与ctrl组相比,*p<0.05;与dtx组相比,#p<0.05;与bet组相比,&p<0.05。
[0194]
图12示出了dtx和bet联合应用48h对taxr细胞凋亡相关蛋白表达的影响结果图。如图12所示,western blot实验结果表明:dtx组与ctrl组相比bcl-2、bax、caspase3蛋白表达差异无统计学意义(p>0.05);bet组和dtx+bet组与ctrl组相比bcl-2蛋白表达下降,bax、caspase3蛋白表达升高,差异有统计学意义(图12a、b、c、d,p<0.05、p<0.01);bet组与dtx组相比bcl-2蛋白表达下降,caspase3蛋白表达升高,差异有统计学意义(图12a、b、c、d,p<0.05、p<0.01);dtx+bet组与dtx组和bet组相比bcl-2蛋白表达下降,bax、caspase3蛋白表达升高,差异有统计学意义(图12a、b、c、d,p<0.05、p<0.01)。其中,图12a为dtx和bet联合应用于taxr细胞的bcl-2、bax、caspase3蛋白条带;b:dtx和bet联合应用于taxr细胞的bcl-2蛋白表达统计分析;c:dtx和bet联合应用于taxr细胞的bax蛋白表达统计分析;d:dtx和bet联合应用于taxr细胞的caspase3蛋白表达统计分析。与ctrl组相比,*p<0.05,**p<0.01;与dtx组(20nmol/l)相比,#p<0.05,##p<0.01;与bet组(200mmol/l)相比,&p<0.05,&&p<0.01)。
[0195]
在一些实施例中,本技术还示出了western blot法检测bet对pi3k/akt/nf-κb信号通路的影响。
[0196]
图13示出了bet与wm联合应用48h对pi3k/akt信号通路相关蛋白表达的影响结果图。如图13所示,bet(200mmol/l)与渥曼青霉素(wm)100μmol/l(pi3k通路抑制剂)联合应用于taxr细胞48h,检测相关蛋白表达情况。结果显示:与ctrl组(对照组)相比,bet组、wm组、bet+wm组的pi3k、akt、abcb1蛋白表达均明显降低,差异有显著性(图13a、b、c、d,p<0.05,p<0.01);与bet组相比,wm组akt蛋白表达下降,bet+wm组pi3k、akt、abcb1蛋白表达均明显降低,差异有显著性(图13c,p<0.01);与wm组相比,bet+wm组pi3k、akt、abcb1蛋白表达下降,差异有显著性(图13a、b、c、d,p<0.01)。其中a:bet和wm联合应用于taxr细胞时pi3k、akt、abcb1蛋白条带;b:bet和wm联合应用于taxr细胞时pi3k蛋白表达统计分析;c:bet和wm联合应用于taxr细胞时akt蛋白表达统计分析;d:bet和wm联合应用于taxr细胞时abcb1蛋白表达统计分析。与ctrl组相比,*p<0.05,**p<0.01;与bet组相比,#p<0.05,##p<
0.01;与wm组相比,&p<0.05,&&p<0.01);
[0197]
图14示出了bay和bet联合应用48h对nf-κb信号通路相关蛋白表达的影响结果图。bet对nf-κb信号通路的影响,采用此信号通路抑制剂bay11-7082(bay)。与ctrl组相比,bay组、bet组、bay+bet组的nf-κbp65、p-ikbα、abcb1蛋白表达均明显降低,差异有统计学意义(图14a、b、c、d,p<0.05,p<0.01);与bay组相比,bet组的nf-κbp65、abcb1蛋白表达下降,bay+bet组nf-κbp65、p-ikbα、abcb1蛋白表达下降,差异有统计学意义(图14a、b、c、d,p<0.05,p<0.01);与bet组相比,bay+bet组nf-κbp65、p-ikbα、abcb1蛋白表达下降,差异有统计学意义(图14a、b、c、d,p<
[0198]
0.01)。a:bay和bet单独与联合应用taxr细胞时nf-κbp65、p-ikbα、abcb1蛋白条带;b:bay和bet单独与联合应用taxr细胞时nf-κbp65蛋白表达统计分析;c:bay和bet单独与联合应用taxr细胞时p-ikbα蛋白表达统计分析;d:bay和bet单独与联合应用taxr细胞时abcb1蛋白表达统计分析。与ctrl组相比,*p<0.05,**p<0.01;与bay组(10μmol/l)相比,#p<0.05,##p<0.01;与bet组(200mmol/l)相比,&p<0.05,&&p<0.01)。
[0199]
综上,利用pca化疗耐药细胞taxr与非耐药细胞c4-2b之间的对比选出abcb1作为研究靶点。bet调节abcb1的作用使得其与dtx的联合应用可恢复taxr对dtx的敏感性从而逆转耐药。揭示了bet调节abcb1和pi3k/akt/nf-κb信号通路的关联性和作为潜在逆转化疗药物的可能性。本发明中,bet对abcb1的抑制作用揭示了bet作为abcb1抑制剂的潜在可能性,同时也表明bet在辅助治疗化疗耐药前列腺癌方面具有重要的应用价值。
[0200]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围
[0201]
为了方便解释,已经结合具体的实施方式进行了上述说明。但是,上述示例性的讨论不是意图穷尽或者将实施方式限定到上述公开的具体形式。根据上述的教导,可以得到多种修改和变形。上述实施方式的选择和描述是为了更好的解释原理以及实际的应用,从而使得本领域技术人员更好的使用所述实施方式以及适于具体使用考虑的各种不同的变形的实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1