半枝莲多糖在制备治疗炎症性肠病的药物中的应用
1.本发明涉及半枝莲多糖在制备治疗炎症性肠病的药物中的应用。
背景技术:
2.炎症性肠病(inflammatory bowel disease,ibd)包括溃疡性结肠炎(ulcerative colitis,uc)和克罗恩病(crohn's disease,cd),是一组不明原因的慢性肠道炎症性疾病,因发病率逐渐升高,已成为我国常见的消化系统疾病,也被who列为现代难治病之一。目前临床主流治疗包括氨基水杨酸盐、皮质类固醇、免疫抑制剂和生物制剂等,但仍存在疗效有限、复发率高、治疗周期长、易产生耐药性等多方面问题,还常常伴有严重的副作用。因此,寻找更廉价且更低毒、高效、可口服给药的天然药物仍具有重要的临床价值。中医药具有毒副作用小、成本低、多靶点、多途径等优势,具有巨大的临床应用前景,因此在uc治疗领域进一步发掘高效低毒的中药及其有效成分并充分阐明其作用机制具有重要的社会和经济意义。
3.半枝莲为唇形科植物半枝莲(scutellaria barbata d.don.)的干燥全草 , 味辛、苦,性寒,归肺、肝、肾经,具有清热解毒、化瘀利尿的功效。在中国被用作抗炎、抗氧化、抗肿瘤和利尿剂,临床常用于治疗癌症、蛇咬伤和炎症性疾病。其中,半枝莲多糖(psb)在抗氧化、抗癌、调节免疫等方面可能具有重要作用,但目前为止尚未见到任何对psb抗ibd相关的活性及其作用机制的报道。同样,对于psb的提取分离方法,前期有相关专利 (申请公布号为cn107216400a、申请号为cn201611209220.0) 采用超声波提取方法,涉及丙酮等有机溶剂,不但毒性大、成本昂贵,且不易实现工业化生产。
技术实现要素:
4.本发明目的是提供半枝莲多糖在制备治疗炎症性肠病的药物中的应用,解决目前治疗ibd缺乏相关药物的问题。
5.本发明采用的技术方案是:半枝莲多糖在制备治疗炎症性肠病的药物中的应用。所述半枝莲多糖由半枝莲中提取获得,有效成分包括阿拉伯糖、半乳糖醛酸、半乳糖、葡萄糖和葡萄糖醛酸等。
6.所述炎症性肠病包括溃疡性结肠炎或克罗恩病。溃疡性结肠炎(ulcerative colitis)是一种病因尚不十分清楚的结肠和直肠慢性非特异性炎症性疾病,病变局限于大肠黏膜及黏膜下层。克罗恩病(crohn's disease)是一种原因不明的肠道炎症性疾病,在胃肠道的任何部位均可发生,但多发于末端回肠和右半结肠。
7.所述半枝莲多糖可加入药学可接受的辅料,制成下列之一的剂型:胶囊剂、片剂、颗粒剂、注射剂、缓释剂、口服液或滴丸剂。
8.作为药物使用时, 所述半枝莲多糖药用剂量为25~50mg/kg。
9.具体的,所述半枝莲多糖按如下方法制备获得:半枝莲加入20~25倍质量的水,加热回流提取1~3小时,过滤取滤渣再加入10~20倍质量的水,继续回流提取1~2小时,过滤、合
并滤液,减压浓缩(真空度
‑ꢀ
0.07 ~
ꢀ‑ꢀ
0.1,温度70℃),浓缩液缓慢加入3~5倍质量的无水乙醇,并不断搅拌,4℃放置过夜,取出,过滤,滤饼干燥,得到半枝莲粗多糖经分离纯化,获得半枝莲多糖。
10.所述分离纯化方法如下:取半枝莲粗多糖,加水溶解,然后加入二氯甲烷与正丁醇体积比5:1的溶液,离心、除去下层有机层及中间层,重复操作(5~8次)至蛋白除净,得到上层水溶液冷冻干燥,得到半枝莲多糖。
11.本发明的有益效果主要体现在:本发明提供了半枝莲多糖在制备治疗炎症性肠病的药物中的应用,所述半枝莲多糖是从唇形科植物半枝莲中分离纯化得到的,具有来源广泛,取材便利等优点,便于工业化大量制备;本发明通过醇沉水溶方法提取制备了psb,该技术简化了psb的制备流程,操作简便、成本低且纯度高;本发明制备的psb具有潜在的抗ibd作用,其作用机制可能与抗炎和调节肠道菌群有关,为其在抗ibd中的应用提供研究基础及理论依据。
附图说明
12.图1为实施例1中psb提取工艺流程图;图2为实施例2中psb的化学成分分析结果;(a)psb的ft-ir光谱;(b)psb的hpgp谱;(c)psb的单糖组成;(d)单糖标准品的色谱图。
13.图3为实施例3中psb对dss诱导的uc小鼠的作用;(a)体重变化曲线;(b)dai变化曲线。psb对dss诱导小鼠脾脏系数的影响。(c)脾脏的代表性图片;(d)脾系数的统计结果(n=6)。与对照组相比,
###
p《0.001;与模型相比,***p《0.001。
14.图4为实施例4中psb对dss诱导的uc小鼠结肠组织炎性细胞因子水平的影响;(a)结肠切片h&e染色的代表性图片。(b)结肠切片形态学评分。每个点表示为平均值
±
标准差(n=6)。与对照组相比,
###
p《0.001,
#
p《0.05。与模型相比,**p《0.01,***p《0.001。psb抑制结肠组织中促炎细胞因子(c)tnf-α(d)ifn-γ(e)il-1β(f)il-18和(g)il-6的水平。与对照组相比,
#
p《0.05,
###
p《0.001;与模型相比,*p《0.05,**p《0.01,***p《0.001。
15.图5为实施例5中psb通过抑制nf-κb和stat3通路的激活发挥抗炎作用;(a)psb抑制dss小鼠p-nf-κb、p-iκbα的激活;(b)psb抑制dss小鼠stat3的激活;(c)p-nf-κb/nf-κb的相对蛋白表达率;(d)p-iκbα/iκbα的相对蛋白表达率;(e)p-stat3/stat3的相对蛋白表达率(n=6)。与对照组相比,
###
p《0.001;与模型组相比,
***
p《0.001。
16.图6为实施例6中psb组作用后差异微生物群落多样性分析的结果;(a) 韦恩图(venn diagram); (b) 菌种丰富度指数(chao1); (c) 观测物种指数(observed species index); (d) 香农多样性指数(shannon's diversity index); (e)辛普森多样性指数(simpson index)。
17.图7为实施例6中不同人群肠道内容物细菌群落多样性分析结果。
具体实施方式
18.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:实施例1:半枝莲多糖(psb)的制备
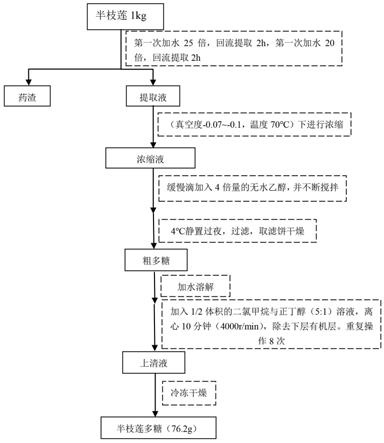
1.1提取:半枝莲1kg置于40l煎药锅中,加入20~25倍量水,回流提取1~3小时,150目过滤;滤渣再加入10~20倍量水,继续回流提取1~2小时,150目过滤,合并滤液。取滤液,减压浓缩(真空度-0.07~-0.1,温度70℃)至投料量的1~2倍,缓慢加入3~5倍量的无水乙醇,并不断搅拌,4℃放置过夜,取出,过滤,滤饼干燥,得到半枝莲粗多糖。
19.1.2纯化:取步骤1.1得到的锦灯笼粗多糖,加水溶解,然后加入1/2体积的二氯甲烷与正丁醇(5:1)溶液,离心10分钟,除去下层有机层及中间层,重复操作至蛋白除净(重复操作8次),得到上层水溶液。取上层水溶液,冷冻干燥,得到半枝莲多糖(76.2g)(psb提取工艺流程图参见图1)。
20.实施例2: 半枝莲多糖的结构鉴定ft-ir光谱如图2a所示,表1总结了峰的属性。ft-ir光谱显示,psb在3407.60、2933.20和1614.13 cm-1
处分别对o-h、c-h和c-o拉伸振动表现出多糖的特征吸收。1000-1200 cm-1
处的吸收归因于吡喃糖环中的c-o-c和c-o-h。hpgpc光谱显示,psb有一个单一的对称峰,这意味着psb是一种均质多糖(图2b),其重均分子量(mw)为1.25
×
106 da(mw/mn=1.86)。此外,其数均分子量(mn)为0.67
×
106da,峰值分子量(mp)为0.9
×
106da。如图2c、d和表2所示,psb的单糖组成主要由阿拉伯糖、半乳糖醛酸、半乳糖、葡萄糖和葡萄糖醛酸组成,摩尔比为1.00:2.09:4.52:4.73:4.90。
21.表1:ft-ir吸收光谱中峰的属性wavenumber/cm-1attributionofpeak3407.60stretchingvibrationsofo-h2933.20asymmetricstretchingvibrationofch21614.13asymmetricstretchingvibrationofc=o1411.64shearvibrationofch21261.22bendingvibrationsofc-h1064.51pyranoside表2:psb的单糖组成numberretentiontime(min)monosaccharidescomposition(%)117.337mannose3.81221.582aminoglucose0.66322.613ribose1.36424.316rhamnose2.70525.910glucuronicacid25.24629.607galacturonicacid10.76736.167galactosamine/841.173glucose24.35943.996galactose23.281045.596xylose1.541148.242arabinose5.15
1253.597fucose0.89实施例3: psb对dss诱导的uc小鼠体重变化、疾病活动指数(dai)评分及脾脏系数的影响实验方法:30只(20
±
2 g)雄性c57bl/6 spf小鼠,随机分为5组(每组6只):对照组、模型组、sasp组、psb组(25mg/kg)和psb组(50mg/kg)。除对照组外,所有小鼠均自由饮用3%dss溶液7天以诱导uc。同时相应的药物按0.1 ml/10g给药量每日灌胃2次,连续给药7天。每日记录小鼠体重、大便及其他异常情况,盲法获得疾病活动指数(dai)评分。第8天处死小鼠进行颈椎脱位解剖取样。对脾脏进行分离、拍照和称重。同时,脾脏系数计算为器官重量/体重(单位:克)。
22.实验结果:图3a表明,psb能显著抑制小鼠体重的减轻,尤其是psb(50 mg/kg)组;图3b表明,psb显著改善了dai评分;图3c-d表明psb使肿大的脾脏也明显缩小。综上所述,psb可显著改善uc小鼠的症状和病理损伤。
23.实施例4 :psb对dss诱导的uc小鼠结肠组织炎性细胞因子水平的影响实验方法:小鼠处理同“实施例3”,颈椎脱位后将所有小鼠的结肠组织分离、测量并尽快拍照,取出结肠内容物,将结肠一分为二。一部分立即在液氮中冷冻,另一部分用4%多聚甲醛固定,包埋、切片、染色并在显微镜下拍照。观察水肿、粘连、溃疡、坏死等病理改变,评估组织学评分。
24.elisa法测炎性细胞因子:将结肠组织的总蛋白浓度均匀化在冰上的pbs缓冲液中。然后使用5417r离心机离心匀浆(5分钟,5000 g,4
°
c)以获得上清液。用bca试剂盒测定蛋白质浓度,用elisa试剂盒检测促炎细胞因子。使用microplate reader 680在450 nm的光密度下测量吸光度值。
25.实验结果:如图4a-b所示,psb(25和50 mg/kg)组显著减轻dss诱导的uc小鼠结肠损伤的病理改变,并显著改善了结肠炎症的组织病理学评分。如图4c-g所示,psb能显著降低tnf-α、ifn-γ、il-1β、il-6和il-18的水平。
26.综上所述,psb(25和50 mg/kg)可以减轻dss诱导的小鼠结肠损伤,并显著降低结肠中的炎性细胞因子水平。
27.实施例5: psb抑制dss诱导的uc小鼠nf-κb和stat3信号通路的激活实验方法:western blot法检测蛋白表达:将实施例4中结肠组织进行提取和离心后,对所有结肠组织上清液的蛋白质浓度进行量化并标准化为相等。所有蛋白质样品通过sds-page分离,然后电泳转移到pvdf膜上。然后,将膜与相应的一级和二级抗体一起孵育,用电化学发光仪检测所有蛋白条带的灰度值,以微管蛋白作为内部对照,使蛋白条带的灰色密度标准化。
28.实验结果:psb显著逆转了p-nf-κb p65和p-iκbα水平的升高(图5a、c和d),同时显著下调stat3的激活(图5b和e)。综上所述,psb(25和50 mg/kg)能明显抑制dss诱导的uc小鼠nf-κb和stat3的激活。
29.实施例6: psb可调节dss诱导的uc小鼠肠道微生物群紊乱实验方法:(1)dna提取:使用e.z.n.a.粪便dna试剂盒从“实例4”所有组中提取dna,使用50
µ
l洗脱缓冲液洗脱总dna进行pcr检测。
30.(2)pcr扩增和16srdna测序:使用引物341f(5'-cctacgggnggcwgcag-3')和805r(5'-gactachvgggtatctaatcc-3')(其中,n、w、h和v是兼并碱基,分别代表n:a/t/c/g;w:a/t;h:a/t/c;v:g/a/c。)扩增16s rrna基因的v4区域。使用25 ng模板dna、12.5
µ
l pcr预混料和2.5
µ
l每个引物进行pcr扩增。
31.(3)数据分析:样本在illumina hiseq平台上测序。使用flash(版本1.2.8)分配、截断和合并成对的结束读取。筛选嵌合序列,并用≥ 使用vsearch软件(v2.3.4)将97%的相似性分配给相同的操作分类单元(otu)。为每个otu选择代表性序列,并使用核糖体数据库项目(rdp)分类器将分类数据分配给每个代表性序列。使用mafft软件(v7.310)确定不同类群中优势种的差异。
32.实验结果:(1)α-多样性分析:如图6a所示,psb(50 mg/kg)可以在一定程度上改善肠道菌群的多样性。如图6b和表3所示,与对照小鼠相比,dss抑制了微生物丰度。观察到的物种指数结果表明,对照组和模型组之间存在着多样性差异(图6c)。同时,虽然四组的shannon和simpson指数相似,但在psb干预后,在一定程度上扭转了多样性(图6d-e)。
33.综上所述,psb(50mg/kg)能显著改善dss诱导的uc小鼠的肠道微生物多样性。
34.表3:α-多样性分析结果 controlmodelsasppsb_50chao1796.39
±
74.11636.78
±
44.47703.01
±
60.13659.09
±
56.10observed_otus792.00
±
74.08634.17
±
44.87699.83
±
59.56656.33
±
56.52shannon7.59
±
0.156.38
±
0.317.02
±
0.226.46
±
0.28simpson0.99
±
0.000.96
±
0.020.98
±
0.010.96
±
0.01
(2)β多样性分析:如图7a-e所示,psb(50mg/kg)组倾向于对照组,表明psb能够调节肠道菌群趋于正常。
35.(3)聚类分析:如图7f-g和表4所示,psb(50mg/kg)对溃疡性结肠炎模型小鼠肠道菌群的变化有明显的调节作用。
36.表4:在门(p_)和属(g_)水平上的聚类分析结果 controlmodelsasppsb_50p_firmicutes50.4427.78
#
52.53*35.78*p_bacteroidetes24.3627.1712.8122.23p_proteobacteria9.8828.86
#
16.85*23.43p_epsilonbacteraeota8.519.078.959.42p_deferribacteres6.752.54
#
8.63*8.00*p_tenericutes0.063.26
#
0.11*0.23*p_bacteria_unclassified0.001.33
#
0.11*0.90*g_lachnospiraceae_nk4a136_group14.164.37
#
24.20*14.54*g_bacteroides0.8217.38
#
5.93*13.12*g_mucispirillum6.752.54
#
8.63*8.00*g_muribaculaceae_unclassified14.003.74
#
2.135.34*g_parasutterella0.118.54
#
0.73*2.81*g_lactobacillus6.070.22
#
1.10*0.50*
g_eisenbergiella0.484.05
#
2.26*0.01*g_ruminococcus3.940.05
#
0.16*1.99*g_anaeroplasma0.063.26
#
0.11*0.23*g_streptococcus0.960.63
#
1.63*1.69*
#
p 《 0.05 vs. control,*p 《 0.05 vs. model.(4)肠道微生物群与炎性细胞因子的相关性:如图7h所示,至少ifn-γ、il-1β、il-6和il-18与肠道微生物群高度相关。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1