一种可原位激活内源性TGFβ1的可注射型骨修复材料的制备及其应用
一种可原位激活内源性tgf
β
1的可注射型骨修复材料的制备及其应用
技术领域
1.本发明涉及生物医药材料领域,具体为一种可原位激活内源性tgfβ1的可注射型骨修复材料的制备及其应用。
背景技术:
2.口腔颌面部再生医学的一个长期目标是治疗由于外伤、肿瘤切除、牙周疾病、牙槽嵴吸收、治疗相关的颌骨骨坏死以及先天畸形所引起的口腔颌面部骨组织缺损、功能丧失和美学畸形。当损伤超过临界骨缺损大小时,骨组织无法自发愈合。目前,自体骨移植仍然是骨缺损修复的“金标准”。但是,取骨手术伴随的疼痛、感染、神经损伤以及功能缺失等风险限制了其应用。同种异体骨或者异种异体骨移植又常伴随免疫排斥或者疾病传播等问题。因此,应用组织工程的方法重建骨缺损部位的研究得到了极大关注。据报道,自1999年到2016年,全世界以组织工程为主题的科研论著共发表41588篇。预计到2023年,论著总数将会翻倍;而到2027年,论著总数更将达到现在的三倍。这进一步说明组织工程科学领域具有强大的生命力和巨大潜力。
3.细胞移植(cell transplantation)和细胞归巢(cell homing),这两种促进组织缺损修复的方式在组织工程研究中都在被广泛应用。前者需要先从患者活体中获取干细胞样本;在体外扩增后,单独或者与支架材料一同注射到缺损部位,期望实现促进组织生长的目的。而后者是指在生物信号诱导下,干细胞或祖细胞向缺损部位迁移和移动,从而实现组织再生。细胞移植的主要科学价值在于可以体外对细胞进行基因修饰以及荧光标记,方便进一步研究这些细胞是否参与组织再生;方便通过连续移植的手段研究这些细胞是否保持干性;以及方便研究损伤处的病理环境对于移植细胞的影响。但是细胞移植过程中,获取/分离活细胞难度大,获取的细胞类型不确定,细胞维持和临床操作过程复杂且花费高,注射的细胞易死亡及流失,离体细胞易产生免疫排斥、病原体传播和致癌性等诸多问题限制了其临床应用。仅利用生物信号(如生长因子)的趋化作用(chemotaxis)诱导间充质干细胞(mesenchymal stem cell,msc)从缺损边缘的细胞外基质(extracellular matrix,ecm)或血液中向缺损处归巢,从而促进组织再生的方法可以很好地避免上述细胞移植带来的问题,同时也是现今组织工程研究的前沿热点,它很有希望未来在临床广泛应用。
4.在骨缺损处通过生物材料或其他载体释放相关的生长因子可以达到诱导骨髓间充质干细胞(bone marrow mesenchymal stem cell,bmsc)归巢并促进骨再生的目的。yoon et al.报道了在壳聚糖水凝胶中加入外源性转移生长因子β1(transforming growth factorβ1,tgfβ1)和骨形成蛋白-2(bone morphogenetic protein-2,bmp-2)后,可以促进兔胫骨缺损修复。但是驱使外源性生长因子在骨缺损处释放的方案存在很多缺点,如支架材料中的生长因子易降解,生物活性不确定和成本高等。因此,很多学者将关注点放在了不直接添加生长因子而诱导bmsc归巢的研究。zhang et al.直接将含有血小板衍生生长因子b(platelet-derived growth factor b,pdgf-b)以及bmp-7序列的腺病毒载体与支架材料
一同注射到小猎犬牙周缺损处后,被转染的细胞可以持续产生相应的生长因子,从而促进了牙周缺损的修复。这种方法虽然节省了成本并避免了蛋白质不稳定的问题,却增加了病毒感染以及免疫排斥的可能性。相比之下,利用内源性生长因子诱导bmsc归巢并成骨的方案将会是更具吸引力以及安全可靠的选择。
5.在哺乳动物体内,内源性tgfβ1广泛存在于器官、组织基质以及很多细胞中。其中,骨基质和血小板内的tgfβ1含量最高。tgfβ1在器官发育、损伤修复、肿瘤抑制以及动脉粥样硬化等方面发挥着重要作用。在骨修复方面,tgfβ1主要通过smad信号通路诱导bmsc归巢;它还能提高骨祖细胞增殖以及在高浓度时促进软骨细胞分化(抑制成骨细胞分化)。与其他生长因子不同,基质中的以及细胞刚分泌的tgfβ1都是以潜伏(latent)tgfβ1(ltgfβ1)复合物的形式存在,不能与其受体相结合。只有通过一定方法破坏tgfβ1蛋白二聚体与潜伏相关前肽(latency-associated propeptide,lap)之间的非共价键(静电相互作用)后,才能获得激活的tgfβ1(activated tgfβ1,atgfβ1)。因此,如何安全有效的激活骨缺损处的内源性ltgfβ1是骨组织工程研究中急需解决的热点问题。
6.ltgfβ1可以在多种理化条件下被激活。通过高温加热(75℃-100℃)或超声震荡、外加整合素结合以及外加蛋白酶催化(如基质金属蛋白酶和血纤维蛋白溶酶)等方法都可以在体外很好的激活ltgfβ1。但是在缺损处加热和超声处理很可能带来二次损伤;生物材料中添加大分子蛋白既不易保存又可能引起免疫反应,因此这些方法都不适合应用于内源性ltgfβ1的激活。目前为止,只有非常有限的文献报道了如何通过激活内源性ltgfβ1,促进组织再生的研究。mooney的研究团队应用低能量激光照射牙髓残余组织后,产生的氧自由基激活了从牙本质小管中释放的内源性ltgfβ1。这些atgfβ1诱导了成人牙源性干细胞(dental stem cell,dsc)从根尖孔向根管内迁移,并实现了牙髓再生。但是由于骨缺损范围通常较大且常伴有出血,而低能量激光只能在很小范围内产生作用,且其在血液中的穿透力有限,因此并不适合在骨组织工程的研究中应用。
7.细胞外ph值的变化可以起到多种调节作用。非生理酸性(ph1-6)以及碱性(ph8-14)环境可以破坏lap与tgfβ1蛋白二聚体之间的静电相互作用,从而解离获得atgfβ1。在体外用浓盐酸处理猪皮质骨后,其酸溶解物中被证明含有atgfβ1。在培养基中加入此酸溶解物后,可以检测到成纤维细胞内的tgfβ1相关目标基因表达。另外,血清中的ltgfβ1在理论上也可以在非生理性ph条件下被激活。血清中的ltgfβ1,是在血凝块形成过程中,由聚集的血小板释放出来的。另外,非生理性ph环境也会很明显的影响骨修复的过程。偏碱性ph环境更利于增强bmsc碱性磷酸酶活性,和促进成骨细胞增殖、分化以及矿化的能力;而偏酸性ph环境会降低成骨细胞中碱性磷酸酶活性以及激活破骨细胞活性,从而增强骨吸收作用。因此,在骨缺损处创造最佳的碱性非生理性ph的环境以及选择合适的作用时间,很可能安全有效的激活骨基质和血清中的ltgfβ1,从而诱导bmsc归巢并促进骨再生。
技术实现要素:
8.本发明的目的在于提供一种可原位激活内源性tgfβ1的可注射型骨修复材料的制备及其应用,以解决上述背景技术中提出的问题。
9.为实现上述目的,本发明提供如下技术方案:
10.一种可原位激活内源性tgfβ1的可注射型骨修复材料,所述修复材料由含水基质
和微球两部分复合而成,所述微球是采用微流控法制备的粒径均一的type a明胶微球,所述含水基质由锂藻土(laponite xlg)及pei改性的明胶分子分散到水相构成。采用扩散负载法将碱性的碳酸氢盐或者中性磷酸盐吸附到明胶微球内后,将其与含水基质混合可制备得到所述可注射型骨修复材料。
11.进一步,所述type a明胶微球采用微流控的方法制备,明胶微球直径在120μm左右,所述基质部分由4.5wt%的锂藻土及2wt%的pei改性的明胶溶液构成。
12.进一步,含水基质的制备方法为:在水中溶解pei改性的明胶,将锂藻土在水中震荡分散30s,之后将它们混合均匀,得到含水基质,其中锂藻土水凝胶终浓度为4.5wt%,pei改性的明胶浓度为2wt%。
13.进一步,所述pei改性的明胶分子制备方法是将pei分子通过碳化二亚胺催化氨基-羧基的缩合反应与type a明胶分子接枝到一起,透析并冻干后获得干燥样品。
14.进一步,所述碱性的碳酸氢盐的水溶液ph值为10,所述中性磷酸盐的水溶液ph值为7.4。
15.本发明还提出了一种可注射型骨修复材料的制备方法,其特征在于包括以下步骤:
16.(1)微流控法制备typea明胶微球:微流控系统的核心部件是微流控芯片,采用pmma材质制成,其厚度3mm,内部孔道宽度为150μm。设备运转时,油相液体切割水相的typea明胶溶液,获得的大小均一的明胶液滴最终通过化学交联、清洗和冻干处理形成粒径120μm的明胶微球;
17.(2)pei改性明胶分子:分别将pei分子和typea明胶分子溶解在ph6的mes[4-吗啉乙磺酸,2-(n-吗啉基)乙磺酸]缓冲液中,通过碳化二亚胺催化的氨基-羧基缩合反应使它们链接,透析和冻干后获得产物;
[0018]
(3)含水基质的制备:在水中溶解pei改性的明胶,并将锂藻土在水中震荡分散,之后将它们混合均匀,得到含水基质其中锂藻土水凝胶终浓度为4.5wt%,pei改性的明胶浓度为2wt%;
[0019]
(4)通过扩散负载法使明胶微球负载碱性碳酸氢或中性磷酸盐。
[0020]
本发明提出了可注射型骨修复材料在诱导bmsc归巢并促进骨再生的应用。
[0021]
进一步,可注射型骨修复材料可有效地激活血清中的ltgfβ1。
[0022]
与现有技术相比本发明的有益效果在于:
[0023]
(1)通过生物材料激活了骨缺损处的ltgfβ1
[0024]
1)控制生物材料的碱性ph值
[0025]
人体血液正常ph值主要通过碳酸盐缓冲体系等维持在中性偏碱的范围,即7.35-7.45。在人体内,注入具有毒性的碱性物质,短期(小于24小时)处于强碱性的环境,以及长期(大于24小时)处于偏碱性的环境都会对人体组织及电解质平衡造成破坏。因此在本项目中,碳酸盐的缓冲体系会被用来调节材料的ph值。碳酸钠-碳酸氢钠缓冲液可以控制ph值为9-11。对照组中则使用中性的磷酸盐缓冲液(pbs)调节材料的ph值为7.4。
[0026]
2)制备了具有可注射性能的水凝胶材料
[0027]
本项目中,拟制备的材料各个成分都具有很好的生物相容性,它将由实体与水凝胶两部分混合而成。实体为type a明胶微球,支持细胞迁移及贴附,并且降解较慢;水凝胶
部分由type a明胶溶液与xlg组合而成,主要调节材料黏度,并且降解较快。
[0028]
3)很好的控制了材料的黏度,使其可以抵抗液体的稀释作用
[0029]
锂藻土(xlg)是碟片状纳米颗粒(直径25nm、厚0.92nm),它本身具有很好的促进成骨的作用。在纯水中,纳米碟片的边缘带正电荷,而碟片两面带有负电荷。据文献报道,在一定浓度下,当它与在纯水中带有正电荷的type a明胶分子接触后,通过强烈的静电相互作用,整个体系将会成为剪切变稀性生物材料(shear-thinning biomaterial,stb),可以很好的抵抗液体稀释作用(sci transl med,2016.8(365):365ra156)。由于type a明胶分子的等电点为ph7-9,当ph值大于9时,它将仅携带负电荷。因此本项目中,具有多氨基结构的聚乙烯亚胺(polyethylenimine,pei)分子会接枝到type a明胶分子上,使其在任何ph条件下都携带正电荷,从而维持水凝胶材料的黏度。
[0030]
4)很好的促进了大鼠血清中tgfβ1的激活,促进了细胞迁移以及体内骨修复
[0031]
通过使用pbs和磷酸盐缓冲液调节材料ph值后,我们发现碱性材料可以有效激活大鼠血清中的tgfβ1。激活的血清可以促进细胞迁移。另外,将生物材料注射到大鼠颅骨缺损中,碱性材料表现出更好的骨修复能力。
附图说明
[0032]
图1制备粒径均一的明胶微球,其中a.微流控芯片设计图;b.明胶微球液滴在微流控芯片管道中形成;c.利用微流控方式制作出的明胶微球显微光镜照片。
[0033]
图2为elisa法检测不同ph的碳酸氢钠碱溶液在不同时间点激活大鼠血清中的tgfβ1情况。
[0034]
图3不同组水凝胶对大鼠血清ph值的影响及不同时间点激活大鼠血清tgfβ1的情况,其中a.激活实验示意图;b.材料激活血清中tgfβ1定量结果;c.材料与血清孵育后ph变化结果。
[0035]
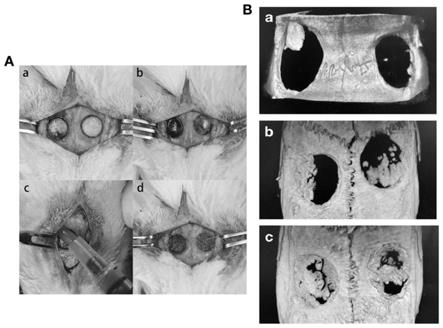
图4:体内实验验证不同组水凝胶的成骨作用,其中a.构建大鼠颅骨缺损模型,注射不同组水凝胶于缺损区域;b.三个月后μct分析不同组水凝胶的成骨效果(a.空白对照组;b.ph7 mgel组;c.ph10 mgel组)。
具体实施方式
[0036]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0037]
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述,附图中给出了本发明的若干实施例,但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容更加透彻全面。
[0038]
实施例1可原位激活内源性tgfβ1的可注射型骨修复材料的制备
[0039]
水凝胶材料分为基质和明胶微球两部分。其中明胶微球采用微流控的方式制备。为保证最终水凝胶材料的可注射性,制备出的明胶微球直径需控制在120μm左右。
[0040]
(1)typea明胶微球的制备:微流控系统的核心部件是微流控芯片。芯片应用
solidworkscad软件设计后数控切削,采用pmma树脂制成,厚度3mm,内部孔道宽度为150μm。配置水相为5%的typea明胶溶液,油相为含20wt%表面活性剂span80的矿物油,油相与水相注射速度分别为18.8ul/min及3.08ul/min。收集装置置于15℃水浴中,可以使流出的明胶液滴凝结成胶体状态,之后加入50ml的5%的戊二醛水溶液,4℃条件下剧烈搅拌5h使明胶微球交联固定。使用环己烷洗去矿物油,再用无水乙醇洗去残留的环己烷,用去离子水洗去无水乙醇后,将微球分散到25mm足量的甘氨酸水溶液中震荡1h,以封闭游离的醛基末端。最后反复去离子水清洗,冻干获得粒径~120μm的明胶微球(图1)。
[0041]
(2)pei改性明胶分子:分别将pei和typea明胶溶解在0.1mol/l的2-(n-吗啉代)乙磺酸缓冲液(mes)中,ph=6;加入催化剂碳化二亚胺(edc)和稳定剂n-羟基琥珀酰亚胺(nhs)后,37℃搅拌反应24h,得到pei改性的明胶分子。优选地,0.9g的typea明胶,180mg的pei(分子量1800da),38.34mg的edc和23.02mg的nhs溶解在上述100ml的mes中,在37℃反应24小时后,在去离子水环境中透析三天,之后冻干得到pei改性的明胶。茚三酮实验可以对氨基进行定量,pei改性后的明胶分子氨基含量提高,分散实验以及流变学结果证实pei改性后的明胶分子与锂藻土颗粒结合力更强,水中不易分散。
[0042]
(3)含水基质:在水中溶解pei改性的明胶,并将锂藻土在水中震荡分散30s,之后将它们混合均匀,得到含水基质,其中锂藻土水凝胶终浓度为4.5wt%,pei改性的明胶浓度为2wt%。
[0043]
(4)激活血清中的ltgfβ1:收集sd大鼠全血,静置半小时待血液凝固后,经5000rpm,10min离心得到血清。使用1m的氢氧化钠和盐酸溶液调节血清酸碱强度,使其ph值分别为9、10、11和12,分别维持0.5h、2h和20h后,将所有血清样品的ph值调回7.4,之后采用elisa法检测大鼠血清中的tgfβ1的含量(图2)。结果证实,ph10的酸碱强度适中且0.5小时可以有效激活血清中的tgfβ1到10ng/ml左右。
[0044]
(5)制备可注射型骨修复材料:首先采用扩散负载法使明胶微球内分别吸附碱性和中性盐。分别置入ph10的碳酸氢钠溶液和ph7.4的pbs溶液中0.5h后冻干,将冻干的微球与pei改性或pei未改性的明胶基质以5:1的比例混合后制备四种不同的可注射水凝胶,elisa法检测四种水凝胶0.5到48小时分别激活大鼠血清中tgfβ1的变化(图3a和b)。同时,使用电子ph计测定上述血清样品的ph值变化(图3c)。结果证实,ph10的可注射水凝胶碱强度适中且可在0.5、10、24和48小时内有效激活大鼠血清中的tgfβ1。
[0045]
实施例2可原位激活内源性tgfβ1的可注射型骨修复材料的应用
[0046]
首先构建sd大鼠颅骨缺损模型。2%的戊巴比妥钠腹腔注射麻醉,固定大鼠头部,备皮,2%的碘伏消毒,颅中缝处正中切开皮肤和肌层5-8mm,剥离骨膜暴露骨面。在颅中缝两侧用外直径5mm环钻制造圆形骨缺损,在缺损区域注射ph7 pei改性的明胶基质微球水凝胶(ph7 mgel)及ph10 pei改性的明胶基质微球水凝胶(ph10 mgel),用5-0的可吸收线缝合肌层,5-0丝线缝合皮肤层。将术后大鼠放在37℃保温垫上直至大鼠苏醒恢复意识,分笼正常喂养。三个月后,co2箱中处死大鼠,颅骨取材后μct扫描,三维重建分析成骨效果。研究结果初步证实,ph10pei改性组的微球水凝胶成骨作用更好(图4)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1