抗IHNV和IPNV共感染海带提取物的制备与应用的制作方法
抗ihnv和ipnv共感染海带提取物的制备与应用
技术领域
1.本发明属于提取物领域,具体涉及一种抗ihnv和ipnv共感染的海带提取物的制备与应用。
背景技术:
2.鲑鳟是国际上主流的水产养殖品种,也是我国主要养殖的冷水性经济鱼类。传染性造血器官坏死病(infectious hematopoietic necrosis,ihn)和传染性胰腺坏死病(infectious pancreatic necrosis,ipn)属于急性病毒病,主要感染鲑鳟鱼类。目前,ihn和ipn是严重威胁鲑鳟鱼产业发展的重大疫病。
3.在自然发病情况下,ihn和ipn的致死率均高达90%以上。在鲑鳟养殖过程中,ihn病毒(ihnv)和ipn病毒(ipnv)具有潜伏期短,传播速度快,且常发生共感染等特点,这极大地增加了病毒性疾病暴发与流行的风险,给鲑鳟鱼养殖带来了更为严重的危害。目前,我国缺乏防控ihnv和ipnv药物。由于疫苗产品的研发周期长、技术难度较大,国内学者对ihnv和ipnv疫苗的研发仍处于实验室阶段,且疫苗的免疫效果(安全性、有效性、稳定性)仍存在很多的问题。因此,亟需开发一种新型抗ihnv和ipnv共感染的药物。
技术实现要素:
4.本发明要解决的技术问题是如何抑制传染性造血器官坏死病毒和传染性胰腺坏死病毒,减少水产养殖业的损失。
5.为解决上述技术问题,第一个方面,本发明提供海带提取物在制备病毒抑制剂或抗病毒药物中的应用,所述病毒为传染性造血器官坏死病毒和传染性胰腺坏死病毒,
6.所述海带提取物按照包括如下步骤的方法制备:
7.1)海带粗提物的制备:包括去除海带浸提液中的蛋白质,得到海带粗提物;所述海带浸提液是对海带进行酶解和水提获得的提取液,
8.2)乙醇沉淀透析保留液收集沉淀获得海带提取物,所述透析保留液为对所述海带粗提物用透析袋法进行透析纯化获得的袋内液体。
9.进一步地,上述的应用中,所述海带浸提液按照包括1-1)和1-2)的方法制备:
10.1-1)将海带和水混合,获得海带浸泡液;
11.1-2)用纤维素酶、果胶酶和木瓜蛋白酶处理所述海带浸泡液获得水提液,对所述水提液进行过滤,收集滤液,对所述滤液进行离心,收集上清液获得海带浸提液。
12.进一步地,上述的应用中,所述1-1)将海带和水混合,获得海带浸泡液具体包括:将干燥的海带(laminaria japonica)(由叶状体和柄组成)粉碎过20目筛,得到海带干粉;取蒸馏水与海带干粉混合使其液料比达到30:1(即蒸馏水与海带干粉的质量比为30:1),浸泡6h,得到海带浸泡液。
13.进一步地,上述的应用中,所述1-2)中用纤维素酶、果胶酶和木瓜蛋白酶处理所述海带浸泡液获得水提液包括:
14.调节所述海带浸泡液的ph至5.0,加入纤维素酶,55℃酶解20min,得到纤维素酶解液;调节所述纤维素酶解液的ph至4.2,加入果胶酶,50℃酶解2h,得到果胶酶解液;调节所述果胶酶解液ph至6.0,加入木瓜蛋白酶,50℃酶解2h后在75℃下浸提3h,得到所述水提液。
15.其中,纤维素酶具体可为来源于里氏木霉atcc26921的纤维素酶,其cas号为9012-54-8。所述纤维素酶可为阿拉丁试剂公司的货号为c128647的产品,添加量可为10u/g干燥的海带。
16.果胶酶具体可为来源于黑曲霉的果胶酶,其cas号为9032-75-1。所述果胶酶可为阿拉丁试剂公司的货号为p116864的产品,添加量可为10u/g干燥的海带。
17.木瓜蛋白酶的cas号为9001-73-4。所述木瓜蛋白酶可为阿拉丁试剂公司的货号为p164463的产品,添加量可为10u/g干燥的海带。
18.进一步地,所述1-2)中的过滤可为真空抽滤,所用布氏漏斗为上海华科产品,布氏漏斗的规格为150mm,所述滤纸为皎洁牌定量滤纸,规格为中速15cm。
19.进一步地,上述的应用中,所述1-2)中所述离心条件为3500g离心15min。
20.进一步地,上述的应用中,所述1)中采用sevage法去除海带浸提液中的蛋白质。
21.进一步地,上述的应用中,所述采用sevage法去除海带浸提液中的蛋白质包括在3500g离心10min。
22.进一步地,上述的应用中,所述sevage法去除海带浸提液中的蛋白质还包括:
23.s1)去除海带浸提液中的蛋白质前,对所述的海带浸提液60℃减压浓缩至原体积的1/10,获得浓缩的海带浸提液;
24.s2)将氯仿和正丁醇按4:1的体积比混合得到混合试剂。将混合试剂与浓缩的海带浸提液按照1:2的体积比混合,放置于空气振荡器中室温剧烈震荡30min;
25.s3)然后将震荡后的混合液进行上述条件离心。
26.进一步地,上述的应用中,所述2)中,所述透析的截留分子量为3500da。
27.进一步地,上述的应用中,2)中所述乙醇沉淀透析保留液收集沉淀包括3500g离心10min,收集沉淀的步骤。
28.进一步地,上述的应用中,所述2)包括对所述沉淀冷冻干燥,制备成干粉的步骤。
29.本发明中,所述冷冻干燥可为真空冷冻干燥。
30.为解决上述技术问题,第二个方面,本发明提供海带在制备病毒抑制剂或抗病毒药物中的应用,所述病毒为传染性造血器官坏死病毒和传染性胰腺坏死病毒。
31.为解决上述技术问题,第三个方面,本发明提供海带在制备上述的海带提取物中的应用。
32.本发明中,所述传染性造血器官坏死病毒可为虹鳟传染性造血器官坏死病毒hlj-15。传染性造血器官坏死病毒hlj-15于2016年4月15日保藏于中国典型培养物保藏中心(简称cctcc;地址:中国武汉,武汉大学;邮编:430072),保藏编号为cctcc no:v201622。
33.本发明中,所述传染性胰腺坏死病毒可为传染性胰腺坏死病毒ipnv-chrtm213毒株。
34.本发明中,所述海带可为laminaria japonica。所述海带可由叶状体和柄组成。
35.本研究以抗ihnv和ipnv为切入点,在细胞水平上筛选获得具有显著抗ihnv和ipnv共感染的海带提取物,这将有助于提升防控ihnv和ipnv的水平,进而减少ihnv和ipnv共感
染给我国水产养殖业带来的经济损失。
36.保藏说明
37.保藏物名称:虹鳟传染性造血器官坏死病毒hlj-15
38.菌株编号:hlj-15
39.保藏机构:中国典型培养物保藏中心
40.保藏机构简称:cctcc
41.地址:中国武汉,武汉大学,邮编:430072
42.保藏日期:2016年4月15日
43.保藏中心登记入册编号:v201622
附图说明
44.图1为海带提取物对细胞安全性分析。
45.图2为海带提取物对ihnv和ipnv共感染的抑制作用。
46.图3为海带提取物对ihnv和ipnv mrna表达的抑制作用。
具体实施方式
47.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
48.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
49.传染性胰腺坏死病毒ipnv-chrtm213毒株分离于某虹鳟养殖场,在文献“feng ji,jing-zhuang zhao,miao liu,tong-yan lu,hong-bai liu,jiasheng yin,li-ming xu.complete genomic sequence of an infectious pancreatic necrosis virus isolated from rainbow trout(oncorhynchus mykiss)in china.virus genes.2016-11-20”中公开,公众按照国家生物安全的有关规定可从申请人处获得该生物材料,所得上述生物材料只为重复本发明的实验所用,不可作为其它用途使用。
50.虹鳟传染性造血器官坏死病毒hlj-15于2016年4月15日保藏于中国典型培养物保藏中心(简称cctcc;地址:中国武汉,武汉大学;邮编:430072),保藏编号为cctcc no:v201622。
51.鲑鱼胚胎细胞(salmon embryo cell line,chse-214细胞)来源于中国典型培养物保藏中心(简称cctcc),编号为gdc0168。
52.下述实施例中所述海带指(laminaria japonica),为市场购买。
53.下述实施例中的纤维素酶cas号为9012-54-8,为阿拉丁试剂公司、商品目录号为c128647的产品;果胶酶cas号为9032-75-1,为阿拉丁试剂公司、商品目录号为p116864的产品;木瓜蛋白酶cas号为9001-73-4,为阿拉丁试剂公司、商品目录号为p164463的产品。
54.下述实施例采用spss19.0统计软件对数据进行处理,实验结果以平均值
±
标准偏差表示,采用one-way a nova检验,p<0.05表示具有显著性差异。
55.实施例1、海带提取物的制备
56.1.1、海带粗提物的制备
57.1.1.1、海带浸提液的制备
58.海带浸提液的制备包括如下步骤:
59.步骤1、将干燥的海带(laminaria japonica)(由叶状体和柄组成)粉碎过20目筛,得到海带干粉;取蒸馏水与海带干粉混合使其液料比达到30:1(即蒸馏水与海带干粉的质量比为30:1),浸泡6h,得到海带浸泡液。
60.步骤2、酶解:将步骤1获得的海带浸泡液放置在超声波振荡器中(超声功率360w)超声30min,用hcl或naoh调节海带浸泡液的ph值至5.0,加入纤维素酶,55℃酶解20min,得到纤维素酶解液;用hcl或naoh调节纤维素酶解液的ph值至4.2,加入果胶酶,50℃酶解2h,得到果胶酶解液;用hcl或naoh调节果胶酶解液的ph值至6.0,加入木瓜蛋白酶,50℃酶解2h后,在75℃下浸提3h,得到水提液。
61.其中,纤维素酶具体可为来源于里氏木霉atcc26921的纤维素酶,其cas号为9012-54-8。所述纤维素酶可为阿拉丁试剂公司的货号为c128647的产品,添加量可为10u/g干燥的海带。
62.果胶酶具体可为来源于黑曲霉的果胶酶,其cas号为9032-75-1。所述果胶酶可为阿拉丁试剂公司的货号为p116864的产品,添加量为10u/g干燥的海带。
63.木瓜蛋白酶的cas号为9001-73-4。所述木瓜蛋白酶可为阿拉丁试剂公司的货号为p164463的产品,添加量为10u/g干燥的海带。
64.步骤3、离心:将步骤2获得的水提液进行真空抽滤(布氏漏斗),收集滤液,将滤液3500g离心15min,收集上清液和沉淀。
65.所用布氏漏斗为上海华科产品,布氏漏斗的规格为150mm,所述滤纸为皎洁牌定量滤纸,规格为中速15cm。
66.步骤4、将蒸馏水与步骤3获得的沉淀按照质量比为30:1的比例混合后,重复步骤2和步骤3,收集上清液。
67.步骤5、合并步骤3和步骤4获得的上清液,得到海带浸提液。
68.1.1.2、去除蛋白的海带浸提液的制备
69.采用sevage法纯化1.1.1获得的海带浸提液,包括如下步骤:
70.步骤1:将海带浸提液60℃减压浓缩至原体积的1/10,获得浓缩的海带浸提液。
71.步骤2:将氯仿和正丁醇按4:1的体积比混合得到混合试剂。将混合试剂与浓缩的海带浸提液按照1:2的体积比混合,放置于空气振荡器中室温剧烈震荡30min;
72.步骤3:3500g,10min离心收集上清液,去蛋白质;
73.重复步骤1和步骤2直至无蛋白质出现,获得的液体为去除蛋白的海带浸提液,即为海带粗提物。
74.1.2、透析获得海带提取物
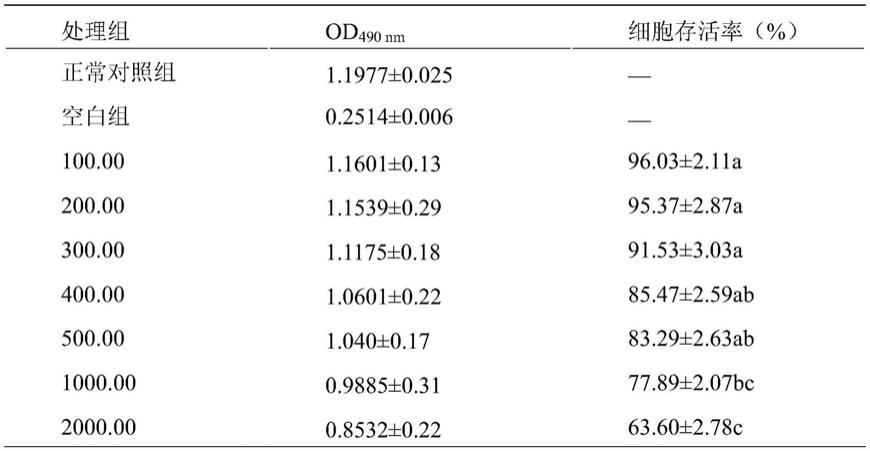
75.步骤1:对1.1.2获得的海带粗提物用透析袋(截留分子量为3500da)在流动的去离子水中进行透析5小时,收集透析袋内的液体即透析保留液;
76.步骤2:将步骤1获得的透析保留液与是其3倍体积的无水乙醇混合,4℃静置24h;将静置混合液3500g离心10min收集沉淀,真空干燥,得到海带提取物。
77.实施例2、海带提取物对细胞安全性的分析
78.2.1、测定方法
79.将chse-214细胞以每孔1.0
×
104个/100μl细胞接种于96孔板中培养24h后开展细胞安全性分析。采用细胞维持液溶解实施例1的海带提取物使其含量分别100、200、300、400、500、1000和2000μg/ml,得到含不同浓度海带提取物的细胞维持液。实验组:弃去96孔板培养液(mem培养基中加入10%fbs、100u/ml青霉素和100u/ml链霉素)后,分别吸取100μl含不同浓度海带提取物的细胞维持液加入到chse-214细胞中,每组8个重复,二氧化碳培养箱15℃培养。同时设正常对照组(接种细胞,不加海带提取物,即用细胞维持液培养)和空白组(不接种细胞,不添加海带提取物,即只添加细胞维持液)。培养7d后mts法测定细胞活性。
80.其中,细胞维持液是向mem培养基中加入fbs、青霉素和链霉素得到的液体,细胞维持液中,fbs的含量为2%、青霉素的含量为100u/ml,链霉素的含量为100u/ml。
81.细胞存活率(细胞活力)(%)=(a
实验组-a
空白组
)/(a
正常对照组-a
空白组
)
×
100%。
82.mts法测定细胞活性的具体步骤为:7天培养结束后,每孔加入30μl mts试剂(promega,g3582),混合均匀置于37℃,co2浓度为5%的培养箱中孵育2h,490nm读取吸光度值。
83.2.2、测定结果
84.细胞存活率的计算结果见图1、表1。从结果中看出,海带提取物浓度在0-300μg/ml范围内,chse-214细胞活性保持在90%以上。当细胞中添加500μg/ml海带提取物时,chse-214细胞活性可以保持在80%以上。当细胞中添加的海带提取物的浓度高于500μg/ml时,细胞存活率随着海带提取物浓度升高而降低。上述结果表明海带提取物浓度在300μg/ml范围内对chse-214细胞具有较好的安全性。
85.表1.海带提取物对细胞的安全性
[0086][0087]
注:不同字母代表差异显著
[0088]
实施例3、海带提取物对ihnv和ipnv共感染细胞的保护作用
[0089]
3.1、测定方法
[0090]
将chse-214细胞每孔1.0
×
104个/100μl细胞接种于96孔板中培养24h后开展抗ihnv、ipnv作用研究。
[0091]
采用细胞维持液(mem培养基中加入2%fbs、100u/ml青霉素和100u/ml链霉素)溶解海带提取物,并与hlj-15和ipnv病毒悬液混匀制备含分别为0、100、200、300、400、500μg/ml的混合液。弃去96孔板细胞培养液(mem培养基中加入10%fbs、100u/ml青霉素和100u/ml链霉素),分别吸取100μl上述混合液加入到chse-214细胞中,使每孔中的hlj-15的moi为1.0,使每孔中的ipnv的moi为0.01,每组8个重复,二氧化碳培养箱15℃培养,观察细胞病变(cpe)情况。实验同时设阳性组(接种细胞,接种hlj-15(moi,1.0)和ipnv(moi,0.01),不加海带提取物)、正常对照组(接种细胞,不加海带提取物,不接病毒)和空白组(不接种细胞,不添加海带提取物,不接种病毒)。
[0092]
当阳性对照组cpe达到75%以上时参照实施例2中mts法测定细胞活性。并计算病毒抑制率。
[0093]
病毒抑制率(%)=(a
实验组组-a
阳性组-a
空白组
)/(a
正常对照组-a
阳性组-a
空白组
)
×
100%。
[0094]
其中,细胞维持液是向mem培养基中加入fbs、青霉素和链霉素得到的液体,细胞维持液中,fbs的含量为2%、青霉素的含量为100u/ml,链霉素的含量为100u/ml。
[0095]
hlj-15为传染性造血器官坏死病毒,ipnv为传染性胰腺坏死病毒。
[0096]
ihnv(hlj-15)细胞病变的判断标准为细胞核变大,核膜逐渐肥厚,细胞染色质趋向边缘并呈颗粒状,空斑边缘处细胞相互牵连。
[0097]
ipnv细胞病变的判断标准为细胞呈拉网状,核固缩,空斑明显。
[0098]
3.2、测定结果
[0099]
测定结果见图2、表2。从结果中可以看出,海带提取物浓度为200μg/ml时,其对ihnv与ipnv共感染的抑制能力达到最高,为55.06%;且随着海带提取物浓度的升高其对ihnv与ipnv共感染的抑制作用明显降低。
[0100]
表2.海带提取物对ihnv与ipnv共感染的抑制活性
[0101][0102]
注:不同字母代表差异显著
[0103]
实施例4、海带提取物对ihnv和ipnv mrna表达的抑制作用
[0104]
4.1、测定方法
[0105]
将含200μg/ml海带提取物的细胞维持液(100μl)加入到chse-214细胞中15℃条件下5%浓度的二氧化碳培养箱孵育12h,然后弃掉维持液并接种hlj-15和ipnv悬液使其moi分别为1和0.01,置于15℃,5%浓度的二氧化碳培养箱中,孵育1h后更换新鲜的细胞维持
液,继续培养42h后收集细胞,以相同条件下不经海带提取物处理,且接种hlj-15和ipnv的chse-214细胞(感染组)作为对照。
[0106]
采用trizol法提取细胞总rna,利用rt-qpcr技术检测细胞中编码ihnv和ipnv结构蛋白基因ihnv-n、ihnv-g、ihnv-l、ipnv-vp2的含量,以内参β-actin矫正个体之间的差异,采用2
-
△△
ct
法进行数据分析,每个样本重复3次。
[0107]
rt-qpcr检测的具体步骤为:利用one stepplus rt-pcr kit(perfect real time)(takara,rr096a)试剂盒,参照说明书方法对ihnv-n、ihnv-g、ihnv-l、ipnv-vp2基因含量进行分析,rt-qpcr引物序列见表3。
[0108]
表3.相关基因的引物信息
[0109][0110]
4.2、测定结果
[0111]
测定结果如图3,从图3中可以看出,与共感染组相比,200μg/ml海带提取物处理chse-214细胞后其细胞内ihnv-n、ihnv-g、ihnv-l、ipnv-vp2基因的含量显著下降。这一结果显示海带提取物可显著抑制细胞内ihnv与ipnv mrna的表达。
[0112]
本发明制备获得具有显著抗ihnv和ipnv共感染活性的海带提取物,200μg/ml浓度海带提取物可显著抑制ihnv与ipnv mrna的表达,对ihnv与ipnv共感染的抑制率达到了55.06%。可见,该海带提取物有望成为抗ihnv和ipnv共感染的新型药物。
[0113]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1