一种可防粘连的肌腱材料及其制备方法与流程
1.本发明属于组织工程再生医疗产品技术领域,具体涉及一种可防粘连的肌腱材料及其制备方法。
背景技术:
2.肌腱损伤是一种常见的运动损伤,一般需要以外科手术进行修补或缝合。由于肌腱的血供较差,肌腱损伤后难以自愈,术后约40%的患者会发生不同程度的肌腱粘连,严重影响了患者功能的康复。当前的研究认为,肌腱粘连是机体一种无菌性纤维增生炎症反应,机体在物理、化学和生物等各种因素刺激下,释放组胺、缓激肽等血管活性物质及细胞因子,使得局部毛细血管通透性增加,导致充血、水肿并形成炎性渗出,渗出液中含有的纤维蛋白、多核细胞和炎性细胞等刺激肌腱周围组织中的成纤维细胞增殖并产生胶原纤维,从而形成粘连。
3.目前,物理隔离是临床最常用的降低肌腱粘连的方法之一,市面上最常见的有硅胶膜、透明质酸膜、几丁质膜、聚乳酸膜、生物羊膜、自体或异体筋膜等(周秀军.不同生物材料预防肌腱损伤后粘连的评价[j].中国组织工程研究与临床康复,2010,14(21):3915-3918;康东.可吸收生物材料在肌腱损伤重建中的防粘连作用[j].中国组织工程研究,2016,20(21):3185-3192.),如专利202010574129.9公开的为壳聚糖修饰的胶原蛋白膜,专利202110906851.2公开的为新鲜羊膜负载药物来昔布,专利202110264223.9则为聚乳酸与i型胶原蛋白按一定比例、分层次复合的膜,这些膜产品具有一定的防止肌腱粘连的作用,但膜与机体黏附性较差,手术时经常需要缝合,固定包裹操作繁琐;同时,这些膜主要通过物理屏障作用,将肌腱周围渗出的纤维蛋白、多核细胞和炎性细胞与肌腱隔离,阻碍了腱周成纤维细胞分泌胶原纤维与肌腱的粘连,发挥防粘连作用,此外,物理隔离反而不利于肌腱组织获取营养物质,延长肌腱组织的再生重建过程。
[0004]
另外,也有一些研究者使用间充质干细胞外泌体(姚之肖.人脐带间充质干细胞外泌体对肌腱修复的作用及相关机制研究.上海交通大学博士学位论文,2020年6月.)或巨噬细胞外泌体(崔昊旻.巨噬细胞外泌体mi rna介导肌腱粘连的机制研究.上海交通大学博士学位论文,2019年5月.)开展了肌腱防粘连的机制性研究,但是众所周知的是,脐带间充质干细胞常作为局部组织免疫微环境的调节,并不具有免疫调节的靶向性;而迄今为止,巨噬细胞在肌腱粘连的形成过程中的角色仍然是一个有争议的话题,一些研究认为巨噬细胞缺少才可以显著改善组织愈合的治疗,减少腱周粘连形成;一些关于巨噬细胞与器官纤维化的研究也表明,巨噬细胞缺失可以显著改善器官愈合,有效防止纤维化基本的发生发展,进一步验证了巨噬细胞是多种组织愈合中的不利因素,因此,使用巨噬细胞外泌体干预肌腱粘连可能并非是一个比较好的选择。
技术实现要素:
[0005]
本发明的目的在于提供一种可防粘连的肌腱材料及其制备方法。
[0006]
一种可防粘连的肌腱材料,所述肌腱材料由调节性t淋巴细胞(regulotary t cell,treg)外泌体与肌腱组成,通过将t淋巴细胞外泌体与肌腱复合后经冻干制备而成。
[0007]
所述t淋巴细胞外泌体用量为1
×
(106~10
20
)个/每g肌腱,肌腱为脱细胞肌腱和/或非脱细胞肌腱。
[0008]
所述肌腱来源于人,非人灵长类动物,猪、马、牛、羊等动物。
[0009]
所述肌腱经深低温冷冻处理和/或经脱细胞处理,其中深低温处理的温度低于-20℃,脱细胞处理方法包括但不限于物理、化学和/或生物学方法。
[0010]
所述调节性t淋巴细胞的表面抗原为cd4、cd25和/或foxp3抗原,来源于人、非人灵长类动物、猪、牛、羊马等的外周血、脐带血、骨髓血或脾脏。
[0011]
所述调节性t淋巴细胞外泌体膜表面表达cd4、cd25和cd73抗原,外泌体粒径介于10~500nm之间。
[0012]
一种可防粘连的肌腱材料的制备方法,按照如下步骤进行:
[0013]
(1)去除肌腱材料的脂肪和筋膜,以75%酒精消毒后,经深低温冷冻至少4周,或经脱细胞处理后再深低温冷冻至少24h;
[0014]
(2)将冷冻的肌腱置于冷冻干燥机中,冻干36~72h;
[0015]
(3)将调节性t淋巴细胞外泌体悬浮于无菌生理盐水或磷酸盐缓冲液中,按1g肌腱复合1
×
(106~10
20
)个外泌体的比例,将调节性t淋巴细胞外泌体悬浮液均匀施加于冻干肌腱,4~25℃条件下静置至少2h,然后深低温冷冻至少24h;
[0016]
(4)将步骤(3)制备的复合调节性t淋巴细胞外泌体的肌腱置于冷冻干燥机中,冻干36~72h,即得可防粘连的肌腱。
[0017]
所述深低温冷冻的温度低于-20℃。
[0018]
本发明的有益效果:treg细胞外泌体可诱导植入肌腱组织部位的免疫耐受,解除肌腱组织植入局部的无菌性炎症反应,使得肌腱周围组织中的成纤维细胞不会过度增殖并分泌过多胶原纤维等细胞外基质。treg细胞外泌体可减少炎性细胞浸润,减少成纤维细胞以及来自内膜的内在肌腱细胞被募集至损伤部位,避免形成无序的细胞外基质。复合treg细胞外泌体的肌腱组织暴露于体液中,可充分获得营养物质,可加快植入腱细胞长入肌腱组织中,缩短肌腱组织再生重建的时间。treg细胞可大规模培养,treg细胞外泌体获取容易,treg细胞外泌体与肌腱材料冻干后,可于冷藏条件或室温条件下长时间保存,货架有效期长,制备的肌腱材料使用方便,无需物理隔离。
附图说明
[0019]
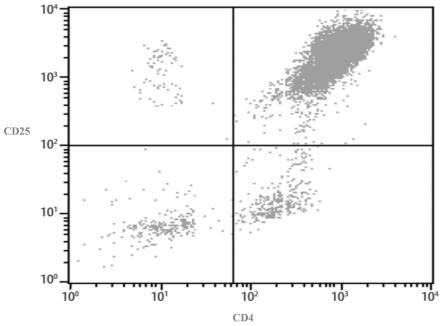
图1为treg细胞表面抗原检测。
[0020]
图2为treg细胞外泌体形态。
[0021]
图3为treg细胞外泌体粒径分布。
[0022]
图4为treg细胞外泌体膜表面抗原表达。
[0023]
图5为术后4周各组腱鞘缺损区大体观察;
[0024]
图中,a:treg-exos组;b:生物羊膜组;c:msc-exos组;d:对照组。
[0025]
图6为术后4周各组腱鞘缺损区组织学观察(he染色,
×
100);
[0026]
图中,a:treg-exos组;b:生物羊膜组;c:msc-exos组;d:对照组。
具体实施方式
[0027]
为了便于理解本发明,下面将对本发明进行更全面的描述。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
[0028]
实施例1 treg细胞外泌体的制备
[0029]
(1)诱导细胞原代培养:无菌采集人外周血,密度梯度离心法分离外周血中的单个核细胞,按照8
×
106/ml的密度加入预先使用抗cd3单抗和抗cd28单抗包被的培养容器中,再加入含tgf-β、il-2和10%血清替代物的培养基,于37℃、5%co2培养箱中培养,诱导treg细胞扩增。
[0030]
(2)细胞传代扩增:每隔2天补充一次含tgf-β、il-2的培养基,培养1周后,将培养基更换为只添加il-2,37℃、5%co2培养箱中继续培养,共培养3周。
[0031]
(3)细胞表型检测:收集treg细胞,吸取2
×
106个细胞,加入抗人cd4-fitc和抗人cd25-pe流式抗体,孵育30min,清洗后上流式细胞仪检测,foxp3则使用foxp3检测试剂盒进行染色(图1)。
[0032]
(4)treg细胞外泌体制备:将收集的treg细胞按照5
×
106个/ml重悬于含il-2的培养基中,于37℃、5%co2培养箱中48h,收集细胞培养上清液,4℃条件下,依次于500g离心15min,除去细胞;上清液再于2000g离心15min,除去细胞碎片。上清液转入超速离心管中,4℃、12000g离心30min,取上清液转入新的超速离心管中,4℃、120000离心60min,弃掉上清液,取离心沉淀物,加入0.9%生理盐水重选,即得外泌体悬液。
[0033]
透射电镜观察外泌体形态(图2)和粒径大小(图3),流式细胞术检测外泌体表面cd4、cd25和cd73抗原的表达(图4)。
[0034]
调节性t细胞(t regulatory cell,treg)是具有免疫调节活性的t细胞亚群,在建立机体的免疫耐受和维持机体稳态中发挥重要作用。treg细胞包括cd4
+
treg细胞、cd8
+
treg以及nkt细胞等。cd4
+
cd25
+
foxp3
+
treg细胞属于cd4
+
t细胞亚群,占正常人外周血及脾脏组织中的cd4
+
t细胞的5%~10%。
[0035]
treg细胞通过其表面表达抑制性分子、分泌抑炎性细胞因子,直接发挥细胞毒作用以及改变抗原呈递细胞的抗原提呈功能而发挥免疫调节作用,以旁分泌和内分泌方式与其他细胞相互作用,进而发挥免疫调节作用,维持自身免疫耐受和调控免疫应答。
[0036]
实施例2外泌体与肌腱的复合方法
[0037]
(1)肌腱原材料经物理方法去除脂肪和筋膜,以75%酒精消毒后,经深低温冷冻(-40℃)4周;
[0038]
(2)将冷冻的肌腱置于冷冻干燥机中,冻干48h;
[0039]
(3)提取的treg细胞外泌体悬浮于无菌生理盐水中,制备成treg细胞外泌体悬浮液,按1g肌腱复合1
×
10
12
个外泌体的比例,将treg细胞外泌体悬浮液均匀施加于冻干肌腱,18℃条件下静置3h,然后深低温冷冻(-40℃)32h;
[0040]
(4)最后,将复合treg细胞外泌体的肌腱置于冷冻干燥机中,冻干48h;
[0041]
(5)冻干机中取出肌腱,即得可防粘连的肌腱。
[0042]
实施例3肌腱复合treg细胞外泌体组合材料对鸡腱鞘缺损修复防粘连试验
[0043]
鸡大腿中上部肌肉注射地西泮注射液,常规消毒,于双侧第三趾跖侧面近位趾间
关节处做纵行2.5cm切口,分离皮下组织,显露腱鞘1.5cm,切除掌侧腱鞘1.0cm及趾浅屈肌腱,横行切断趾深屈肌腱1/2,用无创缝合线做改良kessler法中心缝合,用无创缝合线做周边缝合。treg-exo组:取treg细胞外泌体复合肌腱覆盖腱鞘缺损处,用无创缝合线作端对端缝合固定;msc-exo组:取msc外泌体复合肌腱覆盖腱鞘缺损处,用无创缝合线作端对端缝合固定;生物羊膜组:冻干生物羊膜以生理盐水复水后,覆盖腱鞘缺损处,上皮细胞面朝向肌腱侧,用无创缝合线做周边缝合固定;对照组不做腱鞘修复。4周后,处死动物,观察腱周组织粘连情况(表1、图5)并作粘连程度评分(表2);组织作石蜡切片,行he染色(图6)。
[0044]
表1各组腱周组织粘连情况
[0045]
组别腱周组织粘连情况treg-exo组腱周无明显水肿,无炎性反应,未见粘连存在,肌腱滑动性较好。msc-exo组轻微水肿,部分轻微粘连,肌腱滑动性好。生物羊膜组吻合处未见肉芽组织,无明显粘连,肌腱滑动性较好。对照组吻合处可见明显粘连,肉芽增生、变硬,肌腱滑动性较差。
[0046]
表2观察肌腱粘连程度评分结果(n=5)
[0047]
组别0级1级2级3级4级treg-exos组41000msc-exos组21110生物羊膜组22100对照组00131
[0048]
结论:使用treg细胞外泌体复合肌腱行鸡腱鞘缺损修复防粘连试验,结果显示,treg-exos组动物肌腱修复效果最好,无任何粘连,病理组织观察也发现,treg-exos组动物组织无明显炎性细胞浸润,肌腱细胞长入均匀,肌纤维组织纹理均匀,而其他三组均存在不同程度的炎性细胞浸润和组织粘连。
[0049]
按照目前较为公认的肌腱愈合理论,炎症介质在粘连发生过程中发挥重要作用。成纤维细胞被tgf-β等细胞因子激活后,在分泌胶原和α-sma的同时,可产生il-1β、il-6、tnf-α等多种炎性因子,加重了炎性渗出,从而促进粘连的发生。treg细胞外泌体利用其表面抗原,如cd25、cd73、ctla-4等,可阻止树突状细胞的抗原提呈,进而抑制淋巴细胞增殖,发挥免疫抑制作用,防止成纤维细胞、肌腱细胞因炎性刺激而过度分泌胶原蛋白等细胞外基质;同时,treg细胞外泌体载有的非编码rna、蛋白等组分可与炎性细胞,如中性粒细胞、单核细胞等相互作用,从而减少上皮和腱鞘的肌腱成纤维细胞以及来自内膜的内在肌腱细胞被募集至损伤部位,避免形成无序的细胞外基质。
[0050]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1