放射诱发毒性与机器学习的制作方法
1.本公开的各种实施例涉及通过利用机器学习算法来预测与放射疗法治疗相关联的放射诱发毒性的方法和设备。
背景技术:
2.放射疗法治疗使用例如电子或离子的带电粒子来治疗癌症。也可能的是使用光子。粒子将能量沉积在肿瘤上,以物理方式摧毁肿瘤。
3.放射疗法已经成为许多类型的癌症的有用治疗。尽管如此,已经观察到一些患者随后经历了放射诱发的毒性。这将在下文中进一步详细解释。
4.一个示例采用放射疗法治疗非小细胞肺癌(nsclc)。立体定向体部放射治疗(sbrt)是不能手术的早期nsclc患者的护理标准。然而,肺是对放射敏感的器官,并且放射性肺炎——作为放射诱发的毒性的示例——可能在暴露于大于5格雷的放射之后的仅几个月内出现。肺部肺炎表现为上皮细胞丧失、水肿、炎症、纤维化以及气道、血管和气囊阻塞。患者对放射性肺炎的易感性与任何先前存在的基础肺部疾病直接相关。附加地,对于人群展现出疗效的放射疗法的标准方法(诸如sbrt)对于个体患者可能并不实现最佳结果。
5.因此,难以基于个体患者的解剖和生理特征对当前的标准放射疗法治疗(诸如用于治疗nsclc的sbrt)进行个体化;因此,难以选择最有可能适合个体患者的放射疗法治疗,以最大化治疗反应的可能性,同时最小化不利影响的风险,诸如放射诱发的毒性。
技术实现要素:
6.因此,需要计划放射疗法治疗的先进技术。特别是,需要先进的技术来预测——在放射疗法治疗之前——患者对放射诱发的毒性的易感性。独立权利要求的特征满足了该需要。从属权利要求的特征限定了实施例。
7.公开了一种用于预测与患者目标区域的放射疗法治疗相关联的放射诱发毒性的风险的方法。该方法包括接收与包括目标区域的感兴趣区域相关联的数据。接收到的数据包括感兴趣区域的放射疗法治疗的预定义剂量图和放射疗法治疗前成像数据。该方法进一步包括将训练的机器学习算法应用于接收到的数据,并且由训练的机器学习算法基于接收到的数据生成至少一个毒性指标。所述至少一个毒性指标指示放射诱发毒性的风险。
8.公开了一种执行机器学习算法的训练的方法,所述机器学习算法用于预测与患者目标区域的放射疗法治疗相关联的放射诱发毒性的风险。该方法包括接收与包括目标区域的感兴趣区域相关联的训练数据的多个实例和参考数据的多个实例。参考数据的多个实例中的每一个对应于训练数据的相应实例。训练数据的多个实例中的每一个包括感兴趣区域的放射疗法治疗的剂量图和放射疗法治疗前成像数据。参考数据的多个实例中的每个实例包括至少一个诊断毒性指标,其指示放射诱发的毒性的诊断风险。该方法进一步包括通过机器学习算法处理训练数据的多个实例,以及通过机器学习算法并且为训练数据的多个实例中的每一个生成至少一个相应的估计毒性指标,所述至少一个相应的估计毒性指标指示
估计的放射诱发毒性风险。该方法进一步包括通过基于诊断毒性指标和对应的估计毒性指标之间的比较更新机器学习算法的参数值来执行机器学习算法的训练。
9.一种设备包括处理单元、存储器单元和输入/输出接口。处理单元被配置为执行存储在存储器单元中的程序,以执行用于预测与患者目标区域的放射疗法治疗相关联的放射诱发毒性的风险的方法。该方法包括接收与包括目标区域的感兴趣区域相关联的数据。接收到的数据包括感兴趣区域的放射疗法治疗的预定义剂量图和放射疗法治疗前成像数据。该方法进一步包括将训练的机器学习算法应用于接收到的数据,并且由训练的机器学习算法基于接收到的数据生成至少一个毒性指标。所述至少一个毒性指标指示放射诱发毒性的风险。
10.一种设备包括处理单元、存储器单元和输入/输出接口。处理单元被配置为执行存储在存储器单元中的程序,以执行用于执行机器学习算法的训练的方法,所述机器学习算法用于预测与患者目标区域的放射疗法治疗相关联的放射诱发毒性的风险。该方法包括接收与包括目标区域的感兴趣区域相关联的训练数据的多个实例和参考数据的多个实例。参考数据的多个实例中的每一个对应于训练数据的相应实例。训练数据的多个实例中的每一个包括感兴趣区域的放射疗法治疗的剂量图和放射疗法治疗前成像数据。参考数据的多个实例中的每个实例包括至少一个诊断毒性指标,所述至少一个诊断毒性指标指示放射诱发的毒性的诊断风险。该方法进一步包括通过机器学习算法处理训练数据的多个实例,以及通过机器学习算法并且为训练数据的多个实例中的每一个生成至少一个相应的估计毒性指标,所述至少一个相应的估计毒性指标指示估计的放射诱发毒性的风险。该方法附加地包括通过基于诊断毒性指标和对应的估计毒性指标之间的比较更新机器学习算法的参数值来执行机器学习算法的训练。
11.计算机程序产品或计算机程序或计算机可读存储介质包括程序代码。所述程序代码可以由至少一个处理器执行。执行所述程序代码使得所述至少一个处理器执行用于预测与患者目标区域的放射疗法治疗相关联的放射诱发毒性的风险的方法。该方法包括接收与包括目标区域的感兴趣区域相关联的数据。接收到的数据包括感兴趣区域的放射疗法治疗的预定义剂量图和放射疗法治疗前成像数据。该方法进一步包括将训练的机器学习算法应用于接收到的数据,并且由训练的机器学习算法基于接收到的数据生成至少一个毒性指标。所述至少一个毒性指标指示放射诱发毒性的风险。
12.计算机程序产品或计算机程序或计算机可读存储介质包括程序代码。所述程序代码可以由至少一个处理器执行。执行所述程序代码使得所述至少一个处理器执行一种方法,该方法执行机器学习算法的训练,用于预测与患者目标区域的放射疗法治疗相关联的放射诱发毒性的风险。该方法包括接收与感兴趣区域相关联的训练数据的多个实例,该感兴趣区域包括目标区域和参考数据的多个实例。参考数据的多个实例中的每一个对应于训练数据的相应实例。训练数据的多个实例中的每一个包括感兴趣区域的放射疗法治疗的剂量图和放射疗法治疗前成像数据。参考数据的多个实例中的每个实例包括至少一个诊断毒性指标,所述至少一个诊断毒性指标指示放射诱发的毒性的诊断风险。该方法进一步包括通过机器学习算法处理训练数据的多个实例,以及通过机器学习算法并且为训练数据的多个实例中的每一个生成至少一个相应的估计毒性指标,所述至少一个相应的估计毒性指标指示估计的放射诱发毒性的风险。该方法附加地包括通过基于诊断毒性指标和对应的估计
毒性指标之间的比较更新机器学习算法的参数值来执行机器学习算法的训练。
13.应该理解的是,在不脱离本发明的范围的情况下,上面提到的特征和下面将要解释的特征不仅可以用在所指示的相应组合中,而且还可以用在其他组合中或独立使用。
附图说明
14.图1是根据各种示例的用于放射疗法治疗的高能弯曲束(bent-beam)医用直线加速器的示意图示;图2示意性地图示了根据各种示例的放射疗法治疗的目标区域;图3是根据各种示例的方法的流程图;图4示意性地图示了根据各种示例的机器学习算法的示例性实现;图5是根据各种示例的另一方法的流程图;图6示意性地图示了根据各种示例的设备。
具体实施方式
15.在下文中,将参照附图详细描述本发明的实施例。应当理解,以下对实施例的描述不应被视为限制意义的。不旨在使本发明的范围受下文描述的实施例或附图限制,所述实施例或附图仅被视为是说明性的。
16.附图应被视为附图中图示的示意性表示和元素,其不一定按比例示出。相反,各种元素被表示成使得它们的功能和一般目的对于本领域技术人员而言变得显而易见。功能块、设备、组件或在附图中示出或在本文中描述的其他物理或功能单元之间的任何连接或耦合也可以通过间接连接或耦合来实现。组件之间的耦合也可以通过无线连接来建立。功能块可以用硬件、固件、软件或其组合来实现。
17.本文描述的各种示例通常涉及计划放射疗法治疗的技术。放射疗法治疗可以依靠照射肿瘤来摧毁癌细胞。可能的是使用带电粒子,诸如离子或电子或甚至高能光子。
18.因此,换句话说,放射疗法(也称为放射性疗法)是一种癌症治疗,它使用高剂量的放射来杀死癌细胞并缩小肿瘤。在高剂量下,放射疗法通过破坏癌细胞的脱氧核糖核酸(dna)来杀死癌细胞或减缓其生长。dna受损无法修复的癌细胞停止分裂或死亡。当受损细胞死亡时,它们被身体分解并移除。放射疗法不一定立即杀死癌细胞。在dna被破坏到足以导致癌细胞死亡之前要花费几天或几周的治疗。然后,在放射疗法结束后,癌细胞在数周或数月内不断死亡。
19.作为一般规则,存在主要两种类型的放射疗法,外部射束放射疗法和内部射束放射疗法。外部射束放射疗法是由将射线瞄准目标区域的机器生成的。通过将机器相对于患者进行相对定位,放射的入射路径可调整。另一方面,内部放射疗法是一种将放射源放入患者体内的治疗。放射源可以是固体或液体,分别被称为近距离放射疗法和系统疗法。
20.本文描述的各种技术通常涉及预测与放射疗法治疗相关联的放射诱发毒性的风险。更具体地,可以确定指示放射诱发毒性的风险的至少一个毒性指标。由此,可以做出放射疗法治疗的不良副作用的风险的预测。
21.通常有各种选项可用于实现所述至少一个毒性指标。下面的表1中总结了一些示例。
表1:通过本文所述技术生成的至少一个毒性指标的各种选项,来预测放射诱发毒性的风险。
22.根据本文描述的各种实例,可能的是获得多个这样的毒性指标或仅一个毒性指标。
23.将可能的是使用至少一个毒性指标来调整放射疗法治疗的治疗计划。各种选项可用于调整治疗计划。剂量图(参见表2示例i)可以调整。例如,将可能的是减少放射疗法治疗施用的剂量。将可能的是调整粒子的能量。将可能的是改变和影响粒子的路径。此类任务可以使用相应的算法由计算机实现。
24.根据各种示例,可能的是通过将训练的机器学习算法(诸如深度神经网络)应用于输入数据来确定至少一个毒性指标。
25.根据本文描述的各种示例,各种选项可用于实现输入数据。表1中列出了一些示例。
表2:当确定参见表1的至少一个毒性指标时要考虑的输入数据的各种选项。
26.根据本文描述的各种示例,这样的另一输入数据可以彼此组合,并作为聚合输入提供给机器学习算法,以然后生成至少一个毒性指标。例如,根据本文描述的示例,输入向量的不同通道可以与不同类型的输入数据相关联。各种技术都是基于如下发现:在表2中列出这样的输入数据可以示出与放射诱发毒性风险的强相关性,并且因此适合用作进行这样的预测的输入数据。
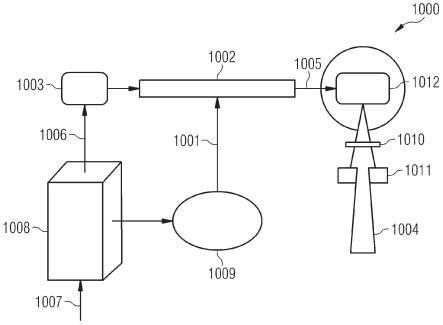
27.图1示意性地图示了用于为放射疗法治疗提供放射的放射源。这是用于放射疗法
的医疗工具的硬件实现的示例。如今,医用直线加速器(称为直线加速器)占据了临床使用中的大部分可操作的兆伏级放射疗法治疗单元。图1是示出了主要组件的高能弯曲束医用直线加速器1000的框图。直线加速器1000使用微波脉冲1001,其例如具有在s波段微波区域(例如,2856 mhz)中的生成电场的频率。微波脉冲1001的微波放射通过加速器波导1002传播,并且由电子枪1003生成并用于创建用于治疗的x射线、即光子(或电子)束1004的电子被注入到加速器波导1002中并被生成的电场加速。加速器波导1002的结构包括具有轴向孔1005的圆柱形金属腔的堆叠,被加速的电子穿过该轴向孔1005。直线加速器1000进一步包括调制器1008,其将线路ac(模拟电流)功率1007转换成产生微波脉冲1001所需的rf(射频)电源1009,以及供应给电子枪1003的高压脉冲1006。
28.一旦被加速,加速的高能电子就在轴向孔1005处出现,并被引导撞击金属靶(图1中未示出)。电子的该突然停止导致其动能部分转换为金属靶中的热量,并且部分转换为轫致辐射(bremsstrahlung)x射线的产生。因为加速器波导1002典型地被水平放置或相对于水平成一些角度放置,所以电子被弯曲系统1012弯曲,并在加速器波导1002和x射线靶之间通过合适的角度,通常是90度或270度。此外,直线加速器1000还包括用于调整放射剂量的剂量测定系统1010和/或准直系统1011。剂量测定系统1010和/或准直系统1011可以由计算设备控制,所述计算设备诸如是直接连接到直线加速器1000的计算机或服务器(图1中未示出)、经由网络远程连接到直线加速器1000的服务器或计算机。
29.直线加速器1000可以基于治疗计划进行操作,该治疗计划指定了其相对于患者的相对定位以及在每个位置中发射的粒子的能量。可以指定发射的持续时间。因此,治疗计划限定了剂量图(参见表2、示例i)。
30.图1的直线加速器1000是用于执行放射疗法治疗的硬件的一个示例。作为一般规则,本公开中提到的放射疗法治疗可以由以下放射疗法治疗系统中的任何一个来执行:调强放射疗法(imrt)系统、图像引导放射疗法(igrt)系统、调强艺术疗法(imat)系统、旋转imrt系统、断层治疗imrt、cyberknife
®
系统、伽玛刀系统、4-d igrt系统、质子束放射疗法(pbrt)系统、轻离子放射疗法系统、重离子放射疗法系统。
31.图2示意性地图示了包括肿瘤2050的目标区域2030和包括目标区域2030的感兴趣区域(roi)2020。roi 2020可以包括特定器官的部分或者是特定器官的部分,诸如肺、脑、肝、胰腺、肾等等。roi 2020的图像可以从通过使用至少一个医学成像扫描技术获取的患者的成像数据2010中获得,所述至少一个医学成像扫描技术诸如包括ct(计算机断层扫描)和x射线的放射摄影成像、包括正电子发射断层扫描(pet)和单光子发射计算机断层扫描(spect)的核医学成像、mri(磁共振成像)扫描、超声成像等(参见表2、示例ii)。
32.在roi 2020内,目标区域2030周围存在健康/正常组织/细胞2040。在放射疗法治疗期间,目标区域2030内的肿瘤细胞和健康细胞以及紧密围绕目标区域2030的健康细胞二者都被例如根据图1的直线加速器1000发射的放射照射。在放射疗法治疗后的一段时间内,roi 2020内的健康细胞可能遭受放射诱发的损伤或疾病,例如放射诱发的肺炎。
33.放射肿瘤学家在为具有癌症的患者计划放射疗法治疗时,确定治疗计划,该治疗计划的放射剂量足够大,以在目标区域2030内潜在地治愈或控制疾病,但不引起严重的健康/正常组织并发症,诸如放射诱发的毒性。各种示例基于如下发现:该任务可能具有挑战性,因为肿瘤控制和健康/正常组织效应反应典型地是放射剂量的陡峭函数;也就是说,输
送剂量的小改变(5%)可以导致组织局部反应的改变(20%)。此外,处方治疗剂量通常必然非常接近健康/正常组织所耐受的剂量。由于最佳治疗的“治疗窗口”很小,因此放射剂量的计划和输送必须高度准确,以避免严重的正常组织并发症,诸如放射诱发的毒性。
34.根据各种示例,可以为个体患者分配评分(参见表1)——即至少一个毒性指标——指示他/她对放射诱发毒性的易感性水平,则该信息可以用于修改治疗计划,例如,从而获得修改的剂量图。
35.因此,根据本文描述的技术,提供了一种预测方法,其基于各种治疗前诊断或计划测试(诸如放射摄影成像扫描、核医学成像扫描、mri扫描、超声成像扫描)和其他临床数据(诸如eeg(脑电图)、ecg(心电图)),可以确定至少一个放射诱发毒性指标作为量化患者在治疗后可能潜在经历的毒性水平的风险评分。
36.在下文中,描述了用于预测与患者目标区域的放射疗法治疗相关联的放射诱发毒性风险的机器学习技术,特别是深度学习技术。依赖于标记训练数据的监督学习可以用于参数化机器学习算法。在监督学习中,目标变量被称为基准真值,并且机器学习算法可以学习因变量和自变量之间的模式。
37.首先,结合图3,基于预训练的机器学习算法,描述了关于推断至少一个毒性指标的细节。稍后将结合图5解释该训练。
38.图3是根据各种示例的方法3000的流程图。可选块利用虚线标记。例如,在例如从存储器加载程序代码时,根据图3的方法3000可以由直接或远程连接到根据图1的示例的直线加速器1000或另一放射疗法硬件的计算设备执行。还将可能的是方法3000至少部分地例如在服务器后端或使用云计算由单独的计算单元执行。计算设备或单独的计算单元可以包括用于执行方法3000的至少一个电路——例如,cpu和/或gpu和/或tpu。
39.方法3000可以基于治疗前数据来预测放射诱发毒性的风险,所述治疗前数据捕获肿瘤周围的健康组织(例如肺实质)对放射的易感性的基础和细微特征。这样的信息可以与如上面提及的计划医学成像扫描和计划剂量图相组合,该计划剂量图捕获肿瘤特征和潜在剂量测定水平,以及其不仅在肿瘤上而且还有其在周围假定健康的组织(例如肺实质)的分布。
40.详细地,在框3010,计算设备或单独的计算单元接收与包括目标区域2030的roi(例如,根据图2的roi 2020)相关联的数据。可以从数据库或临床计划系统接收数据。可以从存储器接收数据。
41.在框3010,可以使用根据表2的输入数据。具体地,接收到的数据可以包括roi 2020的放射疗法治疗的预定义剂量图和放射疗法治疗前成像数据。
42.例如,可以使用roi 2020的放射疗法治疗前成像数据(参见表2、选项ii)。该成像数据可以包括x射线成像数据、ct成像数据、mri成像数据、pet成像数据、spect成像数据、超声成像数据中的至少一种。如果放射疗法治疗前成像数据包括不同成像模态的两种或更多种成像数据,则可以对放射疗法治疗前成像数据应用配准,例如,将ct成像数据与mri成像数据和/或pet成像数据配准。此外,放射疗法治疗前成像数据可以与预定义剂量图配准。
43.接收到的数据可以进一步包括放射疗法治疗的剂量水平(例如,8 gy)、位于目标区域中的肿瘤的临床分期、患者的并存病和/或患者的人口统计数据中的至少一个,如先前结合表2所解释的。
44.在框3020,计算设备或单独的计算单元将训练的机器学习算法应用于接收到的数据。
45.作为一般规则,根据本文描述的各种示例,训练的机器学习算法可以是(深度)神经网络,例如卷积神经网络、循环神经网络、生成对抗网络、残差网络等。例如,训练的机器学习算法包括编码器和分类器,编码器用于基于接收到的数据提取roi的相关特征(有时也称为潜在特征),分类器用于基于提取的roi的相关特征生成至少一个毒性指标。
46.此外,可以通过利用监督学习、半监督学习或强化学习来获得训练的机器学习算法。优选地,通过使用监督学习来训练所训练的机器学习算法。下面将结合图5解释执行训练以获得训练的机器学习算法的计算机实现的方法。
47.在框3030,基于接收到的数据经由训练的机器学习算法,生成至少一个毒性指标。所述至少一个毒性指标指示放射诱发毒性的风险,并且从而示出放射诱发毒性的潜在水平的预测。细节已结合表1进行了解释。
48.可选地,方法3000可以进一步包括:在框3040,在将训练的机器学习算法应用于接收到的数据之前,对接收到的数据应用插补和/或归一化。
49.插补是利用替代值替换缺失数据的过程。当接收到的数据缺失了一定量的信息、诸如放射疗法治疗前图像的像素值时,插补可以用于基于像素周围的像素的像素值来确定缺失的像素值。插补可以包括热卡插补、冷卡插补、均值插补、回归插补和多重插补。
50.归一化可以包括批归一化、权重归一化、层归一化、实例归一化、组归一化、批重新归一化、批实例归一化等。
51.可选地,方法3000可以进一步包括:在框3050,基于所述至少一个生成的毒性指标,评估所述至少一个生成的毒性指标是否指示可接受的放射诱发毒性,即,预定义的剂量图是可接受的(或最佳的)。
52.这样的评估可以通过将所述至少一个生成的毒性指标中的每一个与相应毒性指标的对应阈值进行比较来执行。可以使用其他预定义的规则。可以应用特定于患者的规则。
53.可选地,当所述至少一个生成的毒性指标、即预定义的剂量图不可接受(或次优)时,方法3000可以附加地包括:在框3060,基于所述至少一个生成的毒性指标调整预定义的剂量图,以生成进一步的预定义的剂量图。然后,方法3000可以通过利用进一步的预定义剂量图替换预定义剂量图来迭代执行,直到生成可接受的(或最佳的)毒性指标、即预定义剂量图。
54.例如,在开始时,预定义的剂量图m1与诸如放射疗法治疗前成像数据的其他数据一起被训练的机器学习算法接收和处理,并且从而由训练的机器学习算法生成毒性指标t1。毒性指标t1可以由有经验的放射肿瘤学家评估,或者通过与毒性指标值的阈值进行比较来确定预定义的剂量图m1是否是最佳的。可以代替地使用自动化分析。
55.如果预定义剂量图m1被确定为次优,则通过基于先前的毒性指标t1调整先前的预定义剂量图m1来生成进一步的预定义剂量图m2。然后,该调整的剂量图m2被用于预测相应限定的放射疗法治疗的放射诱发毒性的风险,并且从而通过训练的机器学习算法生成进一步的毒性指标t2。毒性指标t2可以利用与t1相同的方式评估。
56.上面提及的动作——生成进一步的预定义剂量图mn、接收进一步的剂量图mn、通过相同的训练机器学习算法处理进一步的剂量图mn连同相同的其他数据、生成进一步的毒
性指标tn以及评估进一步的毒性指标tn——可以迭代执行,直到确定最佳(或者可能次最佳)预定义剂量图。
57.图4示意性地图示了可以在本文描述的各种示例中使用的机器学习算法的示例性实现。机器学习算法被实现为神经网络4000。神经网络4000包括编码器4010和分类器4020,编码器4010用于提取输入数据4040(诸如与roi 2020相关联的数据)的相关特征4030,分类器4020用于基于提取的输入数据4040的相关特征4030生成至少一个毒性指标4050。
58.在执行神经网络4000的训练(例如,通过使用监督学习、半监督学习或强化学习)以确定神经网络4000的参数和可能的超参数之后,训练的神经网络4000可以用于处理与roi 2020相关联的数据4040(参见表2),以确定指示放射诱发毒性风险的至少一个毒性指标。结合图5描述了关于训练的细节。
59.图5是用于执行机器学习算法(诸如,如图4中所示的神经网络4000)的训练的方法5000的流程图。然后,训练的机器学习算法可以用于图3的方法3000。方法5000可以由执行方法3000的同一计算设备执行,或者由不同的计算设备执行。
60.方法5000是执行机器学习算法的训练的计算机实现的方法,该机器学习算法用于预测与患者的目标区域(例如,根据图2的2030)的放射疗法治疗相关联的放射诱发毒性的风险。
61.详细地,在框5010,接收与包括目标区域(例如,根据图2的2030)的roi(例如,根据图2的roi 2020)相关联的训练数据的多个实例。此外,接收参考数据的多个实例,参考数据的多个实例中的每一个对应于训练数据的相应实例。训练数据的多个实例中的每一个包括放射疗法治疗的剂量图和roi 2020的放射疗法治疗前成像数据。参考数据的多个实例中的每个实例包括至少一个诊断毒性指标,所述至少一个诊断毒性指标指示诊断的放射诱发毒性风险,并且因此作为基准真值。
62.多个实例限定了训练数据集。典型地,较大的训练数据集可以帮助实现更准确的训练。
63.训练数据的多个实例可以包括与患有相同类型的癌症/肿瘤的各种患者相关联的放射疗法治疗前数据,这确保了roi 2020和目标区域2030具有相同或至少相似的解剖和生理特征,并且因此训练数据的多个实例可以被视为基于相同概率分布的实例。参考数据的多个实例可以包括与患有相同类型的癌症/肿瘤的各种患者相关联并且在经历放射疗法治疗之后获得的放射疗法治疗后数据。训练数据的多个实例和参考数据的多个实例可以一一对应(或双射)。
64.类似于根据方法3000接收到的数据,训练数据的多个实例中的每一个可以进一步包括放射疗法治疗的剂量水平(例如,以格雷单位表示)、位于目标区域中的肿瘤的临床分期、另外的患者的并存病和/或另外的患者的人口统计数据中的至少一个。已经结合表2描述了相应的示例。
65.至少一个诊断的毒性指标——细节已结合表1进行了解释——可以通过手动或自动分析放射疗法治疗后数据获得。
66.在一些示例中,可能的是基于在放射疗法治疗后的两个或更多时间点获得的诊断数据,通过进一步训练的机器学习算法生成对应于参考数据的多个实例中的每个实例的至少一个诊断毒性指标,并且诊断数据中的每一个包括roi的成像数据。在这里,将可能的是
使用“machine learning automatically detects covid-19 using chest cts in a large multicenter cohort”arxiv:2006.04998中公开的技术。特别是,将可能的是考虑不同时间点的诊断数据的改变。这样的改变可以指示毒性,例如由于组织的改变而导致的毒性。例如,将可能的是比较在两个或更多时间点获得的roi的成像数据,例如,在执行配准时以像素方式进行比较。然后,竞赛中的改变可以指示放射诱发的毒性。
67.因此,方法5000可以进一步包括执行在两个或更多个时间点获得的roi的成像数据彼此之间或与放射疗法治疗前成像数据的配准。
68.在框5020,使用机器学习算法处理训练数据的多个实例。可选地,方法5000可以进一步包括在通过机器学习算法处理训练数据的多个实例之前,对训练数据的多个实例中的每一个应用插补和/或归一化。
69.在框5030,针对训练数据的多个实例中的每一个,由机器学习算法生成指示放射诱发毒性的估计风险的至少一个相应的估计毒性指标。根据机器学习算法的当前训练状态,所述至少一个估计毒性指标可以被视为对所述至少一个诊断毒性指标的估计。
70.在框5040,计算设备通过基于诊断的毒性指标和对应的估计毒性指标之间的比较更新机器学习算法的参数值来执行机器学习算法的训练。偏差越大,机器学习算法的相应训练状态就越差。可以定义损失函数。可以采用例如反向传播等的优化技术来调整参数。
71.参考图4,神经网络4000可以包括解码器4060。使用解码器4060,可以促进训练。基于解码器4060的输出4070,当执行训练时,可能的是调整编码器4010和分类器4020二者的参数。因此,可以实现分类器4020的更好的性能,即,可以准确地确定至少一个毒性指示器4050。
72.解码器4060可以生成重构的输入数据作为输出4070。输出4070的重构输入数据对应于参考数据。可替代地,解码器4060可以基于训练数据的相关特征4030生成估计的放射特征的多个实例作为roi的输出4070。输出4070的估计放射特征可以包括roi的强度、几何形状、纹理和小波特征。
73.如上所述,编码器4010和分类器4020可以基于分类损失c1被联合训练,即通过基于诊断的毒性指标和对应的估计毒性指标之间的比较来更新编码器4010和分类器4020两者的参数值。
74.可替代地或附加地,编码器4010、分类器4020和解码器4060可以基于分类损失c1和重构损失r1的和或加权和,即c1+r1或来联合训练,其中w1和w2是在训练期间手动选择或调整的超参数。一旦训练完成,例如通过执行方法3000,则将仅使用编码器4010和分类器4020来预测与患者目标区域的放射疗法治疗相关联的放射诱发毒性的风险。
75.因此,方法5000可以可选地进一步包括使用机器学习算法的解码器4060基于训练数据生成重构数据。然后,机器学习算法的参数值的更新进一步基于训练数据的多个实例中的每一个和对应的重构数据之间的比较。
76.可替代地,方法5000可以可选地包括接收roi的诊断放射特征的多个实例,例如连同在框5010接收到的各种数据,并且经由解码器4060生成roi的估计放射特征的多个实例。可以从包含感兴趣区域的总肿瘤体积中提取诊断的放射特征。诊断的放射特征可以包括roi的强度、几何形状、纹理和小波特征。强度特征量化了总肿瘤体积内体素强度的一阶统
计分布。几何特征量化了肿瘤的形状特征。纹理特征描述了体素强度的空间分布,从而量化了肿瘤内的异质性。也可以在对原始图像应用小波变换之后计算强度和纹理特征。诊断的放射特征可以由专家手工制作,或者基于预定义的数学公式计算。机器学习算法进一步包括解码器4060,用于基于提取的roi的相关特征生成roi的估计放射特征。机器学习算法的参数值的更新进一步基于roi的诊断放射特征的多个实例中的每一个与roi的对应估计放射特征之间的比较。
77.图6示意性地图示了根据各种示例的设备6000。设备6000可以是上面提及的计算设备。设备6000包括处理单元6010、存储器单元6020和输入/输出接口6030。处理单元6010被配置为执行存储在存储器单元6020中的程序,以执行方法3000和/或方法5000。输入/输出接口6030可以与剂量测定系统1010和/或准直系统1011相关联的致动器通信,以调整放射疗法治疗的放射剂量。
78.综上所述,已经描述了通过利用人工智能(ai)技术从在计划阶段获取的患者成像数据中提取相关特征(即疾病指纹)来促进在放射疗法治疗之前预测患者对放射诱发毒性的易感性和放射疗法之后放射诱发毒性的潜在表现的技术。该特定于任务的指纹直接从具有相似/相同疾病和治疗的患者的成像数据中计算。因此,它仅包括与放射诱发的毒性紧密相关的信息。这些指纹不同于经典的放射特征,因为它们不是一般的测量,并且被训练成对特定条件或事件最具鉴别能力。该算法还学习应用剂量和roi中组织改变之间的因果关系,并且从而预测放射毒性的可能扩展。
79.特别是,可以基于如至少一个毒性指标所指示的毒性可能性对接受放射疗法的患者进行分层,并且可以标记高风险患者以不同地进行管理。此外,作为输入的剂量水平和/或剂量图可以被调整以计算新的毒性评分,例如达到某个阈值。即提供剂量处方解决方案,该剂量处方解决方案使用来自具有已知计划剂量和毒性曲线的大量结果匹配患者的数据,以帮助肿瘤学家针对特定患者的结果和毒性分布这二者找到最佳剂量。
80.因此,可以基于个体患者的解剖和生理特征精确且可靠地个体化放射疗法治疗,并且从而可以给临床医生机会选择最有可能适于个体患者的放射疗法治疗,以最大化治疗反应的可能性,同时最小化诸如放射诱发的毒性的不利影响的风险。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1