一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶及其制备方法与应用与流程
1.本发明属于生物材料技术领域,具体涉及一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶及其制备方法与应用。
背景技术:
2.富血小板纤维蛋白(prf),是继富血小板血浆后第二代血小板浓缩制品,被定义为一个自体的白细胞和富血小板纤维生物材料;是一种包含白细胞和富血小板纤维蛋白基质的浓缩物,prf的分子结构类似于天然血凝块,可以借助细胞因子的调节作用以及纤维蛋白的支架作用进行组织修复。prf的主要作用机制包括:
①
引导损伤部位组织的血管新生;
②
促进上皮增殖,封闭损伤部位;
③
网络免疫细胞,进行炎症调节;
④
引导循环血中干细胞的迁移、增殖和分化。prf能够促进软、硬组织的生长,有赖于其内的多种生长因子,转化生长因子-β(tgf-β)可以刺激血管和纤维组织生成,对成骨细胞前体有趋化和有丝分裂原作用,抑制破骨细胞进而刺激骨形成,调节其他生长因子的有丝分裂功能,刺激或抑制上皮细胞、成纤维细胞和成骨细胞的有丝分裂;血小板衍生生长因子-ab(pdgf-ab)促进间充质干细胞的分化和生长,刺激血管内皮细胞的分裂,加速血管增生,激活胶原酶而促进胶原蛋白的合成,增加巨噬细胞的活化性以促进创伤部位的修复;类胰岛素生长因子(igf)刺激软骨、骨基质形成,促进成骨细胞前体、成骨细胞复制,增加骨基质蛋白(如骨钙素)的表达;血管内皮细胞生长因子(vegf)促进血管生成;表皮生长因子(egf)促进细胞增殖,增加物质的转运和糖酵解,增强皮肤组织、角膜上皮组织、肺和支气管上皮组织的增殖和分化。此外,prf中富含白细胞细胞因子,如白细胞介素(il)-1β、il-4、il-6、肿瘤坏死因子(tnf)-α等,它们在抗炎与免疫调节中发挥重要作用。在prf形成过程中,由于缓慢的共聚过程使得prf的纤维结构疏松,有助于细胞的迁移和可溶性分子的保留,与此同时,大量血小板被激活,释放出的细胞因子与纤维共聚分子结构密切结合,使得细胞因子的生命跨度延长,在7~14d内持续、缓慢地释放细胞因子,为参与组织再生的间充质干细胞提供生物性的生长环境。目前已广泛应用于口腔科、颌面外科、骨科、整形外科等,主要制备成膜状,用于创面的修复等。
3.脂肪干细胞(adscs)是从脂肪组织中分离得到的一种具有多向分化潜能的干细胞,主要恢复组织细胞的修复功能,促进细胞的再生,恢复年轻面容的同时,身体机能也得到充分改善,有效改善亚健康、早衰等疾病,由内而外真正的有效抵抗衰老。adscs可分泌多种促血管生成因子和抗凋亡因子而抗炎、抗氧化,可抵抗氧自由基的损伤;高水平表达肝细胞生长因子(hgf)、血管内皮生长因子(vegf)、胎盘生长因子(pgf)、转化生长因子-β(tgf-β),此外还有成纤维细胞生长因子-2(fgf-2)、血管生成素-1(ang-l)和血管生成素-2(ang-2),有利于建立更好的损伤修复微环境。目前在临床的应用价值主要表现在其组织修复与重建中,其作用机制有两种:
①
adscs进入人体后,在适宜的成脂微环境下进行分化实现组织修复再生;
②
adscs具有免疫调节作用,其通过与免疫细胞的直接作用或旁分泌的作用,影响免疫细胞的分化和活化,重建机体的免疫平衡,通常两种机制是同时发挥作用的。
adscs在一定的微环境中,可分化为血管内皮细胞,在低氧条件下,adscs分泌更丰富的细胞因子,可促进血管生长、抑制细胞凋亡、抗缺血、抗炎修复的作用;adscs还可以调节t细胞的表达以及分泌细胞因子,此外,adscs的旁分泌效应也是调节免疫微环境、促进组织修复的一个重要因素。
4.现有技术获得的prf是静脉抽自体血液10ml,置于无抗凝血酶的无菌试管中,立即将试管以3000r/min离心10min;静置后,血液样本可分为3层,在位于底层的红细胞碎片和位于顶层的淡黄色澄清液体血小板血浆之间,取出中间层的淡黄色凝胶,即为富血小板纤维蛋白;弃上清,去除凝胶状物底部的红细胞部分,获得初级的prf凝胶,再将其静置于干燥消毒的容器内10min,使其自然收缩并释放其内的血清,或用无菌纱布吸附血清,同时经挤压塑形制备出具有一定形态、弹性及韧性的富血小板纤维蛋白膜。一般用于临床使用的大都是新鲜制备的prf,采血之后立即离心,立即激活成膜后立即植入体内,该方法在临床上是具有局限性的。
技术实现要素:
5.针对上述现有技术,本发明提供一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶及其制备方法与应用,以解决现有技术制备的prf必须立即使用、使用方式单一、应用受限等问题。
6.为了达到上述目的,本发明所采用的技术方案是:提供一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备方法,包括以下步骤:
7.(1)prf制备:采集自体血液于-10~-30℃离心,静置后取中间层淡黄色的富血小板纤维蛋白于-80℃及以下温度中冷冻保存,得未激活状态的prf;
8.(2)负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备:将未激活状态的prf于4℃解冻后,与脂肪干细胞悬液按体积比1:1混合,即得。
9.prf多单独用于创面修复和成骨研究,adscs多用于组织修复和重建,通过在体外扩增后植入体内。本发明结合二者的结构特点、生长特性、作用机制和应用范围,将prf和adscs的技术改进后进行融合创新,扩宽其应用范围。
10.本发明通过采集自体血液后立即低温冷冻离心,分离获取中间层淡黄色富血小板纤维蛋白(prf),将富血小板纤维蛋白(prf)放入-80℃冷冻保存,在使用前将-80℃冷冻的富血小板纤维蛋白(prf)低温解冻后采用三通注射器加入脂肪干细胞(adscs),混合prf和adscs形成负载脂肪干细胞的自体富血小板纤维蛋白溶液后可进行注射,prf在体内激活后成胶,结合adscs形成一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶,prf释放因子可作用于受损组织、促进adscs的生长,adscs也可激活prf中的免疫细胞向促进修复方向分化,进而促进组织修复。prf能促进adscs细胞分泌vegf细胞因子,共同培养更能促进vegf细胞因子的分泌,从而促进组织修复。
11.本发明工艺改进后的prf可直接进行注射,不局限于以往体外形成膜状凝胶后植入的技术,简化了操作方法。工艺改进后的prf可暂时保存于-80℃温度下,不是必须立即使用,改变了prf的使用时间限制。改进后的prf和adscs联合使用,prf的三维立体网状结构可为adscs提供三维生长空间,其排列比较疏松、组织间的空隙比较大,为细胞的附着提供大量的空间;prf中含有很多生长因子,可以很好的促进细胞的分化与增值;prf含有大量的自
身免疫应答细胞,会滞留较多的白细胞,在组织缺损处能起到很好的抗感染作用,并促进缺损组织的形成;同时,adscs在生长过程中会分泌丰富的细胞因子,这些细胞因子会影响prf中的免疫细胞的分化和活化,如白细胞和单核细胞,刺激单核细胞向m2型巨噬细胞分化,促进破损组织的修复,prf和adscs联合使用会加快组织的修复过程。
12.在上述技术方案的基础上,本发明还可以做如下改进。
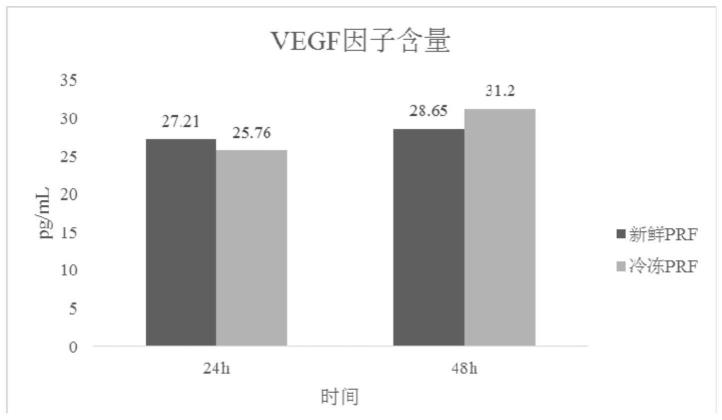
13.进一步,离心条件为500~700g离心5~10min。
14.进一步,脂肪干细胞悬液由以步骤制得:
15.(1)脂肪干细胞分离:将脂肪组织预处理后,用0.1wt%的ⅰ型胶原酶于37℃、160rpm震荡消化3h,其后加入终止消化液终止消化,接着过滤消化液,再于常温下离心,其后收集沉淀加入细胞培养基重悬,得重悬液;
16.(2)细胞传代:将重悬液于37℃、5%co2环境中培养,培养48h后换液,72h后传代,并采用0.25wt%胰蛋白酶消化贴壁细胞,后续传代时待细胞长至融合度80%以上时,进行传代;
17.(3)脂肪干细胞悬液制备:将p3代脂肪干细胞培养至80%以上融合度时,用0.25wt%胰蛋白酶消化、离心、收集细胞沉淀,再用低糖dmem基础培养基重悬细胞,当细胞活率大于80%,细胞量达2
×
104/ml时,得adscs细胞悬液。
18.进一步,脂肪组织的预处理包括以下步骤:将脂肪组织用含200u/ml青链霉素的pbs清洗3次,去除结缔组织、淋巴结和肌肉组织,其后将其剪为1mm3的组织块。
19.进一步,终止消化液为含10wt%cs和100u/ml双抗的dmem。
20.进一步,过滤为用100目细胞筛网过滤。
21.进一步,步骤(1)中离心为以1000~1400r/min离心4~6min。
22.进一步,细胞培养基为由低糖dmem基础培养基加入其质量1%的非必需氨基酸、其质量1%的丙酮酸钠、其质量1%的谷氨酰胺、100u/ml青链霉素和其质量10%的胎牛血清制得。
23.本发明还提供了上述制备方法制得的负载脂肪干细胞的自体富血小板纤维蛋白凝胶。
24.本发明还提供了上述负载脂肪干细胞的自体富血小板纤维蛋白凝胶在制备组织修复产品中的应用。
25.本发明的有益效果是:
26.1、本发明将采集制备后的prf于-80℃以下温度中保存,维持未激活状态,激活后细胞因子的含量不会有影响,改变了prf的使用时间限制,拓宽了其应用范围。
27.2、本发明将prf和adscs细胞制备成一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶,提高了vegf因子的分泌量,且促进了adscs细胞的增殖,进而促进组织修复。
28.3、本发明制备的负载脂肪干细胞的自体富血小板纤维蛋白凝胶还可进行皮下注射,不局限于以往植入的技术,简化了操作方法,扩大了应用方式和范围。
附图说明
29.图1为新鲜采集制备的prf与冷冻保存后制备的prf培养上清中的vegf因子含量比较;
30.图2为prf培养上清液对脂肪干细胞的增殖影响;
31.图3为脂肪干细胞与prf共培养后细胞上清的vegf因子含量。
具体实施方式
32.下面结合实施例对本发明的具体实施方式做详细的说明。
33.本发明所用低糖dmem基础培养基为市售gibco低糖dmem基础培养基。
34.实施例1
35.一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备方法,包括以下步骤:
36.(1)prf制备:用无菌玻璃采血管采集自体血液,其后于-20℃、600g离心8min,静置后取中间层淡黄色的凝胶富血小板纤维蛋白于-80℃冷冻保存,得未激活状态的prf;
37.(2)负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备:将未激活状态的prf于4℃解冻后,与脂肪干细胞悬液按体积比1:1混合,即得。
38.其中,脂肪干细胞悬液由以步骤制得:
39.(1)脂肪干细胞分离:将脂肪组织用含200u/ml青链霉素的pbs清洗3次,去除结缔组织、淋巴结和肌肉组织,其后将其剪为1mm3的组织块,再用0.1wt%的ⅰ型胶原酶于37℃、160rpm震荡消化3h,其后加入含10wt%cs和100u/ml双抗的dmem终止消化,接着用100目细胞筛网过滤消化液,再于常温下以1200r/min离心5min,其后收集沉淀加入含有细胞培养基重悬,得重悬液;
40.(2)细胞传代:将重悬液于37℃、5%co2环境中培养,培养48h后换液,72h后传代,并采用0.25wt%胰蛋白酶消化贴壁细胞,后续传代时待细胞长至融合度85%时,进行传代;
41.(3)脂肪干细胞悬液制备:将p3代脂肪干细胞培养至85%融合度时,用0.25wt%胰蛋白酶消化、离心、收集细胞沉淀,再用低糖dmem基础培养基重悬细胞,当细胞活率大于80%,细胞量达2
×
104/ml时,得adscs细胞悬液。
42.其中,上述细胞培养基由低糖dmem基础培养基加入其质量1%的非必需氨基酸、其质量1%的丙酮酸钠、其质量1%的谷氨酰胺、100u/ml青链霉素和其质量10%的胎牛血清制得。
43.实施例2
44.一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备方法,包括以下步骤:
45.(1)prf制备:用无菌玻璃采血管采集自体血液,其后于-10℃、500g离心10min,静置后取中间层淡黄色的凝胶富血小板纤维蛋白于-85℃冷冻保存,得未激活状态的prf;
46.(2)负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备:将未激活状态的prf于4℃解冻后,与脂肪干细胞悬液按体积比1:1混合,即得。
47.其中,脂肪干细胞悬液由以步骤制得:
48.(1)脂肪干细胞分离:将脂肪组织用含200u/ml青链霉素的pbs清洗3次,去除结缔组织、淋巴结和肌肉组织,其后将其剪为1mm3的组织块,再用0.1wt%的ⅰ型胶原酶于37℃、160rpm震荡消化3h,其后加入含10wt%cs和100u/ml双抗的dmem终止消化,接着用100目细胞筛网过滤消化液,再于常温下以1000r/min离心6min,其后收集沉淀加入含有细胞培养基重悬,得重悬液;
49.(2)细胞传代:将重悬液于37℃、5%co2环境中培养,培养48h后换液,72h后传代,
并采用0.25wt%胰蛋白酶消化贴壁细胞,后续传代时待细胞长至融合度82%时,进行传代;
50.(3)脂肪干细胞悬液制备:将p3代脂肪干细胞培养至82%融合度时,用0.25wt%胰蛋白酶消化、离心、收集细胞沉淀,再用低糖dmem基础培养基重悬细胞,当细胞活率大于80%,细胞量达2
×
104/ml时,得adscs细胞悬液。
51.其中,上述细胞培养基由低糖dmem基础培养基加入其质量1%的非必需氨基酸、其质量1%的丙酮酸钠、其质量1%的谷氨酰胺、100u/ml青链霉素和其质量10%的胎牛血清制得。
52.实施例3
53.一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备方法,包括以下步骤:
54.(1)prf制备:用无菌玻璃采血管采集自体血液,其后于-30℃、700g离心5min,静置后取中间层淡黄色的凝胶富血小板纤维蛋白于-90℃冷冻保存,得未激活状态的prf;
55.(2)负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备:将未激活状态的prf于4℃解冻后,与脂肪干细胞悬液按体积比1:1混合,即得。
56.其中,脂肪干细胞悬液由以步骤制得:
57.(1)脂肪干细胞分离:将脂肪组织用含200u/ml青链霉素的pbs清洗3次,去除结缔组织、淋巴结和肌肉组织,其后将其剪为1mm3的组织块,再用0.1wt%的ⅰ型胶原酶于37℃、160rpm震荡消化3h,其后加入含10wt%cs和100u/ml双抗的dmem终止消化,接着用100目细胞筛网过滤消化液,再于常温下以1400r/min离心4min,其后收集沉淀加入含有细胞培养基重悬,得重悬液;
58.(2)细胞传代:将重悬液于37℃、5%co2环境中培养,培养48h后换液,72h后传代,并采用0.25wt%胰蛋白酶消化贴壁细胞,后续传代时待细胞长至融合度90%时,进行传代;
59.(3)脂肪干细胞悬液制备:将p3代脂肪干细胞培养至90%融合度时,用0.25wt%胰蛋白酶消化、离心、收集细胞沉淀,再用低糖dmem基础培养基重悬细胞,当细胞活率大于80%,细胞量达2
×
104/ml时,得adscs细胞悬液。
60.其中,上述细胞培养基由低糖dmem基础培养基加入其质量1%的非必需氨基酸、其质量1%的丙酮酸钠、其质量1%的谷氨酰胺、100u/ml青链霉素和其质量10%的胎牛血清制得。
61.对比例1
62.一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备方法,包括以下步骤:
63.(1)prf制备:用无菌玻璃采血管采集自体血液,其后于-20℃、600g离心8min,静置后取中间层淡黄色的凝胶富血小板纤维蛋白,将其静置于干燥消毒的容器内10min,使其自然收缩后得到激活的prf凝胶;
64.(2)负载脂肪干细胞的自体富血小板纤维蛋白凝胶的制备:在激活的prf凝胶中加入本发明实施例1制备的脂肪干细胞悬液,即得。
65.实验例1
66.将本发明实施例1制备的未激活状态的prf于4℃解冻后,再将其静置于干燥消毒的容器内10min,使其自然收缩后得到激活的prf凝胶;在激活的prf凝胶中加入低糖dmem基础培养基,于37℃、5%co2中孵育24h和48h,分别收集上清。
67.将新鲜采集制备的prf静置于干燥消毒的容器内10min,使其自然收缩后得到激活
的prf凝胶;在激活的prf凝胶中加入低糖dmem基础培养基,于37℃、5%co2环境中孵育24h和48h,分别收集上清。
68.对收集到的上清采用elisa试剂盒进行生长因子检测,测试结果如图1所示。由图1可得:在得到激活的prf并加入基础培养基培养24h和48h后,新鲜采集制备的prf与冷冻保存后制备的prf培养上清中的vegf因子含量无明显差异,说明在采集、制备后的prf可以在-80℃以下温度中保存,维持未激活状态,激活后细胞因子的含量不会有影响。
69.实验例2
70.将本发明实施例1制备的未激活状态的prf于4℃解冻后,再将其静置于干燥消毒的容器内10min,使其自然收缩后得到激活的prf凝胶;在激活的prf凝胶中加入低糖dmem基础培养基,于37℃、5%co2环境中孵育24h和48h,分别收集上清,得prf培养上清液。取96孔板,按4000个/孔密度接种本发明实施例1制备的adscs细胞悬液,同时加入prf培养上清液,放入37℃、5%co2中孵育24h和48h,采用cck-8试剂检测细胞增殖情况,在450nm处检测吸光度值,结果如图2所示。
71.由图2可得:prf培养上清对脂肪干细胞是促进生长作用,不会抑制adscs生长,也不会导致adscs细胞致瘤生长,prf可以促进adscs增殖。
72.实验例3
73.将本发明实施例1和对比例1所得负载脂肪干细胞的自体富血小板纤维蛋白凝胶静置于干燥消毒的容器内10min,使其自然收缩后得到激活的一种负载脂肪干细胞的自体富血小板纤维蛋白凝胶,放入37℃、5%co2环境中孵育24h和48h,分别收集上清,采用elisa试剂盒进行生长因子检测,结果如图3所示。
74.用无菌玻璃采血管采集自体血液,其后于-20℃、600g离心8min,静置后取中间层淡黄色的凝胶富血小板纤维蛋白(prf),将其静置于干燥消毒的容器内10min,使其自然收缩后得到激活的prf凝胶;在激活的prf凝胶中加入本发明实施例1制备的脂肪干细胞悬液,放入37℃、5%co2环境中孵育24h和48h,分别收集上清,采用elisa试剂盒进行生长因子检测,结果如图3所示。
75.由图3可得:adscs和prf在成胶前混合再激活成凝胶共培养24h和48h后,与对照组adscs+dl(低糖dmem培养基)比较,各实验组24h和48h细胞培养上清中vegf因子含量均高于对照组,说明prf能促进adscs细胞分泌vegf细胞因子;实验组之间比较,添加100μl和500μl的prf都是促进vegf因子分泌的,由于添加量的不同会造成凝胶形成的厚度不同,细胞三维生长的环境也不同,100μl prf添加量组的细胞培养上清中的vegf含量高于500μl添加量组;实验组之间比较,adscs和prf在成胶前混合再激活成凝胶组的vegf因子含量略高于prf预先成胶后加入adscs组的细胞培养上清vegf因子。综合观察可得:prf能促进adscs细胞分泌vegf细胞因子,共同培养更能促进vegf细胞因子的分泌,从而促进组织修复。
76.虽然结合实施例对本发明的具体实施方式进行了详细地描述,但不应理解为对本专利的保护范围的限定。在权利要求书所描述的范围内,本领域技术人员不经创造性劳动即可作出的各种修改和变形仍属本专利的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1