一种二甲双胍恩格列净组合物及其制备方法与流程
1.本发明属于医药领域,具体涉及二甲双胍恩格列净组合物及其制备方法。
背景技术:
2.ii型糖尿病的发病率越来越高,其并发症(如糖尿病足、目盲、肾衰竭等)不仅影响到患者的生活质量,并且有可能导致寿命的缩短。恩格列净(empagliflozin)是一种口服的钠-葡萄糖协同转运蛋白-2(sglt-2)的抑制剂。sglt-2是主要负责从肾小球滤液中再吸收葡萄糖进入体循环的运输者,通过抑制sglt-2,恩格列净减少了肾对滤过葡萄糖的再吸收,并降低了葡萄糖的肾阈值,从而增加了尿糖的排泄。盐酸二甲双胍是经典的降糖药物,可以降低ii型糖尿病患者空腹及餐后的高血糖。
3.二甲双胍恩格列净片为恩格列净和盐酸二甲双胍的复方制剂。经大鼠口服糖耐量实验研究显示,恩格列净和盐酸二甲双胍单独口服以及同时给药均能够降低血糖水平,并且同时给药的降糖作用(降低63%)显著高于单独给予恩格列净(降低37%)或盐酸二甲双胍(降低39%)组,显示出二甲双胍恩格列净片具有更好的降糖效果。
4.二甲双胍恩格列净片是由勃林格殷格翰公司开发用于治疗糖尿病的复方制剂。2015年5月,欧盟批准二甲双胍恩格列净片的上市申请。2015年8月,fda批准二甲双胍恩格列净片上市。该药目前已进口至中国,规格为:850mg/5mg、850mg/12.5mg、1000mg/5mg、1000mg/12.5mg。杭州中美华东制药有限公司生产的500mg/5mg规格产品于2021年6月1日在国内批准上市。
5.恩格列净原料为白色至微黄色的粉末:极微溶于水(phl.0、ph4.0、ph7.47介质中都是极微溶解),微溶于乙醇、50%甲醇,溶于50%乙睛,略溶于甲醇,几乎不溶于甲苯。盐酸二甲双胍原料为白色结晶性粉末:无臭。易溶于水,在甲醇中溶解,在乙醇中微溶,在氯仿或乙醚中不溶。
6.目前我国已有关于二甲双胍恩格列净片的制备工艺专利,如:贝林格尔
·
英格海姆国际有限公司申请的“药物组合物、药物剂型、其制备方法、治疗方法及其用途”(申请号:201510227017.5)公开了sglt-2抑制剂与二甲双胍的固体制剂,还公开了处方,并且提出将盐酸二甲双胍、sglt-2抑制剂、玉米淀粉实施预混合后,再喷入由共聚维酮和纯净水组成的“制粒液体”进行制粒。由于盐酸二甲双胍原料药易失水,且可压性较差,此工艺制备的片剂,会存在硬度偏小,从而引起片剂脆碎度不合格,不利于后续包衣工序的顺利进行,最终片剂之间的溶出rsd偏大,15min溶出rsd超过10%,这可能导致病人服药后血药浓度有较大变异,引起血糖波动。本品中恩格列净占比较小,仅为0.85%,不易混匀,进一步导致15min溶出rsd值增大,增加血糖波动的风险。
7.因此。从提高药品质量的角度出发,需要有一种合适的生产工艺,使恩格列净能够均匀分散在制剂产品中,提高恩格列净混合均匀度,改善物料可压性,能够通过调整压片机压力控制片剂硬度,得到含量、硬度均一的片剂,减小不同片之间15min溶出rsd值。
技术实现要素:
8.本发明公开了一种二甲双胍恩格列净片组合物及其制备方法。制备方法采用将恩格列净分散于制粒液体,再进行流化床制粒的工艺,通过控制流化床制粒参数、颗粒水分,主要解决了传统工艺制备的二甲双胍恩格列净片含量均匀度差、片剂硬度小、脆碎度不合格以及15min溶出rsd值偏大的问题。
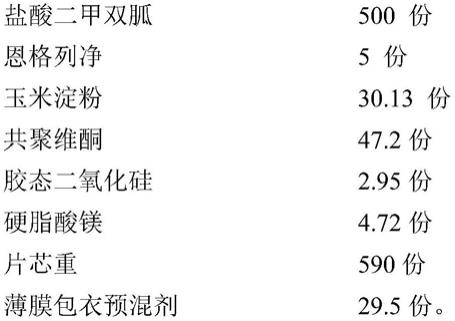
9.本发明所提供的二甲双胍恩格列净片,由下述质量份的原辅料制成:
[0010][0011]
所述二甲双胍恩格列净片为包衣片,除所述薄膜包衣预混剂外,其它原辅料为片芯原辅料。
[0012]
本发明还提供了上述二甲双胍恩格列净片的制备方法。
[0013]
本发明所提供的二甲双胍恩格列净片的制备方法,包括下述步骤:
[0014]
(1)辅料预处理:将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0015]
(2)辅料预混合:将盐酸二甲双胍和玉米淀粉混合;加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉,再加入剩余盐酸二甲双胍;
[0016]
(3)流化床制粒:
[0017]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,再缓慢加入恩格列净原料药,搅拌分散均匀,得含药制粒液,备用;
[0018]
b.制粒:将混合后盐酸二甲双胍和玉米淀粉置于流化床中,进风温度设置70~80℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入含药制粒液制粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度40~50℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分为1.5%~2.5%;
[0019]
(4)整粒:干燥后颗粒采用1.0mm~1.5mm筛网整粒;
[0020]
(5)总混:根据总混后收率加入处方量胶态二氧化硅和硬脂酸镁,混合;
[0021]
(6)压片:采用旋转压片机压片,控制压力3.0kn~6.0kn;
[0022]
(7)包衣:取纯化水和薄膜包衣预混剂配制固含量为13%的包衣液,控制包衣增重为2.0%~5.0%。
[0023]
上述方法步骤(2)中,所述混合是置于柱式料斗混合机中混合,转速8r/min,混合10min。
[0024]
上述方法步骤(5)中,所述混合的时间为10min。可根据总混后收率,折算需要加入的胶态二氧化硅和硬脂酸镁用量,以保证各物料投料量与设计比例一致。
[0025]
与现有技术相比,本发明具有如下优点:
[0026]
1、本发明在原辅料预处理阶段控制各个辅料粒径,其中盐酸二甲双胍和玉米淀粉过40目筛,恩格列净粉碎过80目筛,胶态二氧化硅过80目筛,以保证制备过程中物料能够充分混合均匀;
[0027]
2、本发明采用将恩格列净分散于共聚维酮水溶液中,得到含有恩格列净原料药的制粒液体。采用流化床制粒,喷入制粒液体,使恩格列净原料药均匀分散于物料中,提高含量均匀度,减小不同片之间15min溶出rsd值;
[0028]
3、本发明采用在流化床制粒阶段控制制粒参数的策略;控制进风温度70℃~80℃,控制物料实际温度40℃~50℃,控制颗粒水分在1.5%~2.5%之间,可以提高物料的可压性;
[0029]
4、本发明控制干整粒过程筛网目数,控制干整粒筛网目数为1.0mm~1.5mm,得到颗粒大小均一,流动性、可压性良好的颗粒。
[0030]
5、本发明控制压片过程压片机压力,控制压片机压力为3.0kn~6.0kn,以得到硬度较高、脆碎度合格,且溶出速度较快的片剂。
附图说明
[0031]
图1为实施例1、实施例2、对比例6以及市场上在售二甲双胍恩格列净片中的二甲双胍溶出曲线对比图;
[0032]
图2为实施例1、实施例2、对比例6以及市场上在售二甲双胍恩格列净片中的恩格列净溶出曲线对比图;
[0033]
图3实施例1、实施例2、对比例1、对比例6以及市场上在售二甲双胍恩格列净片中的恩格列净溶出曲线对比图。
具体实施方式
[0034]
下面结合具体实施例对本发明作进一步阐述,但本发明并不限于以下实施例。所述方法如无特别说明均为常规方法。所述原材料如无特别说明均能从公开商业途径获得。
[0035]
实施例1、二甲双胍恩格列净片(500/5mg)制备工艺:
[0036]
二甲双胍恩格列净片处方组成
[0037]
[0038]
二甲双胍恩格列净片制备方法:
[0039]
(1)辅料预处理:采用万能粉碎机将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0040]
(2)辅料预混合:将盐酸二甲双胍和玉米淀粉置于柱式料斗混合机中混合,转速8r/min,混合10min,加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉,再加入剩余盐酸二甲双胍;
[0041]
(3)流化床制粒:
[0042]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,再缓慢加入恩格列净原料药,搅拌分散均匀,得含药制粒液,备用;
[0043]
b.制粒:将混合后盐酸二甲双胍和玉米淀粉置于流化床中,进风温度设置70~80℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入含药制粒液制粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度40~50℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分为1.5%~2.5%;
[0044]
(4)整粒:干燥后颗粒采用1.0mm筛网整粒;
[0045]
(5)总混:根据收率加入处方量胶态二氧化硅和硬脂酸镁,混合10min;
[0046]
(6)压片:采用旋转压片机压片,控制压力3.0kn~6.0kn;
[0047]
(7)包衣:配制固含量为13%(w/w)的包衣液,控制包衣增重为2.0%~5.0%。实施例2、二甲双胍恩格列净片(500/5mg)制备工艺:(采用1.5mm筛网进行干整粒)
[0048]
二甲双胍恩格列净片处方组成
[0049][0050]
二甲双胍恩格列净片制备方法:
[0051]
(1)辅料预处理:采用万能粉碎机将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0052]
(2)辅料预混合:将盐酸二甲双胍和玉米淀粉置于柱式料斗混合机中混合,转速8r/min,混合10min,加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉,再加入剩余盐酸二甲双胍;
[0053]
(3)流化床制粒:
[0054]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,再缓慢加入恩格列净原料药,搅拌分散均匀,得含药制粒液,备用;
[0055]
b.制粒:将混合后盐酸二甲双胍和玉米淀粉置于流化床中,进风温度设置70~80℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入含药制粒液制粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度40~50℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分为1.5%~2.5%;
[0056]
(4)整粒:干燥后颗粒采用1.5mm筛网整粒;
[0057]
(5)总混:根据收率加入处方量胶态二氧化硅和硬脂酸镁,混合10min;
[0058]
(6)压片:采用旋转压片机压片,控制压力3.0kn~6.0kn;
[0059]
(7)包衣:配制固含量为13%(w/w)的包衣液,控制包衣增重为2.0%~5.0%
[0060]
对比例1、二甲双胍恩格列净片(500/5mg)制备工艺:(将恩格列净与盐酸二甲双胍、玉米淀粉混合后,喷入共聚维酮溶液进行制粒)
[0061]
二甲双胍恩格列净片处方组成
[0062][0063]
二甲双胍恩格列净片制备方法:
[0064]
(1)辅料预处理:采用万能粉碎机将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0065]
(2)辅料预混合:将盐酸二甲双胍、恩格列净、玉米淀粉置于柱式料斗混合机中混合,转速8r/min,混合10min,加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉、恩格列净,再加入剩余盐酸二甲双胍;
[0066]
(3)流化床制粒:
[0067]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,备用;
[0068]
b.制粒:将预混合后盐酸二甲双胍、恩格列净、玉米淀粉置于流化床中,进风温度设置70~80℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入共聚维酮溶液制粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度40~50℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分为1.5%~2.5%;
[0069]
(4)整粒:干燥后颗粒采用1.0mm筛网整粒;
[0070]
(5)总混:根据收率加入处方量胶态二氧化硅和硬脂酸镁,混合10min;
[0071]
(6)压片:采用旋转压片机压片,控制压力3.0kn~6.0kn;
[0072]
(7)包衣:配制固含量为13%(w/w)的包衣液,控制包衣增重为2.0%~5.0%
[0073]
对比例2、二甲双胍恩格列净片(500/5mg)制备工艺:(升高进风温度至80~90℃,物料温度50~60℃)
[0074]
二甲双胍恩格列净片处方组成
[0075][0076]
二甲双胍恩格列净片制备方法:
[0077]
(1)辅料预处理:采用万能粉碎机将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0078]
(2)辅料预混合:将盐酸二甲双胍和玉米淀粉置于柱式料斗混合机中混合,转速8r/min,混合10min,加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉,再加入剩余盐酸二甲双胍;
[0079]
(3)流化床制粒:
[0080]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,再缓慢加入恩格列净原料药,搅拌分散均匀,得含药制粒液,备用;
[0081]
b.制粒:将混合后盐酸二甲双胍和玉米淀粉置于流化床中,进风温度设置80~90℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入含药制粒液制粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度50~60℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分为1.5%~2.5%;
[0082]
(4)整粒:干燥后颗粒采用1.0mm筛网整粒;
[0083]
(5)总混:根据收率加入处方量胶态二氧化硅和硬脂酸镁,混合10min;
[0084]
(6)压片:采用旋转压片机压片,控制压力3.0kn~6.0kn;
[0085]
(7)包衣:配制固含量为13%(w/w)的包衣液,控制包衣增重为2.0%~5.0%。
[0086]
对比例3、二甲双胍恩格列净片(500/5mg)制备工艺:(降低进风温度至60~70℃,物料温度30~40℃)
[0087]
二甲双胍恩格列净片处方组成
[0088]
[0089][0090]
二甲双胍恩格列净片制备方法:
[0091]
(1)辅料预处理:采用万能粉碎机将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0092]
(2)辅料预混合:将盐酸二甲双胍和玉米淀粉置于柱式料斗混合机中混合,转速8r/min,混合10min,加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉,再加入剩余盐酸二甲双胍;
[0093]
(3)流化床制粒:
[0094]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,再缓慢加入恩格列净原料药,搅拌分散均匀,得含药制粒液,备用;
[0095]
b.制粒:将混合后盐酸二甲双胍和玉米淀粉置于流化床中,进风温度设置60~70℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入含药制粒液制粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度30~40℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分为1.5%~2.5%;
[0096]
(4)整粒:干燥后颗粒采用1.0mm筛网整粒;
[0097]
(5)总混:根据收率加入处方量胶态二氧化硅和硬脂酸镁,混合10min;
[0098]
(6)压片:采用旋转压片机压片,控制压力3.0kn~6.0kn;
[0099]
(7)包衣:配制固含量为13%(w/w)的包衣液,控制包衣增重为2.0%~5.0%。
[0100]
对比例4、二甲双胍恩格列净片(500/5mg)制备工艺:(控制颗粒水分小于1.5%)
[0101]
二甲双胍恩格列净片处方组成
[0102]
[0103][0104]
二甲双胍恩格列净片制备方法:
[0105]
(1)辅料预处理:采用万能粉碎机将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0106]
(2)辅料预混合:将盐酸二甲双胍和玉米淀粉置于柱式料斗混合机中混合,转速8r/min,混合10min,加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉,再加入剩余盐酸二甲双胍;
[0107]
(3)流化床制粒:
[0108]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,再缓慢加入恩格列净原料药,搅拌分散均匀,得含药制粒液,备用;
[0109]
b.制粒:将混合后盐酸二甲双胍和玉米淀粉置于流化床中,进风温度设置70~80℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入含药制粒液制粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度40~50℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分小于1.5%;
[0110]
(4)整粒:干燥后颗粒采用1.0mm筛网整粒;
[0111]
(5)总混:根据收率加入处方量胶态二氧化硅和硬脂酸镁,混合10min;
[0112]
(6)压片:采用旋转压片机压片,控制压力3.0kn~6.0kn;
[0113]
(7)包衣:配制固含量为13%(w/w)的包衣液,控制包衣增重为2.0%~5.0%。
[0114]
对比例5、二甲双胍恩格列净片(500/5mg)制备工艺:(控制颗粒水分2.5~3.0%)
[0115]
二甲双胍恩格列净片处方组成
[0116][0117][0118]
二甲双胍恩格列净片制备方法:
[0119]
(1)辅料预处理:采用万能粉碎机将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0120]
(2)辅料预混合:将盐酸二甲双胍和玉米淀粉置于柱式料斗混合机中混合,转速8r/min,混合10min,加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉,再加入剩余盐酸二甲双胍;
[0121]
(3)流化床制粒:
[0122]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,再缓慢加入恩格列净原料药,搅拌分散均匀,得含药制粒液,备用;
[0123]
b.制粒:将混合后盐酸二甲双胍和玉米淀粉置于流化床中,进风温度设置70~80℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入含药制粒液制粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度40~50℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分为2.5%~3.0%;
[0124]
(4)整粒:干燥后颗粒采用1.0mm筛网整粒;
[0125]
(5)总混:根据收率加入处方量胶态二氧化硅和硬脂酸镁,混合10min;
[0126]
(6)压片:采用旋转压片机压片,控制压力3.0kn~6.0kn;
[0127]
(7)包衣:配制固含量为13%(w/w)的包衣液,控制包衣增重为2.0%~5.0%。
[0128]
对比例6、二甲双胍恩格列净片(500/5mg)制备工艺:(增加压片机压力至7kn~10kn)
[0129]
二甲双胍恩格列净片处方组成
[0130][0131]
二甲双胍恩格列净片制备方法:
[0132]
(1)辅料预处理:采用万能粉碎机将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0133]
(2)辅料预混合:将盐酸二甲双胍和玉米淀粉置于柱式料斗混合机中混合,转速8r/min,混合10min,加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉,再加入剩余盐酸二甲双胍;
[0134]
(3)流化床制粒:
[0135]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,再缓慢加入恩格列净原料药,搅拌分散均匀,得含药制粒液,备用;
[0136]
b.制粒:将混合后盐酸二甲双胍和玉米淀粉置于流化床中,进风温度设置70~80℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入含药制粒液制
粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度40~50℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分为1.5%~2.5%;
[0137]
(4)整粒:干燥后颗粒采用1.0mm筛网整粒;
[0138]
(5)总混:根据收率加入处方量胶态二氧化硅和硬脂酸镁,混合10min;
[0139]
(6)压片:采用旋转压片机压片,控制压力7kn~10kn;
[0140]
(7)包衣:配制固含量为13%(w/w)的包衣液,控制包衣增重为2.0%~5.0%。
[0141]
对比例7、二甲双胍恩格列净片(500/5mg)制备工艺:(降低压片机压力至1kn~3kn)
[0142]
二甲双胍恩格列净片处方组成
[0143][0144]
二甲双胍恩格列净片制备方法:
[0145]
(1)辅料预处理:采用万能粉碎机将恩格列净原料药粉碎过筛80目,盐酸二甲双胍、玉米淀粉分别过筛40目,胶态二氧化硅过筛80目处理;
[0146]
(2)辅料预混合:将盐酸二甲双胍和玉米淀粉置于柱式料斗混合机中混合,转速8r/min,混合10min,加入顺序为先加入50%量盐酸二甲双胍,再加入玉米淀粉,再加入剩余盐酸二甲双胍;
[0147]
(3)流化床制粒:
[0148]
a.配制制粒液:将共聚维酮溶于纯化水,得到浓度为21.2%(w/w)共聚维酮溶液,再缓慢加入恩格列净原料药,搅拌分散均匀,得含药制粒液,备用;
[0149]
b.制粒:将混合后盐酸二甲双胍和玉米淀粉置于流化床中,进风温度设置70~80℃,引风机频率设置20hz,开始预热物料,当物料温度提高至45℃以上,喷入含药制粒液制粒,供液泵转速设置50rpm,扇面压力和雾化压力分别设置3bar/2bar,控制物料温度40~50℃,制粒液喷完后,关闭加热继续喷入适量纯化水,控制颗粒水分为1.5%~2.5%;
[0150]
(4)整粒:干燥后颗粒采用1.0mm筛网整粒;
[0151]
(5)总混:根据收率加入处方量胶态二氧化硅和硬脂酸镁,混合10min;
[0152]
(6)压片:采用旋转压片机压片,控制压力1.0kn~3.0kn;
[0153]
(7)包衣:配制固含量为13%(w/w)的包衣液,控制包衣增重为2.0%~5.0%。
[0154]
上述实施例及对比例的效果评价:
[0155]
1、改善含量均匀度
[0156]
本发明技术方案中制备的二甲双胍恩格列净片采用流化床制粒工艺,由于本品中恩格列净规格较小,采用将恩格列净原料药分散于粘合剂中进行制粒,以达到将原料药分散均匀的目的。
[0157]
对本发明实施例1、实施例2、对比例1、以及市场上在售二甲双胍恩格列净片进行恩格列净含量均匀度检测,具体检测方法参考中国药典2020年版四部0941含量均匀度检查法。检测结果见表-1。
[0158]
表-1 恩格列净含量均匀度对比结果
[0159][0160]
含量均匀度检测结果显示:实施例1、实施例2产品含量均匀度明显优于对比例1以及在售二甲双胍恩格列净片,说明将恩格列净分散于粘合剂后进行制粒,可以明显改善产品含量均匀度,良好的含量均匀度有利于提高产品的有效性及安全性。
[0161]
2、提高片剂硬度、降低脆碎度
[0162]
本发明技术方案中制备的二甲双胍恩格列净片采用流化床制粒工艺,控制进风温度与物料温度,保证颗粒水分在1.5%~2.5%之间,达到提高片剂硬度的目的,降低脆碎度。
[0163]
对本发明实施例1、实施例2、对比例2、对比例3、对比例4、对比例5、对比例6、对比例7进行硬度及脆碎度检测,具体检测方法参考中国药典2020年版四部0923片剂脆碎度检查法。检测结果见表-3。
[0164]
表-2 硬度及脆碎度对比结果
[0165]
/实施例1实施例2对比例2对比例3对比例4对比例5对比例6对比例7硬度(kg)12.313.66.38.63.611.216.75.4脆碎度<1.0%0.420.381.531.211.94掉盖0.311.51
[0166]
硬度检测结果显示:实施例1、实施例2、硬度可以达到10kg以上,硬度较高,片剂脆碎度小。对比例2、对比例3、对比例4以及对比例7产品硬度较小,均小于10kg,片剂脆碎度较大,均超过药典限度要求,不符合规定。对比例5以及对比例6硬度大于10kg,但对比例5检测脆碎度时掉盖,说明无法进行后续包衣工序。
[0167]
3、提高产品溶出速度
[0168]
本发明技术方案中制备的二甲双胍恩格列净片采用流化床制粒工艺,控制进风温度与物料温度,保证颗粒水分在1.5%~2.5%之间,压片压力控制在3.0kn~6.0kn,达到片剂硬度较高,且溶出速度快的目的。
[0169]
对本发明实施例1、实施例2、对比例6以及市场上在售二甲双胍恩格列净片进行溶出曲线检测对比,具体检测方法参考中国药典2020年版四部9031溶出度与释放度测定法。检测结果见表-3。
[0170]
表-3 溶出曲线检测结果
[0171][0172]
溶出曲线对比图见图1和图2。出试验结果表明:由实施例1、实施例2可知,采用流化床制粒,控制颗粒水分在1.5%~2.5%之间,压片压力控制在3.0kn~6.0kn之间,产品溶出速度较快,15min累积溶出度达到85%以上,溶出曲线与市售品一致。由对比例6可知,提高压片压力至6.0kn以上,产品溶出速度变慢,15min累积溶出度未达到85%以上,与市售品不一致。
[0173]
4、改善溶出度实验rsd值
[0174]
本发明技术方案中制备的二甲双胍恩格列净片采用流化床制粒工艺,由于本品中恩格列净规格较小,采用将恩格列净原料药分散于粘合剂中进行制粒,以达到将原料药分散均匀的目的,同时控制颗粒水分在1.5%~2.5%之间,保证压片后片剂硬度稳定可控,减小溶出度实验rsd值。
[0175]
对本发明实施例1、实施例2、对比例1、对比例7以及市场上在售二甲双胍恩格列净片进行溶出曲线检测对比,具体检测方法参考中国药典2020年版四部9031溶出度与释放度测定法。检测结果见表-4。
[0176]
表-4 恩格列净溶出对比结果
[0177][0178]
含量均匀度检测结果显示:实施例1、实施例2产品溶出曲线各时间点rsd均较小(<10%),对比例1、对比例7以及在售二甲双胍恩格列净片溶出曲线5min、10min、15min时间点rsd值均较大(5min rsd>20%,10min rsd大于10%,15min rsd>5%),说明将恩格列净分散于粘合剂后进行制粒,可以明显改善产品含量均匀度,降低溶出度实验各时间点rsd
值,有利于提高产品的有效性及安全性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1