NIR-II光热材料在制备逆转癌细胞多药耐药性药物中的应用
nir-ii光热材料在制备逆转癌细胞多药耐药性药物中的应用
技术领域
1.本发明属于医药化工技术领域,具体涉及一种nir-ii光热材料在制备逆转癌细胞多药耐药性药物中的应用。
背景技术:
2.癌症是导致人类非正常死亡的主要原因之一,也是我国主要的公共卫生问题之一。化疗药物是行之有效的癌症治疗策略,但是由于化疗药物广泛的使用,导致了癌细胞对化疗药物的多药耐药性(mdr),肿瘤的多药耐药性是导致癌症复发或者化疗失败的重要原因之一。mdr源自癌细胞的先天和/或后天获得能力,可抵抗化疗药物的作用,mdr的机制被广泛研究,主要机制是由于膜蛋白转运蛋白和细胞质酶的紊乱,由于肿瘤积累不足,细胞摄取减少,药物流出增加,dna修复以及代谢修饰和解毒等,都会导致化疗药物对癌细胞的杀伤能力降低甚至失效。
3.研究人员对耐药癌细胞的治疗也有广泛的研究,部分研究对mdr细胞中的细胞表面膜蛋白进行抑制,开发出多种p-糖蛋白(p-gp)抑制剂,减弱mdr细胞的耐药性,使其能有效摄取化疗药物进而能使化疗的功能重新发挥。也有部分研究从基因或者细胞体内一些影响mdr细胞的因素中入手,提高化疗药物在细胞体内的积累,恢复耐药细胞对药物的敏感性。
4.公开号为cn110327337a的中国专利文献公开了麦角胺(一种麦角类生物碱)作为肿瘤多药耐药逆转剂的应用,麦角胺具有较强的肿瘤耐药逆转活性,能够与抗肿瘤药物合用治疗发生多药耐药的肿瘤;公开号为cn110051663a的中国专利文献公开了5α-环氧土木香内酯在抗多药耐药肿瘤方面的应用,5α-环氧土木香内酯能够剂量依赖性地抑制肿瘤细胞,特别是多药耐药肿瘤细胞的生长,并且体外实验显示出其具有较强的逆转肿瘤多药耐药的活性。
5.公开号为cn103342788a的中国专利文献公开了一种负载有核酸和疏水抗癌药物的阳离子胶束复合物,将乙二醇-胺基化聚甲基丙烯酸缩水甘油酯-聚甲基丙烯酸二异丙氨基乙酯三嵌段聚阳离子制成阳离子胶束,在该阳离子胶束上负载核酸和疏水抗癌药物后得到所述的负载有核酸和疏水抗癌药物的阳离子胶束复合物,该复合物可用于癌症治疗,主要用于逆转癌症多药耐药或抑制癌症转移。但该发明方法制备方法复杂。
6.近年来,有研究表明,通过光动力疗法也能有效对耐药癌细胞表面的p-gp蛋白构成破坏,进而有效地减少药物的逃逸,增加耐药癌细胞对药物的敏感性。但是目前该方面的报道不多,并且效果一般,也并不是一种通用的治疗方法。
技术实现要素:
7.本发明提供了nir-ii光热材料在制备逆转癌细胞多药耐药性药物中的应用,该nir-ii光热材料合成方法简单,具有近红外二区荧光发射以及良好的光热转换效率、能产生较高的光热温度,该方法普适性好,能够逆转多种癌细胞的多药耐药性,使其重新对化疗
药物敏感。
8.具体采用的技术方案如下:
9.nir-ii光热材料在制备逆转癌细胞多药耐药性药物中的应用,所述nir-ii光热材料为有机小分子荧光团,具有近红外二区荧光发射和光热效果;所述近红外二区荧光发射范围为900-1700nm。
10.所述的nir-ii光热材料具有近红外二区荧光发射和优异的光热效果,适合光热作用会使细胞蛋白表达的通路会受到抑制,从而导致耐药细胞表达耐药相关蛋白受阻,无法产生对药物的对抗性,使得化疗药物在细胞内有效积累,产生细胞毒性,实现耐药癌细胞耐药性的逆转。
11.优选的,所述nir-ii光热材料具有如式(ⅰ)所示的结构式,
[0012][0013]
本发明还提供了一种逆转癌细胞多药耐药性药物,包含nir-ii光热材料制成的水溶性纳米粒子,所述nir-ii光热材料为有机小分子荧光团,具有如式(ⅰ)所示的结构式,
[0014][0015]
优选的,具有如式(ⅰ)所示结构式的nir-ii光热材料的合成方法包括:
[0016]
(1)氮气氛围下,2.5-二(2-噻吩基)-3.4-二硝基噻吩(原料1)与锌粉和氯化铵在二氯甲烷和甲醇的混合溶剂体系中反应得到中间体2;
[0017]
(2)氮气氛围下,利用中间体2、超干吡啶、亚硫酰苯胺(原料3)、三甲基氯硅烷的反应体系制备得到中间体4;
[0018]
(3)氮气氛围下,利用中间体4和n-溴代丁二酰亚胺(原料5)发生wohl-ziegler反应得到中间体6;
[0019]
(4)氮气氛围下,利用中间体6与三苯胺-4-硼酸(原料7)在四三苯基膦钯(pd(pph3)4)、碱性条件下进行suzuki偶联反应得到具有如式(ⅰ)所示结构式的nir-ii光热材料。
[0020]
该nir-ii光热材料的合成路线可表示为:
[0021][0022]
优选的,将nir-ii光热材料与表面活性剂以1:1-3混合,共沉淀制备得到所述水溶性纳米粒子。
[0023]
进一步优选的,所述表面活性剂为二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg)。
[0024]
体外实验证明,在耐药癌细胞的耐药范围下,向耐药癌细胞体系内加入所述水溶性纳米粒子,培养12-24小时后进行激光照射处理,再培养24-72小时后即可实现耐药癌细胞耐药性的逆转。所述耐药癌细胞包括耐紫杉醇人非小细胞肺癌细胞(a549/ptx细胞)(亲本株为人非小细胞肺癌细胞,a549细胞)和耐阿霉素卵巢癌细胞(a2780/adr)(亲本株为卵巢癌细胞,a2780细胞);当所述的耐药癌细胞为耐紫杉醇人非小细胞肺癌细胞时,其对紫杉醇的耐药范围为0.02-0.16μg/ml;当所述的耐药癌细胞为耐阿霉素卵巢癌细胞时,对阿霉素的耐药范围为0.48-7.8nm。当所述的耐药癌细胞为a549/ptx细胞时,所述的nir-ii光热材料制得的水溶性纳米粒子能够通过抑制p-gp、gst-π、bcl-2蛋白的表达来增加其对化疗药物的敏感性。
[0025]
所述逆转癌细胞多药耐药性药物是注射制剂,辅以激光照射处理使用。激光照射处理的参数为:波长为660nm,功率为0.3-0.5w/cm2,激光照射时间为5-20min。在该优选条件中,可以有效地避免光热作用过热导致完全杀死细胞,但又能有效地逆转癌细胞多药耐药性。
[0026]
与现有技术相比,本发明的有益效果在于:
[0027]
(1)本发明nir-ii光热材料合成方法简单,具有近红外二区荧光发射(996nm),具有良好的光热转换效率(42.6%)和能产生较高的光热温度(100μg/ml能产生高达55℃的温度),能够有效应对肿瘤的治疗深度且能提供足够的热量对其耐药性逆转。
[0028]
(2)本发明基于nir-ii光热材料的光热效果逆转癌细胞多药耐药性,光热作用相较于光动力而言,具有更广的有效治疗范围。
[0029]
(3)本发明提供的纳米粒子药物普适性好,能够应用于多种耐药癌细胞,并实现逆转癌细胞多药耐药性,使其重新对化疗药物敏感,经耐药性逆转的a549/ptx细胞在0.04μg/ml的紫杉醇(ptx)浓度下,细胞存活率仅为60%,当紫杉醇浓度为0.16μg/ml时,a549/ptx细
胞基本全部死亡;本发明供的纳米粒子药物实现了光热作用有效的利用,逆转了a549/ptx对ptx的耐药性,具有巨大的临床研究价值。
附图说明
[0030]
图1为tt-tpa的核磁共振氢谱图。
[0031]
图2为tt-tpa的核磁共振碳谱图。
[0032]
图3为实施例2中nir-ii光热材料制得的水溶性纳米粒子在660nm,0.5w/cm2下照射5分钟的光热测试图谱。
[0033]
图4为实施例2中水溶性纳米粒子的光热稳定性测试图。
[0034]
图5为实施例2中水溶性纳米粒子对a549/ptx细胞和a549细胞正常光照培养和激光照射处理的测试结果图。
[0035]
图6为a549/ptx细胞与a549细胞的耐紫杉醇化疗药物测试结果图。
[0036]
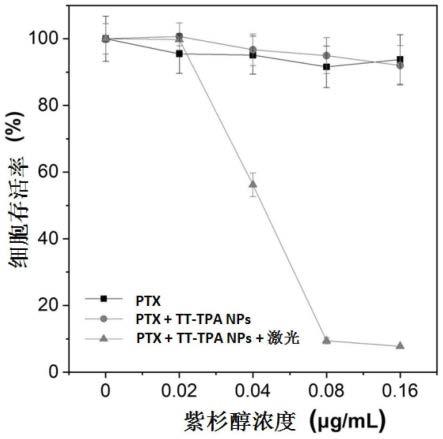
图7为实施例2中水溶性纳米粒子对a549/ptx细胞的耐药性逆转验证图。
[0037]
图8为pbs溶液、tt-tpa nps,tt-tpa nps辅以激光照射三种处理条件下a549/ptx细胞中p-gp蛋白的表达情况表征图。
[0038]
图9为pbs溶液、tt-tpa nps,tt-tpa nps辅以激光照射三种处理条件下a549/ptx细胞中gst-π蛋白的表达情况表征图。
[0039]
图10为pbs溶液、tt-tpa nps,tt-tpa nps辅以激光照射三种处理条件下a549/ptx细胞中bcl-2蛋白的表达情况表征图。
[0040]
图11为实施例4中水溶性纳米粒子对耐阿霉素卵巢癌细胞的耐药性逆转验证图。
具体实施方式
[0041]
下面结合附图与实施例,进一步阐明本发明。应理解,这些实施例仅用于说明本发明,而不用于限制本发明的范围。
[0042]
实施例1 nir-ii光热材料tt-tpa的合成
[0043]
本发明中,nir-ii光热材料的结构式如式(ⅰ)所示:
[0044][0045]
nir-ii光热材料tt-tpa的合成路线可表示为:
[0046]
[0047][0048]
合成方法具体包括如下步骤:
[0049]
(1)中间体2的合成:在100ml两口烧瓶中,分别称取2.5-二(2-噻吩基)-3.4-二硝基噻吩(原料1,0.68g,2mmol)、锌粉(2.94g,44mmol)和氯化铵(0.4g,7mmol),在氮气氛围下,加入二氯甲烷(10ml)和90%(v/v)甲醇(15ml),在常温下反应4h,待反应完成后,将反应液使用硅藻土进行过滤,然后利用二氯甲烷和饱和食盐水进行萃取,进行三次萃取并收集有机相,使用无水硫酸镁进行干燥,将干燥后的有机相过滤后利用旋蒸去除溶剂,后续使用硅胶柱色谱法(200-300目)进行纯化,洗脱剂为石油醚/乙酸乙酯(v/v=6:4),得到黑色粉末中间体2(0.5g),产率73%。
[0050]
(2)中间体4的合成:在100ml两口烧瓶中,称取中间体2(0.278g,1mmol)在氮气氛围保护下,冰浴条件下加入30ml超干吡啶,等待完全溶解后,加入亚硫酰苯胺(原料3,0.42g,3mmol)和滴加三甲基氯硅烷(tmsc)(0.64ml,7mmol),待冰浴中的冰自然溶解后,在常温下继续反应4h,反应结束后旋蒸去除反应液中的溶剂,然后利用二氯甲烷和饱和食盐水进行萃取,进行三次萃取并收集有机相,使用无水硫酸镁进行干燥,将干燥后的有机相过滤后利用旋蒸去除溶剂,后续使用硅胶柱色谱法(200-300目)进行纯化,洗脱剂为石油醚/二氯甲烷(v/v=8:2),得到蓝色的固体中间体4(0.26g),产率93.5%。
[0051]
(3)中间体6的合成:在100ml两口烧瓶中,分别称取中间体4(0.3g,1mmol)和n-溴代丁二酰亚胺(nbs)(原料5,0.36g,2mmol),在氮气保护氛围下,避光条件以及冰浴条件下滴加10ml氯仿溶液于反应体系中,等待完全溶解后,滴加3ml冰醋酸到反应体系中,待冰浴中的冰自然溶解并在常温下持续反应12h,待反应完成后,将反应液旋蒸去除反应液中的溶剂,然后利用二氯甲烷和饱和食盐水进行萃取,进行三次萃取并收集有机相,使用无水硫酸镁进行干燥,将干燥后的有机相过滤后利用旋蒸去除溶剂,得到紫色粉末中间体6,该步骤不需提取即可直接投入下一步反应使用。
[0052]
(4)tt-tpa的合成:依次称取步骤(3)得到的中间体6(0.23g,0.5mmol)和三苯胺-4-硼酸(原料7,0.43g,1.5mmol)、碳酸钾(0.2g,1.5mmol)和四三苯基膦钯pd(pph3)4(45mg,0.0375mmol),在氮气氛围下,加入经过除氧的甲苯溶剂(25ml)和去离子水(5ml),将反应体系加热至90℃反应24h。反应结束后旋蒸去除反应液中的溶剂,然后利用二氯甲烷和饱和食盐水进行萃取,进行三次萃取并收集有机相,使用无水硫酸镁进行干燥,将干燥后的有机相过滤后利用旋蒸去除溶剂,后续使用硅胶柱色谱法(200-300目)进行纯化,洗脱剂为石油醚/二氯甲烷(v/v=6:4),得到墨绿色固体tt-tpa(0.22g),两步产率23.6%。
[0053]
tt-tpa的鉴定:
[0054]1h nmr(400mhz,cdcl3)δ7.50(d,j=9.0hz,2h),7.29(d,j=7.5hz,8h),7.24
–
7.18(m,6h),7.15
–
7.02(m,16h).
[0055]
13
c nmr(126mhz,cdcl3)δ148.32,147.35,133.41,130.46,129.38,127.77,126.41,124.71,124.68,124.60,124.41,123.32,123.05.
[0056]
tt-tpa的核磁共振氢谱图和核磁共振碳谱图分别如图1和图2所示,证明了tt-tpa的成功合成。
[0057]
实施例2 tt-tpa nps的合成
[0058]
将实施例1制得的nir-ii光热材料与二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg)以1:2混合,共沉淀制备得到所述的水溶性纳米粒子。
[0059]
将水溶性纳米粒子分别配制为25μg/ml,50μg/ml,75μg/ml,100μg/ml的溶液,以纯水作为对照,在660nm,0.5w/cm2的激光器下,检测上述纳米粒子溶液与纯水的光热效果,结果如图3所示,该nir-ii光热材料具有良好的光热转换效率(42.6%)和能产生较高的光热温度(100μg/ml能产生高达55℃的温度)。并通过循环5次的激光开光对水溶性纳米粒子(tt-tpa nps)的光热稳定性能进行测试,以商业染料吲哚菁绿(icg)作为对照,结果如图4所示,证明本发明nir-ii光热材料的光热稳定性优异。
[0060]
将水溶性纳米粒子分别配制为5μg/ml,10μg/ml,15μg/ml,20μg/ml,25μg/ml的溶液,以纯水作为对照,将其与a549/ptx细胞或a549细胞5%co2,37℃下共培养48小时,后续加入mtt孵育4小时后,测定该水溶性纳米粒子对a549/ptx细胞和a549细胞在正常光照培养条件下的杀伤能力,得到正常光照培养条件下的测试结果;将水溶性纳米粒子分别配制为5μg/ml,10μg/ml,15μg/ml,20μg/ml,25μg/ml的溶液,以纯水作为对照,将其与a549/ptx细胞或a549细胞5%co2,37℃下共培养24小时后,利用660nm,0.3w/cm2的激光器照射10分钟后,继续培养24小时,后续加入mtt孵育4小时后,测定该水溶性纳米粒子对a549/ptx细胞和a549细胞在激光培养条件下的杀伤能力;如图5所示,在5-25μg/ml的浓度范围内,正常光照培养条件下,该水溶性纳米粒子对a549/ptx细胞和a549细胞没有杀伤作用,a549/ptx细胞和a549细胞在正常光照培养条件下细胞存活率均大于90%;而在激光培养条件下,a549/ptx细胞和a549细胞都呈现明显的光毒性杀伤,当水溶性纳米粒子浓度达到25μg/ml时,这两种细胞的存活率均低于40%。
[0061]
实施例3测试耐紫杉醇人非小细胞肺癌细胞的耐药范围
[0062]
对耐紫杉醇人非小细胞肺癌细胞(a549/ptx细胞)与其亲本a549细胞进行耐药性测试,设置紫杉醇的浓度梯度为0.02μg/ml、0.04μg/ml、0.08μg/ml、0.16μg/ml,将其与a549/ptx细胞和a549细胞共培养48小时后,加入mtt孵育4小时后,溶解在dmso(二甲基亚砜)中测定不同浓度的紫杉醇化疗药物对a549/ptx细胞与a549细胞的杀伤能力,得到a549/ptx细胞与a549细胞的耐药性测试结果;结果如图6所示,可见a549/ptx细胞可耐受0.02~0.16μg/ml的紫杉醇化疗药物。
[0063]
进行体外实验验证实施例2制得的水溶性纳米粒子对a549/ptx细胞的耐药性逆转。在a549/ptx细胞0.02~0.16μg/ml的紫杉醇耐药浓度范围下,将a549/ptx细胞与水溶性纳米粒子在5%co2,37℃下共培养,a549/ptx细胞与水溶性纳米粒子共培养体系内,水溶性纳米粒子的浓度为15μg/ml。培养24小时后,利用660nm,0.3w/cm2的激光器照射10分钟后,继续培养24小时,后续加入mtt孵育4小时后,溶解在dmso中测定nir-ii光热材料制得的水
溶性纳米粒子对a549/ptx细胞在耐受的紫杉醇浓度下,光热条件下对细胞的杀伤能力,结果如图7所示,在正常光照培养条件下,该nir-ii光热材料制得的水溶性纳米粒子对a549/ptx细胞没有杀伤能力,在经过激光照射处理后该nir-ii光热材料制得的水溶性纳米粒子能够使a549/ptx细胞重新对紫杉醇化疗药物敏感。
[0064]
进一步验证a549/ptx细胞中耐药相关蛋白的表达情况,对a549/ptx细胞进行三种处理,分别为加入pbs溶液、加入tt-tpa nps,加入tt-tpa nps辅以激光照射处理,在5%co2,37℃下共培养24小时后,利用660nm,0.3w/cm2的激光器照射10分钟后,继续培养72小时,每组培养100万个细胞,然后再进行蛋白质印迹实验,在共聚焦显微镜下拍摄荧光信号的强弱,通过荧光信号的强弱可以看出相关蛋白的表达情况,验证光热作用对耐药相关蛋白的破坏,三组处理下,p-gp蛋白的表达情况如图8所示(其中,p-gp列表示细胞质的染色结果、hoechst列表示下细胞核的染色结果,merged列表示叠加后的细胞染色结果),gst-π蛋白的表达情况如图9所示(其中,gst-pi列表示细胞质的染色结果、hoechst列表示下细胞核的染色结果,merged列表示叠加后的细胞染色结果),bcl-2蛋白的表达情况如图10所示(其中,bcl-2列表示细胞质的染色结果、hoechst列表示下细胞核的染色结果,merged列表示叠加后的细胞染色结果),由上图结果可知,tt-tpa nps辅以激光照射处理显著抑制了p-gp蛋白、gst-π蛋白和bcl-2蛋白的表达,证明实施例2中nir-ii光热材料制得的水溶性纳米粒子基于光热作用实现对a549/ptx细胞的耐药性逆转。
[0065]
实施例4
[0066]
将实施例1制得的nir-ii光热材料与二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg)以1:3混合,共沉淀制备得到所述的水溶性纳米粒子。
[0067]
测试耐阿霉素卵巢癌细胞(a2780/adr细胞)的耐药范围,耐药浓度为0.478-7.8nm。
[0068]
体外实验验证上述水溶性纳米粒子对a2780/adr细胞的耐药性逆转,操作步骤与实施例4相同,区别仅在于将a549/ptx细胞换为a2780/adr细胞,耐药条件换为0.478-7.8nm的阿霉素,结果如图11所示,在正常光照培养条件下,上述水溶性纳米粒子对a2780/adr细胞没有杀伤能力,在经过激光照射处理后该nir-ii光热材料制得的水溶性纳米粒子能够使a2780/adr细胞重新对阿霉素化疗药物敏感。
[0069]
以上所述的实施例对本发明的技术方案进行了详细说明,应理解的是以上所述的仅为本发明的具体实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充或类似方式替代等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1