一种细胞外囊泡体外装载mRNA的方法与流程
一种细胞外囊泡体外装载mrna的方法
技术领域
1.本发明属于生物制品技术领域,尤其是涉及一种细胞外囊泡体外装载mrna的方法。
背景技术:
2.细胞外囊泡(extracellular vesicles)是一种直径在30-150nm之间的茶托型结构的小囊泡,包含rna、蛋白质、microrna、dna片段等多种成分。全部真核细胞和一些原核细胞均可分泌,主要分布在血液、唾液、尿液、羊水和母乳等多种体液中。它是由细胞质膜内陷形成早期的核内体,核内体内陷包裹物质形成多泡体,而后多泡体在与质膜融合后得以释放。尽管细胞外囊泡早在1983年就被发现,但当时人们普遍认为它是细胞代谢的废弃物,主要作用是在新陈代谢过程中承担扔废料的角色。然而2007年,研究人员发现细胞外囊泡含有母细胞来源的蛋白、脂质和核酸,并能作为信号分子传递其他细胞从而改变靶细胞功能。随着研究结果的不断发现,把细胞外囊泡研究与转化研究推向了新的时代。
3.除了对天然细胞外囊泡的功能性研究,改造并赋予细胞外囊泡新功能也是目前科研热点领域,即通过体内或体外方式装载功能性小分子、核酸或蛋白质,使细胞外囊泡成为良好的生物药递送载体。其中核酸是指寡核苷酸分子,包括小干扰核酸(sirna)、反义核酸(aso)、微小rna(mirna)、信使核糖核酸(mrna)和核酸适体(aptamer)。核酸药物由核苷酸组成,与小分子药物和抗体药物完全不同。主要的小核酸药物有sirna药物和反义核酸(aso)药物。它们主要作用于细胞质mrna,通过碱基互补识别和抑制靶mrna,调节蛋白表达,达到治疗疾病的目的。因为新冠疫情影响,针对新冠病毒的mrna疫苗也成为目前科研热点领域,由美国辉瑞公司和moderna公司生产的mrna疫苗以脂质体为载体,而细胞外囊泡因为其低毒性和生物相容性被认为是未来可能替代脂质体的载体方案。
4.一般来说,通过体外装载生物分子的尺寸较小,例如sirna药物和反义核酸(aso)药物,但是一段典型mrna(1000 bp)的线性长度约为300 nm,超过了典型细胞外囊泡的最大尺寸,所以细胞外囊泡装载大分子量mrna一直是一个挑战。传统的解决方案是通过体内装载的方法,分为两条技术路线,其一是被动装载,即构建mrna过量表达载体,将载体转染进细胞之后,过量表达目标mrna,使其被动装载到细胞分泌的细胞外囊泡中;其二是主动装载,利用在细胞外囊泡中过量表达的rna结合蛋白,结合mrna并定位到细胞外囊泡中。
5.但是传统mrna体内装载细胞外囊泡解决方案有一定局限性,体现在三个方面:(1)mrna必须来源于细胞体内表达,而对于一些现代生物产业应用场景,例如制备mrna疫苗的核酸,其中存在必要的人工化学修饰用于增强生物活性,降低毒性,提高体内稳定性,而生物体内无法生产人工化学修饰成分,例如使用假尿嘧啶核苷作为mrna合成原料,为了降低降低细胞的天然免疫反应;(2)细胞外囊泡来源细胞必须容易进行基因编辑并且可以大规模培养,这就限制了细胞外囊泡来源,例如一些原代细胞难以进行基因编辑,诸如牛奶来源细胞外囊泡和尿液来源细胞外囊泡的工程化改造,都很难通过体内改造细胞获得;(3)体内装载mrna需要设计并合成基因表达载体,在基因层面改造细胞,对实验操作技术水平要求
高,实验成本高且周期长,无法用于实验级别快速筛选判断目标mrna在细胞外囊泡中的装载效率,因为制备工艺复杂也很难进行工业放大生产。
技术实现要素:
6.为解决上述技术问题,本发明提供一种细胞外囊泡体外装载mrna的方法。
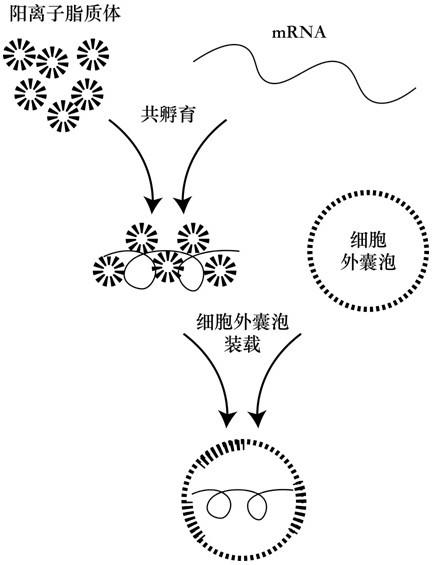
7.本发明采用的技术方案是:一种细胞外囊泡体外装载mrna的方法,将mrna与阳离子脂质体共孵育后装载细胞外囊泡。
8.优选地,选取在中性条件下携带弱负电或电中性脂质体,在弱酸性条件下进行mrna装载;装载后的细胞外囊泡通过超滤换液恢复到中性。
9.优选地,检测装载前后mrna拷贝数,比值为mrna在细胞外囊泡中的包封率。
10.优选地,抽提样品中的rna,通过rt-qpcr定量检测mrna拷贝数。
11.优选地,将mrna与脂质体混合,加入柠檬酸钠,孵育,加入细胞外囊泡后再孵育。
12.优选地,将阳离子脂质溶于三氯甲烷,氮气吹干之后,用pbs复溶,手动或电动挤出器挤出形成脂质体。
13.优选地,阳离子脂质体为dlin-mc3-dma(4-(n,n-二甲基氨基)丁酸(二亚油基)甲酯)、dotap(n-(2,3-dioleoyloxy-1-丙基)三甲胺甲基硫酸甲酯)、dspc(1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱)、dc-chol(n', n'-二甲基乙二胺基氨甲酞基胆固醇)、dop-deda(胆固醇和二油酰甘油磷酸二乙二胺结合物)、 dotma(1,2-双十八烯氧基-3-甲基铵丙烷)、dodma(1,2-二油醇-3-二甲基氨基-丙烷)中的一种或几种。
14.优选地,细胞外囊泡为牛奶来源细胞外囊泡、人源细胞来源细胞外囊泡或尿液来源细胞外囊泡。
15.细胞外囊泡体外装载mrna的方法在制备生物制品中的应用。
16.本发明具有的优点和积极效果是:与传统装载方法比较,本发明提供的方法操作简单,对操作技术水平要求低、实验周期短、成本低;对于所要转载的mrna限制少,相应的具有较广的应用范围;另外,在中性条件下携带弱负电或电中性脂质,在弱酸性条件下进行mrna装载,装载后的细胞外囊泡通过换液的方法恢复到中性环境,可以规避阳离子脂质体携带正电荷而存在细胞毒性的问题;通过本方法装载mrna,最大限度保留了细胞外囊泡的样本,通过rt-qpcr技术即使低浓度或微量检测也能够获得较佳信号值,通过比较装载前后mrna差值,可计算mrna在细胞外囊泡中的包封率。
附图说明
17.图1是本发明细胞外囊泡体外装载mrna的方法示意图;图2是对比例体内mrna装载hek293t人胚胎肾细胞来源细胞外囊泡检测结果;图3是实施例1中dlin-mc3-dma脂质体电镜形态图;图4是实施例1中阳离子脂质体dlin-mc3-dma在不同ph下的带电性质;图5是使用dlin-mc3-dma脂质体、dotap脂质体装载试剂(roche
tm
)和
lipofectamine
tm 3000装载试剂(thermo scientific
tm
)进行mrna装载牛奶来源细胞外囊泡的包封率。
具体实施方式
18.下面结合附图对本发明的实施例做出说明。
19.本发明公开一种细胞外囊泡体外装载mrna的方法,将mrna与阳离子脂质体共孵育后装载细胞外囊泡,利用低毒阳离子脂质体在体外高效装载mrna的细胞外囊泡制备方法,代替传统体内装载mrna的方式,这种装载方法能够广泛应用于制备生物制品,不限细胞外囊泡来源,不限细胞外囊泡溶液纯化方式和纯度,不限mrna来源与人工化学修饰方式,具有较广的应用场景适用范围。
20.阳离子脂质体在中性条件下呈现弱负电或电中性性质,在酸性条件下呈现弱正电性质,选取在中性条件下携带弱负电或电中性脂质体,在弱酸性条件下进行mrna装载,装载后的细胞外囊泡通过超滤换液恢复到中性,再进行细胞实验,从而规避阳离子脂质体因为携带正电荷导致的细胞毒性问题。阳离子脂质体为dlin-mc3-dma(4-(n,n-二甲基氨基)丁酸(二亚油基)甲酯)、dotap(n-(2,3-dioleoyloxy-1-丙基)三甲胺甲基硫酸甲酯)、dspc(1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱)、dc-chol(n', n'-二甲基乙二胺基氨甲酞基胆固醇)、dop-deda(胆固醇和二油酰甘油磷酸二乙二胺结合物)、 dotma(1,2-双十八烯氧基-3-甲基铵丙烷)、dodma(1,2-二油醇-3-二甲基氨基-丙烷)中的一种或几种;细胞外囊泡为牛奶来源细胞外囊泡、人源细胞来源细胞外囊泡或尿液来源细胞外囊泡。
21.具体制备方法如下:制备脂质体:将阳离子脂质溶于三氯甲烷,终浓度为1 mm;氮气吹干之后,用pbs复溶,旋涡振荡10分钟;使用手动或电动挤出器挤出20次,膜孔径为100 nm;制备mrna:以pcdna3.1(+)-egfp质粒为模板,使用近岸蛋白质科技有限公司试剂盒t7 high yield rna transcription kit进行体外转录mrna;使用氯化锂纯化吹干;用无菌无酶水复溶定量;脂质体和mrna共孵育并装载细胞外囊泡:取脂质体3 ul,加入300 ng mrna,添加柠檬酸钠溶液至50 ul,其中,柠檬酸钠浓度为0.2mol/l,通过盐酸和/或氢氧化钠调节其ph值为4.3;室温静置孵育15分钟;加入400 ul细胞外囊泡(颗粒数约为1e11个/ml);37℃静置孵育2小时。
22.本发明某些实施例中还可检测mrna在细胞外囊泡中装载效率,抽提样品中的rna,通过rt-qpcr定量检测mrna拷贝数,孵育装载后,使用核酸酶去除体外未装载的核酸,通过超滤洗脱核酸酶和核酸碎片,抽提样品中的rna,通过rt-qpcr定量检测mrna拷贝数,计算装载前后mrna的比值,即该mrna在细胞外囊泡中的包封率。
23.未装载的mrna处理以及包封率定量步骤如下:使用100 kda超滤管(amicon
®ꢀ
ultra-0.5),将装载mrna后的细胞外囊泡通过超滤换液浓缩至100 ul,新缓冲液为pbs(ph=7.45),将浓缩液100 ul均分为两份,其中一份加入千分之一核酸酶(thermo scientific
tm pierce
tm 通用核酸酶),另一份不添加核酸酶,将两份样品在37℃静置孵育30分钟;使用100 kda超滤管(amicon
®ꢀ
ultra-0.5)洗滤已添加核酸酶的样品5次,目的是
去除核酸酶和核酸片段;用trizol提取两份样品的rna,使用rt-qpcr(takara
tm primescript
tm rt master mix和tb green
®ꢀ
advantage
®ꢀ
qpcr premix)定量样品中的egfp mrna拷贝数;计算核酸酶处理前后mrna拷贝数的比值,即细胞外囊泡装载前后mrna拷贝数的比值,得到该mrna在细胞外囊泡中的包封率。
24.下面结合附图对本发明方案做出说明,其中,未具体说明操作步骤的实验方法,均按照相应商品说明书进行,实施例中所用到的仪器、试剂、耗材如无特殊说明,均可从商业公司购买得到。
25.对比例:体内mrna装载hek293t人胚胎肾细胞来源细胞外囊泡使用pbi-cmv2(takara bio
tm
)双表达元件质粒,在两处多克隆位点(mcs)中分别添加两组基因表达元件,分别为basp-1-mcp与egfp-ms2,其中basp-1是在细胞外囊泡中定位的蛋白质,其序列源于ncbi数据库(uniprot检索号p80723);mcp是mrna结合蛋白,可以抓取ms2序列,其序列源于ncbi数据库(uniprot检索号o64375);egfp序列源于ncbi数据库(uniprot检索号p42212),是一种报告基因;ms2序列可以被mcp抓取,其序列源于ncbi数据库(uniprot检索号p03612)。这个体内装载mrna系统可以通过mcp抓取ms2序列,将egfp mrna装载到细胞外囊泡中。
26.将改造后的质粒做质粒纯化,质粒抽提之后使用lipofectamine 3000(thermo scientific tm
)转染人胚胎肾细胞hek293t细胞(四万个细胞/孔),单次使用100 ng质粒,装载24小时之后,取100 μl上清液,用trizol提取rna,使用rt-qpcr(takara
tm primescript
tm rt master mix和tb green
®ꢀ
advantage
®ꢀ
qpcr premix)定量样品中的egfp mrna拷贝数,其中定量引物分别为:seq id no.1:qpcr-gfp-f(5
’‑3’
):aagcagaagaacggcatcaa;seq id no.2:qpcr-gfp-r(5
’‑3’
):gggggtgttctgctggtagt;测定样品中egfp mrna拷贝数为311597.67
±
20560.77个/100 μl,而空白对照样品中egfp mrna拷贝数为191
±
60.09个/100 μl,如图2所示,证明egfp mrna通过体内装载到细胞外囊泡中。
27.对比例中传统mrna体内装载细胞外囊泡方法具有一定局限性;首先,细胞表达mrna无法进行人工化学修饰,限制了该方法在疫苗等领域的应用;其次,细胞外囊泡只能来源于实验室可培养的细胞株,对于牛奶来源细胞外囊泡或尿液来源细胞外囊泡的应用受限;再次,细胞改造实验操作复杂,成本高,周期长,也限制工业化放大生产。针对这些问题,本发明公开的细胞外囊泡体外装载mrna的方法能够予以解决,下面通过具体实施例做出说明。
28.实施例1:利用低毒阳离子脂质体dlin-mc3-dma体外高效装载mrna的细胞外囊泡制备方法选取低毒阳离子脂质dlin-mc3-dma(4-(n,n-二甲基氨基)丁酸(二亚油基)甲酯)(艾伟拓(上海)医药科技有限公司),溶于三氯甲烷,终浓度为1 mm。氮气吹干之后,用pbs复溶,旋涡振荡10分钟。使用手动挤出器挤出20次,膜孔径为100 nm,如图3是dlin-mc3-dma脂质体电镜形态图,测定该脂质体的带电性质为弱负电,如图4所示为阳离子脂质体dlin-mc3-dma在不同ph下的带电性质。因为作为装载试剂,脂质体必须携带正电荷,才能吸附带
负电的核酸,于是通过调整缓冲液的ph值,在ph=4.3情况下,装载实验就在ph=4.3下进行,使得该脂质体携带正电。
29.4-(n,n-二甲基氨基)丁酸(二亚油基)甲酯mrna是以pcdna3.1(+)-egfp质粒为模板,使用近岸蛋白质科技有限公司试剂盒t7 high yield rna transcription kit进行体外转录mrna,转录过程中使用人工合成假尿嘧啶核苷,用于降低细胞的天然免疫反应。mrna体外转录之后使用氯化锂纯化吹干,用无菌无酶水复溶定量。本实施例中,使用的mrna egfp mrna(约1100 bp),在本发明某些实施例中,还可为其他来源和长度的mrna,本发明公开mrna的装载方法,不拘mrna种类的来源均适用于本装载方法。
30.取脂质体3 ul,加入300 ng mrna,添加柠檬酸钠-氢氧化钠-盐酸(ph=4.3)至50 ul,室温静置孵育15分钟,加入400 ul牛奶来源细胞外囊泡(颗粒数约为1e11个/ml),37℃静置孵育2小时,将mrna装载到牛奶来源细胞外囊泡中。
31.使用100 kda超滤管(amicon
®ꢀ
ultra-0.5),将装载mrna后的细胞外囊泡通过超滤换液浓缩至100 ul,新缓冲液为pbs(ph=7.45),将浓缩样品100 ul均分为两份,其中一份加入千分之一核酸酶(thermo scientific
tm pierce
tm 通用核酸酶),另一份不添加核酸酶,将两份样品在37℃静置孵育30分钟。使用100 kda超滤管(amicon
®ꢀ
ultra-0.5)洗滤已添加核酸酶的样品5次。用trizol提取两份样品的rna,使用rt-qpcr(takara
tm primescript
tm rt master mix和tb green
®ꢀ
advantage
®ꢀ
qpcr premix)定量样品中的egfp mrna拷贝数,其中定量引物分别为:seq id no.1:qpcr-gfp-f(5
’‑3’
):aagcagaagaacggcatcaa;seq id no.2:qpcr-gfp-r(5
’‑3’
):gggggtgttctgctggtagt;计算核酸酶处理前后mrna拷贝数的比值,即细胞外囊泡装载前后mrna拷贝数的比值,得到该mrna在细胞外囊泡中的包封率为76.4%
±
6.8%,如图5所示。
32.细胞外囊泡均为双层磷脂膜结构,尺寸类似,本实施例中针对牛奶来源细胞外囊泡采用的装载方法,也适用于结构与其相类似的其他来源外囊泡。
33.实施例2:利用两种商业装载试剂进行体外装载mrna的细胞外囊泡制备两种基于脂质体的商业细胞装载试剂是dotap脂质体装载试剂(roche
tm
)和lipofectamine
tm 3000装载试剂(thermo scientific
tm
),这两种试剂设计初衷是装载细胞,这两种转染试剂都是脂质体,本实施例测试其用来装载细胞外囊泡的效果。
34.装载方法与实施例1相同,即取dotap脂质体装载试剂或lipofectamine
tm 3000装载试剂3 ul,加入300 ng mrna,室温静置孵育15分钟,加入400 ul牛奶来源细胞外囊泡(颗粒数约为1e11个/ml),37℃静置孵育2小时,将mrna装载到牛奶来源细胞外囊泡中。通过核酸酶处理与rt-qpcr定量之后,计算通过dotap脂质体装载试剂或lipofectamine
tm 3000装
载试剂得到的包封率分别为38.8%
±
3.8%和11.5%
±
3.5%,如图5所示。
35.结合上述实施例能够看出,本方案能够快速表征分析目标mrna在细胞外囊泡中装载效率,节省时间和成本,能够用于mrna和细胞外囊泡装载效率检测,并且通过调节缓冲液ph值避免正电荷相关的细胞毒性,比两种商业化细胞装载试剂对细胞外囊泡装载效果更好。
36.以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1