一种脑电极器件及其制备方法与流程
1.本发明涉及脑电极技术领域,特别涉及一种脑电极器件及其制备方法。
背景技术:
2.脑机接口是一种涉及神经科学、信号检测和信号处理等多学科的交叉技术,在生物医学、神经康复和智能机器人等领域具有重要的研究意义和巨大的应用潜力。它通过在人脑与计算机或其它电子设备之间建立直接的交流和控制通道,从大脑皮层采集脑电信号经过放大、滤波、a/d转换等处理转换为可以被计算机识别的信号,然后对信号进行预处理,提取特征信号,再利用这些特征进行模式识别,最后转化为控制外部设备的具体指令,实现对外部设备的控制。
3.神经电生理监测对于脑科学研究和脑疾病诊断具有不可替代的作用,高质量的神经电生理信号采集技术是中国脑科学基础研究和脑疾病临床研究的顺利开展的基础。对神经电生理信号采集的方法主要依靠脑机接口完成,依据信息采集的方式,其通常被分为非侵入式、半侵入式和侵入式。这三种不同的类型各有优势和局限性。非侵入式的头皮电极直接贴附头皮,无需手术,但因颅骨的衰减,采集到的脑电信号不准确;半侵入式皮层脑电极贴附皮层,脑电信号较为精准;侵入式深部脑电极则直接植入大脑深部,采集到的脑电信号最为精准,可采集立体脑电信号,微创植入,长期在体的植入式深部电极正在逐步成为未来脑机接口主流技术之一。
4.一般情况下,可使用omnetics/微纳连接器、固定在颅骨或者经皮导线将电极采集的信号从身体传送到外部硬件。但是这些接口具有持续感染的风险,因此研究者提出了基于天线的射频技术、电感耦合、电耦合和电容耦合ibc、超声波、光、分子纳米网络等方法的无线通信。尽管如此,受到供电以及带宽影响,无线植入物的寿命和通道数仍是现在的一大难点。因此上千乃至上万量级的脑电器件与后端的主要通讯方式仍然为有线连接。
5.目前脑电极器件首先焊接于印刷电路板上,然后通过匹配的接口连接于市售的处理电路板上,在信号处理电路板上完成初步的放大后,再通过线缆送入计算机,从而完成整个脑电信号的采集和处理的过程。
6.上述传输信号的方式就是使用柔性电缆。通过将探针底座与电极待插入端一起制造在单个芯片上,数据可以直接从探头通过柔性电缆传输到处理端,目前可以实现384通道的传输。该方法较好的柔性为后续的动物实验提供了很大的便利,但是该方法需要将电压信号在电极基底上进行滤波、放大、多路复用和数字化,从而产生无噪声的数字信号,否则未经处理的信号将在电缆的传输过程中易受到噪声干扰,影响数据准确性;且目前柔性电缆可连接的通道数也受到限制,要实现上千甚至上万级别的脑电极通道,需要的多个电缆进行组装,这种连接方式不但繁琐复杂,且集成度较低。此外还存在“微运动”效应,该效应是植入物相对于大脑的独立运动,会导致组织磨损,消除接口电缆可以减小此种影响。
技术实现要素:
7.本发明要解决的是上述现有技术中采用在电极基底上进行信号处理,且采用线缆进行信号传输,通道数少、集成度低的技术问题。
8.为解决上述技术问题,本技术于一方面公开了一种脑电极器件,其包括信号采集芯片、脑电极结构和电路板;
9.该信号采集芯片设于该电路板上,该信号采集芯片通过与该电路板的外围电路的配合能够实现对信号的模数转换、放大和滤波;
10.该信号采集芯片的焊盘区域与该脑电极结构的焊盘结构通过倒装焊连接;
11.该脑电极结构用于采集脑电信号。
12.可选的,该焊盘区域上设有第一焊点阵列;
13.该焊盘结构上设有与该第一焊点阵列对应的第二焊点阵列。
14.可选的,该脑电极结构包括连接与该焊盘结构连接的接触电极结构;
15.该接触电极结构通过与头皮层的接触来实现脑电信号的采集;
16.该接触电极结构为非侵入式、半侵入式和侵入式中的任一种。
17.可选的,该信号采集芯片位于该电路板的第一区域;
18.该第一区域靠近该电路板的端部;
19.该接触电极结构能够伸出该电路板的端部与该头皮层接触。
20.可选的,该接触电极结构包括柔性支撑层、电极线结构和绝缘层;
21.该柔性支撑层上设有该电极线结构;
22.该电极线结构包括电极线和接触电极;
23.该电极线的一端与该接触电极连接,该电极线的另一端与该焊盘结构的焊点连接;
24.该电极线结构上设有该绝缘层,该绝缘层包括电极孔,该电极孔用于暴露出该接触电极。
25.可选的,该接触电极的材料包括铬/金、铬/银或者铬/铂;
26.该柔性支撑层为柔性薄膜材料。
27.可选的,该第一焊点阵列包括128
×
128个焊点;
28.该第二焊点阵列包括128
×
128个焊点;
29.且相邻的焊点之间的间距为100微米。
30.可选的,该接触电极结构包括k个子接触电极结构,该k为大于等于1的整数;
31.该k个子接触电极结构中相邻的子接触电极结构之间存在预设间隔。
32.可选的,该k个子接触电极结构位于同一平面。
33.本技术于另一方面还公开了一种脑电极器件的制备方法,其包括:
34.制备该脑电极结构;该脑电极结构用于采集脑电信号;
35.将该脑电极结构的焊盘结构采用倒装焊与该信号采集芯片的焊盘区域连接;
36.将该信号采集芯片安装在电路板上,该信号采集芯片通过与该电路板的外围电路的配合能够实现对信号的模数转换、放大和滤波。
37.采用上述技术方案,本技术提供的脑电极器件具有如下有益效果:
38.该脑电极器件包括信号采集芯片、脑电极结构和电路板,该信号采集芯片设于该
电路板上,该信号采集芯片通过与该电路板的外围电路的配合能够实现对信号的模数转换、放大和滤波,该信号采集芯片的焊盘区域与该脑电极结构的焊盘结构通过倒装焊连接,该脑电极结构用于采集脑电信号。上述将脑电极结构与信号采集芯片直接连接的方式不仅提高了器件的集成度,且能够提高信号传输质量。
附图说明
39.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
40.图1为本技术第一种可选的脑电极器件的结构示意图;
41.图2为本申第二种可选的脑电极结构的结构示意图;
42.图3为本技术一种可选的接触电极结构的俯视图;
43.图4为本技术第二种可选的脑电极器件的结构示意图;
44.图5为本技术一种可选的信号采集芯片的结构示意图;
45.图6为本技术一种可选的像素电路的结构示意图;
46.图7为本技术另一种可选的像素电路的结构示意图;
47.图8为本技术一种可选的并联的像素电路的结构示意图;
48.图9为本技术第一种可选的接触电极的排布示意图;
49.图10为t1时刻接触电极结构的电势分布模型图;
50.图11为t2时刻接触电极结构的电势分布模型图;
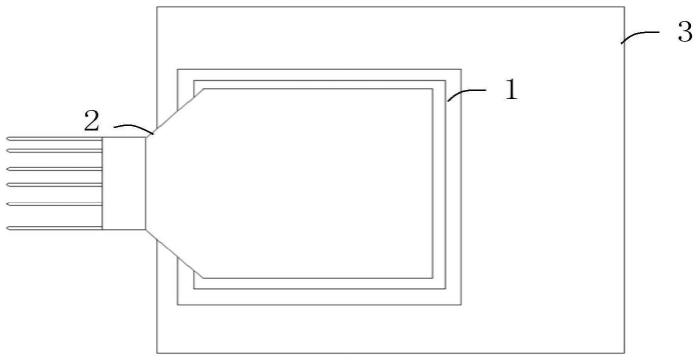
51.图12为本技术一种可选的当接触电极结构插入脑组织中工作状态下的等效电路图;
52.图13为本技术第二种可选的接触电极的排布示意图;
53.图14为本技术第三种可选的接触电极的排布示意图;
54.图15为本技术一种可选的脑电极模块的控制方法的流程图;
55.图16为本技术第三种可选的脑电极器件的结构示意图;
56.图17为本技术第四种可选的脑电极器件的结构示意图;
57.图18为本技术第五种可选的脑电极器件的结构示意图。
58.以下对附图作补充说明:
59.1-信号采集芯片;11-焊盘区域;111-焊柱;112-焊球;2-脑电极结构;21-焊盘结构;22-接触电极结构;221-接触电极;222-子接触电极结构;223-第一接触电极;224-第二接触电极;3-电路板;4-刺激模块;5-测试模块;6-数模转换模块;7-电源模块;8-现场可编程门阵列芯片;9-第一pcb板;10-封装胶。
具体实施方式
60.下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其
他实施例,都属于本技术保护的范围。
61.此处所称的“一个实施例”或“实施例”是指可包含于本技术至少一个实现方式中的特定特征、结构或特性。在本技术的描述中,需要理解的是,术语“上”、“下”、“顶”、“底”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本技术和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本技术的限制。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含的包括一个或者更多个该特征。而且,术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本技术的实施例能够以除了在这里图示或描述的那些以外的顺序实施。
62.尽管阐述本发明的广泛范围的数值范围和参数是近似值,但是具体实例中列出的数值尽可能精确地报告。然而,任何数值固有地包含由其各自测试测量中发现的标准偏差必然产生的某些误差。
63.当本文中公开一个数值范围时,上述范围视为连续,且包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值。进一步地,当范围是指整数时,包括该范围的最小值与最大值之间的每一个整数。此外,当提供多个范围描述特征或特性时,可以合并该范围。换言之,除非另有指明,否则本文中所公开之所有范围应理解为包括其中所归入的任何及所有的子范围。例如,从“1至10”的指定范围应视为包括最小值1与最大值10之间的任何及所有的子范围。范围1至10的示例性子范围包括但不限于1至6.1、3.5至7.8、5.5至10等。
64.参阅图1-2,图1为本技术第一种可选的脑电极结构的结构示意图。图2为本技术第二种可选的脑电极结构的结构示意图。该脑电极器件包括信号采集芯片1、脑电极结构2和电路板3,该信号采集芯片1设于该电路板3上,该信号采集芯片1通过与该电路板3的外围电路的配合能够实现对信号的模数转换、放大和滤波,该信号采集芯片1的焊盘区域11与该脑电极结构2的焊盘结构21通过倒装焊连接,该脑电极结构2用于采集脑电信号。
65.该脑电极1还包括与焊盘结构22连接的接触电极结构22,该接触电极结构22用于接触头皮层,该焊盘结构22包括n个焊点;该n为大于等于2的整数,接触电极结构22包括n个接触电极;该n个焊点与该n个接触电极一一对应连接,该n个接触电极包括m个第一接触电极223和m个第二接触电极224(参阅下图9),m为大于等于1的整数;该m个第一接触电极223与该m个第二接触电极224一一对应,且对应的该第一接触电极223和该第二接触电极224之间的距离小于等于第一预设距离,该信号采集芯片1包括连接的处理器和n个像素电路;该n个像素电路与该n个焊点一一对应连接,该处理器用于通过控制该n个像素电路中的任一个像素电路的导通或者断开实现对该n个接触电极中任一个接触电极开启或者关闭的控制;且当该任一个像素电路导通时,该处理器通过控制该任一个像素电路输出刺激信号或者测试信号实现对该任一个接触电极对目标脑部的刺激或者对对应的像素电路的控制。
66.可选的,该接触电极结构22为非侵入式、半侵入式和侵入式中的任一种。
67.于一种可能的实施方式中,该信号采集芯片1位于该电路板3的第一区域,该第一区域靠近该电路板3的端部,该接触电极结构22能够伸出该电路板3的端部与该头皮层接
触。
68.需要说明的是,脑电极结构2与信号采集芯片1连接时,脑电极结构2的接触电极结构22需要从信号采集芯片1上具有较少元件的一侧伸出,例如,该信号采集芯片1位于电路板3的最侧边,以保证接触电极结构22插入脑组织的长度。
69.于一种可能的实施方式中,参阅图3,图3为本技术一种可选的接触电极结构的俯视图。该接触电极结构22包括柔性支撑层、电极线结构和绝缘层,该柔性支撑层上设有该电极线结构,该电极线结构包括电极线和接触电极221,该电极线的一端与该接触电极221连接,该电极线的另一端与该焊盘结构21的焊点连接,该电极线结构上设有该绝缘层,该绝缘层包括电极孔,该电极孔用于暴露出该接触电极221。
70.于一种可能的实施方式中,该接触电极221的材料包括铬/金、铬/银或者铬/铂,该柔性支撑层为柔性薄膜材料;可选的,柔性薄膜材料包括聚酰亚胺。
71.于一种可能的实施方式中,参阅图4,图4为本技术第二种可选的脑电极器件的结构示意图。该接触电极结构22包括k个子接触电极结构222,该k为大于等于1的整数,该k个子接触电极结构222中相邻的子接触电极结构222之间存在预设间隔。
72.于一种可能的实施方式中,该k个子接触电极结构222位于同一平面。
73.参阅图2和图5,图5为本技术一种可选的信号采集芯片的结构示意图。本技术实施例中,该焊盘区域11上设有第一焊点阵列,该焊盘结构21上设有与该第一焊点阵列对应的第二焊点阵列。
74.于一种可能的实施方式中,该第一焊点阵列包括128
×
128个焊点,且相邻的焊点之间的间距为100微米。即该信号采集芯片1包含128
×
128个通道,每个焊点的尺寸可以是80
×
80微米,该第二焊点阵列包括128
×
128个焊点,使其与信号采集芯片1可以完全对应,后续将第一焊点阵列和第二焊点阵列采用倒装焊的方式在垂直方向上贴合,从而实现了器件的高度集成,有效克服了现有技术中只能采用线缆将二者连接,存在通道数低且信号传输质量差的问题。
75.可选的,该信号采集芯片1可以是mokoto,其包括128
×
128个像素电路,该信号采集芯片1包括四个信号控制线,每个信号控制线控制南北两侧各一个子控制线,每个子控制线上并联有128个像素电路,因此仅凭4个信号输入就可以实现最多的4
×2×
128=1024个刺激通道,即上述n为1024。
76.需要说明的是,为了实现对相邻的子控制线进行隔离和保护,在相邻的子控制下之间还设有分隔电路,上述的n个像素电路不一定是控制芯片的全部焊点,仅是与n个接触电极对应的,实际上,控制芯片可以包括m个像素电路,所述m为大于n的整数。
77.需要说明的是,上述控制芯片的通道数可以是64的l倍个通道,该l可以是大于等于2的整数,例如,64个通道、128个通道、256个通道等。即上述n可以是64、128、256等。
78.以下将以信号采集芯片1为mokoto进行阐述。
79.于一种可行的实施例中,参阅图6,图6为本技术一种可选的像素电路的结构示意图。每个像素电路包括第一电容c1、第一开关s1、第二开关s2、第三开关s3和第四开关s4,该第一电容c1的第一端与信号输入线v0连接,该第一电容c1的第二端与该第二开关s2的第一端连接,该第一开关s1的第一端与该第一电容c1的第二端连接,该第一开关s1的第二端与该信号输入线v0连接,该信号输入线v0与该处理器连接,该第二开关s2的第二端与该第三
开关s3的第一端连接,该第二开关s2的第三端与横向控制信号线s
x[n]
连接,该横向控制信号线s
x[n]
与该处理器连接;该第三开关s3的第二端与第四开关s4的第一端连接,该第三开关s3的第三端与纵向控制信号线s
y[m]
连接,该纵向控制信号线s
y[m]
与该处理器连接;该第四开关s4的第一端与输出端口连接,该输出端口与对应的焊点连接,该第四开关s4的第二端与测试信号处理电路连接。第一开关s1通过与该第四开关s4的配合实现输出刺激信号或者测试信号给对应的接触电极;该处理器通过该信号输入线v0向该像素电路输入刺激信号或者测试信号;该处理器通过该横向控制信号线s
x[n]
控制该第二开关s2的开启或者关闭;该处理器通过该纵向控制信号线s
y[m]
控制该第三开关s3的开启或者关闭。
[0080]
可选的,上述两根选择信号线,即横向控制信号线s
x[n]
和纵向控制信号线s
y[m]
由处理器中的寄存器控制,从而可以从128
×
128个像素电路选择出需要工作的像素电路,即可以利用上述横向控制信号线s
x[n]
和纵向控制信号线s
y[m]
以选择想要实现的刺激通道数,实现可调的刺激通道的选择,图6中的s
x[n]
表示第n行横向控制信号线;s
y[m]
表示第m列纵向控制信号线。
[0081]
可选的,可以是基于用户的操作从而控制第一开关s1和第四开关s4的开启或者关闭,由于第一开关s1和第四开关s4的开启和关闭会形成不同的控制信号,可以是当第一开关s1和第四开关s4闭合时,会输出“0”,从而处理器控制外部输入至信号输入线v0的电压信号作为刺激信号流向输出端口,进而达到接触电极;相反,如果当第一开关s1和第四开关s4闭合时,会输出“1”,从而处理器控制外部输入至信号输入线v0的电压信号作为测试信号流向放大电路,最后通过芯片其他i/o端口输出到外部连接的信号分析设备对该信号进行观测。
[0082]
需要说明的是,上述以及下文中的测试信号,是指当控制芯片接收到测试信号,则会对目标像素电路进行测试,已确定该像素电路是否可正常运行,可以根据控制芯片输出的不同的测试结果信号确定;大多数情况下,该控制芯片主要对目标脑部进行脑电信号的采集。可以通过控制闭合第四开关s4从而实现将采集到的脑电信号输出。
[0083]
当然,也可以直接基于外部的触发信号,使得处理器基于触发信号来控制第一开关s1和第四开关s4的开启或者关闭,从而实现对这两个开关的控制。
[0084]
同理,像素电路中的其他开关,例如第二开关s2、第三开关s3和下文的第五开关s5均可以采用上述两种方式来实现对其的控制,在此不做限制。
[0085]
于一种可行的实施例中,参阅图7,图7为本技术另一种可选的像素电路的结构示意图。为实现更多刺激类型,满足多元化刺激下的神经信号的分析。该每个像素电路还包括第二电容c2和第五开关s5;该第二电容c2的第一端与该第四开关s4的第一端连接,该第二电容c2的第二端与对应的该焊点连接;该第五开关s5的第一端与该第二电容c2的第一端连接,该第五开关s5的第二端与该第二电容c2的第二端连接;该处理器通过控制该第五开关s5的开启或者关闭控制该像素电路输出直流或者交流。也就是说,可以通过控制第五开关s5的开启或者关闭来控制第二电容c2是否短路,可以设置为,当第五开关s5断开时,输出“0”,则信号输入线v0则会输入交流,否则,当第五开关s5闭合时,即短路第二电容c2,输出“1”,则信号输入线v0则会输入直流。
[0086]
可选的,参阅图8,图8为本技术一种可选的并联的像素电路的结构示意图。图8所示的为属于同一行的两个并联的像素电路,故可以由同一个横向控制信号线s
x[n]
连接,第
一个像素电路的纵向控制信号线为s
y[m]
,第二个像素电路的纵向控制信号线为s
y[n+1]
。当并联了多个像素单元时,则依次类推,包括由多个纵向控制信号线s
y[m]
控制的像素单元。
[0087]
于一种可行的实施例中,该接触电极结构22还包括柔性衬底和绝缘层,n个接触电极设于该柔性衬底上,该绝缘层设于该n个接触电极上,该绝缘层包括n个电极孔,该n个电极孔与该n个接触电极一一对应。
[0088]
需要说明的是,当不同像素电路与不同排布方式的接触电极对应时,由于接触电极在脑组织的区域以及距离脑组织的距离均可能会不同,则当调整接触电极与像素电路的对应关系,会影响受到刺激的组织面积、刺激通道数目,刺激的形式、以及刺激的强度等;例如,当接触电极距离脑组织的对应位点距离较远时,为了达到所需的刺激能量,则需要加大刺激电压/电流的强度,相反,则需要减小刺激电压/电流的强度。
[0089]
为了实现电荷平衡,降低外部集成电路复杂度,缩小电路面积。于一种可行的实施例中,参阅图9,图9为本技术第一种可选的接触电极的排布示意图。该柔性衬底的顶部包括相对的第一侧和第二侧,该m个第一接触电极223位于该第一侧,该m个第二接触电极224位于该第二侧,相邻的该第一接触电极223之间存在第二预设距离;该第二预设距离大于等于该第一预设距离,相邻的该第二接触电极224之间存在该第二预设距离。其中,第一接触电极223后续会输入第一刺激信号,第二接触电极224会输入第二刺激信号,且第一刺激信号为与该第二刺激信号为幅度、相位和形状相等的信号,以实现在对应的脑组织区域的电荷平衡。
[0090]
需要说明的是,上述第一刺激信号和第二刺激信号并非瞬时信号,而是一段较短时间内形成的幅度、相位和形状相等的信号;下文的t1时刻和t2时刻形成的信号也是幅度、相位和形状相等的信号。
[0091]
下面将对基于图9中的接触电极结构22实现电荷平衡的原理进行阐述:
[0092]
图9中的接触电极结构22包括了24对接触电极,每个接触电极包括位于第一侧的一个第一接触电极223和位于第二侧的第二接触电极224;需要了解的,当接触电极接收到刺激信号时,其接触的脑组织会被注入电荷,因此周围电势也发生改变。假设在时刻t0,与第一接触电极223连接的第一信号输入线v1和与第二接触电极224连接的第二信号输入线v2均无电压信号输入,则与接触电极相接的组织的电势处处相等,处于一种相对平衡状态。参阅图10,图10为t1时刻接触电极结构的电势分布模型图。当在时刻t1,第一信号输入线v1输入幅度为“1”的信号,第二信号输入线v2输入幅度为“0”的信号,则第一侧的第一接触电极223由于注入电荷形成高电势,第二侧的第二接触电极224则为相对低的电势,相邻第一接触电极223和第二接触电极224所处位置形成电势差,因此有i
sti
从第一接触电极223流向第二接触电极224,如图10所示。参阅图11,图11为t2时刻接触电极结构的电势分布模型图。在时刻t2,第一信号输入线v1输入幅度为“0”的信号,第二信号输入线v2输入幅度为“1”的信号,第一侧的第一接触电极223位置为低电势,第二侧的第二接触电极224则为高电势,i
sti
从第二接触电极224流向第一接触电极223。由于两两成对的第一接触电极223和第二接触电极224电极实际距离非常近,因此由电势差形成的电流可以认为只在两电极之间流动,几乎不向外扩散,由第一接触电极223-组织-组织-第二接触电极224形成的回路的等效原理图如图12所示,图12为本技术一种可选的当接触电极结构插入脑组织中工作状态下的等效电路图。在极短时间内,可以认为在时刻t1和时刻t2产生了大小相等且方向相反的i
sti
,
因此在时刻t2之后,由于刺激而被注入到脑组织内的电荷被相互抵消,实现了电荷平衡。本技术通过两根信号线交替输入刺激不仅解决了电荷平衡问题,避免脑组织受损和电极电解,还提高集成度,简化了外部电路。
[0093]
需要说明的是,图12中的re为接触电极电阻,r和ci分别为脑组织内的等效电阻和电容,rs为两接触电极路径之间存在的电阻。
[0094]
于一种可行的实施例中,参阅图13,图13为本技术第二种可选的接触电极的排布示意图。该n个接触电极形成接触电极集,该接触电极集包括第一接触电极集和第二接触电极集,该第一接触电极集位于该第一侧,该第二接触电极集位于该第二侧,该第一接触电极集中的第一接触电极223和第二接触电极224沿该柔性衬底长度方向交错排列,该第一接触电极集中第一接触电极223的数量和该第二接触电极224的数量之和等于m,该第二接触电极集中的第一接触电极223和第二接触电极224沿该柔性衬底长度方向交错排列,该第二接触电极224中第一接触电极223的数量和第二接触电极224的数量之和等于m,其中,该第一接触电极集中的接触电极的排布方式与该第二接触电极224中的接触电极的排布方式相同。
[0095]
于另一种可行的实施例中,参阅图14,图14为本技术第三种可选的接触电极的排布示意图。该第一接触电极集中的接触电极的排布方式与该第二接触电极224中的接触电极的排布方式相反。
[0096]
需要说明的是,上述脑电极模块在对脑组织进行刺激时,可以选择电压控制模式,可以通过在外部电路产生平衡的双向电压脉冲输入到信号输入线v0,来实现电荷平衡的电刺激,此种方法下可以实现4种不同刺激波形的一共1024通道刺激。
[0097]
于一种可行的实施例中,该信号输入线v0包括3个子信号输入线v0,沿预设方向排列的相邻的子信号输入线v0的相位差为120度。也就是说,当由三根信号线控制刺激的电极位置刚好形成120
°
的角度,且外部三根信号输入端口给出相位差为120
°
的初始刺激,则有可能形成自主发电,即无需从外部的电压发生器中供给刺激信号,而是借用相位差来使信号持续下去。同理使用四根信号线形成90
°
的相位差也可以构成四相发电机,这在未来的无线、可持续、节能设计中是一个极好的发展点。
[0098]
可选的,当信号采集芯片1为上述的mokoto芯片时,且脑电极1为2640通道的器件,该脑电极1的焊盘结构22为30
×
88焊点阵列;相邻的焊点之间的距离为200微米,mokoto芯片中相邻的像素电路单元之间的距离为100微米,则当二者可以采用倒装焊接,从而可以提高集成度,且保证信号质量;由于脑电极1的相邻焊点的距离为相邻像素单元距离的两倍,则该相邻的焊点可以与间隔了的像素单元连接,如此,可以和mokoto的像素单元连接的焊点为30
×
64个,又由于mokoto芯片只有8行阵列有对应的信号线,则可以用于刺激部分的只有30
×
8=240个通道。但通过调整焊点之间的距离,相应的通道数也可以改变,上述仅是示例了一种可选的实施例。
[0099]
综上所述,本技术提供的脑电极模块中由于信号采集芯片1包括多个像素电路,对应脑电极1的多个接触电极,从而可以控制开启不同的刺激通道,实现可调位点的刺激,且可配置的双极电压刺激以实现电荷平衡,降低外部集成电路复杂度,缩小电路面积;而可选的直流/交流刺激可以适应具体的实验场景。该申请不仅实现了高通道刺激,进一步弥补市场上高通道刺激的空白,还能够适应生物医疗领域不同需求的变化,具备更高的灵活性,降
低了研发成本,缩短了实验周期。
[0100]
参阅图15,图15为本技术一种可选的脑电极模块的控制方法的流程图。本技术于另一方面还公开了一种脑电极模块的控制方法,应用于上述脑电极模块,该控制方法包括以下步骤:
[0101]
s1501:获取位点控制信号。
[0102]
s1502:基于该位点控制信号控制对应位点的该像素电路的开启。
[0103]
参见上述描述,可以通过控制第几行横向控制信号线s
x[n]
的和第几列纵向控制信号线s
y[m]
,从而可以控制对应的第二开关s2和第三开关s3的开启和关闭,以实现对应的像素电路整体的导通。
[0104]
s1503:接收功能控制信号。
[0105]
可选的,功能控制信号可以是包括两种,一种是用于控制像素电路输出刺激/测试信号的控制信号;另一种是用于控制像素电路输出直流/交流的控制信号。
[0106]
s1504:基于该功能控制信号控制该像素电路输出刺激信号或者测试信号,以实现对该接触电极对目标脑部的刺激或者对对应的像素电路的控制。
[0107]
参见上述描述,可以通过接收到的第一开关s1和第四开关s4的开闭生成的信号,从而实现输入刺激信号或者测试信号,当为刺激信号时,则由输出端口输入到脑组织,当为测试信号时,为输入放大电路中。
[0108]
还可以通过控制第五开关s5的开启或者关闭来实现确定输入到像素电路中的刺激信号是交流还是直流。具体实现方式详见上述描述,在此不再赘述。
[0109]
本技术还提供一种脑电极器件,参阅图16,图16为本技术第三种可选的脑电极器件的结构示意图。该脑电极器件还包括设于上述同一电路板3上的刺激模块4和测试模块5,该刺激模块4和该测试模块5分别与该信号采集芯片1连接,该刺激模块4用于生成刺激信号,该刺激信号用于通过该脑脑电极结构2对脑皮层进行刺激;该信号采集芯片1用于对该脑脑电极结构2的通道进行通断控制,以及测试信号和该刺激信号的切换输入;该测试模块5用于接收该信号采集芯片1发送的测试结果信号,并对该测试结果信号进行数模转换处理;该测试结果信号是该信号采集芯片1基于该测试信号生成的信号。
[0110]
由此,通过本技术提供的上述脑机接口前端器件不仅能够实现对脑皮层的采集和刺激,基于该信号采集芯片1和测试模块5的配合还能够实现对信号采集芯片1中的像素电路的测试。例如,可以是对上文像素电路的短路和断路的测试。
[0111]
为了更好不失真的传输信息,压缩数据,需要对电极直接采集到的模拟信号进行模数转换。于一种可选的实施例中,参阅图17,图17为本技术第四种可选的脑电极器件的结构示意图。脑电极器件还包括数模转换模块6和电源模块7;该数模转换模块6与该信号采集芯片1连接;该电源模块7与该信号采集芯片1、该数模转换模块6连接;该电源模块7用于给该信号采集芯片1和该数模转换模块6供电;该电源模块7包括锂电池、第一低压差线性稳压器和第二低压差线性稳压器;该锂电池通过该第一低压差线性稳压器与该信号采集芯片1连接;该锂电池通过该第二低压差线性稳压器与该数模转换模块6连接;该数模转换模块6用于接收该信号采集芯片1发送的脑电信号,并对该脑电信号进行数模转换处理。采用锂电池能够保证电信号的精度,且噪声较小,能够为一些敏感电源供电,例如上述的信号采集芯片1中的部分器件(对应的引脚)和数模转换模块6中的部分器件(对应的引脚),且由于实际
脑电信号非常微弱,往往只有几十μv到几mv,受噪声影响严重,因此对噪音要求非常高,本技术采用低压差分信号的方式对信号进行传输,采用低压和低电流驱动方式,实现了低功耗、低误码率、低串扰和低辐射、低噪声。
[0112]
一般,对于低密度的电极来说,面积和功率限制都可以放宽,信号放大和模数转换都可在片上进行,产生的数字数据通过串行外围接口流向采集板。但是在高密度脑电器件应用时,为了防止记录过程中的脑组织损伤,大脑内的植入物的面积和功率都大大受到限制。因此对于高通量的电极来说,神经信号的放大等一系列处理不能够像现有的低通量有源器件一样集成在电极单板上,需使用额外的pcb板,在板上集成神经信号放大芯片,再配合adc电路等进行片外转换。然而,目前的外接电路板上集成的芯片只能实现32位点的通量,通量较低。可选的,本技术中的控制芯片可以是上述的mokoto,由于其可以实现最多的4
×2×
128=1024个刺激通道。且为了提高数据转换效率,上述数模转换模块6可以包括两个子模块,可以在该信号采集芯片1的南北两侧附近均设有一个子模块。
[0113]
可选的,当该信号采集芯片1为mokoto时,该信号采集芯片1的每个通道的采集速率大于等于40帧数/秒,通过芯片内的多路复用,使得在南北两侧每边有16个输出,因此要求每个输出通道的采样速率不低于128
×
64
×
40/16=20.48msample/s,再者为了使量化噪声远低于热噪声本底,需要至少12位的数模转换模块6分辨率,因此整个芯片的数据传输速率要不低于12bit
×
20.48m
×
16
×
2=7.86g比特/秒。
[0114]
于一种可选的实施例中,参阅图17,脑电极器件还包括现场可编程门阵列(field programmable gate array,fpga)芯片;该现场可编程门阵列芯片8与该信号采集芯片1、该数模转换模块6、该测试模块5和该刺激模块4连接;该现场可编程门阵列芯片8用于给该测试模块5和刺激模块4供电,并将接收到的该数模转换器发送的脑电信号发送给信号采集设备。
[0115]
可选的,该现场可编程门阵列芯片8的电压包括5伏,该现场可编程门阵列芯片8可以为对于供电信号精度要求不高的器件提供电源,通过其与不同的低压差线性稳压器连接,从而可以输出不同电压。
[0116]
可选的,该现场可编程门阵列芯片8可以为给数模转换模块6、刺激模块4和信号采集芯片1的以下模块供电,其中,数模转换模块6的引脚有dvdd_ti_adc(1.2v),ti_adc(1.8v),misc(3.3v),刺激模块4的引脚有vref(3.5v),信号采集芯片1的引脚有vddio(3.3v),vddd(3.3v);需要说明的,vddio,vddd是给信号采集芯片1进行供电的引脚,vref是给刺激模块4中需要产生3.3v参考电压芯片的供电,由于信号采集芯片1输出的电平范围在0-3.3v左右,而数模转换模块6的输入信号要求在0-1.8v左右,需要做电平转换,因此,该misc是给位于数模转换模块6中的电平转换模块供电的。
[0117]
于一种可选的实施例中,该锂电池的电压包括3.7伏;经过该第一低压差线性稳压器输出的电压范围包括0.5~3.3伏;经过该第二低压差线性稳压器输出的电压包括1~1.8伏。
[0118]
可选的,信号采集芯片1输出的测试结果信号可以是经由测试模块5的mbs_n mbs_s输入。
[0119]
为了实现高精度刺激信号,于一种可选的实施例中,该刺激模块4可以是芯片,该芯片的分辨率为12bit,dnl仅有0.5lsb,该刺激模块4输出的刺激电压范围为0-3.3伏,该刺
激模块4输出的刺激电压值与预设电压值的误差范围为0-0.4毫伏。具有极高的精度,除了产生高精度的电压刺激外,还需要一个接地开关,在每次刺激周期结束后导通接地,以及时释放掉由于阻抗变化、电源不匹配等原因积累起的不平衡电荷,从而可以进行长期循环刺激,使得电极电压保持在安全阈值以内,避免由于电荷累积对组织造成不可逆的损伤。
[0120]
通过上述示例可以看出,本技术提供的脑机接口前端器件的设计可以为高通量的脑电信号的采集处理提供了一个很好的解决方案,将信号的放大滤波、模数转换、刺激集成在一块外接pcb上,实现高通量脑电信号的处理转换;且将信号放大、滤波芯片以及模数转换、刺激模块4集成在同一个神经记录前端,与探针分开,缓解植入物噪声、功率和面积方面的压力,可最大程度减少对活体检测对象的损伤影响;同时可以实现最多1024个通道同时刺激,并有高达12bit分辨率,并配合开关控制接地短路,以在刺激间隙释放累积的电荷,实现刺激电荷平衡。通过将上述器件与脑脑电极结构2配合,可以精准地记录生理和病理过程中神经元电活动以及神经分子的变化,以此为依据破译大脑回路如何运作以及疾病中可能出现的功能障碍,并辅助刺激功能,根据检测到的结果反馈调整刺激参数,配合诸如帕金森、癫痫等脑疾病的早期争端与神经调控治疗。
[0121]
考虑到万道量级的信号之间存在的串扰以及对噪声质量的高要求,本技术提供的该脑脑电极结构2的接触电极上并不会集成有源电路,仅负责脑电信号的采集和传输,需另外使用信号采集芯片1对采集到的万道信号进行放大、滤波,经处理的信号经复用在脑电信号处理芯片的南北两端分别通过16个i/o口输出,再在pcb板上的电路经过一系列的转换通过spi方式传输到现场可编程门阵列芯片8上进行数据的整合控制,最后现场可编程门阵列芯片8通过万兆电缆输送信号到客户端进行可视化处理。基于上述脑电极器件能够实现采集、刺激、测试功能,且高通量的信号传输。
[0122]
综上所述,本技术提供的该脑电极器件,由于脑电极结构2与信号采集芯片1是通过倒装焊的方式连接的,从而实现的焊区直接连接,具有信号路径最短、组装密度最高、电性能好及散热性好,在微弱的脑电信号从被采集到转换成放大的数字信号过程中,真实信号受到的噪音干扰大大减小,提高信号的精度,其输出信号可以直接传送到fpga,进行尖峰分类等数据处理。具有极高的集成度,大大缩小了高通道脑机接口系统的面积,为将来产品小型化的应用提供了一种可靠的方法。且采用倒装焊工艺对于产品开发、原型设计和小批量生产而言成本低、速度快且灵活,同时易于使用自动化设备扩大到基于晶圆的大批量生产。由于采用倒装焊的方式实现脑电极结构2与信号采集芯片1之间的互联,减去了电缆的使用,使得整个系统在硬件方面更加牢固,增加了系统的稳定性,且减少了电极和组织之间的“微运动”,降低组织磨损,延长器件使用寿命。
[0123]
本技术于另一方面还公开了一种脑电极器件的制备方法,其包括:
[0124]
1)制备该脑电极结构2;该脑电极结构2用于采集脑电信号。
[0125]
2)将该脑电极结构2的焊盘结构21采用倒装焊与该信号采集芯片1的焊盘区域11连接。
[0126]
步骤2)中,倒装焊的工艺可以是热压倒装焊,一种可选地热压倒装焊工艺如下步骤:
[0127]
2.1先在信号采集芯片1上生长焊点,形成焊盘区域11,该焊盘区域11的每个焊点的高度可以根据焊点间隙进行相应调整,可选的,该焊点的高度范围为60-10微米,以适应
上述焊盘结构21的焊点之间的间距,该焊盘结构21的焊点之间的间距范围实际也是可以根据需求进行调整的,延续上述是实施例,该焊盘结构21的焊点之间的间距为200微米。参阅图18,图18为本技术第五种可选的脑电极器件的结构示意图。当上述焊盘结构21的焊点之间的间距降低时,焊盘区域11的焊点的高度也可以适当降低。
[0128]
可选的,该焊盘区域11的焊点包括焊柱111和位于焊柱112上的焊球,该焊柱的材料包括铜;该焊球的材料包括锡-银。
[0129]
2.2当步骤2.1是在包含多个信号采集芯片的未切割分片的大板制备的,则还需要对该大板进行减薄、分片处理,得到单个信号采集芯片。
[0130]
2.3将信号采集芯片与一个对应的第一pcb基板9粘结,还可以对后续信号采集芯片1上需要打线的地方开设打线凹槽,如图18所示,便于后续的打线操作,提高容错度。
[0131]
2.4在上述第一pcb板上贴装电容、电阻等所需的元器件。
[0132]
2.5将信号采集芯片和第一pcb基板9上的对应元器件进行打线连接。可选的,上述线的材料包括金。金线的线径范围为0.5-0.7mil,可以是0.5mil、0.6mil或者0.7mil。
[0133]
2.6对打线区域利用封装胶10进行封装处理。
[0134]
2.8基于上述步骤2.6可以得到待焊接的信号采集芯片器件,通过脑电极结构放置在预设区域,并使脑电极结构的焊盘结构21朝上,取一个信号采集芯片器件,将该信号采集芯片器件的焊盘区域11的焊点对准上述焊盘结构21的焊点,在不加压力的过程加热回流焊接,焊接温度可以包括217摄氏度。
[0135]
3)将该信号采集芯片1安装在电路板3上,该信号采集芯片1通过与该电路板3的外围电路的配合能够实现对信号的模数转换、放大和滤波。以上所述仅为本技术可选实施例,并不用以限制本技术,凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1