β-环糊精介导的免疫细胞-载药脂质体偶连体在抗动脉粥样硬化中的应用
1.本发明涉及超分子化学,超分子材料和细胞制剂技术领域,具体而言,涉及β-环糊精介导的免疫细胞-载药脂质体偶连体在抗动脉粥样硬化中的应用。
背景技术:
2.动脉粥样硬化是心血管疾病的主要原因,例如心脏病发作、中风和外周血管疾病。脂质代谢障碍为动脉粥样硬化的病变基础,其特点是受累动脉病变从内膜开始,一般先有脂质和复合糖类积聚、出血及血栓形成,进而纤维组织增生及钙质沉着,并有动脉中层的逐渐蜕变和钙化,导致动脉壁增厚变硬、血管腔狭窄。病变常累及大中肌性动脉,一旦发展到足以阻塞动脉腔,则该动脉所供应的组织或器官将缺血或坏死。
3.目前临床一线药物主要包括降低胆固醇、血压或减少凝血的药物,然而,大多数药物对斑块部位的富集效果并不令人满意,导致临床疗效有限。此外,这些药物主要作用于改善血管和血液病理,抑制动脉粥样硬化的进一步发展,但对清除现有血管斑块的作用很小。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供β-环糊精介导的免疫细胞-载药脂质体偶连体及其制备方法和应用。
6.为实现本发明的上述目的,特采用以下技术方案:
7.第一方面,本发明实施例提供了β-环糊精介导的免疫细胞-载药脂质体偶连体在制备治疗动脉粥样硬化、调节血管斑块面积或是调节血清炎症水平和高密度脂蛋白胆固醇含量的药物中的应用。
8.第二方面,本发明实施例提供了一种β-环糊精介导的免疫细胞-载药脂质体偶连体,该偶连体是通过β-环糊精介导的主客体作用相互连接形成的;
9.其中,免疫细胞为巨噬细胞、中心粒细胞和树突细胞中的任意一种。
10.第三方面,本发明实施例提供了一种β-环糊精介导的免疫细胞-载药脂质体偶连体的制备方法,其包括将偶联有嵌膜材料的β-环糊精或客体分子与免疫细胞共孵育得到β-环糊精或客体分子修饰的免疫细胞,再将修饰有客体分子或β-环糊精的脂质体与β-环糊精或客体分子修饰的免疫细胞混合。
11.相比于现有技术,本发明具有以下有益效果:
12.本发明提供了一种β-环糊精介导的免疫细胞-载药脂质体偶连体在抗动脉粥样硬化中的应用。基于动脉粥样硬化的炎性病理特点,选择具有炎症趋向性和变形性的内源性免疫细胞作为递送载体,构建免疫细胞-载药脂质体搭便车式给药系统,作为药物“内应式”载体,在体内发挥类似于“间谍”样的作用,响应斑块部位的炎性信号,实现自主引导的靶向治疗效果,增强药物在动脉板块部位的积累,同时创造性的发现β-环糊精不仅作为主体分
子用于构建免疫细胞-载药脂质体,还可结合斑块中胆固醇,促进其溶解,降低斑块面积,与载药脂质体实现协同抗动脉粥样硬化疗效,具有良好应用前景。
附图说明
13.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
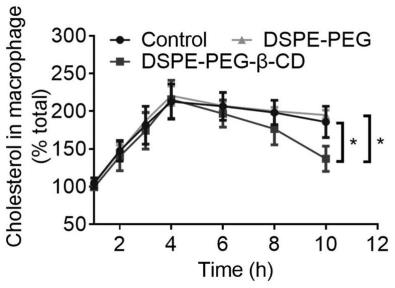
14.图1为本发明实施例2中dspe-peg-β-cd对胆固醇的增容试验的结果;
15.图2为本发明实施例3中β-环糊精介导的巨噬细胞-脂质体偶连体对斑块靶向递送效率的影响图;
16.图3为本发明实施例4中β-环糊精介导的巨噬细胞-槲皮素脂质体偶连体对血管斑块面积的影响图;
17.图4为本发明实施例4中β-环糊精介导的巨噬细胞-槲皮素脂质体偶连体对血清炎症水平和胆固醇的影响图。
具体实施方式
18.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
19.动脉粥样硬化的病理特征涉及大量单核细胞和巨噬细胞的募集,巨噬细胞可作为靶向递送至血管斑块的理想药物载体。然而,由于巨噬细胞固有的吞噬能力,现有技术中的基于巨噬细胞的载体大部分是通过直接药物内化方式构建的,由于纳米药物在细胞内的代谢以及巨噬细胞的胞吐作用,均会影响基于细胞功能的靶向效率。同时,目前抗动脉粥样斑块药物主要为降胆固醇药物,很少有溶解已存斑块的药物。
20.本发明实施例提供了一种β-环糊精介导的免疫细胞-载药脂质体偶连体,该偶连体是通过β-环糊精介导的主客体作用相互连接形成的。其中,免疫细胞为巨噬细胞、中心粒细胞和树突细胞中的任意一种;载药脂质体为负载他汀类、抗炎类、抗氧化药物及其复合物的脂质体。
21.β-环糊精介导的主客体作用是指β-环糊精和客体在满足结构互补和能量匹配的条件下,通过非共价相互作用选择性结合,形成具有特定功能的超分子的过程。
22.基于血管斑块形成过程中的巨噬细胞富集效应以及血管斑块组织的炎性信号,本发明选择具有炎症趋向性和变形性的内源性免疫细胞作为递送载体,构建β-环糊精介导的免疫细胞-载药脂质体搭便车式给药系统。在应用时,包含有免疫细胞的偶连体可作为药物“内应式”载体,在体内发挥类似于“间谍”样的作用,响应斑块部位的炎性信号,自主引导β-环糊精介导的免疫细胞-载药脂质体偶连体靶向病灶,增强药物在动脉板块部位的积累,同时创造性的发现β-环糊精不仅作为主体分子用于构建免疫细胞-载药脂质体,还可结合斑块中胆固醇,促进其溶解,降低斑块面积,与载药脂质体实现协同抗动脉粥样硬化疗效。
23.本发明提供的β-环糊精介导的免疫细胞-载药脂质体偶连体可以根据治疗需求进行适应性的调整,应用范围广,为靶向治疗的有效实现提供了新思路。
24.优选地,载药脂质体为负载他汀类、抗炎类、抗氧化药物及其复合物的脂质体。
25.优选地,载药脂质体中脂质体是单室脂质体,多室脂质体和多囊脂质体中的任意一种。
26.优选地,他汀类、抗炎类、抗氧化药物及其复合物与脂质体的质量比值为0.01:1-2:1。
27.需要说明的是,上述他汀类、抗炎类、抗氧化药物及其复合物与脂质体的质量比值可以根据需要选择,并不限于上述比值,其他质量比值能够使用并发挥治疗作用,也属于本发明的保护范围。
28.本发明实施例提供了如前述任意实施例所述的β-环糊精介导的免疫细胞-载药脂质体偶连体的制备方法,其包括:偶联有嵌膜材料的β-环糊精或客体分子与免疫细胞共孵育得到β-环糊精或客体分子修饰的免疫细胞,再将修饰有客体分子或β-环糊精的脂质体与β-环糊精或客体分子修饰的免疫细胞混合。
29.其中,嵌膜材料为peg-dmpe、peg-dppe、peg-dspe或peg-chol。
30.客体分子为金刚烷或二茂铁。
31.优选地,上述β-环糊精与客体分子的摩尔比为1-10:1-10,孵育时间≥10秒,温度为25~30℃。
32.本发明实施例还提供了β-环糊精介导的免疫细胞-载药脂质体偶连体在制备治疗动脉粥样硬化、调节血管斑块面积或是调节血清炎症水平和高密度脂蛋白胆固醇含量的药物中的应用。
33.以下结合实施例对本发明的特征和性能作进一步的详细描述。
34.材料:
35.1.实验动物
36.雌性apoe-/-小鼠,体重18-22g,澳门大学健康科学学院,许可证号:001/d1cv/dis/2021。自然光照周期饲养,术前12h禁食,自由饮水。
37.2.药品及试剂
38.免疫细胞为巨噬细胞,dspe-peg-β-cd和dspe-peg-ada均购自西安瑞禧生物科技有限公司,dmem培养基和elisa试剂盒购自赛默飞世尔科技(中国)有限公司,磺酸基花青素cy5和槲皮素购自上海阿拉丁生化科技股份有限公司。
39.3.实验仪器
40.小动物活体成像系统(ivis lumina lt series iii):perkinelmer公司;离心机:德国艾本德;多功能酶标仪:赛默飞公司。
41.4.动脉粥样硬化小鼠模型制备
42.连续给6周龄雄性apoe-/-小鼠喂食高脂食物1个月后,开始出现动脉粥样硬化斑块,巨噬细胞大量迁移,因此,这些小鼠用于后续研究巨噬细胞-槲皮素脂质体偶连体的斑块靶向递送效果和疗效。
43.5.槲皮素脂质体(qt-np)和β-环糊精修饰的巨噬细胞(cd-mp)的制备
44.将dspe-peg-β-cd与巨噬细胞共孵育1.5小时,得到β-cd修饰的巨噬细胞(cd-mp)。
45.在制备脂质体过程中将槲皮素作为疏水药物负载于脂质体中制备得到槲皮素脂质体(qt-np),即将磷脂、胆固醇及槲皮素溶于氯仿中,然后将氯仿溶液在一玻璃瓶中旋转蒸发,使在烧瓶内壁上形成一薄膜,然后将磷酸盐缓冲液加入烧瓶中不断搅拌即得槲皮素脂质体。
46.实施例1
47.本实施例提供了一种巨噬细胞-槲皮素脂质体偶连体的制备方法,其包括以下步骤:
48.将10μm的dspe-peg-β-cd与巨噬细胞共孵育1.5小时,得到β-cd修饰的巨噬细胞,再将修饰ada的脂质体与β-cd修饰的巨噬细胞混合,β-cd与ada的摩尔比为1:1,孵育时间为60秒,温度为25℃。
49.实施例2
50.本实施例以胞吞胆固醇晶体的巨噬细胞模型进行实施例1提供的dspe-peg-β-cd对胆固醇的增容研究。
51.将巨噬细胞与200mg胆固醇晶体共孵育4小时,然后加入含有10mm dspe-peg-β-cd或者dspe-peg或空白的新鲜培养基,在孵育预定时间(2小时、4小时、6小时)后,收集巨噬细胞并通过hplc测定细胞内的胆固醇浓度。
52.结果如图1所示:经dspe-peg-β-cd处理的巨噬细胞中的胆固醇含量较低,且随着孵育时间延长而显著减少,但dspe-peg处理的巨噬细胞与空白对照组的胆固醇含量相似,均处于较高水平。由此表明dspe-peg-β-cd可促进胞内胆固醇结晶的溶解和外排。
53.实施例3
54.本实施例以动脉粥样硬化小鼠模型进行实施例1提供的巨噬细胞-槲皮素脂质体偶连体的靶向性研究。
55.将小鼠随机分为3组,负载cy5的脂质体(cy5-np)、巨噬细胞-cy7脂质体偶连体(mp-cy5-np)、巨噬细胞和cy7脂质体的混合物(mp+cy5-np),按1mgcy5/kg的剂量进行尾静脉给药。
56.采用体内成像系统(ivis)进行体外主动脉组织成像,考察经cy5-np、mp+cy5-np、mp-cy5-np处理的小鼠中主动脉的荧光强度。
57.结果如图2所示:负载cy5的脂质体(cy5-np)、巨噬细胞-cy7脂质体偶连体(mp-cy5-np)、巨噬细胞和cy7脂质体混合物(mp+cy5-np)三组靶向性实验中,经过mp-cy5-np处理的小鼠主动脉荧光强度最高,经过mp+cy5-np处理的小鼠主动脉荧光强度次之,经过cy5-np处理的小鼠主动脉荧光强度最低,由此表明mp-cy5-np内应式给药系统可增强cy5-np在斑块血管的靶向富集效果。
58.实施例4
59.本实施例以动脉粥样硬化小鼠模型进行实施例1提供的巨噬细胞-槲皮素脂质体偶连体的疗效研究。
60.将小鼠随机分为4组,模型组(生理盐水,saline)、槲皮素脂质体(qt-np)、β-环糊精修饰的巨噬细胞(cd-mp)和巨噬细胞-槲皮素脂质体偶连体(mp-qt-np),剂量为20mg/kg qt且巨噬细胞数量保持相同,每周微静脉给药一次,连续给药两个月,同时小鼠保持高脂饮食。
61.在实验结束时,在显微镜下解剖主动脉,并通过oro染色测量主动脉斑块面积。
62.采用elisa试剂盒检测saline、qt-np、cd-mp和mp-qt-np处理的小鼠血清中tnf-α和il-6的炎症水平。最后,利用试剂盒分析各组高密度脂蛋白胆固醇含量(hdl-c)、总胆固醇(tc)的产生。
63.所得结果采用graphpad7.0统计软件进行分析。实验数据均已m
±
sd表示,多组数据间比较采用单因素方差分析。*p≤0.05,**p≤0.01,and***p≤0.001.
64.如图3所示:与saline组、qt-np组和cd-mp组相比,给小鼠尾静脉给药为mp-qt-np的小鼠主动脉红色面积最小,表明mp-qt-np能显著降低主动脉斑块含量。
65.如图4所示:给小鼠尾静脉给药为mp-qt-np的小鼠血清中tnf-α和il-6的炎症水平显著低于saline组、qt-np组和cd-mp组;给小鼠尾静脉给药为mp-qt-np的小鼠总胆固醇(tc)含量低于saline组、qt-np组和cd-mp组;而高密度脂蛋白胆固醇含量(hdl-c)在mp-qt-np组中显著高于saline组、qt-np组和cd-mp组。表明mp-qt-np处理的小鼠血清炎症水平能够得到明显降低,高密度脂蛋白胆固醇可以得到明显升高。
66.综上所述,本发明实施例的β-环糊精介导的巨噬细胞-槲皮素脂质体是通过β-环糊精介导的主客体作用相互连接形成的,是基于超分子主客体作用构建的新一代细胞制剂,由于板块形成过程中的巨噬细胞富集效应以及血管斑块组织的炎性信号,可实现基于巨噬细胞功能的斑块靶向递送效果,同时创造性的发现β-环糊精不仅作为主体分子用于构建免疫细胞-载药脂质体,还可结合斑块中胆固醇,促进其溶解,降低斑块面积,与载药脂质体实现协同抗动脉粥样硬化疗效。
67.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1