用于克服癌症多药耐药性的纳米颗粒的制备方法及所得产品和应用
1.本发明涉及一种用于克服癌症多药耐药性的纳米颗粒的制备方法,具体涉及一种从饥饿/化学动力/化疗联合疗法三方面着手设计的克服癌症多耐药性的纳米颗粒的制备方法及所得产品和应用,属于纳米材料制备技术领域。
背景技术:
2.由于肿瘤细胞的多药耐药性(mdr),抗癌药物自身的高毒性和药物难以有效地在肿瘤部位积聚等癌症治疗障碍,临床化疗作为一种传统的癌症治疗方式,通常只有有限的治疗结果。癌症多药耐药性的主要机制是肿瘤细胞过度表达了p-糖蛋白转运蛋白,导致了化疗药物的流出。为了提高治疗效果和减轻副作用,通过化学修饰相关反应基团将原化疗药物改造成前药,能够有效避免药物流出效应,是一种有前途的方法。前药的转换依赖肿瘤微环境的独特特性,例如低ph值、升高的活性氧(ros)、高细胞内谷胱甘肽浓度和过度表达的代谢酶。另外,肿瘤细胞快速的增殖需要大量的营养物质供应,旨在切断肿瘤生长所需营养物质的饥饿疗法引起了广泛关注。葡萄糖氧化酶(gox)是一种氧化还原酶,可以高效催化葡萄糖快速转化为葡萄糖酸,从而剥夺肿瘤细胞的葡萄糖并使肿瘤细胞缺乏营养物质而死亡。h2o2作为酶促反应的副产物,能与金属离子发生芬顿反应产生剧毒的羟基自由基,导致细胞膜脂过氧化、线粒体功能障碍和肿瘤细胞dna损伤。同时,芬顿反应的产物之一活性氧(ros)能刺激阿霉素前药转化为阿霉素,实现了阿霉素在肿瘤细胞内的精准释放,避免了药物对正常体细胞的毒性作用。
3.金属多酚网络(mpns)是一种新兴的生物材料,由酚羟基和多价金属离子之间的配位相互作用构成。金属多酚网络在生物医学应用中显示出巨大的潜力,因为它们提供了一种快速、简单的方式来构建多功能纳米平台。mpns可以附着在纳米颗粒表面形成保护涂层,不仅提高了纳米载体的生物相容性和血液循环时间,而且有助于控制特定环境下生物活性成分的释放。其次,化学修饰的多酚和金属离子可以通过自组装形成纳米颗粒,同时封装活性物质。由于它们的弱络合作用,mpns倾向于在酸性肿瘤微环境或溶酶体中分解。通过在其结构中引入二硫键,mpns还可以在富含谷胱甘肽的细胞质中表现出还原敏感性。这些特性使mpns成为药物输送的有利平台。
4.目前,未见将葡萄糖氧化酶、金属多酚网络、阿霉素前药进行结合使用的报道。
技术实现要素:
5.本发明的目的是提供一种通过饥饿/化学动力/化疗联合疗法克服癌症多耐药性的纳米颗粒及所得产品,该方法通过用聚乙烯亚胺修饰fe3o4纳米颗粒,然后静电吸附葡萄糖氧化酶,然后利用具有ph和还原双敏感的金属多酚网络包裹pei修饰的fe3o4纳米颗粒,最后通过静电作用结合阿霉素前药,得到通过饥饿/化学动力/化疗联合疗法克服癌症多耐药性的纳米颗粒。
6.本发明具体技术方案如下:一种用于克服癌症多药耐药性的纳米颗粒的制备方法,包括以下步骤:(1)将fe3o4纳米颗粒分散在水中,然后加入聚乙烯亚胺(pei)溶液对fe3o4纳米颗粒进行修饰,得到pfns纳米颗粒;(2)将步骤(1)得到的pfns纳米颗粒分散在水中,加入葡萄糖氧化酶(gox)溶液,混合得到负载葡萄糖氧化酶的pfns纳米颗粒(gpfns);(3)将步骤(2)获得的负载葡萄糖氧化酶的pfns纳米颗粒分散在水中,依次加入邻苯二酚封端的八臂聚乙二醇溶液、fecl3溶液和tris-hcl缓冲液进行反应,获得金属多酚网络(mpns)封装的负载葡萄糖氧化酶的pfns纳米颗粒(mgpfns);(4)将步骤(3)获得的金属多酚网络封装的负载葡萄糖氧化酶的pfns纳米颗粒分散在阿霉素前药(pdox)溶液中,混合获得用于克服癌症多药耐药性的纳米颗粒(cadns)。
7.进一步地,步骤(1)中,fe3o4纳米颗粒和pei的质量比为1:3~4。
8.进一步地,步骤(1)中,在fe3o4纳米颗粒和聚乙烯亚胺的混合溶液中,fe3o4纳米颗粒的浓度为0.8-1.2mg/ml。
9.进一步地,步骤(1)中,fe3o4和pei混合溶液搅拌时间为16~24 h,然后通过离心收集pei修饰的fe3o4纳米颗粒,并用去离子水洗涤2~3次,冻干获得pfns。
10.进一步地,步骤(2)中,pfns和gox的质量比为3~4:1。
11.进一步地,步骤(2)中,pfns纳米颗粒与葡萄糖氧化酶的混合溶液中,pfns纳米颗粒的浓度为0.5-0.7 mg/ml。
12.进一步地,步骤(2)中,pfns和gox混合溶液在室温下搅拌时间为0.5~1 h,然后通过离心收集负载gox的pfns,并用去离子水洗涤2~3次,冻干获得gpfns。
13.进一步地,步骤(3)中,负载葡萄糖氧化酶的pfns纳米颗粒(gpfns)、邻苯二酚封端的八臂聚乙二醇(cpeg),fecl3的质量为10~12:20:3~4。
14.第一步地,步骤(3)中,tris-hcl缓冲液的ph为8.5~8.7,浓度为50~60 mm,反应体系中的水与tris-hcl缓冲液的体积比为11~12:3~4。
15.进一步地,步骤(3)中,每加入一种溶液需搅拌30 s~1 min后再加入另一种,所有溶液加入完成后,再搅拌1~2 min,然后通过离心获得金属多酚网络封装的gpfns,并用去离子水洗涤2~3次。
16.进一步地,步骤(4)中,阿霉素前药为化学修饰具有ros响应的阿霉素前体。
17.在本发明某一具体实施方式中,所述阿霉素前药为下述结构式的化合物;进一步地,步骤(4)中,阿霉素前药溶液的浓度为0.4~0.5 mg/ml,所用的溶剂为有机溶剂,例如二氯甲烷等。
18.进一步地,步骤(4)中,mgpfns和pdox的质量为4~6:1~1.5。
19.进一步地,步骤(4)中,mgpfns和pdox混合溶液搅拌时间为20~24 h,然后通过离心收集纳米颗粒并在真空烘箱中于30~35
°
c下干燥获得。
20.进一步地,步骤(1)、(2)、(3)和(4)中,离心转速为10000~12000 rpm,离心时间为10~12 min。
21.葡萄糖氧化酶可以高效催化葡萄糖快速转化为葡萄糖酸,从而剥夺肿瘤细胞的葡萄糖并使肿瘤细胞缺乏营养物质而死亡。h2o2作为酶促反应的副产物,能与金属离子发生芬顿反应产生剧毒的羟基自由基,导致肿瘤细胞膜脂过氧化、线粒体功能障碍和dna损伤。同时,芬顿反应的产物之一活性氧(ros)能刺激阿霉素前药转化为阿霉素,改善了阿霉素无法富集到肿瘤部位和药物自身的高毒性的问题。本发明基于癌症饥饿疗法,以及化学动力学疗法的原理,通过用聚乙烯亚胺修饰fe3o4纳米颗粒,然后静电吸附葡萄糖氧化酶,然后利用具有ph和还原双敏感的金属多酚网络包裹pei修饰的fe3o4纳米颗粒,最后通过静电作用结合阿霉素前药,得到纳米颗粒。金属多酚网络中的二硫键和配位键,不仅使纳米颗粒实现了在低ph值、高细胞内谷胱甘肽浓度的肿瘤部位的富集和释放,而且提高了纳米载体的生物相容性和血液循环时间。因此,该纳米颗粒也在本发明保护范围之内。
22.本发明基于饥饿疗法、以及化学动力学疗法、化疗联合疗法的的原理,所得纳米颗粒具有ph和还原双敏感性,具有很好的体内长期稳定性和生物相容性,能够有效避免化疗药物的流出,能够改善阿霉素无法富集到肿瘤部位和药物自身的高毒性的问题,同时通过葡萄糖氧化酶剥夺肿瘤细胞的营养和芬顿反应产生羟基自由基促进肿瘤细胞凋亡,对耐药性肿瘤具有显著的治疗效果。因此,本发明还提供了上述用于克服癌症多药耐药性的纳米颗粒在制备癌症药物中的应用。
23.本发明的工作原理及有益效果在于:1、本发明通过用聚乙烯亚胺修饰fe3o4纳米颗粒,然后静电吸附葡萄糖氧化酶,然后利用具有ph和还原双敏感的金属多酚网络包裹pei修饰的fe3o4纳米颗粒,最后通过静电作用结合阿霉素前药,得到纳米颗粒。本发明纳米颗粒具有良好的体内长期稳定性、生物相容性、靶向性,能够有效避免化疗药物的流出,能够有效被积累到肿瘤部位,能够促进肿瘤细胞凋亡,能够有效治疗和预防癌症,对肿瘤具有显著的治疗效果。
24.2、本发明纳米颗粒负载的葡萄糖氧化酶可以高效催化葡萄糖快速转化为葡萄糖酸,从而剥夺肿瘤细胞内的葡萄糖并使肿瘤细胞缺乏营养而死亡。h2o2作为酶促反应的副产物,能与金属离子发生芬顿反应产生剧毒的羟基自由基,导致肿瘤细胞膜脂过氧化、线粒体功能障碍和dna损伤。同时,芬顿反应的产物之一活性氧(ros)能刺激阿霉素前药转化为阿霉素,改善了阿霉素无法富集到肿瘤部位和药物自身高毒性的问题,提高了癌症化疗药物的疗效。
25.3、本发明制备方法操作简便,能耗低,环境友好,易于扩大生产。
附图说明
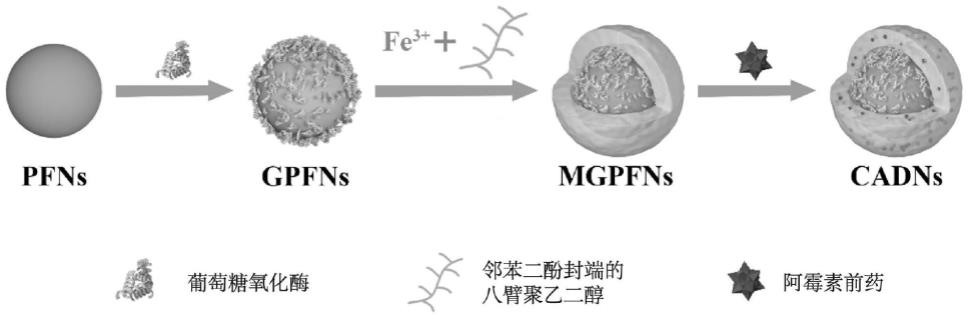
26.图1是实施例1制备的用于克服癌症多药耐药性的纳米颗粒cadns的制备示意图。
27.图2是实施例1中pfns的透射电子显微镜图片。
28.图3是实施例1中cadns的透射电子显微镜图片。
29.图4为实施例1制备的cadns的动态激光散射结果。
30.图5为实施例2中不同样品的uv光谱,其中(1)mgpfns,(2)pfns,(3)gpfns,(4)cadns,(5)pdox和(6)gox。
31.图6为实施例3制备的cadns在pbs(ph=5.2)、pbs(ph=6.0)、pbs(ph=7.4)和还原性谷胱甘肽溶液(1 mm,ph=7.4)中累积释放dox的结果。
32.图7为实施例3制备的cadns在pbs(ph=5.2)、pbs(ph=6.0)、pbs(ph=7.4)和还原性谷胱甘肽溶液(1 mm,ph=7.4)中的累积释放gox的结果。
33.图8为实施例4中通过流式细胞术测定dox、cadns对具有抗药性的mcf-7细胞的体外细胞摄取评估结果。
34.图9为实施例5中通过cck-8测定不同浓度的pdox、dox和cadns对普通的mcf-7细胞的体外细胞毒性评估结果。
35.图10为实施例5中通过cck-8测定不同浓度的pdox、dox和cadns对具有抗药性的mcf-7细胞的体外细胞毒性评估结果。
具体实施方式
36.为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步的详细说明。
37.下述实施例中,所用fe3o4纳米颗粒按照autoclave-free facile approach to the synthesis of highly tunable nanocrystal clusters for magnetic responsive photonic crystals中记载的方法合成,带有邻苯二酚末端的八臂聚乙二醇(cpeg)按照cn112315941a中记载的方法合成,阿霉素前药(pdox)由上海纳孚生物科技有限公司定制合成。
38.实施例1通过饥饿/化学动力/化疗联合疗法用于克服癌症多药耐药性的纳米颗粒的制备过程如图1所示,具体步骤如下:聚乙烯亚胺修饰的fe3o4纳米颗粒(pfns)的合成:将10 mg fe3o4纳米粒子超声分散在9 ml去离子水中,然后加入1 ml pei溶液(40 mg/ml)。搅拌24 h后,离心(10000 rpm,10 min)收集pei修饰的fe3o4纳米颗粒,用去离子水洗涤3次,冻干。
39.负载gox的pfns(gpfns)的合成:将1 mg pfns超声分散在1 ml去离子水中,向其中加入0.25 mg gox(0.5 mg/ml,0.5 ml)溶液。将混合物在室温下涡旋30 min并离心(10000 rpm,10 min),用去离子水洗涤3次以去除游离的gox,冻干获得负载gox的pfns。
40.金属多酚网络(mpns)封装的gpfns(mgpfns)的合成:将1.2 mg gpfns重新分散在1 ml去离子水中。涡旋30秒后,依次加入cpeg溶液(50 μl,40 mg/ml)、fecl3溶液(50 μl,6 mg/ml)和tris-hcl缓冲液(ph=8.5、300 μl、50 mm),每加入一种溶液涡旋30 s后再加入另一种,全部加入后再涡旋2 min。通过离心(10000 rpm,10 min)和用水洗涤未反应的cpeg和fecl3,获得mgpfns。
41.cadns的合成:将所制备的1.2 mg mgpfns分散在含pdox(0.4 mg/ml)的1 ml ch2cl2溶液中。搅拌24 h后,通过离心(10000 rpm,10 min)收集纳米颗粒并在真空烘箱中于35
°
c下干燥,得到通过饥饿/化学动力/化疗联合疗法用于克服癌症多药耐药性的纳米颗粒cadns。
42.图2为pfns的透射电镜图,从图中可以看出,pei修饰的fe3o4纳米颗粒的粒径约为70 nm。图3为cadns的透射电子显微镜图片,从图中可以看出,cadns的粒径约为80 nm,纳米颗粒表面覆盖有一层薄薄的金属多酚网络。图4为cadns的动态激光散射结果,从图中可以看出,cadns具有平均119.3 nm的流体动力学粒径和相对窄的粒径分布,这说明我们的纳米材料具有较小的粒径尺寸,能够被肿瘤细胞摄取。
43.实施例2聚乙烯亚胺修饰的fe3o4纳米颗粒(pfns)的合成:将10 mg fe3o4纳米粒子超声分散在9 ml去离子水中,然后加入1 ml pei溶液(35 mg/ml)。搅拌24 h后,离心(12000 rpm,10 min)收集pei修饰的fe3o4纳米颗粒,用去离子水洗涤3次,冻干得到pfns。
44.负载gox的pfns(gpfns)的合成:将1 mg pfns超声分散在1 ml去离子水中,向其中加入0.25 mg gox(0.5 mg/ml,0.5 ml)溶液。将混合物在室温下涡旋30 min并离心(12000 rpm,10 min),用去离子水洗涤3次以去除游离的gox,冻干获得负载gox的pfns。
45.金属多酚网络(mpns)封装的gpfns(mgpfns)的合成:将1 mg gpfns重新分散在1 ml去离子水中。涡旋30秒后,依次加入cpeg溶液(50 μl,40 mg/ml)、fecl3溶液(50 μl,6 mg/ml)和tris-hcl缓冲液(ph=8.5、300 μl、60 mm),每加入一种溶液涡旋30 s后再加入另一种,全部加入后再涡旋2 min。通过离心(12000 rpm,10 min)和用水洗涤未反应的cpeg和fecl3,获得mgpfns。
46.cadns的合成:将所制备的1 mg mgpfns分散在含pdox(0.4mg/ml)的1 ml ch2cl2溶液中。搅拌20 h后,通过离心(12000 rpm,10 min)收集纳米颗粒并在真空烘箱中于30
°
c下干燥,得到通过饥饿/化学动力/化疗联合疗法用于克服癌症多药耐药性的纳米颗粒cadns。
47.图5为(1)mgpfns,(2)pfns,(3)gpfns,(4)cadns,(5)pdox和(6)gox的uv光谱,通过比较(2)、(3)和(6)的紫外可见光吸收光谱图,其中gpfns和gox在275 nm处有特定吸收,而pfns不具有该特征,则证明gox被成功负载。通过比较(1)、(4)和(5)的紫外可见光吸收光谱图,pdox和cadns在486 nm和253 nm处有特定吸收峰,而mgpfns不具有该特征,则证明pdox被成功负载。以上结果表明,cadns是负载了pdox和gox的纳米颗粒,在进入肿瘤细胞后,gox能够催化葡萄糖转化为葡萄糖酸夺取肿瘤细胞营养物质,pdox在ros作用下转换为dox发挥化疗作用。
48.实施例3cadns体外ova释放行为研究为了评估本研究中制造的mpns涂层的多重响应性,以0.2 mg/ml的dox浓度,将 cadns分散在不同的缓冲溶液中,包括a:pbs(ph=5.2)、b:pbs(ph=6.0)、c:pbs(ph=7.4)和d:还原性谷胱甘肽溶液(1 mm,ph=7.4)四种溶液中,并保持在37
°
c下避光孵育。在给定的时间点,离心后取出 200 μl上清液,通过uv-vis光谱对释放的dox进行定量,并通过bradford试剂盒对gox进行定量。每次补充额外的200 μl相关pbs以保持缓冲液体积恒定。
49.由于肿瘤组织中发生异常高水平的糖酵解,过多的乳酸在细胞外基质中积累,导致肿瘤微环境呈弱酸性。此外,细胞内溶酶体具有更酸性的环境(ph=4.5~6.5),肿瘤细胞质中谷胱甘肽的浓度远高于正常组织。图6和图7为cadns在pbs(ph=5.2)、pbs(ph=6.0)、pbs(ph=7.4)和d:还原性谷胱甘肽溶液(1 mm,ph=7.4)的体外释放dox和gox的结果,可以看出ph值和谷胱甘肽对dox和gox的释放有显着影响。16 h后,cadns在ph=7.4时仅释放了26.3%
的dox,但在ph=6.0时,释放了80.4%的dox,在ph=5.2时,几乎所有的dox都被释放。同样,在ph=5.2、ph=6.0和谷胱甘肽条件下也发现了gox的快速释放。其原因是酸性条件可以破坏mpns中的配位键,还原性谷胱甘肽可以打开mpns内的二硫键。这些结果证明,cadns对ph和还原具有敏感性,可用于在靶向肿瘤微环境中有效释放药物。
50.实施例4cadns体外细胞摄取取生长状态好的具有抗药性的mcf-7细胞,消化后用1640全部培养基重悬并计数,然后以7.5
×
104个细胞每孔的量将细胞铺于12孔板中,培养24 h。第二天吸出每孔的培养基并用pbs洗细胞一次,然后根据实验设置分别加入pbs,dox和实施例2的cadns(5 μm的dox或pdox浓度)的1640基本培养基溶液1 ml,全程避光,孵育细胞4 h。然后将每孔中的培养基吸出,用pbs洗一次,加入300 μl胰酶消化液2 min后,然后加入500
ꢀµ
l 1640全培终止,用移液枪吹打12孔板使贴在壁上的细胞脱落,1200 rpm离心5min后,用500 μl pbs重悬,用于流式细胞仪分析。
51.众所周知,dox通过抑制拓扑异构酶ii和中断dna的合成来对抗肿瘤细胞,并且dox的细胞内积累对于细胞死亡诱导和抗肿瘤治疗效果至关重要。图8是通过流式细胞术测定dox、cadns对具有抗药性的mcf-7细胞的体外细胞摄取评估结果。我们把空白组划分为0.90%的相对阴性,相比游离dox组8.60%的相对摄取率,具有抗药性的mcf-7细胞显示出对cadns更高的摄取率,达到了98.63%。原因可能是具有抗药性的mcf-7细胞高度表达p-糖蛋白转运蛋白,导致了dox的流出。另一方面mpns的包裹提高了无机纳米颗粒的生物相容性,有利于纳米颗粒附着到肿瘤细胞上被摄取,改善了单一dox摄取率低,易被降解的缺点。上述表明cadns能更好地被肿瘤细胞摄取,从而发挥接下来的细胞内的酶促反应和芬顿反应作用。
52.实施例5cadns体外细胞毒性评估首先,将普通的mcf-7和具有抗药性的mcf-7细胞以每孔6000个细胞的密度在96孔板中孵育24小时。以dox或pdox的浓度(0.1、0.5、1.0、5.0、10、50 μm)来添加dox、pdox 和实施例2的cadns到相关孔中。将96孔板在细胞培养箱中放置24小时后,使用标准cck-8分析法测定细胞活力。
53.在评估细胞内药物积累后,我们在普通的mcf-7和具有抗药性的mcf-7细胞中研究了了dox、pdox和cadns的体外肿瘤细胞杀伤效率。如图9和图10所示,即使浓度为50 μm,pdox在所有细胞中也仅显示出轻微的细胞毒性,细胞活力均高于80%。这一结果可能是由于dox的抗癌作用关键的氨基被苯基硼酸酯结构阻断,从而降低了pdox的细胞毒性。对于mcf-7,细胞活力随着dox浓度的增加而相应下降,在50 μm浓度下达到27.8%。然而,具有抗药性的mcf-7细胞对dox表现出明显的耐药性,导致细胞死亡更少,最终细胞存活率为67.7%。相比之下,cadns在普通肿瘤细胞和抗药性的肿瘤细胞中导致更高的细胞死亡率,这可能是由于羟基自由基引起的动态损伤和pdox转变为了dox。当cadns的剂量相当于50 μm pdox时,几乎所有的mcf-7和具有抗药性的mcf-7细胞都会死亡。上述结果展示了cadns对普通肿瘤细胞和具有抗药性的肿瘤细胞优秀的杀伤作用。
54.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精
神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1