一种适用于骨折内固定术前制作的可降解材料及其制备方法及应用与流程
1.本发明涉及生物医用材料领域,具体地说涉及一种适用于骨折内固定术前制作的可降解材料及其制备方法及应用。
背景技术:
2.当骨折较严重,出现明显位移,需将骨折部位切开复位,之后通过钢板、螺钉等固定,被称为内固定。骨折内固定可维持骨折端稳定性,更好促进骨折恢复。骨折内固定的方法非常多,通常需要根据骨折的具体部位和具体的解剖结构确定固定方法,比如锁骨骨折可以选用锁骨s型钢板以及锁骨钩钢板固定;肱骨近端骨折主要使用肱骨近端髁锁定钢板、肱骨近端亚髁锁定钢板以及肱骨近端髁钢板;其他部位还有专门的锁定钢板,或者空心加压螺钉以及交锁髓内针;还有椎弓根钉等固定。骨折部位不同,固定方法相差甚远,需要根据具体部位以及医生的手术经验决定和选择。内固定材料一般在术后一年至一年半左右,骨折完全恢复的情况下拆除。但骨折恢复后内固定的拆除会给患者带来二次手术的痛苦,对刚刚重建愈合的组织造成副损伤,导致难愈合、愈合慢,且有二次感染的风险,甚至需要再次手术治疗。
3.近年来,骨折内固定理论和技术取得了前所未有的发展,对指导临床骨科疾病发挥了重要的作用。治疗骨缺损多采用自体移植和合成材料植入的方法,但自体移植骨数量受来源的限制,且很难根据缺损部位准确塑型,而同种异体移植则可能成为疾病的传染源;合成材料虽是永久性植入的,但可能引起诸多感染、骨腐蚀等副作用。而对于植入人体的人工骨材料来说,既要要求它能经得起体液的腐蚀和溶解,具有良好的生物相容性及生物活性,还要具有良好的化学稳定性和力学性能。
4.生物医用材料是指具有特殊性能、特殊功能,用于人体器官外科修复、理疗康复、诊断、检查、治疗病患等医疗、保健领域,而对人体组织、血液不致产生不良影响的材料。国际标准化组织(iso)法国会议专门定义的“生物材料”就是生物医学材料,它是指“以医疗为目的,用于与组织接触以形成功能的无生命材料”。生物材料按应用性质来分类,分为:抗凝血材料(心血管材料)、齿科材料、骨科材料、眼科材料、吸附解毒材料(血液灌流用)、假体材料、缓释材料、生物黏合材料、透析及超滤用膜材料、一次性医用材料,等等。按医用材料使用要求分类,分为:非植入性材料、植入性材料、血液接触性材料、降解和吸收性材料。
5.生物医用高分子材料是生物医用材料的一个重要组成部分,是一类用于诊断、治疗和器官修复与再生的材料,具有延长病人生命、提高病人生存质量的作用,是材料科学化学、生命科学生医学交叉的发展领域,其研究和开发既有重大的社会需求,也有重大的经济需求。高性能医用高分子材料和器械是现代医学各种诊断和治疗技术赖以存在的基础,并不断推动创新产品的出现。医用高分子材料的研究至今已有70多年,1949年,美国首先发表了医用高分子的展望性论文。在文章中,第一次介绍了利用聚甲基丙烯酸甲酯作为人和头盖骨和关节。利用聚酰胺纤维作为手术缝合线的临床应用情况。聚合物的分子设计是目前
生物高分子科学工作者的一个重要课题,分析“分子设计”即推断、预测、高分子生物材料的构成原子、分子种类、结合和聚集态等问题,并描绘出该分子的结构、组织、形态的具体构象。进行了医用生物高分子聚合物的分子设计,目的就是如何合成和制造具有指定性能和结构的高分子生物材料。分子设计进一步与实际联系就是“材料设计”,材料设计属目的学范畴,是工程学范畴的课题。
6.组织工程(tissue engineering)是近年来正在兴起的一门新学科,属于生物高技术范畴。组织工程一词最早是在1987年美国科学基金会在华盛顿举办的生物工程小组会上提出的,1988年将基正式定义为,应用生命科学与工程学的原理与技术,在正确认识哺乳动物的正常及病理两种状态下的组织结构与功能关系基础上,研究开发用于修复、维护、促进人体各种组织或器官损伤后的功能和形态的生物替代物的一门新兴学科。组织工程支架的高分子材料,理论上对软、硬组织替代和修复的讨论已涉及组织工程、尤其骨组织工程这一研究热点。用于组织工程的生物材料
‑‑
组织工程支架材料是组织工程的基础,是组织工程领域中的一个不可缺的环节,因此组织工程支架自然形成了组织工程的一个分支。近年来,组织工程支架材料这一领域的研究极为活跃,人们不仅在组织工程的最早产品人工皮肤领域进行了更为完善的研究和开发,同时,在诸如人工骨、软骨、神经、血管材料等各系统,都进行了大量的研究和探索。组织材料是根据材料用于不同人体组织,并根据具体替代组织具备的功能所设计的,组织支架材料包括:骨、软骨、血管、神经、皮肤和人工器官,如肝、脾、肾、膀胱等。
7.经反复体内生物学动物实验发现,将聚合物植入体内易在植入周围发生水肿并出现炎症细胞浸润和多核巨细胞,成纤维细胞增殖形成纤维;同时,聚合体降解而成的微粒被巨噬细胞吞食,其植入骨内有迟发性炎症反应,且发生率仍然较高。
8.可吸收性生物降解材料是较为理想的骨组织工程材料,良好的替代和修复材料,是一种比以往几十年来研究的高分子生物降解性的优胜替代和骨修复材料,具有创造性和新颖性。可吸收性生物降解材料材料作为一个理想的骨组织工程材料应能满足以下3个基本条件:
①
有良好的生物相容性。产品本身或降解产物对细胞、组织和机体无毒性,植入后不会引起免疫排斥反应。
②
材料可吸收性生物降解,降解速度与组织再生的速度相匹配;
③
具有一定的刚度(硬度)弹性和柔韧性,以满足骨与关节活动时传导应力的需要。生物降解聚合物由于具有机械性能优异,生物相容性好等优点,在生物医学领域如骨移植、骨水泥、药物控释、组织工程支架等方面有着越来越多的应用。
9.几十年来我国采用了医用骨水泥进行骨填充和骨修复。骨水泥是一类在临床外科手术中操作方便,能像水泥一样根据需要任意塑性和自行固化的骨修复材料,在骨修复等领域有着广泛的应用。目前可作为骨水泥使用的一种材料是聚甲基丙烯酸甲醋(pmma),由于其组织成分与自然骨组织完全不同,因此生物相容性存在着很大的问题。传统的无机磷酸钙水泥拥有很好的相容性和高的生物活性,但其力强度太低,抗压强度小,抗张强度低,脆性大,而弹性模量大大高于自然骨。此外,有排斥反应,慢性疼痛,巨噬细胞反应等,不能根据缺损部位的填充和修复需要治疗的地方,并且还可以遇到体液和血液难以固化以及不可吸收,排斥反应方面的问题。
10.骨科生物降解材料是上世纪80年代国际上开发的一种新材料。生物降解内固定材料已经研究了几十年,新近研制的材料是聚乙醇酸(polyglycolide)和聚乳酸
(polylactide)为基础的聚合物,将其制成螺钉和内固定棒应用于临床骨折的内固定。骨折愈合后在体内能自身降解和吸收,不用再手术取出。目前已成为商品化市场销售,国外有许多国家用于内固定关节内及关节周围骨折和手部骨折。其中,芬兰的生物降解可吸收螺钉已积累了2万多病例,中国自1993年起也开始引进。然而在应用过程中逐渐发现该生物降解可吸收螺钉有毒副作用,存在巨噬细胞反应、非炎症性反应,骨折延迟愈合或不愈合的问题。这是因为以往研究的可吸收螺钉、可吸收棒制成的内固定材料是以聚乙醇酸和聚乳酸聚合的两组分的大分子之间没有共价键的联系,而结构决定性质,结构取决于两项的相容性,由于没有共价键其分子量为大分子结构,因此内固定材料对骨组织的刺激性大,引起排斥反应和巨噬细胞反应等并发症的出现。以往的研究表明,生物降解材料在人体内最终分解为h2和co2,毒性极低,但对组织的刺激性大,会造成组织积液和肿胀;材料降解的微粒也会被人体视为异物刺激体内诱发排斥反应——巨噬细胞反应。所以,其组织相容性仍然不及现应用的金属内固定性能好。
11.人体骨骼有206块,常发生在分布于四肢的骨折,但四肢骨折如胫腓骨干双骨折、股骨干骨折均在生物力学上对骨折固定常用的钛合金钢板、螺钉等进行骨折内固定。例如,股骨干是支撑人体的重要骨骼结构,是全身最粗的管状骨,强度最高,多由于高能量直接暴击(交通事故、火器伤等)才会造成骨折。之所以使用钛合金材料进行内固定是因为它坚硬、不易变形、不易腐蚀,并且轻巧。然而,不同的骨组织部位承载人体不同的受力和功能。例如,桡骨远端骨折是指距桡骨下端关节面3
㎝
以内的骨折。然而腕部关节的活动频率高、功能恢复要求高。治疗不当容易导致关节慢性疼痛和僵硬,严重影响手部的功能,给患者生活造成不变。应根据骨折的部位和功能合理选择更适用的骨修复材料,而不同聚合物的生物相容性和降解速度各有差异,其机械强度和柔韧性也存在差异。修复剪应大的大尺寸骨折部位则需要刚度大的材料,但往往柔韧性低;而具备良好柔韧性的材料多生物力学不能达到剪应大的骨折内固定(如胫腓骨骨折、股骨干骨折等),存在刚度(硬度)较低的缺陷。
12.而目前市面上的骨折内固定可降解材料一般会在术前预先在工厂制作出骨折内固定替代部件,制得的该部件不易保存,较长时间的存放会导致挥发变质(表面逐渐发粘,硬度降低),使得材料标准难以把控,直接影响手术成功率和患者的恢复。如因长时间存放使该产品发生变质挥发,则不可作为内固定可降解材料达到骨折内固定的生物力学要求。
13.β-tcp(β-tricalcium phosphate),即β-磷酸三钙,粉剂,作为人工骨替代材料自70年代起应用于临床。β-tcp的成分与骨矿物组成类似,β-tcp中ca和p离子的比例为1.5:1,在体内降解为ca和p离子并以此提供给新生的骨组织,逐步被新骨组织代替,具有良好的生物相容性。作为一种植入材料,β-tcp的生物降解性能良好。通常,生物降解过程有两种途径,即体液介导过程和细胞介导过程。而β-tcp具有利于体液浸入的连通大孔结构以及以利于组织细胞长入的微孔结构。β-tcp被植入体内经过一段时间,发生陶瓷生物降解,最终无异物存留,材料完全吸收后形成新骨的塑型不再吸收材料存在的影响,而且新骨的强度由于新骨与材料结合的强度,通过不同的制备工艺来改变材料的孔机构、理化性能(生物吸收率、机械强度、孔隙结构等)可以满足不同的临床应用要求。但β-tcp疲劳强度低、脆性大,抗折、抗冲击性能不能满足高负荷人工骨的要求。
14.目前应用广泛的可降解性生物材料有聚乙醇酸(pga)和聚乳酸(pla),但其由于化学结构缺乏反应性官能团,不具有亲水性等缺点,大大限制了作为骨修复材料的应用。因
乙烯吡咯烷酮=440mg~880mg:230mg~360mg:120mg~340mg:160mg~440mg:10ml~20ml:15ml~25ml:10ml~25ml。
23.优选的,本发明所述的β-磷酸三钙:聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯:聚富马酸丙烯酯:n-乙烯吡咯烷酮=480mg~880mg:260mg~300mg:160mg~260mg:220mg~300mg:15ml~20ml:15ml~25ml:15ml~20ml。
24.本发明所述的n-乙烯吡咯烷酮由江苏南通润丰石油化工有限公司生产。
25.本发明所述的乙酸乙酯为购买的市售分析纯。
26.乙酸乙酯为五色透明液体,无毒性作为提取物,用于医药,有机酸等产品的生产,有一定的粘合能力,是聚羟基乙酸、聚乳酸、聚羟基丁酸酯最合适的溶解剂。
27.一种适用于骨折内固定术前制作的可降解材料的制备方法,其包括以下步骤:
⑴
按配比取β-磷酸三钙搅拌制成为超微粒子粉末,得材料a,备用;
⑵
按配比将聚羟基乙酸、聚乳酸、聚羟基丁酸酯加入酯类有机溶剂交联反应,得到聚合物材料b,备用;
⑶
按配比将聚富马酸丙烯酯、n-乙烯吡咯烷酮交联反应,得到聚合物材料c,备用;
⑷
在6℃~10℃条件下,将材料a、聚合物材料b混合且在转速1000转/分的搅拌速度下搅拌10~15分钟,并继续在磁力条件下搅拌至超微粒子固化为止,所得的交联反应后的聚合材料然后干燥成粉末,得到混合超微粒子粉末,备用;
⑸
将步骤
⑶
所得的聚合物材料c以1000转/分进行离心分离得液体聚合物材料备用液;
⑹
将步骤
⑸
所得的液体聚合物材料备用液与步骤
⑷
所得的混合超微粒子粉末以1000转/分进行分离搅拌10~15分钟,即得混合超微粒子湿粉末,然后用西林瓶灌装备用。
28.本发明步骤
⑴
中所述的β-磷酸三钙的配比量为440mg~880mg;所述的步骤
⑵
中的配比为聚羟基乙酸:聚乳酸:聚羟基丁酸酯:酯类有机溶剂=230mg~360mg:120mg~340mg:160mg~440mg:10ml~20ml,所述的酯类有机溶剂为乙酸乙酯;所述的步骤
⑶
中的配比为聚富马酸丙烯酯:n-乙烯吡咯烷酮=15ml~25ml:10ml~25ml。
29.优选的,本发明步骤
⑴
中所述的β-磷酸三钙的配比量为480mg~880mg;所述的步骤
⑵
中的配比为聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯=260mg~300mg:160mg~260mg:220mg~300mg:15ml~20ml;所述的步骤
⑶
中的配比为聚富马酸丙烯酯:n-乙烯吡咯烷酮=15ml~25ml:15ml~20ml。
30.本发明步骤
⑷
中所述的干燥为在60℃~120℃条件下烘干1~2小时或冷冻干燥,再经钴60辐射(168小时)灭菌。
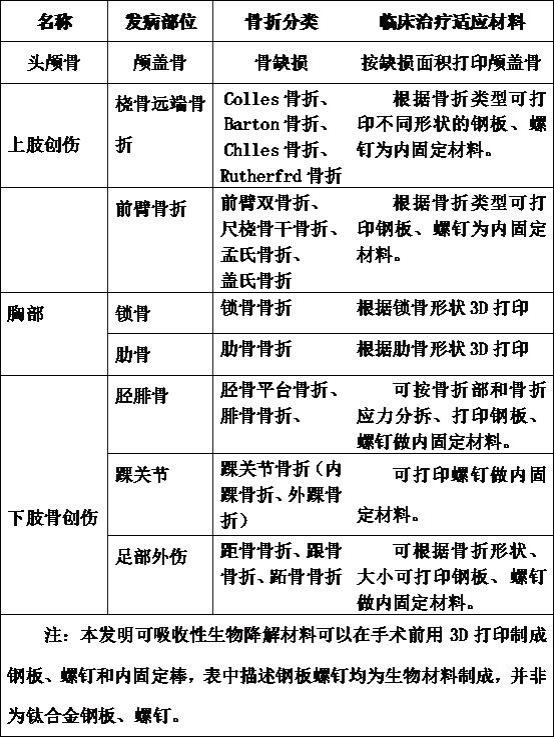
31.本发明步骤
⑹
中所述的混合超微粒子湿粉末中的含水量为2%~3%。
32.一种适用于骨折内固定术前制作的可降解材料的应用,取混合超微粒子湿粉末按骨折内固定临床应用要求术前制作,利用现有的3d打印设备进行3d打印人工骨,制成可降解内固定件(可塑形钢板、螺钉、骨折固定棒等)。
33.由于采用上述技术方案,本发明较好的实现了发明目的,其制备的混合超微粒子湿粉末属于骨折内固定可吸收性生物降解材料,应用骨折病例范围广,适应于各种剪应力小的骨折内固定材料固定骨折,可根据骨折的分类,术前制作通过3d打印成适合不同部位和不同骨折类型的可塑形钢板、螺钉、骨折固定棒等固定骨折;配方中用β-磷酸三钙和聚羟
基乙酸、聚乳酸,聚羟基丁酸酯复合成韧性和强度都很好的骨修复材料;聚羟基乙酸(polyglycolic acid,pga)具有良好的生物相容性,使作为软骨细胞的细胞外基质,能较好地诱导和促进软骨细胞的黏附、增殖和分化,形成软骨组织,聚合物中的脂键易于水解,属于非酯性水解在体内降解的产物为羟基乙酸,易于参加体内代谢;但pga由于降解较快,易出现崩解,导致整过支架塌陷,而且pga降解形成的单体羟基乙酸在局部积累,造成局部ph下降,导致细胞中毒乃致死亡,本发明为了解决这一问题,采取与聚乳酸交联,聚乳酸(polylactic acid,pla)具有良好的机械强度;但容易导致局部出现非特异性无菌炎症,目前认为这可能与pla降解过程中酸性降解产物引起局部ph下降有关,本发明又采取与聚羟基丁酸酯交联聚合,聚羟基丁酸酯(polyhydroxybutyrate,phb)是原核微生素在碳、氮营养失衡的情况下,作为碳源和能量储存而合成的热塑性聚酯。与其他天然高分子比较,phb为具有良好的力学性能,与合成下降解聚酯相比,又有较好的组织相容性,而且它由生物合成,不带有化工原料合成可能产生的对人体有害的一些副产品,且有可吸收生物降解可控、无毒副作用,避免二次手术;材料骨生物力学性良好,植入人体内固定骨折有适当的机械性,具备一定的刚度(硬度)且抗折、弹性(柔韧性)高,以满足持续的应用;物理特性稳定,术前制作可有效避免挥发变质。
34.本发明中用于骨折内固定可降解材料术前制作的混合超微粒子湿粉末,是在根据病人骨折的部位、骨折的类型、骨折的形状术前制作:
①
能通过3d打印制作适合骨折形状不同的内固定材料(钢板、螺钉),牢固固定骨折;
②
解决术前缺少适应骨折骨固定的材料,给病人带来的痛苦以及延误病期;
③
骨折内固定可降解材料如术前制作出来后,如因长时间存放该产品发生变质挥发,不能作为内固定可降解材料,无法达到骨折内固定的生物力学要求;解决采用传统肽合金钢板、螺钉带来的第二次手术减少患者痛苦,减少医疗费用。
35.本发明的骨折内固定术前制作的可降解材料的生物相容性和骨传导性能好,β-tcp与聚羟基乙酸、聚乳酸、聚羟基丁酸酯关联反应形成的聚合物材料能增强材料的刚度(硬度)、柔韧性,大大提高了内固定材料的抗折强度,可适用于剪应力小的骨折,应用于锁骨骨折、肋骨骨折、肱骨近端骨折、肱骨内外科骨折、桡骨小头骨折、科雷氏骨折、手指骨骨折、胫骨平台骨折、双踝骨骨折、距骨骨折、足跖骨骨折、足趾骨骨折,重建骨折和骨缺损的治疗,适用于制作小螺钉、小钢板(剪应力小)的可降解内固定件,具有缩短骨折愈合时间、增强抗折强度的作用,能够较好的促进骨折愈合。
具体实施方式
36.下面结合实施例对本发明作进一步说明。
37.实施例1:一种适用于骨折内固定术前制作的可降解材料,它由以下配比原料制成:β-磷酸三钙:聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯:聚富马酸丙烯酯:n-乙烯吡咯烷酮=440mg~880mg:230mg~360mg:120mg~340mg:160mg~440mg:10ml~20ml:15ml~25ml:10ml~25ml(本实施例的原料配比为β-磷酸三钙:聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯:聚富马酸丙烯酯:n-乙烯吡咯烷酮=480mg:260mg:160mg:220mg:15ml:15ml:15ml)。
38.本发明所述的n-乙烯吡咯烷酮由江苏南通润丰石油化工有限公司生产。
39.本发明所述的乙酸乙酯为购买的市售分析纯。
40.乙酸乙酯为五色透明液体,无毒性作为提取物,用于医药,有机酸等产品的生产,有一定的粘合能力,是聚羟基乙酸、聚乳酸、聚羟基丁酸酯最合适的溶解剂。
41.一种适用于骨折内固定术前制作的可降解材料的制备方法,其包括以下步骤:
⑴
按配比取β-磷酸三钙搅拌制成为超微粒子粉末,得材料a,备用;
⑵
按配比将聚羟基乙酸、聚乳酸、聚羟基丁酸酯加入酯类有机溶剂交联反应,得到聚合物材料b,备用;
⑶
按配比将聚富马酸丙烯酯、n-乙烯吡咯烷酮交联反应,得到聚合物材料c,备用;
⑷
在6℃~10℃条件下(本实施例为8℃),将材料a、聚合物材料b混合且在转速1000转/分的搅拌速度下搅拌10~15分钟(本实施例为12分钟),并继续在磁力条件下搅拌至超微粒子固化为止,所得的交联反应后的聚合材料然后干燥成粉末,得到混合超微粒子粉末,备用;
⑸
将步骤
⑶
所得的聚合物材料c以1000转/分进行离心分离得液体聚合物材料备用液;
⑹
将步骤
⑸
所得的液体聚合物材料备用液与步骤
⑷
所得的混合超微粒子粉末以1000转/分进行分离搅拌10~15分钟,即得混合超微粒子湿粉末,然后用西林瓶灌装备用。
42.本发明步骤
⑴
中所述的β-磷酸三钙的配比量为440mg~880mg(本实施例中β-磷酸三钙的配比量为480mg);所述的步骤
⑵
中的配比为 聚羟基乙酸:聚乳酸:聚羟基丁酸酯:酯类有机溶剂=230mg~360mg:120mg~340mg:160mg~440mg:10ml~20ml,所述的酯类有机溶剂为乙酸乙酯(本实施例的配比为260mg:160mg:220mg:15ml);所述的步骤
⑶
中的配比为聚富马酸丙烯酯:n-乙烯吡咯烷酮=15ml~25ml:10ml~25ml(本实施例的配比为15ml:15ml)。
43.本发明步骤
⑷
中所述的干燥为在60℃~120℃条件下烘干1~2小时或冷冻干燥(本实施例为60℃条件下烘干2小时),再经钴60辐射灭菌。
44.本发明步骤
⑹
中所述的混合超微粒子湿粉末中的含水量为2%~3%(本实施例为2%)。
45.一种适用于骨折内固定术前制作的可降解材料的应用,取混合超微粒子湿粉末按骨折内固定临床应用要求术前制作,利用现有的3d打印设备进行3d打印人工骨,制成可降解内固定件。
46.实施例2:本实施例中的一种适用于骨折内固定术前制作的可降解材料,它由以下配比原料制成:β-磷酸三钙:聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯:聚富马酸丙烯酯:n-乙烯吡咯烷酮=880mg:360mg:340mg:300mg: 15ml:25ml:25ml。
47.本实施例中的一种适用于骨折内固定术前制作的可降解材料的制备方法,其步骤
⑴
中所述的β-磷酸三钙的配比量为880mg;所述的步骤
⑵
中的配比为 聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯=360mg:340mg:300mg:15ml;
所述的步骤
⑶
中的配比为聚富马酸丙烯酯:n-乙烯吡咯烷酮= 25ml:25ml。
48.本实施例所述的步骤
⑷
中材料a、聚合物材料b在6℃~10℃条件下(本实施例为10℃)混合且在转速1000转/分的搅拌速度下搅拌10~15分钟(本实施例为15分钟);所述的干燥为在60℃~120℃条件下烘干1~2小时或冷冻干燥(本实施例为120℃条件下烘干1小时),再经钴60辐射灭菌。
49.本实施例中步骤
⑹
中所述的混合超微粒子湿粉末中的含水量为2%~3%(本实施例为3%)。
50.余同实施例1。
51.实施例3:本实施例中的一种适用于骨折内固定术前制作的可降解材料,它由以下配比原料制成:β-磷酸三钙:聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯:聚富马酸丙烯酯:n-乙烯吡咯烷酮=880mg:360mg:340mg:300mg: 10ml:25ml:25ml。
52.本实施例中的一种适用于骨折内固定术前制作的可降解材料的制备方法,其步骤
⑴
中所述的β-磷酸三钙的配比量为880mg;所述的步骤
⑵
中的配比为 聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯=360mg:340mg:300mg:10ml。
53.本实施例步骤
⑷
中所述的干燥为在60℃~120℃条件下烘干1~2小时或冷冻干燥(本实施例为110℃条件下烘干1小时),再经钴60辐射灭菌。
54.本实施例中步骤
⑹
中所述的混合超微粒子湿粉末中的含水量为2%~3%(本实施例为2.7%)。
55.余同实施例2。
56.实施例4:本实施例中的一种适用于骨折内固定术前制作的可降解材料,它由以下配比原料制成:β-磷酸三钙:聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯:聚富马酸丙烯酯:n-乙烯吡咯烷酮=440mg:230mg:120mg:160mg:10ml:15ml:10ml。
57.本实施例中的一种适用于骨折内固定术前制作的可降解材料的制备方法,其步骤
⑴
中所述的β-磷酸三钙的配比量为440mg;所述的步骤
⑵
中的配比为 聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯=230mg:120mg:160mg:10ml;本实施例中所述的步骤
⑶
中的配比为聚富马酸丙烯酯:n-乙烯吡咯烷酮= 15ml:10ml;本实施例所述的步骤
⑷
中材料a、聚合物材料b在6℃~10℃条件下(本实施例为6℃)混合且在转速1000转/分的搅拌速度下搅拌10~15分钟(本实施例为10分钟);所述的干燥为在60℃~120℃条件下烘干1~2小时或冷冻干燥(本实施例为70℃条件下烘干1.5小时),再经钴60辐射灭菌。
58.本实施例中步骤
⑹
中所述的混合超微粒子湿粉末中的含水量为2%~3%(本实施例为2%)。
59.余同实施例1。
60.实施例5:本实施例中的一种适用于骨折内固定术前制作的可降解材料,它由以下配比原料制成:β-磷酸三钙:聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯:聚富马酸丙烯酯:n-乙烯吡咯烷酮=800mg:300mg:260mg:440mg:20ml:20ml:20ml。
61.本实施例中的一种适用于骨折内固定术前制作的可降解材料的制备方法,其步骤
⑴
中所述的β-磷酸三钙的配比量为800mg;所述的步骤
⑵
中的配比为聚羟基乙酸:聚乳酸:聚羟基丁酸酯:乙酸乙酯=300mg:260mg:440mg:20ml;所述的步骤
⑶
中的配比为聚富马酸丙烯酯:n-乙烯吡咯烷酮=20ml:20ml。
62.本实施例所述的步骤
⑷
中材料a、聚合物材料b在6℃~10℃条件下(本实施例为10℃)混合且在转速1000转/分的搅拌速度下搅拌10~15分钟(本实施例为15分钟);所述的干燥为在60℃~120℃条件下烘干1~2小时或冷冻干燥(本实施例为110℃条件下烘干1小时),再经钴60辐射灭菌。
63.本实施例中步骤
⑹
中所述的混合超微粒子湿粉末中的含水量为2%~3%(本实施例为2.5%)。
64.余同实施例2。
65.试验例试验㈠:本发明新型术前制作骨折内固定可吸收性材料,其材料的强度、刚度(硬度)、固定骨折的稳定性,了解骨受外力影响、骨的应力和骨的生物力学功能等,对研究由内固定可吸收性材料,对骨折内固定材料的生物力学研究十分重要。
66.骨与关节是人体的支架或框架,是力的主要载体,它具有生物学特性,又具有力学特性,生物学特点是活骨存在和适应其力学环境的基础,而力学特性是骨应力塑型,应力应变,骨结构改建的力学条件等(见表1)。
67.表1骨折内固定可吸收性材料与骨骼的生物力学分析
名称骨生物力学要求骨生物力学分析骨的强度骨抵抗外力破坏的能力在外力作用下,保持自身的连续性和完整性,不发生中段的能力。若外力超过骨的最大承载能力时,则会发生骨折。骨的刚度骨抵抗外力而不发生变形的能力在外力作用下,骨仍能保持固有形态和尺寸和不发生改变的能力,当外力大于其最大刚度时,骨折发生变形。骨的稳定性骨在外力作用下,骨仍然保持原来相对位置不发生改变的能力当外力超过其稳定性时,骨的相对位置则发生移位。力学上称位移。骨的外力作用于骨的力统称为骨的外力包括:自重力,肌群收缩力,肌张力,暴力等。骨的应力在外力作用下,骨组织在位置移位进所产生的相互作用力称之为应力。应力与骨愈合,新骨形成,骨质疏松,骨组织的形状和结构,骨的改建,塑性变形密切相关。
骨的生物力学功能(1)承受外力,产生应力,传导应力;(2)为肌群收缩提供着力点;(3)保护脏器和重要组织;(4)产生生物电;(5)声音导体;(6)肌肉关节;(7)骨的应力应变,应力使骨组织发生形状和尺寸的改变,称为应力应变。 弹性变形骨组织受到应力作用后,发生了形状放尺寸的变形改变。应力作用消失后骨组织的变形即随之恢复原状,这种应力应变称弹性变形。疲劳变形虽然作用到骨上的应力不大,但作用的周期短,频率高,形成一种交叉性应力作用。如变换速度超过了恢复变形的速度,导致骨组织处在不可恢复变形的应力环境中,骨终出现塑性变形。故疲劳骨折又称积累性应力骨折。
本发明通过动物试验研究,对大白兔各10只,桡骨人工造成骨折,骨折后试验组植入实施例1制得的适用于骨折内固定术前制作的可降解材料(3d打印而成的规格6.67
㎝
,身长100
㎜
,宽面3.8
㎜
,身厚4
㎜
的可降解内固定件)固定骨折,对照组用北京贺氏骨水泥固定骨折,12周后人工处死,对试验组和对照组骨折部位通过“液压万能检测仪”对骨折部位的愈合进行力学测试,测试要求对拉伸、压重,曲弯等进行测试,试验组的抗折强度明显高于对照组。
68.骨科生物力学的研究还表明,充足和血供和完整受力骨结构的生物学基础和不断的承受外力,产生的应力,传导应力的力学环境在制定治疗计划和治疗方法时,一定要尽力保护或恢复骨的血液循环和骨的完整性。本发明对研究的骨折内固定可降解材料,可在术前根据骨折部位和类型行3d打印出符合骨折生物力学的可塑形材料固定骨折,在随着骨愈合到临床愈合材料的能表面和本体降解,保证了骨折局部的血流循环,克服和应用钛合金或金属内固定材料所为坚强的内固定带来的骨生物力学的改变,应力遮挡,甚至造成钢板螺钉松动、断裂,造成血循环障碍和再骨折等并发症。
69.临床应用分析:本发明内固定材料3d打印,临床适应症分析(见表2)。
70.表2:本发明骨折内固定3d打印临床适应症
表3:骨折内固定可吸收性材料钢板制作表规格(
㎝
)身长l(
㎜
)宽面b(
㎜
)身厚(
㎜
)6.671003.848.341254.86101505.8613.342007.8616.672508.88本发明骨折内固定对剪应力小的骨折选用生物材料制成的钢板、螺钉治疗骨折,大大减少了治疗成本费用,减少病人行第二次手术的痛苦。减少因应力遮挡及固定后出现的原骨折及各种副作用。本发明生物材料钢板、螺钉对人体无毒副作用,能生物降解,骨相容性好,能促进骨折愈合优点。
71.材料在骨折内固定术前3d打印临床适应症分析,该产品适应于人体骨折剪应力小的骨折,能有效替代部分以往的骨水泥及各种金属钢板、螺钉和金属固定棒材料的临床应用。减少患者治疗费用,减少因第二次手术的痛苦、减少因金属钢板、螺钉坚强的内固定并发再骨折及各种并发症的发生。
72.表4: 骨折内固定可降解螺钉规格设计表注:可降解螺钉的制作是根据骨折的部位、类形和植入骨折部位骨折的厚度制作的,一般临床应用于肱骨内外髁骨折、手指骨骨折、桡骨小头骨折、胫骨平台骨折、双踝骨折、距骨骨折、跖骨骨折,足趾骨骨折。
73.本发明骨折内固定可降解材料对剪应力小的骨折选用生物材料制成的钢板、螺钉治疗骨折,大大减少了治疗成本费用,减少病人行第二次手术的痛苦。减少因应力遮挡及固定后出现的原骨折及各种副作用。本发明生物材料钢板、螺钉对人体无毒副作用,能生物降解,骨相容性好,能促进骨折愈合优点。
74.材料在骨折内固定术前3d打印临床适应症分析,该产品适应于人体骨折剪应力小的骨折,能有效替代部分以往的骨水泥及各种金属钢板、螺钉和金属固定棒材料的临床应用。减少患者治疗费用,减少因金属钢板、螺钉坚强的内固定并发再骨折及各种并发症的发生。
75.本发明骨折内固定材料3d打印人工骨对用于的内固定材料在设计的长度和厚度及刚度可大于不锈钢的制作要求。因为可降解内固定材料除了具有一定的刚度(硬度)外,材料本身具有一定的弹性、柔韧性,并能克服因不锈钢坚强的内固定和应力遮挡所造成的钢板断裂、骨愈合延迟及非炎症性反应等并发症。而本发明骨折内固定可降解材料。适应于骨科生物力学的应力要求,而且不需二次手术,骨折达到临床愈合期(三个月满)后,材料可变成co2和h2o,通过人体代谢排出体外。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1