胸腺素α1在制备预防和/或治疗中枢神经可塑性功能障碍的药物中的应用
胸腺素
α
1在制备预防和/或治疗中枢神经可塑性功能障碍的药物中的应用
技术领域
1.本发明属于医药技术领域。更具体地,涉及胸腺素α1在制备预防和/或治疗中枢神经可塑性功能障碍的药物中的应用。
背景技术:
2.神经可塑性(neuro-plasticity),是指通过重复性的经验改变大脑的结构,以适应环境变化的能力。目前,各种精神类疾病,如老年痴呆、抑郁症、帕金森等均表现有神经可塑性功能障碍,如神经递质水平下降、神经炎症异常、神经可塑性相关因子表达异常、神经细胞凋亡相关因子表达异常等,对患者的工作和生活均造成了极大的影响。
3.胸腺素α1(thymosinα1,简称:tα1)是最早从tf5组分中纯化得到均一状态的一个活性多肽,由28个氨基酸组成,n端被乙酰化,等电点为ph4.2,不含甲硫氨酸、半胱氨酸和芳香氨基酸。tα1作为一种免疫活性肽,广泛分布于哺乳动物的各个组织器官,可提高细胞免疫功能,如激活淋巴巨噬细胞、增强机体细胞及体液免疫保护,临床药品名为日达仙,已广泛用于各种肝炎类治疗,是一种有效、无毒副作用的免疫增强剂,基于其如此优异的免疫增强效果,tα1的新应用逐渐成为学者们的研发热点,如现有技术将tα1应用于制备糖尿病药物,以及用于制备预防和治疗变态反应的药物,但目前尚未有tα1在改善中枢神经可塑性功能障碍方面的相关研究。
技术实现要素:
4.本发明针对现有技术的不足,提供胸腺素α1在制备预防和/或治疗中枢神经可塑性功能障碍的药物中的应用,为预防和/或治疗中枢神经可塑性功能障碍的药物提供一种新的原料选择。
5.本发明的第一目的是提供胸腺素α1在制备预防和/或治疗中枢神经可塑性功能障碍的药物中的应用。
6.本发明的第二目的是提供提供一种预防和/或治疗中枢神经可塑性功能障碍的药物。
7.本发明上述目的通过以下技术方案实现:
8.本发明使用慢性不可预见性动物应激模型(cums)诱导c57小鼠中枢神经可塑性功能障碍的最后3周每天上午腹腔注射给药一次,向小鼠进行腹腔注射给药胸腺素α1,发现胸腺素α1能有效抑制神经递质(ne、da、5-ht)水平的下降及其代谢异常,能通过改善海马促炎因子(ifn-γ)和海马抗炎因子(il-4)的表达异常以改善神经炎症的异常,还能改善神经可塑性相关因子(psd95、dcx、p-erk)和神经细胞凋亡相关因子(bax、bcl-2)的表达异常,从而有效预防和/或治疗中枢神经可塑性功能障碍,因此,本发明提供了胸腺素α1在制备预防和/或治疗中枢神经可塑性功能障碍的药物中的应用。
9.优选地,所述中枢神经可塑性功能障碍包括神经递质水平下降、神经炎症异常、神
经可塑性相关因子表达异常、神经细胞凋亡相关因子表达异常中的一种或几种。
10.进一步优选地,所述神经递质包括ne、da、5-ht中的一种或几种。
11.进一步优选地,所述神经炎症异常包括海马促炎因子和/或海马抗炎因子的表达异常。
12.更优选地,所述海马促炎因子包括ifn-γ。
13.更优选地,所述海马抗炎因子包括il-4。
14.进一步优选地,所述神经可塑性相关因子包括psd95、dcx、p-erk中的一种或几种。
15.进一步优选地,所述神经细胞凋亡相关因子包括bax、bcl-2中的一种或几种。
16.胸腺素α1能有效抑制神经递质(ne、da、5-ht)水平的下降及其代谢异常,能通过改善海马促炎因子(ifn-γ)和海马抗炎因子(il-4)的表达异常以改善神经炎症的异常,还能改善神经可塑性相关因子(psd95、dcx、p-erk)和神经细胞凋亡相关因子(bax、bcl-2)的表达异常,从而有效预防和/或治疗中枢神经可塑性功能障碍,因此,一种以胸腺素α1为活性成分的、预防和/或治疗中枢神经可塑性功能障碍的药物应当在本发明的保护范围之内,该药物还包括药学上可接受的载体或赋形剂,制成不同的剂型,如注射剂、口服液、散剂、片剂、颗粒剂、胶囊剂、糖浆剂、粉针剂、水针剂、汤剂、酒剂、缓控释制剂、肠溶剂或混悬剂等。
17.本发明具有以下有益效果:
18.本发明提供了胸腺素α1在制备预防和/或治疗中枢神经可塑性功能障碍的药物中的应用。所述胸腺素α1能有效抑制神经递质(ne、da、5-ht)水平的下降及其代谢异常,能通过改善海马促炎因子(ifn-γ)和海马抗炎因子(il-4)的表达异常以改善神经炎症的异常,还能改善神经可塑性相关因子(psd95、dcx、p-erk)和神经细胞凋亡相关因子(bax、bcl-2)的表达异常,从而有效预防和/或治疗中枢神经可塑性功能障碍。
附图说明
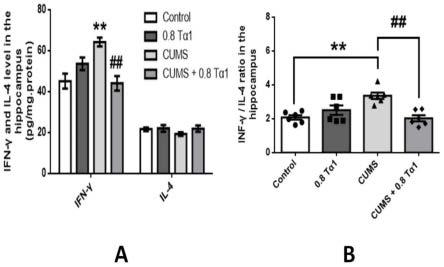
19.图1a为四组小鼠海马促炎因子ifn-γ、海马抗炎因子il-4的表达情况;图1b为小鼠海马促炎因子ifn-γ表达量与海马抗炎因子il-4表达量的比值(ifn-γ/il-4)统计情况。(
**
p《0.01vs.control;
##
p《0.01vs.cums)
20.图2a为四组小鼠神经可塑性相关因子psd95的表达情况,图2b为四组小鼠神经可塑性相关因子dcx的表达情况,图2c为四组小鼠神经可塑性相关因子p-erk的表达情况,图2d为蛋白印迹实验结果。(
*
p《0.05,
**
p《0.01,
^
p《0.05vs.control;
#
p《0.05,
##
p《0.01vs.cums)
21.图3a为四组小鼠海马抗凋亡因子bcl-2的表达情况,图3b为四组小鼠海马促凋亡因子bax的表达情况,图3c为四组bcl-2含量与bax含量的比值(bcl-2/bax)统计情况。(p《0.01vs.control;
#
p《0.05,
##
p《0.01vs.cums)
具体实施方式
22.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
23.除非特别说明,以下实施例所用试剂和材料均为市购。
24.一、实验动物
25.性成熟的c57小鼠,购自长沙市天勤生物技术有限公司。饲养环境:每个笼子(30*19*16cm)饲养12只小鼠、温度:23
±
1℃、湿度:50
±
10%、12h光照-黑暗循环的标准实验动物房、充足水源和饲料。
26.二、实验分组
27.将c57小鼠分为4组(control组、0.8tα1组、cums组、cums+0.8tα1组),每组10只,分别按照表1方式进行处理。
28.表1
[0029][0030]
其中,应激为:使用慢性不可预见性动物应激模型(cums)诱导c57小鼠中枢神经可塑性功能障碍,以下应激源随机独立操作,保证在一周内不重复,以免动物产生适应性,每天独立操作2个应激源,持续应激11周;
[0031]
应激源为:禁水12h,禁食12h,垫料异味处理,100r/min的摇床3h,50ml离心管束缚1h,4℃低温环境1h,倾斜笼子过夜(12h),闪光灯照射过夜,每隔3h开关灯切换持续24h,昼夜通亮灯光照射24h,拥挤环境6h(10只小鼠同时放进一个直径10cm,高20cm的圆柱型利器盒中),15℃冷水游泳10min,湿垫料过夜,单笼孤独过夜;
[0032]
生理盐水、0.8mg/kg tα1均于应激最后3周每天上午腹腔注射给药一次。
[0033]
三、数据处理
[0034]
用spss 19.0进行数据处理,结果用平均值
±
标准误表示,采用two-way方差分析,lsd分析比较各组的区别。统计图由graphpad prism 6所制。p《0.05为差异显著。
[0035]
实施例1胸腺素α1能有效抑制神经递质水平的下降
[0036]
一、实验方法
[0037]
(1)溶液的配制:
[0038]
组织裂解液:将高氯酸、乙二胺四乙酸二钠、l-半胱氨酸加入水中,使高氯酸的终浓度为0.6mol/l,乙二胺四乙酸二钠的终浓度为0.5mmol/l,l-半胱氨酸的终浓度为0.1g/l,混匀即得到所述组织裂解液。
[0039]
高氯酸沉淀剂:将磷酸氢二钾、乙二胺四乙酸二钠加入水中,使磷酸氢二钾的终浓度为1.2mol/l,乙二胺四乙酸二钠的终浓度为2mmol/l,混匀即得到所述高氯酸沉淀剂。
[0040]
柠檬酸-乙酸钠缓冲液:将柠檬酸、乙酸钠、1-庚烷磺酸钠、三乙胺、乙二胺四乙酸二钠加入水中,使柠檬酸的终浓度为50mmol/l,乙酸钠的终浓度为50mmol/l,1-庚烷磺酸钠
的终浓度为0.5mmol/l,三乙胺的终浓度为5mmol/l,乙二胺四乙酸二钠的终浓度为0.5mmol/l,混匀即得到所述柠檬酸-乙酸钠缓冲液。
[0041]
(2)神经递质的提取和测定:
[0042]
将四组小鼠分别处死,取出大脑,并于冰上快速剥离出海马组织于液氮中速冻,-80℃保存备用。取10mg海马组织,置于1.5ml离心管中,加入150μl组织裂解液,充分匀浆,冷冻离心15min(14000r/min、4℃)后,取上清液再离心一次。离心后的液体加入等体积的高氯酸沉淀剂,0℃冰浴10min后冷冻离心15min(14000r/min、4℃),用0.45μm滤膜过滤,滤液进样高效液相色谱仪(hplc),上机对脑组织中的单胺类神经递质进行定性和定量。
[0043]
其中,测定的脑组织单胺类神经递质种类有:去甲肾上腺素(ne)、多巴胺(dopamine,da)、3-甲氧-4羟苯乙二醇(3-methoxy-4-hydroxyphenylglycol,mhpg)、5-羟色胺(5-ht)、5-羟基吲哚乙酸(5-hiaa)、高香草酸(hva);
[0044]
色谱分析条件为:色谱柱为waters c18柱(150mm
×
4.6mm,5μm);流动相为柠檬酸-乙酸钠缓冲液:甲醇(87:13,v/v);流速为1.0ml/min;进样量为20μl;发射波长为330nm,激发波长为280nm;
[0045]
定性和定量方法为:按单胺类神经递质标准品的保留时间定性待测样品的各个色谱峰,再通过已知标准品浓度、已知标准品峰面积、待测样品峰面积进行定量样品的神经递质含量,并计算5-ht含量与其代谢产物5-hiaa含量的比值(5-ht/5-hiaa)、ne含量与其代谢产物mhpg含量的比值(ne/mhpg)、da含量与其代谢产物hva含量的比值(da/hva)。
[0046]
二、实验结果
[0047]
结果如表2所示,cums组(只应激、注射生理盐水)的小鼠脑组织单胺类神经递质da、5-ht的水平及5-ht/5-hiaa、ne/mhpg、da/hva相较于control组(无应激、注射生理盐水)均显著下降。
[0048]
而与cums组相比,注射了tα1的cums+0.8tα1组da、5-ht水平及5-ht/5-hiaa、ne/mhpg、da/hva均更接近于control组,表明胸腺素α1能有效抑制神经递质水平的下降,从而有效预防和/或治疗中枢神经可塑性功能障碍。
[0049]
表2
[0050][0051]
其中,
*
p《0.05,
**
p《0.01vs.control,
#
p《0.05,
##
p《0.01vs.cums。
[0052]
实施例2胸腺素α1能有效改善神经炎症的异常
[0053]
一、实验方法
[0054]
将四组小鼠分别处死,取出大脑,并于冰上快速剥离出海马组织于液氮中速冻,-80℃保存备用,取20mg海马组织,加入200μl蛋白裂解液,12000r/min转速离心15分钟后,取上清,利用蛋白定量试剂盒测定上清液蛋白浓度,-80℃保存备用。按照elisa试剂盒说明书取相应量海马上清液进行测试,测定海马促炎因子ifn-γ、海马抗炎因子il-4的表达情况。
[0055]
二、实验结果
[0056]
结果如图1所示,其中,图1a为四组小鼠海马促炎因子ifn-γ、海马抗炎因子il-4的表达情况,图1b为小鼠海马促炎因子ifn-γ表达量与海马抗炎因子il-4表达量的比值(ifn-γ/il-4)统计情况。
[0057]
可见,cums组(只应激、注射生理盐水)的小鼠海马促炎因子ifn-γ,以及ifn-γ/il-4的表达水平相较于control组(无应激、注射生理盐水)均显著提升,海马抗炎因子il-4相较于control组有所降低。
[0058]
而与cums组相比,注射了tα1的cums+0.8tα1组海马促炎因子ifn-γ、海马抗炎因子il-4、以及ifn-γ/il-4均更接近于control组,表明胸腺素α1能通过有效抑制海马促炎因子ifn-γ的表达、且促进海马抗炎因子il-4的表达,以改善海马促炎因子和海马抗炎因子的表达异常,改善cums诱导的中枢促炎/抗炎因子的失衡,进一步改善神经炎症的异常,从而有效预防和/或治疗中枢神经可塑性功能障碍。
[0059]
实施例3胸腺素α1能有效改善神经可塑性相关因子的表达异常
[0060]
一、实验方法
[0061]
1、蛋白的提取
[0062]
将四组小鼠分别处死,取出大脑,并于冰上快速剥离出海马组织于液氮中速冻,-80℃保存备用。取20mg海马组织,加入200μl蛋白裂解液,12000r/min转速离心15分钟后,取上清,利用蛋白定量试剂盒测定上清液蛋白浓度,-80℃保存备用。
[0063]
2、蛋白印迹(wb)实验
[0064]
(1)上样蛋白量:30μg;
[0065]
(2)sds-page胶配制:根据蛋白的分子量大小,选择10%浓度的分离胶;
[0066]
(3)sds-page电泳:将30μg蛋白样品依次加入到上样孔中,浓缩胶:恒压60v,30min;分离胶:恒压100v,60min(根据溴酚蓝位置调整电泳时间);
[0067]
(4)转膜:将分离胶、pvdf膜、滤纸、转膜架浸入1
×
sds转膜缓冲液中,按照黑色筛板-海绵-滤纸-凝胶-pvdf膜-滤纸-海绵-白色筛板的顺序叠好后装入电转槽中,加入预冷的1
×
sds转膜缓冲液,连接电源,恒流250ma转膜2h;
[0068]
(5)蛋白封闭:转膜结束后将膜放入封闭液,25℃摇床上缓慢封闭1h;
[0069]
(6)一抗二抗孵育:封闭结束,加入一抗(psd95,dcx,p-erk,actin,均购自santa公司),4℃过夜,tbst清洗pvdf膜3次,每次15min,加入二抗(鼠抗),25℃摇床孵育2h,tbst洗膜3次,每次15min;
[0070]
(7)曝光:配制超敏ecl化学发光试剂,将pvdf膜放入化学发光成像系统进行曝光,image j软件分析条带光密度值。
[0071]
二、实验结果
[0072]
结果如图2所示,其中,图2a为四组小鼠神经可塑性相关因子psd95的表达情况,图2b为四组小鼠神经可塑性相关因子dcx的表达情况,图2c为四组小鼠神经可塑性相关因子p-erk的表达情况,图2d为蛋白印迹实验结果。
[0073]
可见,cums组(只应激、注射生理盐水)的小鼠神经可塑性相关因子psd95、dcx、p-erk相较于control组(无应激、注射生理盐水)均显著降低。
[0074]
而与cums组相比,注射了tα1的cums+0.8tα1组小鼠神经可塑性相关因子psd95、dcx、p-erk均更接近于control组,表明胸腺素α1能有效提升神经可塑性相关因子的表达水平,从而有效预防和/或治疗中枢神经可塑性功能障碍。
[0075]
实施例4胸腺素α1能有效改善神经细胞凋亡相关因子的表达异常
[0076]
一、实验方法
[0077]
将四组小鼠分别处死,取出大脑,并于冰上快速剥离出海马组织于液氮中速冻,-80℃保存备用。取20mg海马组织,加入200μl蛋白裂解液,12000r/min转速离心15分钟后,取上清,利用蛋白定量试剂盒测定上清液蛋白浓度,-80℃保存备用。取海马上清液按照elisa试剂盒说明书进行测试,测定神经细胞凋亡相关因子bax、bcl-2的表达情况。
[0078]
二、实验结果
[0079]
结果如图3所示,其中,图3a为四组小鼠海马抗凋亡因子bcl-2的表达情况,图3b为四组小鼠海马促凋亡因子bax的表达情况,图3c为四组bcl-2含量与bax含量的比值(bcl-2/bax)统计情况。
[0080]
可见,cums组(只应激、注射生理盐水)的小鼠海马促凋亡因子bax的表达水平相较于control组(无应激、注射生理盐水)显著升高,抗凋亡因子bcl-2的表达水平、以及bcl-2/bax相较于control组均显著降低。
[0081]
而与cums组相比,注射了tα1的cums+0.8tα1组小鼠海马抗凋亡因子bcl-2、海马促凋亡因子bax、bcl-2/bax均更接近于control组,表明胸腺素α1能有效促进抗凋亡因子bcl-2的表达,抑制促凋亡因子bax的表达,以改善神经细胞凋亡相关因子的表达异常,从而有效预防和/或治疗中枢神经可塑性功能障碍。
[0082]
综上,本发明使用慢性不可预见性动物应激模型(cums)诱导c57小鼠中枢神经可塑性功能障碍的最后3周每天上午腹腔注射给药一次,向小鼠进行腹腔注射给药胸腺素α1,发现胸腺素α1能有效抑制神经递质(ne、da、5-ht)水平的下降及其代谢异常,能通过改善海马促炎因子(ifn-γ)和海马抗炎因子(il-4)的表达异常以改善神经炎症的异常,还能改善神经可塑性相关因子(psd95、dcx、p-erk)和神经细胞凋亡相关因子(bax、bcl-2)的表达异常,从而有效预防和/或治疗中枢神经可塑性功能障碍,
[0083]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1