甘草黄酮类化合物在制备预防和/或治疗哮喘炎症的药物中的应用的制作方法
1.本技术涉及生物医学领域,尤其涉及甘草黄酮类化合物在制备预防和/或治疗哮喘炎症的药物中的应用。
背景技术:
2.哮喘是由多种细胞(如嗜酸性粒细胞、肥大细胞、t淋巴细胞、中性粒细胞、气道上皮细胞等)和细胞组分参与的气道慢性炎症为特征的异质性疾病,这种慢性炎症与气道高反应性相关,通常出现广泛而多变的可逆性呼气气流受限,导致反复发作的喘息、气促、胸闷、咳嗽等症状,随病程的延长可产生气道不可逆性缩窄和气道重塑,严重影响人们的身心健康和生活质量。
技术实现要素:
3.有鉴于此,本技术提供了甘草黄酮类化合物在制备预防和/或治疗哮喘炎症的药物中的应用,甘草黄酮类化合物细胞毒性小,能够有效抑制哮喘炎症,在预防或治疗哮喘炎症方面具有广泛的应用前景。
4.本技术提供了甘草黄酮类化合物在制备预防和/或治疗哮喘炎症的药物中的应用,所述甘草黄酮类化合物包括甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷中的至少一种。
5.可选的,所述甘草黄酮类化合物抑制肺成纤维细胞中炎症因子的释放。
6.进一步的,所述甘草黄酮类化合物抑制所述肺成纤维细胞中嗜酸性粒细胞趋化因子1的产生。
7.再进一步的,所述甘草黄酮类化合物抑制所述嗜酸性粒细胞趋化因子1产生的ic50值为0.35μg/ml-9.6μg/ml。
8.可选的,所述甘草黄酮类化合物抑制th2免疫细胞炎症因子的产生。
9.可选的,所述甘草黄酮类化合物的制备方法包括:将甘草原料进行粉碎,得到甘草粉;所述甘草粉用乙醇提取后,得到乙醇提取物;所述乙醇提取物经分离纯化后得到所述甘草黄酮类化合物。
10.可选的,所述甘草黄酮类化合物作为单一活性成分或与其他药学上可接受的活性成分构成所述预防和/或治疗哮喘炎症的药物;所述其他药学上可接受的活性成分包括扎鲁司特、孟鲁司特钠和普仑司特中的至少一种。
11.可选的,所述预防和/或治疗哮喘炎症的药物还包括药学上可接受的载体和/或辅料,所述载体包括溶剂、聚合物和脂质体中的一种或多种,所述辅料包括稀释剂和稳定剂中的一种或多种。
12.可选的,所述预防和/或治疗哮喘炎症的药物的形式包括片剂、胶囊、粉剂、颗粒剂、丸剂、糖浆剂、溶液剂和混悬剂中的一种或多种。
13.可选的,所述预防和/或治疗哮喘炎症的药物通过口服或注射的方式施用。
14.本技术提供了甘草黄酮类化合物在制备预防和/或治疗哮喘炎症的药物中的应用,甘草黄酮类化合物包括甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷中的至少一种,该甘草黄酮类化合物能够有效改善哮喘炎症,并且细胞毒性小,可以用于药物中,有利于哮喘炎症的预防、治疗等,改善哮喘患者的生活质量。
附图说明
15.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
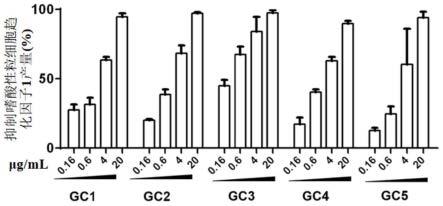
16.图1为甘草黄酮类化合物对嗜酸性粒细胞趋化因子1的抑制效果图。
17.图2为gc3处理不同时间对嗜酸性粒细胞趋化因子1的抑制效果图。
18.图3为不同浓度的gc3对嗜酸性粒细胞趋化因子1的抑制效果图。
19.图4为不同浓度的gc3对细胞活性的影响的结果图。
20.图5为不同浓度的gc3对il-4含量的影响的结果图。
21.图6为不同浓度的gc3对il-5含量的影响的结果图。
22.图7为gc3对细胞增殖能力的影响的结果图。
23.图8为gc3对细胞活性的影响的结果图。
具体实施方式
24.下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
25.本技术提供了甘草黄酮类化合物在制备预防和/或治疗哮喘炎症的药物中的应用,甘草黄酮类化合物包括甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷中的至少一种。在本技术中,甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷均具有优异的抑制哮喘炎症反应的作用,并且不具有细胞毒性,可以用于药物中,作为预防和/或治疗哮喘炎症的活性成分,起到预防和/或治疗哮喘炎症的作用,从而改善哮喘患者的哮喘炎症,提升哮喘患者的生活质量。
26.在本技术中,甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷的化学结构式如下所示:
[0027][0028]
在本技术中,可以将甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素或新异甘草苷中用于预防和/或治疗哮喘炎症的药物中,可以将甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷中的任意两种用于预防和/或治疗哮喘炎症的药物中,可以将甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷中的任意三种用于预防和/或治疗哮喘炎症的药物中,也可以将甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷中的任意四种用于预防和/或治疗哮喘炎症的药物中,还可以将甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷全部用于预防和/或治疗哮喘炎症的药物中。当甘草黄酮类化合物中包括两种或两种以上的活性成分时,多种活性成分之间的质量比可以根据需要进行选择,对此不作限定。
[0029]
在本技术实施方式中,甘草黄酮类化合物抑制肺成纤维细胞中炎症因子的释放。也就是说,甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素、新异甘草苷均能够抑制肺成纤维细胞中炎症因子的释放,从而有效抑制哮喘炎症。
[0030]
在本技术实施方式中,甘草黄酮类化合物抑制肺成纤维细胞中嗜酸性粒细胞趋化因子1的产生。嗜酸性粒细胞是最主要的炎性细胞,嗜酸性粒细胞趋化因子1(eotaxin-1)能够调控嗜酸性粒细胞的聚集、活化、黏附和脱颗粒,以及诱导嗜酸性粒细胞的趋化性的作用,是哮喘发生过程中重要的炎性因子。本技术提供的甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素、新异甘草苷均能够抑制肺成纤维细胞中嗜酸性粒细胞趋化因子1的产生,抑制炎症反应,从而达到抑制哮喘炎症的作用。在本技术一实施例中,甘草黄酮类化合物抑制嗜酸性粒细胞趋化因子1产生的ic50值为0.35μg/ml-9.6μg/ml。本技术提供的甘草黄酮类化合物抑制嗜酸性粒细胞趋化因子1产生的ic50值低,可以在较低浓度下即可产生显著的抑制作用,同时不会产生细胞毒性,更有利于甘草黄酮类化合物在预防和/或治疗哮喘炎症的药物中的使用。在一实施例中,甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素、新异甘草苷抑制嗜酸性粒细胞趋化因子1产生的ic50值分别为9.6μg/ml、2.3μg/ml、0.35μg/ml、4.2μg/ml和4.2μg/ml。
[0031]
在本技术实施方式中,甘草黄酮类化合物抑制th2免疫细胞炎症因子的产生。也就是说,甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素、新异甘草苷均能够抑制th2免疫细胞炎症因子的产生,从而有效抑制哮喘炎症。具体的,th2免疫细胞炎症因子可以但不限于为il-4、il-5等。
[0032]
在本技术实施方式中,甘草黄酮类化合物作为单一活性成分或与其他药学上可接受的活性成分构成预防和/或治疗哮喘炎症的药物。在本技术一实施例中,甘草黄酮类化合物作为预防和/或治疗哮喘炎症的药物的唯一活性成分,如此,该预防和/或治疗哮喘炎症
的药物通过甘草黄酮类化合物的作用达到抑制哮喘炎症的效果。在本技术另一实施例中,甘草黄酮类化合物与其他药学上可接受的活性成分构成预防和/或治疗哮喘炎症的药物,如此,通过甘草黄酮类化合物与其他药学上可接受的活性成分共同作用,达到抑制哮喘炎症的效果。进一步的,其他药学上可接受的活性成分包括扎鲁司特、孟鲁司特钠和普仑司特中的至少一种。采用上述其他药学上可接受的活性成分可以达到进一步抑制哮喘炎症的作用,从而提高预防和/或治疗哮喘炎症的药物的药效。在本技术又一实施例中,当甘草黄酮类化合物与其他药学上可接受的活性成分构成预防和/或治疗哮喘炎症的药物时,甘草黄酮类化合物的含量大于其他药学上可接受的活性成分的含量;如此,甘草黄酮类化合物作为预防和/或治疗哮喘炎症的药物的主要活性成分。
[0033]
在本技术实施方式中,预防和/或治疗哮喘炎症的药物还包括药学上可接受的载体和/或辅料。在本技术中,“药学上可接受的载体和/或辅料”用于运输、稳定、稀释本技术中的甘草黄酮类化合物,使甘草黄酮类化合物发挥应有的作用,载体、辅料必须和甘草黄酮类化合物兼容并且不影响甘草黄酮类化合物的活性,同时载体、辅料本身是相对无毒的,且不与甘草黄酮类化合物发生反应引起毒副作用。在本技术一实施例中,载体包括溶剂、聚合物和脂质体中的一种或多种。具体的,溶剂可以但不限于包括水、生理盐水,以及其他非水性溶剂;聚合物可以但不限于包括聚赖氨酸、聚乙烯亚胺及其改性物、聚酰胺-胺型树枝状高分子及其衍生物、聚丙烯亚胺及其衍生物、壳聚糖、聚乳酸-羟基乙酸、聚乳酸、明胶、环糊精、海藻酸钠、白蛋白和血红蛋白中的一种或多种;脂质体可以但不限于通过阳离子类脂、中性辅助类脂、胆固醇、磷脂自组装而成,也可以通过二硬脂酰基磷脂酰乙醇胺-聚乙二醇穿插于磷脂分子形成的磷脂层中形成。在本技术中,甘草黄酮类化合物可以分散或吸附在上述载体中形成分散体系,也可以被上述脂质体、聚合物包封形成球状结构,预防和/或治疗哮喘炎症的药物可以进行缓释、控释或靶向释放,让其发挥最佳的效能,还能够提高预防和/或治疗哮喘炎症的药物的稳定性,并会减少药物刺激。在本技术一实施例中,辅料包括稀释剂和稳定剂中的一种或多种。具体的,稀释剂可以但不限于包括淀粉类、糖类、纤维素类和无机盐中的一种或多种,例如片剂中的黏合剂、填充剂、崩解剂、润滑剂,丸剂中的酒、醋、药汁等,半固体制剂软膏剂、霜剂中的基质部分等;所述稳定剂可以但不限于为防腐剂、抗氧剂、助溶剂、乳化剂等。
[0034]
在本技术实施方式中,预防和/或治疗哮喘炎症的药物的形式包括片剂、胶囊、粉剂、颗粒剂、丸剂、糖浆剂、溶液剂和混悬剂中的一种或多种。具体的药物的形式取决于在实际中的应用需要。
[0035]
在本技术实施方式中,预防和/或治疗哮喘炎症的药物通过口服或注射的方式施用。当口服给药时,预防和/或治疗哮喘炎症的药物的剂型可以为固体,也可以为液体。在一实施例中,注射可以但不限于通过腹膜内注射、皮下注射、肌肉注射或静脉注射的方式施用。
[0036]
在本技术实施方式中,甘草黄酮类化合物的制备方法包括:将甘草原料进行粉碎,得到甘草粉;甘草粉用乙醇提取后,得到乙醇提取物;乙醇提取物经分离纯化后得到甘草黄酮类化合物。在本技术中,甘草原料进行粉碎更有利于在提取过程中甘草黄酮类化合物的提取。具体的,可以但不限于通过锤式粉碎机进行粉碎。在一实施例中,乙醇的浓度可以但不限于为85%-95%。在一具体实施例中,采用95%的乙醇进行提取,甘草黄酮类化合物的
提取率更高,有利于甘草黄酮类化合物后续的分离、纯化。在一实施例中,乙醇提取物可以通过大孔吸附树脂、硅胶层析柱以及制备高效液相色谱进行分离纯化,得到甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷中的至少一种。其中,通过大孔吸附树脂进行初步分离,硅胶层析柱进行再次分离纯化,通过制备高效液相色谱获得最终的物质。进一步的,在硅胶层析柱进行分离纯化的过程中,可以选择梯度浓度的氯仿、甲醇和水形成的溶剂进行洗脱,从而获得甘草黄酮类化合物。具体的,可以但不限于选择氯仿和甲醇的体积比为(90-95):(5-10)(如95:5、92:8、91:9、90:10等),此时通过硅胶层析柱可以获得含有甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷的甘草黄酮类化合物。进一步的,通过制备高效液相色谱可以获得含甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素或新异甘草苷单一活性成分的甘草黄酮类化合物。再进一步的,经过制备高效液相色谱后再经过硅胶层析柱进行精制,进一步提高纯度。
[0037]
本技术提供的甘草黄酮类化合物可以从甘草中醇提获得,乙醇毒性较小可以回收利用,降低生产成本,并且整个制备过程操作简单、安全,并且甘草黄酮类化合物的提取率高。可以理解的,还可以通过化学合成的方法获得上述甘草黄酮类化合物。相比于化学合成法,通过从甘草原料中获得的甘草黄酮类化合物更加方便且安全可靠,该方法获得的甘草黄酮类化合物可以作为天然活性成分用于预防和/或治疗哮喘炎症的药物中,提高药物的安全性,降低药物的副作用。
[0038]
下面通过具体的实施例对本技术进行进一步的说明。
[0039]
将甘草原料进行粉碎,得到甘草粉;甘草粉用95%乙醇提取,得到乙醇提取物;将乙醇提取物上hp-20大孔树脂柱(1000mm
×
90mm i.d.),分别用70%甲醇和90%甲醇洗脱。取90%甲醇洗脱液上silica柱层析(205mm
×
60mm i.d.),依次用氯仿、氯仿-甲醇(体积比95:5)、氯仿-甲醇(体积比9:1)、氯仿-甲醇-水(体积比6:4:1)洗脱,氯仿-甲醇(体积比95:5)洗脱液继续上silica柱层析(290mm
×
32mm),用氯仿-甲醇(体积比95:5)分离,得到溶出部位。溶出部位通过制备高效液相色谱仪进行分离纯化,其中,高效液相色谱仪(jasc0 pu-2086,jasco ri-2031,jasco uv-2075)的色谱柱为waters xbridge c18 ods柱,流动相为70%甲醇-0.06%tfa,流速5ml/min,得到甘草苷(gc1)、甘草素(gc2)、7,4
’‑
二羟基黄酮(gc3)、美迪紫檀素(gc4)和新异甘草苷(gc5),上述物质经过silica柱层析精制即可。
[0040]
将人肺成纤维细胞hlf-1培养在含10%胎牛血清的f-12培养基培养,获得哮喘细胞模型。在细胞密度达到90%-100%时,向每组实验组的培养基中加入不同浓度(0.16μg/ml-20μg/ml)的甘草苷(gc1)、甘草素(gc2)、7,4
’‑
二羟基黄酮(gc3)、美迪紫檀素(gc4)或新异甘草苷(gc5),每组实验组做三次平行实验,在培养72h后取上清检测嗜酸性粒细胞趋化因子1的产量,获得实验组抑制嗜酸性粒细胞趋化因子1产量的效果,结果如图1所示。可以看出,在浓度为0.16μg/ml-20μg/ml中,五种甘草黄酮类化合物均能够有效抑制嗜酸性粒细胞趋化因子1的产生,并且浓度越大,抑制效果越明显,五种甘草黄酮类化合物抑制嗜酸性粒细胞趋化因子1产生的ic50值为0.35μg/ml-9.6μg/ml。
[0041]
以下以7,4
’‑
二羟基黄酮(gc3)的实验结果为例进行说明。
[0042]
将人肺成纤维细胞hlf-1培养在含10%胎牛血清的f-12培养基培养,获得哮喘细胞模型。在细胞密度达到90%-100%时,向实验组培养基中加入10μm的gc3,溶剂对照组不加入gc3,在培养24h、48h、72h、96h以及120h后取上清检测嗜酸性粒细胞趋化因子1的产量,
结果如图2所示。可以看出,gc3处理72h后可以显著抑制嗜酸性粒细胞趋化因子1的产生,且一直到120h仍然具有抑制作用,与溶剂对照组相比,实验组在72h的抑制率为58
±
7%、在96h的抑制率为52
±
9%、在120h的抑制率为76
±
3%。由于哮喘模型中存在剧烈的炎症反应,进一步在体外验证了甘草黄酮类化合物对炎症因子il4/tnfα诱导的肺成纤维细胞hlf-1中嗜酸性粒细胞趋化因子1表达的影响。将上述哮喘细胞模型的细胞密度达到90%-100%时,向每组加入不同浓度(0-10μm)的gc3,在培养72h后取上清检测嗜酸性粒细胞趋化因子1的产量并采用噻唑蓝(mtt)染色法检测细胞活性,结果如图3和图4所示。可以看出,gc3对炎症因子il-4/tnf-α诱导的肺成纤维细胞hlf-1中嗜酸性粒细胞趋化因子1表达有显著的抑制作用,并存在浓度依赖性,同时gc3没有产生明显的细胞毒性,对细胞友好。th2型淋巴细胞d10在含有10%大鼠生长因子和100μg/ml的伴清蛋白(ca)的rpmi和ehaa培养基中培养。经辐射处理的akr小鼠脾细胞作为抗原呈递细胞(apc),与d10细胞以5:1的比例共培养在含有50μg/ml ca的rpmi和ehaa的培养基中,向每组加入不同浓度(0-20μm)的gc3,溶剂对照组不加入gc3,每组实验组做三次平行实验,在培养72h后取上清检测il-4和il-5的含量,结果如图5和图6所示。可以看出,gc3的加入可以抑制th2型淋巴细胞中炎症因子的产生,并且存在浓度依赖性,gc3的浓度为20μm时抑制能力最强;添加20μm gc3对il-4和il-5的抑制效果分别是不加gc3时的3倍和8倍左右。同时,采用mtt染色和台盼蓝染色方法检测细胞增殖能力和细胞活性,结果如图7和图8所示。可以看出,gc3的加入可以显著降低细胞增殖水平但不影响细胞活性。因此,gc3对哮喘炎症反应有显著的抑制作用。
[0043]
甘草苷、甘草素、美迪紫檀素、新异甘草苷分别经过上述相同的实验可以得到与gc3相同的实验结论;同时,将甘草的乙醇提取物进行硅胶柱层析后,得到包括了甘草苷、甘草素、7,4
’‑
二羟基黄酮、美迪紫檀素和新异甘草苷的甘草黄酮类化合物,该甘草黄酮类化合物经过上述相同的实验可以得到与gc3相同的实验结论。因此,本技术提供的甘草黄酮类化合物的制备方法简单,操作方便,安全性高,提取率高,该甘草黄酮类化合物具有优异的抑制哮喘炎症的效果,细胞毒性小、无副作用,能够用于预防和/或治疗哮喘炎症的药物中,改善哮喘患者的生活质量。
[0044]
以上所述实施例仅表达了本技术的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本技术专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本技术构思的前提下,还可以做出若干变形和改进,这些都属于本技术的保护范围。因此,本技术专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1