一种乳酸菌口服液及其在缓解和治疗腹泻中的应用的制作方法
1.本发明涉及功能微生物应用技术领域,具体涉及一种乳酸菌口服液及其在缓解和治疗腹泻中的应用。
背景技术:
2.益生菌是指有益的细菌或真菌,其中乳酸细菌(lactic acid bacteria,lab)是最重要的益生菌,其中包括乳杆菌(latobacillus)、乳球菌(lactococcus)、链球菌(streptococcus)、肠球菌(enterococcus)和双歧杆菌(bifidobacterium)等。双歧杆菌和乳杆菌一直是公认的安全的益生菌,对机体健康没有致病性,具有一定的食用安全性。目前益生菌的分离和筛选主要来源于传统发酵食品、自然环境、动物和人体等,由于外源益生菌的生长环境与人体胃肠道的环境相差甚远,因而许多学者认为理想的益生菌最好来自于人体自身的胃肠道。高全新等研究发现,宿主和肠道菌群之间存在着特异性相互选择的关系,当菌株的来源和使用对象一致时,就会增强菌株对宿主益生功效的特异性和针对性。此外,he 等人发现人源益生菌相比外源益生菌,在耐胆汁、耐酸和耐胃液,胃肠道定植和黏附力,抑菌作用等方面的功能性更具优势。因此,相对于其它来源的益生菌,人源益生菌具有安全性高,不容易被人体肠道的免疫系统所排斥,具有遗传稳定性,因而更适合作为人类益生菌来使用。
3.大量的研究已证实,益生菌具有调节人体血清胆固醇水平、降血压、抗氧化、预防或治疗便秘等功能,还能有效调节人体免疫力、预防癌症和抑制肿瘤生长。马爽等人通过体外抗氧化效应的研究,筛选出一株植物乳杆菌菌的羟自由基的清除能力高于对照菌株鼠李糖乳杆菌lgg;陈路清等,筛选出9株受试菌株具有良好的耐酸、耐胆盐和细胞粘附特性,且5株菌降胆固醇均达到50%以上。santosa等通过动物实验发现双歧杆菌等,可降低腹泻及肠炎的发病率,抑制急性肠炎、轮状病毒引起的腹泻,以及抗生素导致的腹泻;constantine 等通过动物实验证实益生菌还可通过黏附和降解潜在的致癌物质来预防和抑制结肠癌的发生。
4.腹泻由多种原因引起,如急性肠胃炎、消化不良、肠道内菌群失调、药物等。不管是哪种原因引起的腹泻,在腹泻期间都会导致肠道内的菌群紊乱。益生菌可以改善肠道内的菌群平衡,抑制有害细菌的繁殖、生长,抑制肠道内的炎症,促进肠道内的消化以及吸收,提高人体的免疫力,从而改善腹泻的情况。特别是由于过度使用抗生素引起的肠道内菌群失调导致的腹泻,服用益生菌非常有益处。而且益生菌没有一点副作用,大人、小孩、孕妇都可以服用,治疗腹泻的效果也是显著的。
5.人们对生活和健康的日益重视,对自然的、健康的制品越来越认知,势必为益生菌产品的开发和应用带来契机,尤其是可以作为食品的益生菌制剂越来越受到人们的青睐。益生菌-微生态-人体健康这个领域在近几年来成为许多研究者关注的热门领域。
技术实现要素:
6.本发明的目的是提供一种具有缓解和治疗腹泻功能的乳酸菌口服液及其制备方法。所述乳酸菌口服液中鼠李糖乳杆菌(lactobacillus rhamnosus)活菌量高,能显著提高肠道中益生菌的数量,优化菌群结构,提高机体免疫力,并且对成人腹泻的治疗效果明显。
7.本发明一方面提供了一种乳酸菌口服液,所述乳酸菌口服液是通过将鼠李糖乳杆菌发酵制备得到。
8.所述鼠李糖乳杆菌为鼠李糖乳杆菌yksw(lactobacillus rhamnosus yksw),并于2022年3月29日保藏于中国武汉武汉大学的中国典型培养物保藏中心,保藏编号为cctcc no: m2022337。
9.所述乳酸菌口服液中活菌数不低于30亿/ml。
10.本发明还提供了上述乳酸菌口服液的制备方法,具体步骤包括:(1)配制液体发酵培养基,灭菌;(2)按发酵量的3-5%将鼠李糖乳杆菌接种至液体发酵培养基中;(3)发酵温度36~40℃,发酵时间为12~18h;(4)将发酵液进行无菌灌装,包装,即得乳酸菌口服液。
11.所述的液体发酵培养基中各组分及其质量体积比分别为:红糖7.5-9.0%、葡萄糖8.0-10.0%、乳清粉0.08-0.10%、土豆泥0.10-0.15%、k2hpo
4 0.04-0.07%、kh2po
4 0.03-0.05%、mgso
4 0.05-0.08%。
12.进一步优选的,所述的液体发酵培养基中各组分及其质量体积比分别为:红糖8.5%、葡萄糖4.0%、脱脂乳粉10%、土豆泥0.10%、乳清粉0.15%、kh2po
4 0.06%、k2hpo
4 0.05%、mgso
4 0.06%。
13.所述的液体培养基的初始ph值为5.5-6.5。
14.进一步优选的,所述的发酵温度为37℃。
15.进一步优选的,所述的发酵时间为15h。
16.有益效果本发明所述乳酸菌口服液是以鼠李糖乳杆菌yksw为发酵菌株制备得到的,活菌量高,超过30亿/ml。所述鼠李糖乳杆菌yksw筛选自健康成年人的粪便,对大肠杆菌、沙门氏菌、金黄色葡萄球菌和幽门螺旋杆菌均有显著的抑制作用,尤其对大肠杆菌和幽门螺旋杆菌的抑制作用最强,抑菌圈直径超过30mm;具有非常强的耐胃酸、耐胆汁盐能力,在人工胃酸和肠液中3h时的存活率分别高达197.40%和90.45%;能高效去除胆固醇,去除率高达89.83%;具有很强的抗氧化能力,能高效清除dpph自由基和羟基自由基,其发酵液上清液和无细胞提取物对dpph
·
自由基的清除率分别高达78.62%和61.2%,对羟基自由基的清除率分别高达80.15%和60.33%;该菌株具有很强的抗脂质过氧化能力,其发酵上清液对脂质氧化的抑制率高达69.55%。此外,该菌株能高产胞外多糖,产量达689.4 mg/l,远远高于对照菌,取得了意料不到的技术效果。
17.食用本发明所述乳酸菌口服液能明显增加人体肠道内乳酸菌和双歧杆菌的数量,优化菌群结构,有利于维持肠道健康,提高机体免疫力;还能有效缓解和治疗成人腹泻,服用口服液的受试者,腹泻持续的时间与服用药物的对照组基本相当;但与服用药物相比,服用口服液的受试者粪便排出量明显减少,取得了意料不到的技术效果。
附图说明
18.图1为鼠李糖乳杆菌yksw的菌落形态图。
具体实施方式
19.除了本发明筛选出的菌株外,实施本发明所用的各种原料、生产设备均可选自市售的任意一种,并没有特殊的限定。
20.以下实施例是为了更好地说明阐述本发明内容,本领域相关的技术人员可以借助实施例更好地理解和掌握本发明。但是,本发明的保护和权利要求范围不限于所提供的案例。
21.实施例1鼠李糖乳杆菌yksw的分离筛选与鉴定本发明从半年内未进食益生菌制剂的健康志愿者粪便中分离得到一株抑菌效果特别突出的乳酸菌。经菌落形态特征、生理生化特征和分子生物学鉴定,确定该菌株为一株新的鼠李糖乳杆菌,命名为鼠李糖乳杆菌yksw(lactobacillus rhamnosus yksw),并于2022年3月29日保藏于中国武汉武汉大学的中国典型培养物保藏中心,保藏编号为cctcc no: m2022337。
22.鼠李糖乳杆菌yksw的菌落形态如图1所示,菌落直径在1.5-2.5mm,呈圆形,乳白色,表面有光泽、湿润,边缘整齐;在显微镜下观察,菌体呈短杆状。
23.鼠李糖乳杆菌yksw的16s rdna序列如seq id no:1所示。
24.鼠李糖乳杆菌yksw碳源代谢试验结果如表1所示。
25.表1鼠李糖乳杆菌yksw碳源代谢结果表纤维二糖蜜二糖龙胆二糖甘露醇苦杏仁苷+-+-+乳糖麦芽糖甘露糖水杨苷海藻糖-++++松三糖棉子糖山梨糖醇木糖鼠李糖+-+-+蔗糖半乳糖阿拉伯糖葡萄糖酸钠菊粉++++-果糖d-塔格糖土伦糖糖原甘油++
‑‑
+注:“+”为阳性反应;
“‑”
为阴性反应。
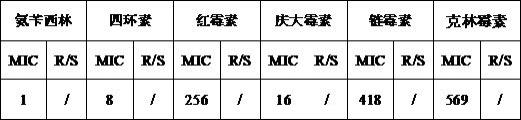
26.采用微量肉汤稀释法测定抗生素对鼠李糖乳杆菌yksw的最小抑菌浓度mic值。具体结果见表2。
27.表2 鼠李糖乳杆菌yksw的抗生素mic值(μg/ml)
从表2的结果可以看出,本发明提供的鼠李糖乳杆菌yksw对四环素、氨苄西林等常见抗生素较敏感,生物安全性良好。
28.实施例2鼠李糖乳杆菌yksw的抑菌性能测定1、乳酸菌菌液制备:将鼠李糖乳杆菌yksw接种于100ml mrs液体培养基中,37℃静置培养48h;2、致病菌菌液制备:分别将大肠杆菌、沙门氏菌、金黄色葡萄球菌和幽门螺旋杆菌(四种致病菌均由山东大学赠送)接种于营养肉汤培养基,37℃摇床培养过夜;3、抑菌实验—双层平板,牛津杯法:每5ml灭菌营养琼脂培养基(50℃左右)加100μl致病菌菌液(菌量106数量级),混匀后倾倒至营养琼脂平板做成双层平板,凝固后在培养基上放置牛津杯,向牛津杯中添加200μl培养好的乳酸菌菌液,待菌液扩散后放入37℃培养箱中培养20h,观察抑菌圈直径。结果如表3所示。
29.表3 鼠李糖乳杆菌yksw对致病菌的抑制作用致病菌大肠杆菌沙门氏菌金黄色葡萄球菌幽门螺旋杆菌抑菌圈直径30mm23mm26mm31mm从表3的数据可以看出,本发明提供的鼠李糖乳杆菌yksw对大肠杆菌、沙门氏菌、金黄色葡萄球菌和幽门螺旋杆菌均有显著的抑制作用,尤其对大肠杆菌和幽门螺旋杆菌的抑制作用最强,抑菌圈直径超过30mm。
30.实施例3 鼠李糖乳杆菌yksw耐胃酸、耐胆盐实验1、耐胃酸性能检测方法:取活化后的鼠李糖乳杆菌yksw菌悬液40ml加入50ml离心管中,离心(5000g、5min)收集菌体,用pbs缓冲液洗涤两次后向离心管中加入40ml人工胃液(取稀盐酸16.4ml加水摇匀稀释至1000ml,用浓盐酸或10%的naoh调整ph为2.0,于121℃灭菌30min,在无菌室以1g/100ml比例加胃蛋白酶),37℃水浴培养3h,每隔30min摇匀一次,于0h、2h和3h分别取样作活菌计数,以0h样品为对照,分别计算2h和3h样品菌体的存活率。
31.2、耐胆汁盐性能检测方法:取活化后的鼠李糖乳杆菌yksw菌悬液40ml加入50ml离心管中,离心(5000g、5min)收集菌体,用pbs缓冲液洗涤两次后向离心管中加入40ml人工肠液(配制方法:取kh2po
4 6.8g,加蒸馏水500ml溶解,用0.4%(w/v)的naoh溶液调节ph值至6.8,加水至1000ml,每100ml溶液中加0.3g禽胆盐,充分溶解后,于115℃灭菌15min),37℃水浴培养2h,每隔30min摇匀一次,于0h、2h和3h分别取样作活菌计数,以0h样品为对照,分别计算2h和3h样品菌体的存活率。
32.存活率=(2h或3h时的活菌数/0h时的活菌数)
×
100%。
33.同时,以鼠李糖乳杆菌cgmcc1.552作为对照,进行上述耐胃酸和耐胆汁盐性能检测。具体结果见表4。
34.表4鼠李糖乳杆菌yksw耐胃酸、耐胆汁盐性能检测结果
从表4中的数据可以看出,本发明筛选到的鼠李糖乳杆菌yksw具有非常强的耐胃酸、耐胆汁盐能力。该菌株在人工胃酸和肠液中3h时的存活率分别高达197.40%和90.45%,远远高于对照菌;而且,与2h时的存活率相比,该菌株在人工胃液中3h时的存活率得到明显提高,说明鼠李糖乳杆菌yksw在胃酸中不但能够有效存活,而且还实现了增殖,取得了意料不到的效果。
35.实施例4鼠李糖乳杆菌yksw对胆固醇的去除效果本实验参照brashears等( 1998)的方法,并略有改进。
36.将鼠李糖乳杆菌yksw菌株活化后接种于mrs 培养基,37℃培养过夜,作为种子液。
37.配制含5%(v/v)蛋黄液的mrs 培养基,取其中2 ml培养基,5000 r/min离心7min,取1ml上清液置于离心管中,加入9ml无水乙醇,振荡处理5 min,10000 r /min离心10min,取2 ml上清液加入2 ml p-fe-s 试剂,冰浴混匀反应30 min,测od550,计算培养基中胆固醇的初始含量。
38.然后,将鼠李糖乳杆菌yksw的种子液接种至上述mrs培养基中,在37℃条件下培养24 h后,再次测定培养基中胆固醇的最终含量,计算鼠李糖乳杆菌yksw对胆固醇的去除率。同时以鼠李糖乳杆菌cgmcc1.552作为对照菌株,采用上述同样的操作,计算该菌对胆固醇的去除率。具体结果见表5。
39.胆固醇去除率=(初始含量-最终含量)/初始含量
×
100%。
40.表5鼠李糖乳杆菌yksw对胆固醇的去除效果菌 株胆固醇去除率鼠李糖乳杆菌yksw89.38%对照菌鼠李糖乳杆菌cgmcc1.55226.27%从表5的结果可知,本发明提供的鼠李糖乳杆菌yksw能高效去除胆固醇,去除率高达89.83%,显著高于对照菌株,取得了意料不到的技术效果。
41.实施例5 鼠李糖乳杆菌yksw的抗氧化能力测定将鼠李糖乳杆菌yksw进行传代活化后,按5%的体积比接种于mrs液体培养基, 37℃静置培养24h,3 000 r /min,离心15 min,分别收集发酵上清和菌体。
42.制备无细胞提取物:用ph值为7.4的磷酸缓冲溶液( pbs) 洗涤菌体3次,重新悬浮于磷酸缓冲溶液中,调整菌数至10
9 cfu /ml;然后超声波冰浴破碎菌体,10000 r /min 离心10 min,上清液即为无胞提取物。
[0043] 1、羟基自由基清除实验
ros自由基中,羟基自由基是最有活性的,在金属离子(如铜离子或铁离子)存在的条件下,超氧阴离子和过氧化氢能生成羟基自由基。羟基自由基是一种氧化性很强的自由基,会对生物细胞大分子造成损伤而影响细胞的正常功能。因此,对羟基自由基的清除能力是抗氧化性能的一个主要指标。
[0044]
esr法测定清除羟基自由基的能力:分别将50
ꢀµ
l鼠李糖乳杆菌yksw 的发酵上清液和无细胞提取物各加入到50
ꢀµ
l浓度为0.3 mol/l的dmpo后,把反应的体系转入到密封的石英毛细管中,然后加50
ꢀµ
l浓度为10 mol/l的h2o2启动反应。反应2.5 min后,通过er 200d src esr光谱仪分析。对照为0.05 mol/l的磷酸盐缓冲溶液(ph 7.4)。样品对
•
oh的清除作用以清除率表示。
[0045]
清除率=(h0—h)/ h0×
100%。
[0046]
式中:h和h0分别表示样品与对照波谱信号强度,信号的相对强度用波谱信号的第二个峰值来表示。
[0047]
结果显示:鼠李糖乳杆菌yksw 的发酵上清液和无细胞提取物对羟基自由基的清除率分别高达80.15%和60.33%。
[0048] 2、dpph
·
自由基清除实验dpph
·
是一种很稳定的以氮为中心的自由基,若受试物能清除它,则表示受试物抗氧化效果显著。
[0049]
dpph
·
溶液;各取1 ml发酵上清液和无细胞提取物,分别加入1 ml浓度为0.2 mmol /l的dpph
·
,混匀,室温下静置30min后,在517 nm处测吸光度变化。
[0050]
dpph
·
的清除率( %) = [1
‑ꢀ
( a1
ꢀ‑
a2) /a3]
×
100。
[0051]
式中: a1表示未加样品的dpph ·
溶液的原始吸光度;a2表示样品在测定波长时的本身吸光度;a3表示加样后dpph 溶液的吸光度。
[0052]
结果显示:鼠李糖乳杆菌yksw 的发酵上清液和无细胞提取物均能强力去除dpph
·
,其清除率分别高达78.62%和61.2%。
[0053]
上述结果表明,本发明提供的鼠李糖乳杆菌yksw具有很强的抗氧化能力,其发酵液上清液和无细胞提取物能高效清除自由基,而且发酵上清液的清除效果要明显高于无细胞提取物。从而说明鼠李糖乳杆菌yksw生长期间的代谢产物对自由基的清除发挥更重要的作用,抗氧化能力更强。
[0054] 3、菌株抗脂质过氧化实验(1)亚油酸乳化液制备:0.1ml亚油酸,0.2ml tween 20,19.7ml去离子水。
[0055]
(2)0.5 ml的pbs溶液(ph 7.4)中加入1 ml亚油酸的乳化液,1 ml feso4(1%),再加入0.5 ml鼠李糖乳杆菌yksw 的发酵上清液,37℃水浴1.5 h,混合液加入0.2 ml tca(4%),2 ml tba(0.8%),100 ℃水浴30 min,迅速冷却,4000 rpm/min离心15 min,收集上清液在532 nm下测吸光度即为a;对照组以0.5 ml蒸馏水代替样品即为a0。
[0056]
抑制率(%)=(a0-a)/ a0×
100%。
[0057]
注: a为样品组吸光度;a0为对照组吸光度。
[0058]
同时以鼠李糖乳杆菌cgmcc1.552作为对照菌株,采用上述同样的操作,测定对照菌的脂质过氧化抑制率。结果见表6。
[0059]
表6 鼠李糖乳杆菌yksw抗脂质过氧化能力菌 株脂质过氧化抑制率鼠李糖乳杆菌yksw69.55%对照菌鼠李糖乳杆菌cgmcc1.55219.83%从表6的结果可知,本发明提供的鼠李糖乳杆菌yksw具有很强的抗脂质过氧化能力,其发酵上清液对脂质氧化的抑制率高达69.55%,远远高于对照菌,取得了意料不到的技术效果。
[0060]
实施例6 鼠李糖乳杆菌vhprobi o17产胞外多糖的制备将鼠李糖乳杆菌yksw菌株活化后,以5%(v/v)的接种量接种到mrs液体培养基中,37℃培养48 h;将发酵液10000g离心20 min,收集上清液;将上清液中加入3倍体积的预冷无水乙醇,4℃醇沉36h;10000g离心20 min,收集沉淀;用去离子水充分溶解沉淀后,向其中加入同等剂量的10%(m/v)三氯乙酸溶液,4℃放置过夜;再次以10000g离心20 min,去除蛋白,收集上清液。将得到的上清液再次醇沉过夜后离心,收集多糖沉淀。
[0061]
将多糖沉淀用去离子水溶解后,装入透析袋(mw cut-off 14 000 da );用去离子水透析2天,去除小分子杂质,即得到胞外粗多糖溶液。经过冷冻干燥,得到粉末状胞外粗多糖。将粗多糖加入同等剂量的去离子水后,采用苯酚-硫酸法测定并比较胞外多糖产量。
[0062]
同时以鼠李糖乳杆菌cgmcc1.552作为对照菌株,采用上述同样的操作,测定对照菌胞外多糖的产量。
[0063]
具体结果见表7。
[0064]
表7 鼠李糖乳杆菌yksw胞外多糖产量菌 株胞外多糖产量鼠李糖乳杆菌yksw689.4mg/l对照菌鼠李糖乳杆菌cgmcc1.552126.7mg/l从表7的结果可知,本发明提供的鼠李糖乳杆菌yksw能高产胞外多糖,产量达689.4 mg/l,远远高于对照菌,取得了意料不到的技术效果。
[0065]
实施例7一种乳酸菌口服液及其制备方法在发酵罐中加入适量水,分别将红糖、葡萄糖、脱脂乳粉、乳清粉、土豆泥、k2hpo4、kh2po4、mgso4加入到罐中,搅拌溶解后定容。利用高温蒸汽控制发酵罐内压力0.09~0.10mpa,使温度控制在115℃~121℃,杀菌25~45min,结束后冷却降温至35~40℃,其中各成分的质量体积比最终分别为:红糖7.5%、葡萄糖5.0%、脱脂乳粉8%、土豆泥0.08%、乳清粉0.12%、kh2po
4 0.04%、k2hpo
4 0.03%、mgso
4 0.05%,培养基的初始ph值为5.5-6.0。
[0066]
按3%的体积比将鼠李糖乳杆菌yksw的种子液接种于发酵罐中,搅拌15min,充分混匀后关闭搅拌;控制发酵温度为36℃,发酵时间为18h,冷水迅速降温至10℃以下,进行无菌灌装、包装,即得到乳酸菌口服液,其中鼠李糖乳杆菌yksw活菌数约为3.2
×
109cfu/ml。
[0067]
实施例8一种乳酸菌口服液及其制备方法在发酵罐中加入适量水,分别将红糖、葡萄糖、脱脂乳粉、乳清粉、土豆泥、k2hpo4、kh2po4、mgso4加入到罐中,搅拌溶解后定容。利用高温蒸汽控制发酵罐内压力0.09~0.10mpa,使温度控制在115℃~121℃,杀菌25~45min,结束后冷却降温至35~40℃,其中各成分的质量体积比最终分别为:红糖8.5%、葡萄糖4.0%、脱脂乳粉10%、土豆泥0.10%、乳清
粉0.15%、kh2po
4 0.06%、k2hpo
4 0.05%、mgso
4 0.06%,培养基的初始ph值为5.5-6.0。
[0068]
按5%的体积比将鼠李糖乳杆菌yksw的种子液接种于发酵罐中,搅拌15min,充分混匀后关闭搅拌;控制发酵温度为40℃,发酵时间为12h,冷水迅速降温至10℃以下,进行无菌灌装、包装,即得到乳酸菌口服液,其中鼠李糖乳杆菌yksw活菌数约为3.8
×
109cfu/ml。
[0069]
实施例9一种乳酸菌口服液及其制备方法在发酵罐中加入适量水,分别将红糖、葡萄糖、脱脂乳粉、乳清粉、土豆泥、k2hpo4、kh2po4、mgso4加入到罐中,搅拌溶解后定容。利用高温蒸汽控制发酵罐内压力0.09~0.10mpa,使温度控制在115℃~121℃,杀菌25~45min,结束后冷却降温至35~40℃,其中各成分的质量体积比最终分别为:红糖9.0%、葡萄糖3.5%、脱脂乳粉8.5%、土豆泥0.09%、乳清粉0.10%、kh2po
4 0.07%、k2hpo
4 0.03%、mgso
4 0.08%,培养基的初始ph值为5.5-6.0。
[0070]
按4%的体积比将鼠李糖乳杆菌yksw的种子液接种于发酵罐中,搅拌15min,充分混匀后关闭搅拌;控制发酵温度为37℃,发酵时间为15h,冷水迅速降温至10℃以下,进行无菌灌装、包装,即得到乳酸菌口服液,其中鼠李糖乳杆菌yksw活菌数约为3.0
×
109亿cfu/ml。
[0071]
实施例10 乳酸菌口服液的效果评价从健康人群中随机挑选成年男女各10名,每天收集其新鲜粪便,分别检测其中的乳酸菌和双歧杆菌数量,计算平均值。20名健康成年人每天早晚各饮用本发明实施例8所述乳酸菌口服液100 ml,一周后,连续三天检测其新鲜粪便中乳酸菌及双歧杆菌数量,计算平均值。具体结果见表8。
[0072]
表8 粪便中乳酸菌和双歧杆菌数量的变化乳酸菌双歧杆菌饮用前1.68
×
108cfu/g4.51
×
109cfu/g饮用后8.15
×
109cfu/g2.57
×
10
11
cfu/g从表8的数据可知,与饮用前相比,饮用本发明提供的乳酸菌口服液后,人体肠道内乳酸菌和双歧杆菌的数量显著增加,菌群结构更加优化,有利于维持肠道健康,提高机体免疫力,取得了意料不到的技术效果。
[0073]
实施例11 乳酸菌口服液对成人腹泻的治疗效果评价本着自愿的原则,本发明对30名患中度脱水急性腹泻的成年人(18-40周岁)进行了随机、双盲临床试验,用于评价本发明所提供的含鼠李糖乳杆菌yksw的乳酸菌口服液在治疗腹泻中的效果。
[0074]
药物对照组:15名,口服蒙脱石散,一天三次,每次一袋;益生菌组:15名,一天三次,每次口服实施例8所述乳酸菌口服液100ml。
[0075]
记录每个受试者每天的下列数据:排便体积,排便频率和稠度以及精确的体重值。腹泻的持续时间被定义为治疗后直到排出最后一次液体或半液体粪便(之后再24小时内再没有出现异常粪便)所经过的小时数。
[0076]
统计结果显示,益生菌组的受试者腹泻持续的时间为1.8h,与药物对照组基本相当。但与药物对照组相比,益生菌组的受试者粪便排出量明显减少(以每千克体重每天的克数计)。
[0077]
上述结果表明,本发明提供的鼠李糖乳杆菌yksw的乳酸菌口服液对成人腹泻有显著的治疗效果,取得了意料不到的技术效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1