一种曲氟尿苷替匹嘧啶片剂及其制备方法与流程
1.本发明涉及药物技术领域,尤其涉及一种曲氟尿苷替匹嘧啶片剂及其制备方法。
背景技术:
2.曲氟尿苷替匹嘧啶为抗肿瘤核苷类药物,含有曲氟尿苷和盐酸替匹嘧啶两种成分,两者的摩尔比为1:0.5,剂型为薄膜衣片,有15mg和20mg两种规格,主要治疗既往接受过氟嘧啶类、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗血管内皮生长因子(vegf)治疗、抗表皮生长因子受体(egfr)治疗(ras野生型)的转移性结直肠癌(mcrc)患者。根据成人的推荐起始剂量约为35mg/m2/次,早晚餐后1小时内口服,每日两次,于每一个疗程的第1-5天和第8-12天口服,28天为一个疗程,应持续服用直至疾病进展或出现不可耐受的毒性。根据体表面积(bsa)计算剂量,最高剂量为80mg/次。
3.曲氟尿苷替匹嘧啶片中,活性成分之一的盐酸替匹嘧啶易水解。为实现其稳定性,大鹏药品株式会社开发了一种采用“25℃时的临界湿度为85%以上的糖类”作为100%赋型剂的方法,避免了药物在长期放置过程中降解的药物组成技术手段。但是,该药物在长期放置后,其溶出曲线与初始药物会发生较大变化,从而影响药效的吸收和利用。
技术实现要素:
4.有鉴于此,本发明提供了一种曲氟尿苷替匹嘧啶片剂及其制备方法,本发明提供的曲氟尿苷替匹嘧啶片剂长期放置不会降解,而且长期放置后,其溶出曲线与初始药物一致。
5.本发明提供了一种曲氟尿苷替匹嘧啶片剂,包括:曲氟尿苷替匹嘧啶片;容纳所述曲氟尿苷替匹嘧啶片的铝塑泡罩;套设在所述铝塑泡罩外的药用复合袋;设置在所述铝塑泡罩和所述药用复合袋之间的干燥剂。
6.本发明采用铝塑泡罩作为直接接触曲氟尿苷替匹嘧啶片的内包材,外套药用复合袋,中间加干燥剂,改善了盐酸替匹嘧啶高湿不稳定的情况,提高了曲氟尿苷替匹嘧啶片有关物质等关键质量属性的稳定性,尤其是使得曲氟尿苷替匹嘧啶片保存后与初始曲氟尿苷替匹嘧啶片具有相似的溶出曲线。此外,本发明使用的包装形式大大提高了制剂的安全性、有效性的同时,无需必须采用“25℃时的临界湿度为85%以上的糖类”作为100%赋型剂,从而拓宽了曲氟尿苷替匹嘧啶片药物处方组成。
7.所述铝塑泡罩用于容纳曲氟尿苷替匹嘧啶片,在一个实施例中,所述铝塑泡罩为聚氯乙烯/铝箔泡罩,即药用聚氯乙烯硬片和铝箔形成的泡罩包装。在一个实施例中,所述聚氯乙烯/铝箔泡罩中,所述聚氯乙烯硬片的水蒸汽透过量低于2.5g/m2.24h,铝箔水蒸汽透过量低于0.5g/m2.24h。在一个实施例中,所述聚氯乙烯/铝箔泡罩为ptp泡罩。
8.所述药用复合袋用于包裹容纳有曲氟尿苷替匹嘧啶片的铝塑泡罩。在一个实施例中,所述药用复合袋为聚酯/铝/聚乙烯药用复合袋。
9.在所述铝塑泡罩和所述药用复合袋之间的干燥剂,干燥剂用于保持铝塑泡罩内的
水分,既不能过于湿润影响曲氟尿苷替匹嘧啶片的吸水降解,也不能过于干燥导致曲氟尿苷替匹嘧啶片开裂。在一个实施例中,所述干燥剂为硅胶干燥剂、纤维干燥剂或氯化钙中的一种或多种。
10.采用本技术提供的包装方法包装曲氟尿苷替匹嘧啶片时,无需必须必须采用“25℃时的临界湿度为85%以上的糖类”作为100%赋型剂,拓宽了曲氟尿苷替匹嘧啶片药物处方组成。
11.在一个实施例中,所述曲氟尿苷替匹嘧啶片包括:曲氟尿苷、盐酸替匹嘧啶和药学上可接受的辅料。其中,曲氟尿苷和盐酸替匹嘧啶的摩尔比为1:0.5。
12.在一个实施例中,所述药学上可接受的辅料包括赋形剂、崩解剂、润滑剂和包衣材料。其中,所述赋形剂可以是25℃时的临界湿度为85%以上的糖类,也可以是25℃时的临界湿度为85%以下的其他常用固体制剂赋型剂。在一个实施例中,所述赋形剂选自乳糖、甘露醇、微晶纤维素或蔗糖中的一种或多种。在一个实施例中,所述崩解剂选自预胶化淀粉或者交聚维酮中的一种或多种。在一个实施例中,所述润滑剂选自硬脂酸或者硬脂酸镁中的一种或多种。在一个实施例中,所述包衣材料选自市场上采购的胃溶型薄膜包衣预混剂,主要由羟丙甲纤维素、聚乙二醇、二氧化钛等组成无隔水/防水功能。
13.曲氟尿苷替匹嘧啶片的一个典型组成包括:
14.20质量份的曲氟尿苷;
15.9.42质量份的盐酸替匹嘧啶;
16.120.98质量份的乳糖;
17.8质量份的预胶化淀粉;
18.1.6质量份的硬脂酸;
19.曲氟尿苷替匹嘧啶片的一个典型组成包括:
20.20质量份的曲氟尿苷;
21.9.42质量份的盐酸替匹嘧啶;
22.114.98质量份的甘露醇;
23.14质量份的交聚维酮;
24.1.6质量份的硬脂酸镁;
25.曲氟尿苷替匹嘧啶片的一个典型组成包括:
26.20质量份的曲氟尿苷;
27.9.42质量份的盐酸替匹嘧啶;
28.120.98质量份的乳糖;
29.8质量份的交聚维酮;
30.1.6质量份的硬脂酸镁;
31.曲氟尿苷替匹嘧啶片的一个典型组成包括:
32.20质量份的曲氟尿苷;
33.9.42质量份的盐酸替匹嘧啶;
34.60.98质量份的乳糖;
35.60质量份的微晶纤维素;
36.8质量份的交聚维酮;
37.1.6质量份的硬脂酸镁。
38.为避免在造粒过程中,发生盐酸替匹嘧啶高湿降解产物增加,本发明所述曲氟尿苷替匹嘧啶中间体颗粒采用原辅料直接混合的方式进行,即将曲氟尿苷、盐酸替匹嘧啶和药学上可接受的辅料直接混合、压片制成。
39.本发明采用铝塑泡罩作为直接接触曲氟尿苷替匹嘧啶片的内包材,外套药用复合袋,中间加干燥剂,改善了盐酸替匹嘧啶高湿不稳定的情况,提高了曲氟尿苷替匹嘧啶片有关物质等关键质量属性的稳定性,尤其是提高了氟尿苷替匹嘧啶片在稳定性放置过程中物理、化学稳定性,使得曲氟尿苷替匹嘧啶片溶出行为在放置期间变化大幅度减小,与初始曲氟尿苷替匹嘧啶片具有相似的溶出曲线。此外,本发明使用的包装形式大大提高了制剂的安全性、有效性的同时,无需必须采用“25℃时的临界湿度为85%以上的糖类”作为100%赋型剂,从而拓宽了曲氟尿苷替匹嘧啶片药物处方组成。试验结果表明,本发明提供的包装形式能够使曲氟尿苷替匹嘧啶片在高湿环境下仍具有较好的稳定性、较低的有关物质水平,且放置过程中有关物质无明显变化、溶出曲线无明显变化,更利于曲氟尿苷替匹嘧啶片的生产、运输、使用,极大程度的提高了本品给药的安全性,使患者临床使用上更加安全稳定。
附图说明
40.图1为实施例1包装好的制剂高温高湿下放置30天的hplc图谱;
41.图2为实施例2包装好的制剂高温高湿下放置30天的hplc图谱;
42.图3为实施例3包装好的制剂高温高湿下放置30天的hplc图谱;
43.图4为实施例4包装好的制剂高温高湿下放置30天的hplc图谱;
44.图5为对比例2包装好的制剂高温高湿下放置30天的hplc图谱;
45.图6为对比例3包装好的制剂高温高湿下放置30天的hplc图谱;
46.图7为对比例4包装好的制剂高温高湿下放置30天的hplc图谱;
47.图8为实施例1~4提供的制剂成品的溶出曲线;
48.图9为实施例及对比例包装好的制剂高温高湿下放置30天的溶出曲线。
具体实施方式
49.本发明提供了一种曲氟尿苷替匹嘧啶片剂及其制备方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
50.以下结合实施例对本发明提供的曲氟尿苷替匹嘧啶片剂及其制备方法进行进一步说明。
51.如无特殊说明,本发明采用的材料,皆可于市场购得。
52.实施例1
53.制剂配方组成如表1所示:
54.表1实施例1提供的制剂配方
55.成分用量
曲氟尿苷20g盐酸替匹嘧啶9.42g乳糖120.98g预胶化淀粉8g硬脂酸1.6g包衣粉增重2~3%
56.制备方法如下:
57.两种原料与辅料充分混合,压片,最终包衣即得制剂成品;
58.将所述制剂成品采用ptp(聚乙烯膜/铝箔)泡罩包装,外套聚酯/铝/聚乙烯药用复合袋,中间加纤维干燥剂。
59.实施例2
60.制剂配方组成如表2所示:
61.表2实施例2提供的制剂配方
62.成分用量曲氟尿苷20g盐酸替匹嘧啶9.42g甘露醇114.98交聚维酮14g硬脂酸镁1.6g包衣粉增重2~3%
63.制备方法如下:
64.两种原料与辅料充分混合,压片,最终包衣即得制剂成品;
65.将所述制剂成品采用ptp(聚乙烯膜/铝箔)泡罩包装,外套聚酯/铝/聚乙烯药用复合袋,中间加纤维干燥剂。
66.实施例3
67.制剂配方组成如表3所示:
68.表3实施例3提供的制剂配方
69.成分用量曲氟尿苷20g盐酸替匹嘧啶9.42g乳糖120.98g交聚维酮8g硬脂酸镁1.6g包衣粉增重2~3%
70.制备方法如下:
71.两种原料与辅料充分混合,压片,最终包衣即得制剂成品;
72.将所述制剂成品采用ptp(聚乙烯膜/铝箔)泡罩包装,外套聚酯/铝/聚乙烯药用复合袋,中间加硅胶干燥剂。
73.实施例4
74.制剂配方组成如表4所示:
75.表4实施例4提供的制剂配方
76.成分用量曲氟尿苷20g盐酸替匹嘧啶9.42g乳糖60.98g微晶纤维素60g交聚维酮8g硬脂酸镁1.6g包衣粉增重2~3%
77.制备方法如下:
78.两种原料与辅料充分混合,压片,最终包衣即得制剂成品;
79.将所述制剂成品采用ptp(聚乙烯膜/铝箔)泡罩包装,外套聚酯/铝/聚乙烯药用复合袋,中间加氯化钙干燥剂。
80.对比例1
81.制剂配方组成如表5所示:
82.表5对比例1提供的制剂配方
83.成分用量曲氟尿苷20g盐酸替匹嘧啶9.42g乳糖60.98g微晶纤维素60g交聚维酮8g硬脂酸镁1.6g包衣粉增重2~3%
84.制备方法如下:
85.两种原料与乳糖、微晶纤维素和交聚维酮充分混合,加入纯化水润湿后制粒,干燥后加入硬脂酸镁,混合均匀后压片,最终包衣即得制剂成品,检测有关物质。
86.对比例2
87.将实施例1制备的制剂成品存储于高密度聚乙烯瓶中。
88.对比例3
89.将实施例2制备的制剂成品存储于高密度聚乙烯瓶中。
90.对比例4
91.将实施例1制备的制剂成品采用ptp(聚乙烯膜/铝箔)泡罩包装,外套聚酯/铝/聚乙烯药用复合袋,中间不加干燥剂。
92.试验例1
93.对实施例1~4和对比例1制备的制剂成品进行检测,考察其有关物质的水平,有关物质检测方法:用十八烷基硅烷键合硅胶为填充剂,色谱柱为inertsil ods-3(4.6mm
×
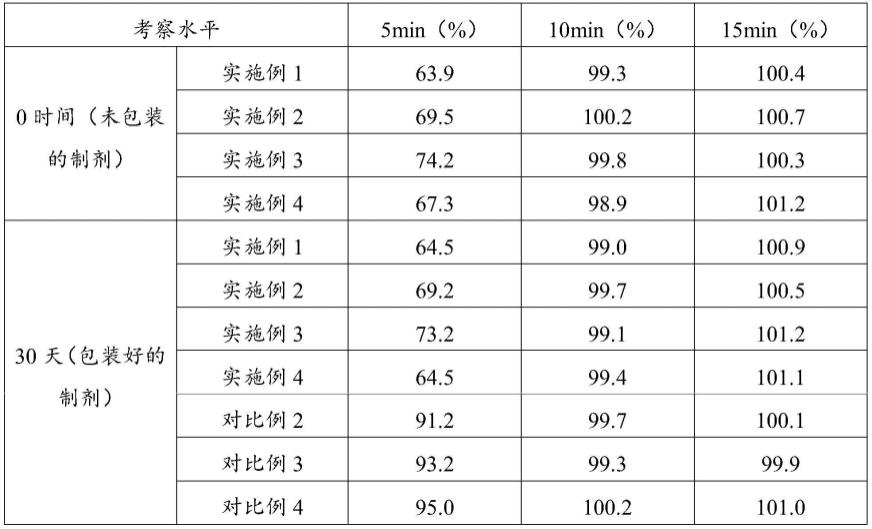
250mm,5μm)或其他相似的色谱柱,以磷酸盐缓冲液(取二水合磷酸二氢钠1.4g和庚烷磺酸
钠0.9g,加水900ml溶解,用磷酸调节ph值至2.7)为流动相a,以乙腈为流动相b;检测波长为210nm;柱温为40℃;流速1.0ml/分钟。溶出度检测方法:用十八烷基硅烷键合硅胶为填充剂;以0.025mol/l磷酸氢二钠溶液-甲醇(76:24)为流动相;检测波长为276nm,柱温40℃,流速1.0ml/min,出峰顺序依次是盐酸替匹嘧啶与曲氟尿苷。
94.对实施例1~4制备的制剂成品进行检测,测试其溶出曲线,溶出条件:溶出方法:桨法,转速:50rpm,溶出介质:纯化水,体积900ml;
95.结果参见表6,表6为实施例1~4和对比例1制备的制剂成品的有关物质检测结果。
96.表6实施例1~4和对比例1制备的制剂成品的有关物质检测结果
97.杂质含量(%)限度实施例1实施例2实施例3实施例4对比例1tpi-杂质a≤0.1%n.dn.dn.dn.dn.dtpi-杂质b≤0.2%0.040.030.060.030.03tpi-杂质c≤0.2%n.dn.dn.dn.d0.14tpi-杂质d≤0.2%0.030.030.03n.d0.02tpi-杂质e≤0.2%n.dn.dn.dn.dn.d单个未知杂质≤0.2%n.dn.dn.dn.d0.08
98.注释:因高湿条件仅影响盐酸替匹嘧啶杂质水平,此表仅统计盐酸替匹嘧啶的杂质。
99.从实施例1~实施例4以及实施对比例1有关物质检测可以看出,本品更适合直压工艺,实施对比例1为经过湿法制粒后压片,有关物质检测可以看出经湿法制粒后,有降解杂质产生,说明本品种采用直压工艺生产是合适的。
100.对实施例1~4制备的制剂成品进行检测,测试其溶出曲线,溶出条件:溶出方法:桨法,转速:50rpm,溶出介质:纯化水,体积900ml;
101.将实施例1~4和对比例2~4制备得到的包装好的制剂放于25℃,高湿90%
±
5%条件下放置30天,按照上述方法考察有关物质情况和溶出曲线,结果参见图1~图9、表7和表8,图1为实施例1包装好的制剂高温高湿下放置30天的hplc图谱,图2为实施例2包装好的制剂高温高湿下放置30天的hplc图谱,图3为实施例3包装好的制剂高温高湿下放置30天的hplc图谱,图4为实施例4包装好的制剂高温高湿下放置30天的hplc图谱,图5为对比例2包装好的制剂高温高湿下放置30天的hplc图谱,图6为对比例3包装好的制剂高温高湿下放置30天的hplc图谱,图7为对比例4包装好的制剂高温高湿下放置30天的hplc图谱,图8为实施例1~4提供的制剂成品的溶出曲线,图9为实施例及对比例包装好的制剂高温高湿下放置30天的溶出曲线,表7为实施例及比较例制备得到的制剂成品以及包装好的制剂的溶出曲线,表8为实施例及比较例制备的包装好的制剂高湿30天保存后的有关物质情况统计表。
102.表7实施例及比较例制备得到的制剂成品以及包装好的制剂的溶出曲线
[0103][0104]
表8实施例及比较例制备的包装好的制剂高湿30天保存后的有关物质情况统计表
[0105][0106]
注释:因高湿条件仅影响盐酸替匹嘧啶杂质水平,此表仅统计盐酸替匹嘧啶的杂质。
[0107]
由图1~图9、表6、表7和表8可知,无论采用25℃时的临界湿度为85%以上的糖类,还是25℃时的临界湿度为85%以下的其他常用固体制剂赋型剂,实施例1、实施例2、实施例3和实施例4,0时间检测有关物质水平一致,均保持在较低水平。同时,采用本发明所述包装形式,无论与25℃时的临界湿度为85%以上的糖类赋型剂进行制剂组合,还是与25℃时的临界湿度为85%以下的其他常用固体制剂赋型剂组合,药品均具有良好的物理、化学稳定性,尤其是溶出曲线与初始制剂相同。而采用其他包装形式,即便与25℃时的临界湿度为85%以上的糖类赋型剂进行制剂组合在稳定性期间,也会出现杂质增加和溶出大幅度提高的情况。
[0108]
综上所述,本发明所述的包装形式可以提高药品质量和药品的安全性。
[0109]
以上实施例仅是本发明的优选实施方式,在不脱离本发明原理的前提下,在本发明中药组合物的基础上还可以作出若干改进、调整或润饰,这些也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1