神农香菊微乳剂及其制备方法、神农香菊微乳凝胶剂、化妆品
1.本发明涉及化妆品技术领域,具体涉及一种神农香菊微乳剂及其制备方法、神农香菊微乳凝胶剂、化妆品。
背景技术:
2.循环经济模式颇受关注,这是一种能够实现工业生产中废物利用率与潜在利用价值,以减少资源短缺和工业急速发展对环境造成的极大破坏,从而实现一种资源可持续利用和多元化发展的局势。就以往的研究与报道发现,工业作物每年会产生一定具有潜力的经济价值较低的工业副产品。
3.神农香菊(chrysanthemum indicum var.aromaticum,cia)系菊科菊属多年生草本植物,分布于湖北省神农架地区海拔2000m以上向阳的开阔空旷地上,全株具有独特的浓郁香气,为神农架地区特有植物。与原变种相比,神农香菊的特点在于花、叶均具有显著地香气,其浓郁的香味引起学者和企业的兴趣,神农香菊花被用来提取精油或浸膏,已经广泛应用于饮料、中药、化妆品及香烟中。神农香菊是我国特有植物,目前的研究多集中于神农香菊花的部位,而茎和叶则丢弃,造成了资源浪费。
技术实现要素:
4.本发明的目的是为了克服现有技术存在的无法利用神农香菊的茎和叶,造成资源浪费的问题,提供神农香菊微乳及其制备方法和微乳凝胶、化妆品。
5.为了实现上述目的,本发明一方面提供一种神农香菊微乳剂,该神农香菊微乳剂含有神农香菊茎叶提取物、油相、乳化剂、助乳化剂和水,其中,所述油相为神农香菊花精油。
6.优选地,相对于10重量份的所述油相,所述神农香菊茎叶提取物的含量为0.5~3重量份,所述乳化剂的含量为24~33重量份,所述助乳化剂的含量为22~31重量份;
7.优选地,所述神农香菊茎叶提取物、所述油相、所述乳化剂和所述助乳化剂的总量与水的重量之比为1:2~10。
8.优选地,所述神农香菊微乳剂含有0.44份神农香菊茎叶提取物、4.22份油相、13.27份乳化剂、12.52份助乳化剂和69.55份水。
9.优选地,所述乳化剂选自聚氧乙烯氢化蓖麻油rh-40、吐温-80、吐温-20、辛酸癸酸聚乙二醇甘油酯和氢化蓖麻油co-40中的至少一种,优选为吐温-80。
10.优选地,所述助乳化剂选自二乙二醇单乙基醚、聚甘油油酸酯和1,2-丙二醇中的至少一种,优选为二乙二醇单乙基醚。
11.优选地,所述神农香菊茎叶提取物按照以下工序制备:
12.将神农香菊茎叶用乙醇超声提取,过滤后收集提取液,浓缩,干燥,得粗提取物;
13.将粗提取物用d101大孔树脂柱进行纯化处理,然后浓缩、干燥,得到神农香菊茎叶提取物。
14.优选地,所述神农香菊花精油按照以下工序制备:
15.将神农香菊鲜花剪碎,然后加入氯化钠溶液中,充分混匀并浸泡1.5~2.5h,得到混合液;
16.向所述混合液中加入玻璃珠并混匀,然后加热,到沸腾状态后,保持4~6h,得到油状物;
17.将所述油状物冷却,然后加入无水硫酸钠以除去水分,得到神农香菊花精油。
18.本发明第二方面提供一种如上所述的神农香菊微乳剂的制备方法,所述制备方法包括以下步骤:
19.将神农香菊茎叶提取物、油相、乳化剂和助乳化剂混匀,得到混合物;
20.将所述混合物加入水中,混匀,得到神农香菊微乳剂。
21.本发明第三方面提供一种神农香菊微乳凝胶剂,所述神农香菊微乳凝胶剂包括聚合物材料、甘油以及如上所述的神农香菊微乳剂。
22.优选地,所述聚合物材料为透明质酸钠;
23.优选地,所述神农香菊微乳凝胶剂中,所述聚合物材料、甘油和油相的重量比为2:5~10:4~5。
24.本发明第四方面提供一种化妆品,所述化妆品包括如上所述的神农香菊微乳剂或如上所述的神农香菊微乳凝胶剂。
25.在本发明中,以神农香菊茎叶提取物和神农香菊花精油制得神农香菊微乳剂,通过二者的协同作用,使制得的神农香菊微乳剂的美白和抗衰老效果好,从而可以成功地应用于化妆品配方,并具有未来临床应用的潜力;神农香菊茎叶提取物的添加,降低了微乳剂的细胞毒性和皮肤刺激,使微乳剂的安全性高;此外,神农香菊茎叶提取物的使用,可以实现神农香菊茎叶的回收再利用,从而充分利用神农香菊全株植物,减少了资源的浪费,绿色环保。
附图说明
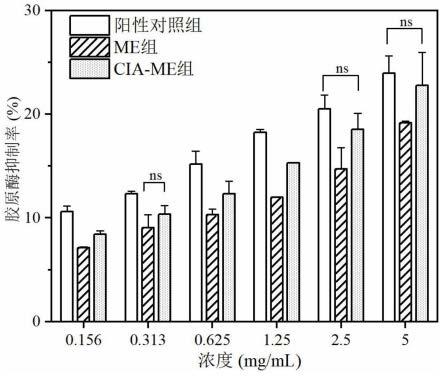
26.图1是实施例1制得的cia-me和对比例1制得的me对胶原蛋白酶的抑制活性对比;
27.图2是实施例1制得的cia-me和对比例1制得的me对弹性蛋白酶的抑制活性对比;
28.图3是实施例1制得的cia-me和对比例1制得的me对络氨酸酶的抑制活性对比;
29.图4为实施例1制得的cia-me、对比例1制得的me和曲酸对细胞酪氨酸酶活性的影响结果图;
30.图5为实施例1制得的cia-me、对比例1制得的me和曲酸对细胞内黑色素含量的影响结果图;
31.图6为实施例1制得的cia-me、对比例1制得的me和曲酸对细胞外黑色素含量的影响结果图;
32.图7为应用实施例1制得的神农香菊微乳凝胶剂、实施例1制得的cia-me、对比例1制得的me对l929细胞的毒性测试结果图;
33.图8为应用实施例1制得的神农香菊微乳凝胶剂、实施例1制得的cia-me、对比例1制得的me对b16f10黑色素瘤细胞的毒性测试结果图;
34.图9为高剂量0.5g的应用实施例1制得的神农香菊微乳凝胶剂、实施例1制得的
cia-me、对比例1制得的me对sd大鼠背部皮肤刺激试验结果图;
35.图10为低剂量0.1g的应用实施例1制得的神农香菊微乳凝胶剂、实施例1制得的cia-me、对比例1制得的me对sd大鼠背部皮肤刺激试验结果图。
具体实施方式
36.以下结合附图对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
37.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
38.本发明提出一种神农香菊微乳剂,该神农香菊微乳剂含有神农香菊茎叶提取物、油相、乳化剂、助乳化剂和水,其中,所述油相为神农香菊花精油。
39.微乳是由油相、乳化剂、助乳化剂组成的一种新型药物载体,在温和搅拌下遇水可自乳化成粒径小于100nm的水包油型乳剂,在增加难溶性药物溶解度、促进药物透皮吸收、提高生物利用度和减少水解方面具有明显优势近年来已广泛用于药物制剂开发中。在本发明中,微乳所载药物为神农香菊茎叶提取物。
40.本发明不限制所述神农香菊茎叶提取物的制备方法,可以采用常规方式制得,在本发明中,所述神农香菊茎叶提取物(ce)按照以下工序制备:
41.步骤a1、将神农香菊茎叶用乙醇超声提取,过滤后收集提取液,浓缩,干燥,得粗提取物;
42.步骤a2、将粗提取物用d101大孔树脂柱进行纯化处理,然后浓缩、干燥,得到神农香菊茎叶提取物。
43.具体地,在步骤(1)中,神农香菊茎叶与乙醇的料液比为1:5g/ml,即每1g神农香菊茎叶对应加入5ml乙醇。此外,所述乙醇的浓度为70%,超声提取时间为60min。
44.本发明采用d101树脂纯化神农香菊茎叶提取物的总黄酮和总酚。在一优选实施方式中,步骤(2)包括:将粗提取物用水溶解,得到上样液,然后上d101大孔树脂柱进行吸附,先用水洗脱以去除杂质,再用乙醇洗脱,收集乙醇洗脱液,收集洗脱液,在50℃下减压旋转蒸发浓缩,然后进行冷冻干燥以完全去除水分,得到神农香菊茎叶提取物;其中,上样液的浓度为0.12g/ml,上样体积3bv,上样流速为3bv/h,乙醇洗脱浓度80%,洗脱流速4.5bv/h,洗脱体积4bv。
45.本发明还采用acquity超高效液相色谱联用xevo g2-xs四极杆飞行时间质谱(uplc-q-tof-ms)(waters,usa),并采用masslynx 4.1数据处理软件对上述提取得到的神农香菊茎叶提取物进行uplc/q-tof-ms分析。通过分析确定了神农香菊茎叶提取物中的31种成分,表明神农香菊茎叶提取物中至少含有31种成分。在确定的31种成分中,黄酮醇11种,黄酮6种,黄烷酮5种,黄酮碳苷2种,异黄酮1种,黄酮醇1种,酚酸5种。ce中黄酮类化合物中以黄酮醇为主。此外,神农香菊茎叶提取物中黄酮类化合物的主要特征是黄酮苷元与一种或多种糖形成糖苷结构。
46.在本发明中,所述神农香菊花精油按照以下工序制备:
47.步骤b1、将神农香菊鲜花剪碎,然后加入氯化钠溶液中,充分混匀并浸泡1.5~2.5h,得到混合液。
48.步骤b2、向所述混合液中加入玻璃珠并混匀,然后加热,到沸腾状态后,保持4~6h,得到油状物;
49.步骤b3、将所述油状物冷却,然后加入无水硫酸钠以除去水分,得到神农香菊花精油。
50.在具体的实施方式中,所述神农香菊花精油的制备步骤为:将100g神农香菊鲜花剪碎,在烧杯中配制质量浓度为2.5~10%、体积为1000~1500ml的氯化钠溶液,将剪碎后的神农香菊鲜花加入该烧杯中充分混匀并浸泡2h,得到混合液;将混合液置于2000ml圆底烧瓶中,加数粒玻璃珠并振摇混合,连接挥发油测定器与回流冷凝管,自冷凝管上端加氯化钠溶液使其充满挥发油测定器的刻度部分,将圆底烧瓶置电热套中加热至微沸,调压并保持微沸状态,连续提取5h,得油状物;将油状物冷却放置后收集,用无水硫酸钠除去水分,得到神农香菊花精油。
51.本发明采用agilent 7890气相色谱(gc)与leco pegasus ht质谱联用,采用agilent db-5ms色谱柱(30cm
×
250μm
×
0.25μm,j&w scientific,folsom,ca,usa)对上述提取得到的神农香菊花精油进行气相色谱-质谱分析。水蒸气蒸馏所得神农香菊花精油共检测出64种成分。神农香菊花精油主要成分种类为萜烯类,其他含氧化合物主要为醛类、酯类、醇类和酮类,检测出的相对含量占神农香菊花精油总成分的90.799%。2h-吡喃-3(4h)-1,6-乙烯基二氢-2,2,6-三甲基-(23.291%)、菲兰丁烯(18.736%)、芳樟醇(13.811%)和(e)-β-法尼烯(3.23%)是该化合物中最突出的化合物。这些化合物在检测物质中所占比例分别为总萜(25.00%)、氧萜(34.38%)、芳香烃(1.56%)、芳香族含氧化合物(20.31)、脂肪族烃(3.13%)、脂肪族含氧化合物(7.81%)和苯丙素等其他化合物(7.81%)。
52.在本发明中,所述乳化剂选自聚氧乙烯氢化蓖麻油rh-40吐温-80(tween-80)、吐温-20(tween-20)、辛酸癸酸聚乙二醇甘油酯(labrasol)和氢化蓖麻油co-40中的至少一种,通过选用上述物质,使药物(即神农香菊茎叶提取物)在乳化剂中的溶解度高,从而使微乳的稳定性好。
53.为了使药物在助乳化剂中的溶解度高,从而使微乳的稳定性好,在本发明中,所述助乳化剂选自二乙二醇单乙基醚(transcutol-p)、聚甘油油酸酯(cc497)和1,2-丙二醇中的至少一种。
54.优选地,所述乳化剂为吐温-80,所述助乳化剂为二乙二醇单乙基醚(transcutol-p),如此,乳化剂和助乳化剂的配伍性良好,能制得神农香菊微乳液,且神农香菊微乳液的性能更好。
55.在本发明中,所述神农香菊茎叶提取物、所述油相、所述乳化剂和所述助乳化剂的总量与水的重量之比为1:2~10,优选为1:2~5。
56.在优选的实施方式中,相对于10重量份的所述油相,所述神农香菊茎叶提取物的含量为0.5~3重量份,所述乳化剂的含量为24~33重量份,所述助乳化剂的含量为22~31重量份。更优选地,相对于10重量份的所述油相,所述神农香菊茎叶提取物的含量为1~2重量份,所述乳化剂的含量为26~33重量份,所述助乳化剂的含量为25~30重量份。
57.在最优选的实施方式中,所述神农香菊微乳剂含有0.44份神农香菊茎叶提取物、
4.22份油相、13.27份乳化剂、12.52份助乳化剂和69.55份水,如此,制得的微乳液的粒径和分散度指数(pdi)最小。
58.可以理解的是,该最优选的实施方式可以换算为,相对于10重量份的所述油相,所述神农香菊茎叶提取物的含量为1.04重量份,所述乳化剂的含量为31.4重量份,所述助乳化剂的含量为29.67重量份,所述油相、所述乳化剂和所述助乳化剂的总量与水的重量之比为1:2.28。
59.本发明还提出了如上所述的神农香菊微乳剂的制备方法,该制备方法包括以下步骤:
60.步骤c1、将神农香菊茎叶提取物、油相、乳化剂和助乳化剂混匀,得到混合物;
61.步骤c2、将所述混合物加入水中,混匀,得到神农香菊微乳剂。
62.在具体的实施方式中,步骤c2包括:将所述混合物缓慢加入蒸馏水中,涡旋4小时,得到均匀的神农香菊微乳剂。也即,本发明制得的是水包油微乳液。
63.在本发明中,所述神农香菊茎叶提取物和油相(神农香菊花精油)的制备方法如前所述,在此不做赘述。
64.进一步地,本发明还提出一种神农香菊微乳凝胶剂,所述神农香菊微乳凝胶剂包括聚合物材料、甘油以及如上所述的神农香菊微乳剂。
65.聚合物材料一般不与乳化剂或助乳化剂发生反应,也不影响微乳液的稳定性。此外,通过制成微乳凝胶,能进一步降低药物毒性及刺激性,还能提高微乳的黏度,改善其与皮肤的黏附性,对水难溶性药物的释放和吸收有促进作用,具有微乳和凝胶的双重优点。因此,所述神农香菊微乳凝胶剂在皮肤表面的停留时间长,使其美白和抗衰老的效果好,且药物毒性和刺激性低。
66.在优选的实施方式中,所述聚合物材料为透明质酸钠。
67.通过甘油的添加,提高了制得的神农香菊微乳凝胶的保湿性。
68.进一步地,所述神农香菊微乳凝胶剂中,所述聚合物材料、甘油和油相的重量比为2:5~10:4~5,如此,制得的微乳凝胶的三维结构在环境条件下保持稳定。具体的,所述聚合物材料、甘油和油相的重量比可以为2:5:4、2:5:4.22、2:6:4.2、2:8:4.5、2:9:4.4或2:10:5,优选为2:5:4.22。
69.可以理解的是,在神农香菊微乳剂的基础上,制备神农香菊微乳凝胶剂时,由于要添加聚合物材料和甘油,因此,需要对应减少水的添加量,也即,在一优选实施例中,每100重量份的神农香菊微乳凝胶剂中,含有0.44份神农香菊茎叶提取物、4.22份油相、13.27份乳化剂、12.52份助乳化剂、62.55份水、2份聚合物材料和5份甘油,在上述配比下,制得的神农香菊微乳凝胶的性能优异。
70.在具体的实施方式中,所述神农香菊微乳凝胶剂按以下工序制得:将神农香菊茎叶提取物、神农香菊花精油、乳化剂和助乳化剂混匀,得到混合物;将所述混合物加入水中,混匀,形成均匀的微乳液(即神农香菊微乳剂)后,在搅拌状态下,加入聚合物材料和甘油,继续搅拌,直至形成透明的半固态水凝胶,即神农香菊微乳凝胶剂。
71.此外,本发明还提出一种化妆品,所述化妆品包括如上所述的神农香菊微乳剂或神农香菊微乳凝胶剂。
72.当原料为神农香菊微乳剂时,所述化妆品包括乳液、精华、面膜、面霜、化妆水和精
华液等。此外,还可将神农香菊微乳剂与其他辅料(防腐剂、香精等),和/或与其他组分(润肤剂等)一起制成化妆品使用。
73.当原料为神农香菊微乳凝胶剂时,可以直接作为化妆品使用,也可以作为组分之一,与其他辅料(例如防腐剂、香精等),和/或与其他组分(例如润肤剂等)一起制成化妆品使用。
74.需要说明的是,所述神农香菊微乳剂或神农香菊微乳凝胶剂的具体成分或制备方法参照上述实施例,由于本发明化妆品采用了上述所有实施例的全部技术方案,因此因此至少具有上述实施例的技术方案所带来的所有有益效果。也即,所述化妆品至少美白和抗衰老效果好,安全性高,且减少了资源的浪费,绿色环保。
75.以下将通过实施例对本发明进行详细描述,但本发明的保护范围并不局限于此。
76.以下实施例中,所用原料与化学试剂如下所示:
77.神农香菊花、茎、叶于2021年10月采自神农架中药产业研究所种植基地(湖北);大孔吸附树脂购自yurolite(中国);tween-80,tween-20,transcutol-p(二乙二醇单乙基醚),甘油和1,2-丙二醇来自macklin(中国);labrasol(辛酸癸酸聚乙二醇甘油酯)由gattefoss
é
(法国)提供;(法国)提供;oleique cc 497(聚甘油油酸酯)和120wda透明质酸(ha-t)采购自巴斯夫(马来西亚)。芦丁、儿茶素、曲酸购自源叶(中国)。小鼠成纤维细胞l929细胞株和小鼠黑色素瘤(b16f10)购自中国上海icell生物科技有限公司。dulbecco改良eagle medium(dmem)产自中国合肥百夏普。所有其他使用的化学品均为分析试剂级(中国,阿拉丁)。
78.实施例1
79.本实施例用于说明本发明所述的神农香菊微乳剂及其制备方法。
80.所述神农香菊微乳剂含有神农香菊茎叶提取物、油相(神农香菊花精油)、乳化剂(吐温-80)、助乳化剂(二乙二醇单乙基醚)和水;
81.其中,相对于10重量份的所述油相,神农香菊茎叶提取物的含量为1.04重量份,乳化剂的含量为31.4重量份,助乳化剂的含量为29.67重量份,神农香菊茎叶提取物、油相、乳化剂和助乳化剂的总量与水的重量之比为1:2.284(即神农香菊微乳剂含有以下重量份数的组分:0.44份神农香菊茎叶提取物、4.22份油相、13.27份乳化剂、12.52份助乳化剂和69.55份水);
82.神农香菊茎叶提取物按以下工序制备:
83.将神农香菊茎叶用乙醇超声提取,过滤后收集提取液,浓缩,干燥,得粗提取物,其中,神农香菊茎叶与乙醇的料液比为1:5g/ml,乙醇的浓度为70%,超声提取时间为60min;将粗提取物用水溶解,得到上样液,然后上d101大孔树脂柱进行吸附,先用水洗脱以去除杂质,再用乙醇洗脱,收集乙醇洗脱液,收集洗脱液,在50℃下减压旋转蒸发浓缩,然后进行冷冻干燥以完全去除水分,得到神农香菊茎叶提取物,其中,上样液的浓度为0.12g/ml,上样体积3bv,上样流速为3bv/h,乙醇洗脱浓度80%,洗脱流速4.5bv/h,洗脱体积4bv。
84.神农香菊花精油按以下工序制备:
85.将100g神农香菊鲜花剪碎,在烧杯中配制质量浓度为5%、体积为1200ml的氯化钠溶液,将剪碎后的神农香菊鲜花加入该烧杯中充分混匀并浸泡2h,得到混合液;将混合液置于2000ml圆底烧瓶中,加数粒玻璃珠并振摇混合,连接挥发油测定器与回流冷凝管,自冷凝
管上端加上述氯化钠溶液使其充满挥发油测定器的刻度部分,将圆底烧瓶置电热套中加热至微沸,调压并保持微沸状态,连续提取5h,得油状物;将油状物冷却放置后收集,用无水硫酸钠除去水分,得到神农香菊花精油。
86.所述神农香菊微乳剂由以下步骤制得:将神农香菊茎叶提取物、油相、乳化剂和助乳化剂混匀,得到混合物;将所述混合物缓慢加入蒸馏水中,涡旋4小时,得到均匀的微乳液,即神农香菊微乳剂,将其记作cia-me。
87.实施例2
88.按照实施例1所述的方法进行实施,与之不同的是:所述神农香菊微乳剂含有神农香菊茎叶提取物、油相(神农香菊花精油)、乳化剂(吐温-80)、助乳化剂(1,2-丙二醇)和水;其中,相对于10重量份的所述油相,神农香菊茎叶提取物的含量为0.8重量份,乳化剂的含量为25重量份,助乳化剂的含量为22重量份,神农香菊茎叶提取物、油相、乳化剂和助乳化剂的总量与水的重量之比为1:2.5;
89.神农香菊花精油的制备步骤中,氯化钠溶液的质量浓度为2.5%,体积为1500ml。
90.实施例3
91.按照实施例1所述的方法进行实施,与之不同的是:所述神农香菊微乳剂含有神农香菊茎叶提取物、油相(神农香菊花精油)、乳化剂(氢化蓖麻油co-40)、助乳化剂(聚甘油油酸酯)和水;其中,相对于10重量份的所述油相,神农香菊茎叶提取物的含量为3重量份,乳化剂的含量为33重量份,助乳化剂的含量为27重量份,神农香菊茎叶提取物、油相、乳化剂和助乳化剂的总量与水的重量之比为1:10。
92.实施例4
93.按照实施例1所述的方法进行实施,与之不同的是:所述神农香菊微乳剂含有神农香菊茎叶提取物、油相(神农香菊花精油)、乳化剂(聚氧乙烯氢化蓖麻油rh-40)、助乳化剂(二乙二醇单乙基醚)和水;其中,相对于10重量份的所述油相,神农香菊茎叶提取物的含量为1.6重量份,乳化剂的含量为27.8重量份,助乳化剂的含量为31重量份,神农香菊茎叶提取物、油相、乳化剂和助乳化剂的总量与水的重量之比为1:6。
94.对比例1
95.按照实施例1所述的方法实施,与之不同的是,神农香菊微乳剂中不含有神农香菊茎叶提取物,即神农香菊微乳剂含有以下重量份数的组分:4.22份油相、13.27份乳化剂、12.52份助乳化剂和69.99份水,将制得的神农香菊微乳剂记作me。
96.测试例1
97.将实施例1-4制得的cia-me和对比例1制得的me进行抗氧化能力、总黄酮含量(tfc)和总酚含量(tpc)测试。
98.1、测试方法
99.(1)清除2-2-diphenyl-1-苦味肼基(dpph)自由基测试方法如下:
100.在ep管中加入80%甲醇稀释的me和cia-me样品溶液150μl,再加入150μl dpph乙醇溶液,涡度混合,室温(25℃)暗置30min。室温离心5min(12000rpm),取200μl于96孔板上,用酶标仪在517nm处读取吸光度值a。dpph自由基清除实验以自由基的百分比计算,公式如下:
[0101][0102]
式中a1为无样品dpph溶液的吸光度;a2为dpph与样品溶液的吸光度;a3为不含dpph的样品溶液的吸光度。trolox的校正方程为y=1.9813x+2.7447(r2=0.9998),样品清除自由基活性以mmol trolox当量(mmolteac/l样品)表示。
[0103]
(2)2,2'-氨基-双-(3-乙基苯并噻唑啉-6-磺酸)(abts)自由基清除测试方法如下:
[0104]
abts与过硫酸钾(k2s2o8)反应生成绿色abts+自由基,在734nm处吸收峰最强。在抗氧化剂存在的情况下,抗氧化剂与abts自由基结合,使颜色逐渐褪色。abts接收到的电子越多,颜色就越淡。将7.4mmol/l的abts溶液与2.6mmol/l的k2s2o8溶液等体积混合,置于室温暗置12-16h,制备abts工作液。用80%无水乙醇稀释得到的溶液,734nm处吸光度为0.70
±
0.05。取不同浓度的标准溶液和样品溶液各10ul,加入200μl的abts工作液,室温孵育2-6min。在734nm处测定od值,3次平行测定后按公式计算abts自由基清除率。trolox清除自由基活性的校准方程为y=0.6676-0.6578x(r2=0.9996),样品清除自由基活性以mmol trolox当量(mmol teac/l样品)表示。
[0105]
(3)铁还原抗氧化能力(frap)测试方法如下:frap工作液:0.3mol/l醋酸钠缓冲液(ph 3.6)、10mmol/l tptz溶液(溶于40mmol/l盐酸中)、20mmol/l fecl3溶液,按体积比10:1:1混合。取不同浓度的标准溶液和样品溶液各5μl,加入frap工作液180μl,37℃孵育3-5min。在734nm处测定od值,三次平行测定后按公式计算frap自由基清除率。铁离子还原抗氧化能力(frap)的标定方程为y=0.2846x-0.00513(r2=0.9995)。样品的铁还原抗氧化能力以mmolfeso4当量(mmolfeso4/l样品)表示。
[0106]
(4)总黄酮含量(tfc)测试方法如下:取样品(4mg/ml)适量,与10%亚硝酸钠溶液、5%硝酸铝、4%氢氧化钠和适量超纯水混合均匀。以芦丁(0.01-0.06mg/ml)作为标准对照,使用紫外-可见分光光度计在510nm处测量吸光度。芦丁标准曲线方程为y=11.7x+0.0054(r2=0.9990)。样品中总黄酮含量以芦丁的当量表示(mg/g)。
[0107]
(5)总酚含量(tpc)测试方法如下:取样品(4mg/ml)适量,取适量与0.5ml福林-酚试剂涡旋混匀,加入6%碳酸钠溶液和适量蒸馏水,涡旋混匀。以儿茶酚(20-120μg/ml)为标准对照,使用紫外-可见分光光度计在760nm处测量吸光度。以儿茶酚标准曲线方程为y=0.0093x+0.0005(r2=0.9997)。样品中总酚含量以儿茶酚的当量表示(mg/g)。
[0108]
2、测试结果如下表1所示。
[0109]
表1
[0110]
nitroanilide(sana)溶液。孵育10分钟后,在405nm处测定吸光度。所有酶抑制率计算公式如下:
[0122][0123]
式中a0为控制管的吸光度;a1为与样品反应混合物的吸光度。
[0124]
2、测试结果如图1和图2所示(图1和图2中,ns指的是无显著差异)。
[0125]
由图1和图2可以看出,实施例1制得的cia-me对胶原酶和弹性蛋白酶的抑制活性好,优于对比例1制得的me。特别在抗胶原酶实验中,当cia-me浓度为2.5mg/ml和5mg/ml时,cia-me与阳性对照组差异无统计学意义。并且,在抗弹性蛋白酶实验中,cia-me除最低浓度外的活性均高于阳性对照组。
[0126]
测试例3
[0127]
将实施例1制得的cia-me和对比例1制得的me进行美白性能测试。
[0128]
1、酪氨酸酶抑制活性测试
[0129]
酪氨酸酶是黑色素生成的主要限速酶,其活性与黑色素含量呈正相关。多巴转化为多巴胺醌是由酪氨酸酶促进的。多巴胺醌有两种代谢途径。前者转化为黑色素,后者与黑色素相互作用,将半胱氨酸转化为棕色黑色素。如果样品能抑制酪氨酸酶的活性,就能间接抑制黑色素的形成,从而具有美白效果。
[0130]
(1)抑制酪氨酸酶活性测试方法如下:
[0131]
将不同浓度的样品溶液加到96孔板上,分别加入40μl酪氨酸酶(磷酸盐缓冲液310u/ml)和80μl磷酸盐缓冲液(0.1m,ph=6.8),25℃孵育10min,再加入40μl底物(2.5mm l-酪氨酸或5mm l-dopa),25℃孵育10min。孵育后,用酶标仪在475nm处测量吸光度。
[0132]
(2)测试结果如图3所示(其中,图3a以l-酪氨酸为底物时酪氨酸酶的抑制活性;图3b以l-多巴为底物时酪氨酸酶的抑制活性,ns指的是无显著差异)。
[0133]
由图3a可以看出,以l-酪氨酸为底物时,cia-me浓度分别为0.625mg/ml和2.5mg/ml时,抗酪氨酸酶活性与阳性对照无显著差异。由图3b所示,以l-多巴为底物时,除了浓度均为0.156mg/ml和0.313mg/ml时,其余浓度的cia-me的抗酪氨酸酶活性低于阳性对照。以l-酪氨酸和l-多巴为底物时,5mg/ml cia-me抗酪氨酸酶活性无显著差异。说明神农香菊茎叶提取物的添加也显著提高了me的抗酪氨酸酶活性。
[0134]
2、b16f10黑色素瘤细胞的黑色素生成实验
[0135]
为了进一步探索me和cia-me的皮肤美白特性,我们建立b16f10黑色素瘤细胞模型,研究其对黑色素生成的抑制作用。并根据细胞毒性实验(见测试例4)选择适当的浓度进行实验。α-msh通过与细胞膜上的受体结合激活camp通路,导致mitf表达的激活,继而酪氨酸酶的表达,从而促进黑素生成。
[0136]
2.1、测试方法
[0137]
(1)胞内酪氨酸酶活性测定方法如下:
[0138]
将b16f10细胞接种于24孔板,每孔5
×
104个细胞,过夜贴壁。然后将细胞暴露于200nm的α-黑素细胞刺激激素(α-msh)中48小时。处理后,用磷酸盐缓冲液洗涤两次,并用pbs和1%tritonx-100裂解细胞。细胞裂解液10000g离心10min,每个细胞上清液溶于100μl0.1mm磷酸钠缓冲液(ph6.8)中,与100μl 5mm l-dopa 96孔板混合,然后在37℃孵育3h。通
过测量475nm处的吸光度并与100%的对照细胞比较,计算每个样品的胞内酪氨酸酶活性。
[0139]
(2)抑制黑色素生成实验测试方法如下:
[0140]
实验前一天将5
×
104细胞/孔接种于24孔板中,co2培养箱培养24
±
2h,每孔加入细胞培养基2ml。样品在200nmα-msh细胞培养基中孵育24小时后,使用前用0.22μm过滤器过滤。实验过程中,将24孔板中的细胞培养液弃之后,加入含检测样品或对照样品及α-msh的细胞培养液2ml,在co2培养箱中孵育48
±
2h。
[0141]
细胞外黑色素含量测定:培养结束后,收集细胞上清,置于1.5ml ep管中,200μl置于96孔板上,酶标仪在405nm处测定吸光度。
[0142]
细胞黑色素含量测定:培养后用pbs洗涤2次,加入1n naoh 250μl,60℃裂解20min。取上述细胞裂解液上清200μl于96孔板中,用酶标仪在405nm处测定吸光度。与对照细胞比较,计算每个样品细胞外和细胞内的黑色素含量均为100%。
[0143]
2.2、测试结果如图4-6所示,其中,处理过的细胞的每一个百分比相对于对照组的报告。在p《0.05处验证数据的统计学差异,在图中以不同的上标表示。
[0144]
图4为对比例1制得的me、实施例1制得的cia-me和曲酸(kojic)对细胞酪氨酸酶活性的影响结果图,由图4可以看出,对比例1制得的me和实施例1制得的cia-me可以抑制酪氨酸酶活性。与α-msh处理对照细胞相比,1.25mg/ml时cia-me对细胞酪氨酸酶活性的抑制作用(58.63%)显著高于曲酸处理对照细胞(50.94%)。在0.0195mg/ml~0.313mg/ml浓度范围内,cia-me组酪氨酸酶活性始终显著高于me组。
[0145]
图5和图6分别为对比例1制得的me、实施例1制得的cia-me和曲酸(kojic)对细胞内和细胞外黑色素含量的影响结果图。细胞外和细胞内的黑色素含量以载体的百分比表示。
[0146]
由图5和图6可以看出,me和cia-me对b16f10细胞的黑色素合成有明显的剂量依赖性抑制作用。当两种浓度均为1.25mg/ml时,cia-me(90.07%)对曲酸对照(103.17%)细胞内黑色素含量的抑制作用强于α-msh处理的对照细胞。此外,cia-me对细胞内黑色素含量的抑制作用(99.33%)与曲酸对照(98.12%)相当。同样,me在实验浓度范围内对细胞外黑色素和细胞内黑色素含量均有特异性抑制作用,且呈剂量依赖性。
[0147]
通过酪氨酸酶抑制活性测试和b16f10黑色素瘤细胞的黑色素生成实验结果可以看出,神农香菊花精油与神农香菊茎叶提取物具有极好的协同作用,可同时应用于美白化妆品,发挥神奇的天然美白效果。
[0148]
应用实施例1
[0149]
本实施例用于说明本发明所述的神农香菊微乳凝胶剂及其制备方法。
[0150]
所述神农香菊微乳凝胶剂含有透明质酸钠、甘油和神农香菊微乳剂,其中,神农香菊微乳剂为实施例1所述的神农香菊微乳剂,且透明质酸钠、甘油和油相的重量比为2:5:4.22(即:每100重量份的神农香菊微乳凝胶剂中,含有0.44份神农香菊茎叶提取物、4.22份油相、13.27份乳化剂、12.52份助乳化剂、62.55份水、2份聚合物材料和5份甘油)。
[0151]
所述神农香菊微乳凝胶剂由以下步骤制得:
[0152]
在搅拌状态下,将透明质酸钠粉和甘油加入神农香菊微乳剂中,然后继续搅拌,直至形成透明的半固态水凝胶,即神农香菊微乳凝胶剂。
[0153]
应用实施例2
[0154]
按照应用实施例1所述的方法进行实施,与之不同的是:透明质酸钠、甘油和油相的重量比为2:6:4。
[0155]
应用实施例3
[0156]
按照应用实施例1所述的方法进行实施,与之不同的是:透明质酸钠、甘油和油相的重量比为2:10:4。
[0157]
测试例4
[0158]
将应用实施例1制得的神农香菊微乳凝胶剂、实施例1制得的cia-me和对比例1制得的me进行体外细胞毒性和皮肤刺激性测试。
[0159]
1、测试方法
[0160]
(1)采用mtt细胞毒性试验评估me、cia-me和神农香菊微乳凝胶剂对小鼠l929纤维肉瘤和黑色素瘤b16f10细胞的细胞毒性。具体操作如下:l929细胞与b16f10在5%co2培养箱中37℃培养。采用由10%(v/v)胎牛血清和1%抗生素(100iu/ml青霉素和100μg/ml链霉素)组成的改良eagle培养基(dmem)培养l929和b16f10细胞。实验前一天,将1
×
104细胞/孔接种到96孔板中,在co2培养箱(rwd,中国)中培养24
±
2h,每孔加入200μl细胞培养液。样品在dmem培养基中孵育24h,使用前用0.22μm过滤器过滤。将指数生长期的细胞以1
×
104细胞/孔的密度接种于96孔板,培养24h,然后加入含不同浓度实验组的新鲜培养基100μl。孵育24h后,加入50份mtt液,在培养箱中继续培养2h。去除mtt溶液后,每孔加入100μl异丙醇溶液,摇板。用微孔板计测定570nm处的吸光度。
[0161]
(2)通过皮肤刺激试验,测定me、cia-me和神农香菊微乳凝胶剂在两种不同剂量下对sd大鼠皮肤的毒性。在其中一个剂量试验中,所有大鼠随机分为四组,每组3只,包括三个试验组(me组、cia-me组和cia-me凝胶组)和对照组(生理盐水处理组)。实验前24小时左右,实验动物背部的皮毛在不损伤表皮的情况下被去毛,左右两侧的去毛范围约为2cm
×
2cm。试验中,每天1次将0.5g和0.05g生液直接涂抹在无毛皮肤上,连续7天,每天观察红斑和水肿的发展。为观察皮肤深层组织病理变化,评价被试制剂在皮肤上的安全性,将处理后的皮肤用4%多聚甲醛固定,石蜡包埋,切片,苏木精/伊红染色,组织学显微镜拍照。
[0162]
2、测试结果如图7-10所示,其中,cia-megel指的是神农香菊微乳凝胶剂,control指的是对照组。
[0163]
图7为样品对l929细胞处理后,l929细胞的细胞活力;图8为样品对b16f10细胞处理后,b16f10细胞的细胞活力。*p《0.05;**p《0.01;***p《0.001。
[0164]
由图7可以看出,当me浓度为2.5mg/ml时,l929细胞活力低于80%。当cia-me浓度为5mg/ml时表现出细胞毒性。在不同浓度的神农香菊微乳凝胶剂(0.156~5mg/ml)下,l929细胞的活力保持在95%以上。
[0165]
由图8可以看出,所有样品在浓度为5mg/ml时,b16f10黑色素瘤细胞的活性均小于80%。因此,采用0.156-0.313mg/ml me和0.156-1.25g/ml cia-me进行前文的抑制b16f10黑色素瘤细胞黑色素生成能力的实验。
[0166]
图9为me、cia-me和神农香菊微乳凝胶剂在高剂量0.5g下对sd大鼠皮肤的毒性结果图(分别为直接观察图和大鼠切片显微照片,100x),图10为me、cia-me和神农香菊微乳凝胶剂在低剂量0.1g下对sd大鼠皮肤的毒性结果图。在使用部位观察到皮肤红斑和水肿,表明该配方可能刺激皮肤。
[0167]
实验采用0.5g高剂量样品时,观察给药部位的皮肤照片和病理组织切片,由图9可以看出,me组皮肤刺激反应最强,其表皮广泛坏死、脱落,炎症细胞浸润;cia-me组刺激反应较me组轻,主要表现为表皮部分上部细胞坏死和过度角化;与对照组(正常皮肤)相比,cia-me凝胶组未见明显异常。这意味着该神农香菊微乳凝胶剂可以减少微乳液对皮肤的刺激。
[0168]
低剂量0.1g组,由图10可以看出,连续给药7天后,与对照组相比,me、cia-me和cia-me凝胶没有对大鼠皮肤造成任何刺激,说明皮肤表面的上皮衬里和颗粒细胞结构完整,真皮未见明显炎症细胞浸润及水肿组织损伤。
[0169]
上述测试结果表明,神农香菊茎叶提取物和透明质酸钠的加入可以降低me的细胞毒性和皮肤刺激性,提高其生物利用度。
[0170]
另外,按照与实施例1相同的测试方法,对实施例2-4进行测试,测试结果显示,制得的神农香菊微乳的美白效果和抗衰老效果均优于对比例1,且细胞毒性和皮肤刺激性低于对比例1。
[0171]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1