乌梅治疗糖尿病的用途
1.本发明涉及医药技术领域,具体涉及一种乌梅治疗糖尿病的用途。
背景技术:
2.目前糖尿病是全世界严重的健康问题之一,而现有的降血糖药物存在由于需要长期用药而导致的药物副作用大等问题,故糖尿病的治疗仍然是人类健康的一个巨大挑战。从传统的中药材中筛选出天然的降血糖化学成分,以期为糖尿病的治疗寻找到更有效、更安全以及更经济的药物具有重要意义。
3.自公元前1550年世界上出现了第一份称为“多尿”疾病的文字记录,人类对于糖尿病这个古老的病种认识已有3000余年,但迄今为止仍是医学上未解决的难题之一。2019年国际糖尿病联合会调查结果显示,目前全球约有4.63亿人患有糖尿病,预计2045年将增至7亿,糖尿病患病率的增长速度令人担忧此外,有研究显示糖尿病人会增加其患癌症、心血管疾病、残疾等疾病的风险,糖尿病的并发症是其死亡率高的主要原因。
4.目前治疗糖尿病的药物中占主导地位的是西药,其具有起效快及作用靶点明确等优势,但另一方面,由于糖尿病患者需长期服药的特点,使其易产生耐受、肝肾损伤、造血系统损害等副作用日益凸显。中医治疗糖尿病(消渴病)已有数千年的历史,尤其对于糖尿病慢性并发症的防治取得了很好的临床效果。
技术实现要素:
5.基于此,本发明提供了一种乌梅水提物、乌梅水提物的70%醇部位和 /或乌梅总黄酮提取物在制备用于预防和/或治疗血糖异常和/或糖尿病和/或糖尿病并发症的药品、食品和/或保健品中的用途。
6.根据本发明的另一个方面,提供了一种乌梅水提物、乌梅水提物的 70%醇部位和/或乌梅总黄酮提取物在制备用于抑制α-淀粉酶和/或α-葡萄糖苷酶的药品、食品和/或保健品中的用途。
7.根据本发明的另一个方面,提供了一种包含乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物的药物组合物或药物制剂在制备用于预防和/或治疗血糖异常和/或糖尿病和/或糖尿病并发症的药品、食品和/ 或保健品中的用途。
8.根据本发明的另一个方面,提供了一种包含乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物的药物组合物或药物制剂在制备用于抑制α-淀粉酶和/或α-葡萄糖苷酶的药品、食品和/或保健品中的用途。
9.进一步地,该乌梅水提物通过以下方法制备:
10.(1)将该乌梅去核后,置于烘箱中干燥、粉碎并过筛,得到乌梅去核粗粉;(2)称取适量的该乌梅去核粗粉置于容器中,以第一液料比加入水,预浸15~60min后加热回流提取1~3h,放至室温后过滤,得到第一滤液;(3)在该容器中以第二液料比加入水,加热回流提取1~3h,放至室温后过滤,得到第二滤液;以及(4)合并该第一滤液和该第二滤液、减压浓
缩并蒸干,得到该乌梅水提物。
11.进一步地,该干燥的温度为35℃至55℃。进一步地,该干燥的温度为约45℃。进一步地,该干燥的时间为5~7h。进一步地,该干燥的时间为约6h。进一步地,该筛为三号筛。进一步地,该容器为提取罐或烧瓶。进一步地,该提取罐为中药提取罐。进一步地,该提取罐为具有加热和/或搅拌功能的提取罐。进一步地,该烧瓶为圆底烧瓶。进一步地,该第一液料比为1:7~1:13。进一步地,该第一液料比为约1:10。进一步地,该第二液料比为1:6~1:10。进一步地,该第二液料比为约1:8。进一步地,该第一液料比与该第二液料比是相同的或不同的。进一步地,该预浸的时间为约30min。进一步地,该加热回流提取的时间为约2h。进一步地,该蒸干是在水浴中进行的。进一步地,该水浴的温度为40℃至60℃例如约50℃。
12.进一步地,该乌梅水提物的70%醇部位通过以下方法制备:(1)称取适量的该乌梅水提物,加入水形成混悬液,将该混悬液上样于大孔树脂;(2)分别使用水、30%醇和70%醇进行洗脱(其中,每个部位洗脱 5至8个柱体积,例如5个柱体积或8个柱体积);以及(3)将该70%醇洗脱获得的洗脱液减压浓缩并蒸干,得到该乌梅水提物的70%醇部位。
13.进一步地,该大孔树脂为d101大孔树脂。进一步地,该蒸干是在水浴中进行的。进一步地,该水浴的温度为40℃至60℃例如约50℃。
14.进一步地,该乌梅总黄酮提取物通过以下方法制备:(1)将该乌梅去核后,置于烘箱中干燥、粉碎并过筛,得到乌梅去核粗粉;(2)称取适量的该乌梅去核粗粉置于容器中,加入石油醚脱脂,得到脱脂后的乌梅去核粗粉;(3)将该脱脂后的乌梅去核粗粉置于该容器中,以第一液料比加入第一溶剂,加热回流提取1~3h,放至室温后过滤,得到第一滤液;(4)在该容器中以第二液料比加入该第一溶剂,加热回流提取1~3 h,放至室温后过滤,得到第二滤液;(5)合并该第一滤液和该第二滤液、减压浓缩并蒸干,得到浸膏;以及(6)将该浸膏用水溶解,乙酸乙酯萃取,将乙酸乙酯层减压浓缩至干并蒸干,得到该乌梅总黄酮提取物。
15.进一步地,该干燥的温度为35℃至55℃。进一步地,该干燥的温度为约45℃。进一步地,该干燥的时间为5~7h。进一步地,该干燥的时间为约6h。进一步地,该筛为三号筛。进一步地,该容器为烧瓶例如圆底烧瓶。进一步地,该第一液料比为1:7~1:13。进一步地,该第一液料比为约1:10。进一步地,该第二液料比为1:7~1:13。进一步地,该第二液料比为约1:10。进一步地,该第一液料比与该第二液料比是相同的或不同的。进一步地,该第一溶剂为65%~75%乙醇例如约60%乙醇。进一步地,该加热回流提取的时间为约2h。进一步地,该蒸干是在水浴中进行的。进一步地,该水浴的温度为40℃至60℃例如约50℃。
16.进一步地,该药物组合物包括α-淀粉酶抑制剂、α-葡萄糖苷酶抑制剂、双胍类降糖药、磺脲类降糖药、噻唑烷二酮类降糖药、格列奈类降糖药和二肽基肽酶-4抑制剂。进一步地,该α-淀粉酶抑制剂来自于植物种子的胚乳和/或微生物的代谢产物。进一步地,该植物为小麦、大米、高粱、花生和/或豆类植物。进一步地,该α-葡萄糖苷酶选自以下的一种或多种:阿卡波糖、伏格列波糖和米格列醇。进一步地,该双胍类降糖药为二甲双胍。进一步地,该磺脲类降糖药选自以下的一种或多种:格列本脲、格列美脲、格列齐特、格列吡嗪和格列喹酮。进一步地,该噻唑烷二酮类降糖药选自以下的一种或多种:罗格列酮和吡格列酮。进一步地,该格列奈类降糖药选自以下的一种或多种:瑞格列奈、那格列奈和米格列奈。进一步地,该二肽基肽酶-4抑制剂选自以下的一种或多种:西格列汀、沙格列汀和维格列汀。
17.进一步地,该药物制剂包括一种或多种辅料。进一步地,该辅料选自以下的一种或
多种:崩解剂、粘合剂、填充剂、润滑剂、助流剂和着色剂。进一步地,该崩解剂选自以下的一种或多种:羧甲淀粉钠、聚维酮、低取代羟丙纤维素和预胶化淀粉。进一步地,该粘合剂选自以下的一种或多种:微晶纤维素、聚维酮、羟丙基甲基纤维素、聚乙烯吡咯烷酮、糊精、聚乙烯醇、阿拉伯胶、琼脂、明胶、黄蓍胶和聚乙二醇。进一步地,该填充剂选自以下的一种或多种:硅化微晶纤维素、微晶纤维素和乳糖。进一步地,该润滑剂选自以下的一种或多种:硬脂酸镁、硬脂酸钙和滑石粉。进一步地,该乳化剂选自以下的一种或多种:山梨醇酐单硬脂酸酯、山梨糖醇脂和大豆磷脂。进一步地,该着色剂为赤鲜红或日落黄。进一步地,该药物制剂的剂型为胶囊剂、片剂、颗粒剂、散剂、锭剂、冲剂、粉剂和丸剂。
18.进一步地,该血糖异常为糖耐量异常、胰岛素抵抗性和/或高胰岛素血症。进一步地,该糖尿病为临界性糖尿病、自发性i型糖尿病、诱发型 i型糖尿病、自发性ii型糖尿病和/或诱发型ii型糖尿病。进一步地,该糖尿病为化学物质和/或高脂高糖所诱导的糖尿病。进一步地,该化学物质为四氧嘧啶和/或链脲佐菌素。进一步地,该四氧嘧啶的造模方法包括腹腔注射约120mg/kg的四氧嘧啶(alx)约24小时后再次注射约100 mg/kg的四氧嘧啶。进一步地,该糖尿病并发症为血脂紊乱。进一步地,该乌梅水提物的70%醇部位是通过保护胰岛细胞、改善血脂代谢和/或增强机体抗氧化的作用而发挥降血糖作用的。
19.本发明的有益效果:
20.本发明通过制备乌梅中不同活性部位,以酶-抑制剂体外筛选模型和体内动物模型相结合的方式,确定乌梅体外降血糖的活性部位,为乌梅在降血糖中药应用中的开发提供理论依据。
附图说明
21.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的附图,而并不超出本发明所要求保护的范围。
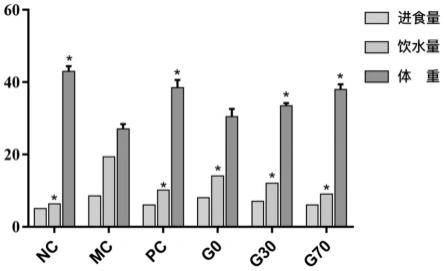
22.图1为大孔树脂不同部位给药组小鼠给药四周后饮食、饮水及体重比较示意图。与模型对照组(mc)比较,各给药组小鼠体重均有上升,饮食、饮水量均有一定下降(与g0相比,g70的饮水量和体重均p《0.05,而g30介于二者之间)。
23.图2为大孔树脂不同部位给药组小鼠给药四周期间的空腹血糖值示意图。其中a、b、c、d、e分别为nc、pc、g0、g30、g70组与mc 组4周给药期间的空腹血糖值对比图;f图为各组的降糖率。与模型对照组(mc)比较,测定数据显示,给药4周,g0的降糖率为5%,g30组的降糖率为20%,g70的降糖率为35%(与g0和g30相比,g70的降糖率均p《0.05)。
24.图3为大孔树脂不同部位给药组给药四周后给予小鼠灌胃2g/kg的葡萄糖溶液后不同时间点的血糖值比较示意图。其中a、b、c、d、e分别为nc、pc、g0、g30、g70组与mc组灌胃2g/kg的葡萄糖溶液后不同时间点的血糖值对比图;f图为各组的auc值。与模型对照组(mc)比较,各组的auc显著降低,降低幅度pc》g70》g30》g0组(与g0和 g30相比,g70的auc均p《0.05)。
25.图4为大孔树脂不同部位给药组小鼠给药四周后胰腺病理切片图 (200x)。
26.图5为大孔树脂不同部位给药组小鼠给药四周后抗氧化结果示意图。
27.其中a、b、c分别为各组gsh-px、mda和sod含量。与模型对照组 (mc)比较,四周给药后各组给药血清中的sod、gsh-px以及mda 水平均有一定的恢复,除gsh-px指标外,其余两个指标均恢复至正常水平(与g0相比,g70的gsh-px、mda和sod含量均p《0.05)。
28.图6为大孔树脂不同部位给药组小鼠给药四周后血脂结果示意图。其中a、b、c分别为各组tc、tg、ldl-c和hdl-c含量。与模型对照组 (mc)比较,pc组和各给药组均能降低其tc、tg含量;给药28天后ldl-c水平有一定的改善,含量以pc组最低,g70次之,g30次之,最后是g0;给药4周后,pc组和各治疗组的hdl-c浓度均有一定增高 (与g0相比,g70的tg、ldl-c和hdl-c含量均p《0.05)。
具体实施方式
29.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明所保护的范围。
30.除非另外说明,本文所用的所有技术和科学术语和缩略语具有本发明领域或该术语应用领域中普通技术人员通常所理解的含义。虽然本发明实施过程中可使用类似于或等价于本文公开的那些的任何比例、温度、物质或材料,但本文描述了优选的比例、温度、物质或材料。本发明包含多个方面、特征和实施方案,其中这样的多个方面、特征和实施方案可以以任意期望的方式组合和变型。本发明的这些和其它方面、特征和实施方案在参照本发明的其余部分包括如下详细描述时变得显而易见。除非上下文清楚地指明,如本文所用,单词的单数形式包括复数,反之亦然。因此,“一”、“一个”和“该”通常包括相应术语的复数。例如,“一种乌梅水提物”包括所述“乌梅水提物”的复数。类似的,术语“例如”,特别是位于一系列术语前面时,仅表示示范性和解释性的,不应被视为是排除性的或综合性的。
31.正如背景技术部分所描述的,现有上市的治疗糖尿病的药物存在严重的不良反应、毒性较大、药物作用机制较为单一的问题。为了解决上述问题,本发明提供了一种乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物在制备用于预防和/或治疗血糖异常和/或糖尿病和/ 或糖尿病并发症的药品、食品和/或保健品中的用途。
32.乌梅为蔷薇科植物梅prunus mume(sieb.)sieb.et zucc.近成熟的干燥果实经过低温烘干后焖至色变黑而成,其别名又为“熏梅”,“黑梅”,“酸梅”等。乌梅的药用来源历史悠久,最早记载于《神农本草经》,被列为中品。乌梅被收录于第一批药食两用的中药材目录,是食品或药品开发的重要原料之一。《神农本草经》记载:“梅,木似杏而枝干劲脆,春初时开白花,花将谢而叶始生,二月结实如豆,五月采将熟大于杏者之,以百草烟熏至黑色即为乌梅也”。乌梅的原植物为落叶小乔木,在世界各地均有广泛分布,但主要分布在东南亚国家。在我国乌梅种植主要分布于四川、浙江以及福建等省,其中以四川省达州市最具盛名,其种植距今已有600多年的历史,种植历史及种植面积均为全国之最。
33.根据本发明的另一个方面,提供了一种乌梅水提物、乌梅水提物的 70%醇部位和/或乌梅总黄酮提取物在制备用于抑制α-淀粉酶和/或α-葡萄糖苷酶的药品、食品和/或保健品中的用途。
34.本发明的术语“食品”、“保健品”的含义是期望被动物(包括人) 摄入并向该动物
提供营养或保健作用的产品或组合物。本发明的术语“食品”、“保健品”还可被表述为“食物产品”、“保健产品”、“保健组合物”或“食物组合物”等。
35.根据本发明的另一个方面,提供了一种包含乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物的药物组合物或药物制剂在制备用于预防和/或治疗血糖异常和/或糖尿病和/或糖尿病并发症的药品、食品和/ 或保健品中的用途。
36.根据本发明的另一个方面,提供了一种包含乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物的药物组合物或药物制剂在制备用于抑制α-淀粉酶和/或α-葡萄糖苷酶的药品、食品和/或保健品中的用途。
37.在一种优选的实施方式中,该乌梅水提物通过以下方法制备:(1) 将该乌梅去核后,置于烘箱中干燥、粉碎并过筛,得到乌梅去核粗粉; (2)称取适量的该乌梅去核粗粉置于容器中,以第一液料比加入水,预浸15~60min后加热回流提取1~3h,放至室温后过滤,得到第一滤液; (3)在该容器中以第二液料比加入水,加热回流提取1~3h,放至室温后过滤,得到第二滤液;以及(4)合并该第一滤液和该第二滤液、减压浓缩并蒸干,得到该乌梅水提物。
38.在一种优选的实施方式中,该干燥的温度为35℃至55℃。在一种优选的实施方式中,该干燥的温度为约45℃。在一种优选的实施方式中,该干燥的时间为5~7h。在一种优选的实施方式中,该干燥的时间为约6 h。在一种优选的实施方式中,该筛为三号筛。在一种优选的实施方式中,该容器为提取罐或烧瓶。在一种优选的实施方式中,该提取罐为中药提取罐。在一种优选的实施方式中,该提取罐为具有加热和/或搅拌功能的提取罐。在一种优选的实施方式中,该烧瓶为圆底烧瓶。在一种优选的实施方式中,该第一液料比为1:7~1:13。在一种优选的实施方式中,该第一液料比为约1:10。在一种优选的实施方式中,该第二液料比为 1:6~1:10。在一种优选的实施方式中,该第二液料比为约1:8。在一种优选的实施方式中,该第一液料比与该第二液料比是相同的或不同的。在一种优选的实施方式中,该预浸的时间为约30min。在一种优选的实施方式中,该加热回流提取的时间为约2h。在一种优选的实施方式中,该蒸干是在水浴中进行的。在一种优选的实施方式中,该水浴的温度为40℃至 60℃例如约50℃。
39.在本发明中,温度、时间、液料比或者其它参数以范围、优选范围、或一系列上限优选值和下限优选值限定的范围表示时,这应当被理解为具体公开了由任何范围上限或优选值与任何范围下限或优选值的任一配对所形成的所有范围,而不论该范围是否单独公开了。例如,当公开了范围“35℃至55℃”时,除非另外说明,否则该范围意图包括其端值和在该范围内的所有点值,例如35、36、37、38、39、40、41、42、43、44、 45、46、47、48、49、50、51、52、53、54、55等等,不限于上述所列举的这些数值。并且在上述的数值范围内,均能够实现本发明的效果。
40.关于数值的术语“约”或“大约”意指该数值的
±
5%,但明确地包括确切的数值。例如,“约”45℃的温度是指从42.75℃至47.25℃的浓度,但也明确地包括刚好45℃的温度;“约”6h的时间是指从5.7h至6.3h 的时间,但也明确地包括刚好6h的时间;“约”1:10的液料比是指从 1:9.5至1:10.5的时间,但也明确地包括刚好1:10的液料比;“约”1:8的液料比是指从1:7.6至1:8.4的液料比,但也明确地包括刚好1:8的液料比;“约”30min的时间是指从28.5min至31.5min的时间,但也明确地包括刚好30min的时间;“约”2h的时间是指从1.9h至
2.1h的时间,但也明确地包括刚好2h的时间;“约”50℃的温度是指从47.5℃至 52.5℃的温度,但也明确地包括刚好50℃的温度。
41.在一种优选的实施方式中,该乌梅水提物的70%醇部位通过以下方法制备:(1)称取适量的该乌梅水提物,加入水形成混悬液,将该混悬液上样于大孔树脂;(2)分别使用水、30%醇和70%醇进行洗脱(其中,每个部位洗脱5至8个柱体积,例如5个柱体积或8个柱体积);以及 (3)将该70%醇洗脱获得的洗脱液减压浓缩并蒸干,得到该乌梅水提物的70%醇部位。
42.在一种优选的实施方式中,该大孔树脂为d101大孔树脂。在一种优选的实施方式中,该蒸干是在水浴中进行的。在一种优选的实施方式中,该水浴的温度为40℃至60℃例如约50℃。
43.在一种优选的实施方式中,该乌梅总黄酮提取物通过以下方法制备:
44.(1)将该乌梅去核后,置于烘箱中干燥、粉碎并过筛,得到乌梅去核粗粉;(2)称取适量的该乌梅去核粗粉置于容器中,加入石油醚脱脂,得到脱脂后的乌梅去核粗粉;(3)将该脱脂后的乌梅去核粗粉置于该容器中,以第一液料比加入第一溶剂,加热回流提取1~3h,放至室温后过滤,得到第一滤液;(4)在该容器中以第二液料比加入该第一溶剂,加热回流提取1~3h,放至室温后过滤,得到第二滤液;(5)合并该第一滤液和该第二滤液、减压浓缩并蒸干,得到浸膏;以及(6)将该浸膏用水溶解,乙酸乙酯萃取,将乙酸乙酯层减压浓缩至干并蒸干,得到该乌梅总黄酮提取物。
45.在一种优选的实施方式中,该干燥的温度为35℃至55℃。在一种优选的实施方式中,该干燥的温度为约45℃。在一种优选的实施方式中,该干燥的时间为5~7h。在一种优选的实施方式中,该干燥的时间为约6 h。在一种优选的实施方式中,该筛为三号筛。在一种优选的实施方式中,该容器为烧瓶例如圆底烧瓶。在一种优选的实施方式中,该第一液料比为1:7~1:13。在一种优选的实施方式中,该第一液料比为约1:10。在一种优选的实施方式中,该第二液料比为1:7~1:13。在一种优选的实施方式中,该第二液料比为约1:10。在一种优选的实施方式中,该第一液料比与该第二液料比是相同的或不同的。在一种优选的实施方式中,该第一溶剂为65%~75%乙醇例如约60%乙醇。在一种优选的实施方式中,该加热回流提取的时间为约2h。在一种优选的实施方式中,该蒸干是在水浴中进行的。在一种优选的实施方式中,该水浴的温度为40℃至60℃例如约 50℃。
46.在一种优选的实施方式中,该药物组合物包括α-淀粉酶抑制剂、α-葡萄糖苷酶抑制剂、双胍类降糖药、磺脲类降糖药、噻唑烷二酮类降糖药、格列奈类降糖药和二肽基肽酶-4抑制剂。在一种优选的实施方式中,该α
‑ꢀ
淀粉酶抑制剂来自于植物种子的胚乳和/或微生物的代谢产物。在一种优选的实施方式中,该植物为小麦、大米、高粱、花生和/或豆类植物。在一种优选的实施方式中,该α-葡萄糖苷酶选自以下的一种或多种:阿卡波糖、伏格列波糖和米格列醇。在一种优选的实施方式中,该双胍类降糖药为二甲双胍。在一种优选的实施方式中,该磺脲类降糖药选自以下的一种或多种:格列本脲、格列美脲、格列齐特、格列吡嗪和格列喹酮。在一种优选的实施方式中,该噻唑烷二酮类降糖药选自以下的一种或多种:罗格列酮和吡格列酮。在一种优选的实施方式中,该格列奈类降糖药选自以下的一种或多种:瑞格列奈、那格列奈和米格列奈。在一种优选的实施方式中,该二肽基肽酶-4抑制剂选自以下的一种或多种:西格列汀、沙格列汀和维格列汀。
47.在一种优选的实施方式中,该药物制剂包括一种或多种辅料。在一种优选的实施方式中,该辅料选自以下的一种或多种:崩解剂、粘合剂、填充剂、润滑剂、助流剂和着色剂。在一种优选的实施方式中,该崩解剂选自以下的一种或多种:羧甲淀粉钠、聚维酮、低取代羟丙纤维素和预胶化淀粉。在一种优选的实施方式中,该粘合剂选自以下的一种或多种:微晶纤维素、聚维酮、羟丙基甲基纤维素、聚乙烯吡咯烷酮、糊精、聚乙烯醇、阿拉伯胶、琼脂、明胶、黄蓍胶和聚乙二醇。在一种优选的实施方式中,该填充剂选自以下的一种或多种:硅化微晶纤维素、微晶纤维素和乳糖。在一种优选的实施方式中,该润滑剂选自以下的一种或多种:硬脂酸镁、硬脂酸钙和滑石粉。在一种优选的实施方式中,该乳化剂选自以下的一种或多种:山梨醇酐单硬脂酸酯、山梨糖醇脂和大豆磷脂。在一种优选的实施方式中,该着色剂为赤鲜红或日落黄。在实际应用过程中,可根据实际情况添加上述药用辅料之外的其它辅料。
48.在一种优选的实施方式中,该药物制剂的剂型为胶囊剂、片剂、颗粒剂、散剂、锭剂、冲剂、粉剂和丸剂。
49.在实际应用过程中,可根据实际情况添加上述药用辅料之外的其它辅料,或者改变成其它适应临床需求的剂型,或者与其它降糖药物相组合,而不受上述所列举的具体内容的限制。
50.在一种优选的实施方式中,该血糖异常为糖耐量异常、胰岛素抵抗性和/或高胰岛素血症。在一种优选的实施方式中,该糖尿病为临界性糖尿病、自发性i型糖尿病、诱发型i型糖尿病、自发性ii型糖尿病和/或诱发型ii型糖尿病。在一种优选的实施方式中,该糖尿病为化学物质和/或高脂高糖所诱导的糖尿病。在一种优选的实施方式中,该化学物质为四氧嘧啶和/或链脲佐菌素。在一种优选的实施方式中,该四氧嘧啶的造模方法包括腹腔注射约120mg/kg的四氧嘧啶(alx)约24小时后再次注射约 100mg/kg的四氧嘧啶。
51.本发明考察了如表1所示的糖尿病小鼠的不同给药方案
52.表1糖尿病小鼠的不同给药方案
53.54.上述3种不同的alx造模给药方法,血糖浓度在11.1-27.8mmol/l 之间为成功的糖尿病小鼠模型,实验发现第1组小鼠有3只死亡,3只血糖浓度高于27.8mmol/l,故造模成功率为40%;第2组有1只血糖浓度低于11.1mmol/l,有2只血糖浓度高于27.8mmol/l,故造模成功率为 70%;第3组14天内有5只血糖浓度低于11.1mmol/l,故造模成功率为50%。因此,采用第2组,即先腹腔注射120mg/kg的alx,间隔24h 后,第2次注射100mg/kg的alx,该造模方法死亡率低,造模成功率较高,且模型稳定,可用于后续试验。
55.在一种优选的实施方式中,该糖尿病并发症为血脂紊乱。
56.在一种优选的实施方式中,该乌梅水提物的70%醇部位是通过保护胰岛细胞、改善血脂代谢和/或增强机体抗氧化的作用而发挥降血糖作用的。
57.根据本发明的另一个方面,提供了一种乌梅水提物、乌梅水提物的 70%醇部位和/或乌梅总黄酮提取物,用于预防和/或治疗血糖异常和/或糖尿病和/或糖尿病并发症。
58.根据本发明的另一个方面,提供了一种预防和/或治疗血糖异常和/或糖尿病和/或糖尿病并发症的方法,包括向该受试者施用有效量的上述乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物。
59.根据本发明的另一个方面,提供了一种乌梅水提物、乌梅水提物的 70%醇部位和/或乌梅总黄酮提取物,用于抑制α-淀粉酶和/或α-葡萄糖苷酶。
60.根据本发明的另一个方面,提供了一种抑制α-淀粉酶和/或α-葡萄糖苷酶的方法,包括向该受试者施用有效量的上述乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物。
61.根据本发明的另一个方面,提供了一种包含乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物的药物组合物或药物制剂,用于预防和/或治疗血糖异常和/或糖尿病和/或糖尿病并发症。
62.根据本发明的另一个方面,提供了一种预防和/或治疗血糖异常和/或糖尿病和/或糖尿病并发症的方法,包括向该受试者施用有效量的上述包含乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物的药物组合物或药物制剂。
63.根据本发明的另一个方面,提供了一种包含乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物的药物组合物或药物制剂,用于抑制α-淀粉酶和/或α-葡萄糖苷酶。
64.根据本发明的另一个方面,提供了一种抑制α-淀粉酶和/或α-葡萄糖苷酶的方法,包括向该受试者施用有效量的上述包含乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物的药物组合物或药物制剂。
65.在本发明中,术语“受试者”、“个体”或“患者”在此可互换地使用并且是指一种脊椎动物,优选一种哺乳动物。哺乳动物可以是人、非人灵长类动物、小鼠、大鼠、狗、猫、马或牛,但不限于这些实例。除人以外的哺乳动物可以有利地用作代表糖尿病模型的受试者。优选地,所述受试者是人。这样的受试者们典型地遭受或易于患有一种可以通过给予本发明的上述乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物。
66.本发明所用的上述乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物的“有效量”可以获得所需要的治疗和/或预防效果。对此用途有效的量将取决于例如治疗的疾病的阶段和严重性、个体体重和总体健康状况、递送的途径、所采用的具体的活性物
质或制剂的活性、炎症的类型以及处方医师的判断。剂量的给予可以每周一次,或两天或每天一次,或甚至每天几次。可以在短期(例如数周至数月)或更长时间段(数月至数年)给予剂量单元。“有效量”具体指的是向所治疗的受试者赋予治疗作用(例如,控制、缓解、改善、缓和或减缓进展);或预防(例如,延迟发作或降低发展风险)疾病、病症或病状或其症状的上述乌梅水提物、乌梅水提物的70%醇部位和/或乌梅总黄酮提取物。
67.需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
68.以下结合具体实施例对本发明作进一步详细描述,这些实施例不能理解为限制本发明所要求保护的范围。
69.实施例
70.实验仪器:流水式中药粉碎机(弘玖制药机械有限公司),dhg
‑ꢀ
9240a型电热恒温鼓风干燥箱(上海精宏实验设备有限公司),hh-s型水浴锅(长城科工贸有限公司),ar1140型精密电子天平(梅特勒-托利多仪器有限公司),t6新世纪紫外-可见分光光度计(普析通用仪器有限责任公司),f-4500荧光分光光度计(日本日立公司),phs-3c型ph 计(上海精密仪器仪表公司),mili-q超滤除热源型超纯水仪(美国millipore公司),电子分析天平(北京市科伟永兴仪器有限公司),安稳免调码血糖仪(三诺血糖仪器有限公司),低温离心机(北京市科伟永兴仪器有限公司)。
71.实验试剂:乌梅药材购买于四川省达州市达州区乌梅基地,由郑州大学药学院鉴定为蔷薇科植物梅的干燥成熟果实,样品留置于郑大药学院标本馆。spf级雄性昆明小鼠,体重18-20g,购买于河南省动物实验中心,许可证号为scxk(豫)2017-0001。小鼠专用饲料与垫料购买于河南省动物实验中心,许可证号为scxk(豫)2015-0005。α-葡萄糖苷酶,阿卡波糖,α-淀粉酶,3,5-二硝基水杨酸(dns)均购买于索莱宝生物科技有限公司。磷酸氢二钠、磷酸二氢钠、碳酸钠、淀粉、二甲基亚砜 (dmso),石油醚、乙酸乙酯、95%乙醇、甲醇等化学试剂均为分析纯,购买于上海麦克林生化科技有限公司。阳性药(盐酸二甲双胍片),羧甲基纤维素钠(cmc-na)、四氧嘧啶(alx)、生理盐水均为分析纯,水为超纯水。
72.实施例一乌梅不同给药部位的制备
73.1.1、样品制备方法
74.1.1.1、水提物的制备:中药乌梅人工去核后,置于45℃烘箱干燥6 h,药材粉碎并过三号筛,即得乌梅去核粗粉。精密称取50.0g乌梅去核粗粉置于1000ml圆底烧瓶中,以液料比1:10加入超纯水500ml,预浸 30min,保持小火微沸加热回流提取2h,第二次以液料比1:8加热回流提取2h,放至室温后过滤,合并两次滤液,滤液减压浓缩至少量,转移至已称过空重的蒸发皿中,于50℃水浴蒸干,即得乌梅水提物浸膏,计算得膏率,备用。
75.1.1.2、95%醇提物的制备:精密称取50.0g乌梅去核粗粉置于1000 ml圆底烧瓶中,以液料比1:10加入95%乙醇500ml,预浸30min,保持小火微沸加热回流提取2h,第二次以液料比1:8加热回流提取2h,放至室温后过滤,合并两次滤液,滤液减压浓缩至少量,转移至已称过空重的蒸发皿中,于50℃水浴蒸干,计算得膏率,备用。
76.1.1.3、总有机酸的制备:称取上述乌梅去核粗粉50.0g,以液料比 1:10加入超纯水500ml,加热回流提取1.5h,第二次以液料比1:8加热回流提取1.5h,过滤,合并两次滤液,滤液减压浓缩至少量,加入适量的1mol/l的hcl酸化,静置过夜,于10000r/min离心10min,
得到沉淀物,抽滤,将抽滤得到的固体转移至已称过空重的蒸发皿中,于50℃水浴蒸干,备用,计算乌梅总有机酸的提取率。取适量制备所得乌梅总有机酸样品用超纯水溶解,样品溶液点于硅胶薄层板上,喷洒0.1%的溴酚蓝溶液,若发现蓝色背景下出现黄色斑点,说明该样品中含有有机酸类化学成分。
77.1.1.4、总多糖的制备:称取上述乌梅去核粗粉50.0g置于1000ml的圆底烧瓶中,加入石油醚500ml,保持小火微沸加热回流提取1h,抽滤,弃去石油醚溶液,乌梅药材残渣挥干石油醚后置于1000ml的圆底烧瓶中,加入80%乙醇500ml,预浸30min,回流1h,抽滤,弃去滤液,药渣挥干80%乙醇后加入超纯水500ml,加热回流2h,趁热抽滤,滤液减压浓缩至少量后加入5倍体积的无水乙醇,静置过夜后于10000r/min 离心10min,得到沉淀物,将沉淀物用乙醇洗涤后挥干溶剂,即得乌梅总多糖。将得到的沉淀物转移至已称过空重的蒸发皿中,于50℃水浴蒸干,备用,计算乌梅总多糖的提取率。取适量制备所得的乌梅总多糖用超纯水溶解,取1ml样品溶液置于试管中,向其中加入10%的α-萘酚乙醇溶液0.5ml,震荡混匀,倾斜试管加入数滴浓硫酸,不振摇,溶液分为两层,若发现与浓硫酸接触面呈紫红色环,说明该样品含有多糖类化学成分。
78.1.1.5、总生物碱的制备:称取上述乌梅去核粗粉50.0g置于1000ml 圆底烧瓶中,第一次液料比1:10,加入500ml的80%乙醇溶液,预浸30 min,保持小火微沸加热回流提取2h,第二次以液料比1:8,加入400ml 的80%乙醇,保持小火微沸加热回流提取2h,冷却到室温后,过滤,合并两次滤液,滤液减压浓缩至少量,用10%naoh溶液调至ph》10,使生物碱变成游离状态后采用氯仿萃取,将氯仿层减压浓缩至干,转移至已称过空重的蒸发皿中,50℃水浴蒸干,备用,计算乌梅总生物碱的提取率。取适量制备所得的乌梅总生物碱用80%乙醇溶解,分别取1ml样品溶液置于3支试管中,各试管中分别加入碘化铋试剂、磷钼酸试剂以及硅钨酸试剂2-3滴,若发现分别出现红棕色沉淀、黄褐色沉淀以及灰白色沉淀,表明该样品中含有生物碱类物质。
79.1.1.6、总黄酮的制备:称取上述去核的乌梅粗粉50.0g置于1000ml 圆底烧瓶中,按照2.3.4中加入石油醚脱脂,得到脱脂后的乌梅去核粗粉。将脱脂后的乌梅粗粉置于1000ml圆底烧瓶中,加入70%乙醇500 ml,加热回流2h,连续提取两次,放冷至室温后过滤,滤液减压浓缩至少量,转移至蒸发皿中50℃水浴蒸干,将得到的浸膏用水溶解,乙酸乙酯萃取,将乙酸乙酯层减压浓缩至干,转移至已称过空重的蒸发皿中, 50℃水浴蒸干,备用,计算乌梅总黄酮的提取率。取适量制备所得的乌梅总黄酮用乙酸乙酯溶解,取1ml样品溶液置于试管中,加入少量镁粉,再加入0.5ml浓盐酸溶液,置于沸水浴中加热2-3min,若样品溶液呈现棕色至红色,说明该样品确实含有黄酮类化学成分。
80.1.2、样品制备结果:采用加热回流提取法得到了乌梅水提物、95%乙醇提取物、总多糖、总有机酸、总黄酮、总生物碱6个不同给药活性部位,其提取率分别为35.01%、23.97%、10.61%、6.01%、4.24%、 1.97%。此外,经定性鉴别,各大类成分检识反应均呈阳性,说明制备所得的总多糖、总有机酸、总黄酮、总生物碱均含各自成分。
81.实施例二α-淀粉酶抑制活性研究
82.2.1、溶液的配制
83.2.1.1、淀粉溶液的配制:精密称取1.0g可溶性淀粉置于烧杯中,加入适量磷酸缓冲液,于电热套中加热并搅拌至淀粉成透明粘稠状,放置室温后定容于100ml容量瓶中,即
得1%的可溶性淀粉溶液,备用。
84.2.1.2、α-淀粉酶溶液的配制:精密称取3.0mg的α-淀粉酶,加入适量磷酸缓冲液配成3u/ml的α-淀粉酶溶液,α-淀粉酶溶液需要现配现用。
85.2.1.3、样品冲液的配制:(1)乌梅水提物溶液配制:精密称取乌梅水提物浸膏50.0mg,加入适量磷酸缓冲溶液配成50mg/ml的乌梅水提物溶液,从中取100μl溶于900μl的磷酸缓冲溶液中,即得5mg/ml的乌梅水提物样品母液,备用。(2)乌梅醇提物溶液配制:精密称取乌梅 95%醇提物浸膏50.0mg加入适量二甲基亚砜溶液配成50mg/ml的乌梅醇提物溶液,从中取100μl溶于900μl的磷酸缓冲溶液中,即得5 mg/ml的乌梅醇提液样品母液,备用。(3)乌梅总有机酸溶液配制:同乌梅水提物溶液配制方法,即得5mg/ml的乌梅总有机酸溶液母液,备用。(4)乌梅总多糖溶液配制:同乌梅水提物溶液配制方法,即得5 mg/ml的乌梅总多糖溶液母液,备用。(5)乌梅总黄酮溶液配制:同乌梅醇提液配制方法,即得2.5mg/ml的乌梅总黄酮溶液母液,备用。 (6)乌梅总生物碱溶液配制:同乌梅醇提液配制方法,即得2.5mg/ml 的乌梅总生物碱溶液,备用。(7)阿卡波糖溶液配制:精密称取5.0mg 阿卡波糖,加入适量磷酸缓冲液溶配制成浓度为0.5mg/ml阿卡波糖阳性对照药母液,备用。
86.2.2、α-淀粉酶抑制活性测定方法:取25ml比色管,按照二倍稀释法将2.1.3中各样品母液稀释为5个浓度梯度,设置样品反应、样品对照、空白反应以及空白对照4个组,所有组设置3个复管。加样顺序及加样量如下表2所示。
87.表2α-淀粉酶抑制活性的测定方法
[0088][0089]
阳性对照药阿卡波糖的测定方法同上,所有实验重复三次。按照下式计算抑制率并用graphpad prism 7.0软件作图,spss 22.0软件计算出α-淀粉酶抑制活性的ic
50
值,结果用平均值
±
相对标准偏差(mean
±
sd)表示。抑制率(%)=1—(药物反应组od值—药物对照组od值)/(空白反应组od值—空白对照组od值)
×
100%。
[0090]
2.3、α-淀粉酶抑制活性测定结果:α-淀粉酶在酶浓度为3u/ml,底物可溶性淀粉为
浓度1%时测定并计算得到各样品不同浓度下α-淀粉酶的抑制率,见表3。由实验结果可知,6个样品对α-淀粉酶均有一定的抑制活性,且随着样品浓度的增大抑制率逐渐增大,但均没有阳性对照药阿卡波糖的抑制活性高,显著低于阿卡波糖(p《0.05),其抑制活性的大小顺序为(以生药材计):乌梅水提物》总黄酮》95%醇提物》总生物碱》总多糖 》总有机酸。综上,乌梅水提物α-淀粉酶抑制活性最好。
[0091]
表3不同样品α-淀粉酶抑制活性的ic
50
值
[0092][0093]
注:与阿卡波糖比较:*p《0.05。
[0094]
对乌梅药材不同极性提取物及不同大类成分对α-葡萄糖苷酶抑制活性测定结果来看,乌梅总黄酮及水提物活性较强,而乌梅总多糖和乌梅总有机酸活性较弱(与乌梅总多糖和乌梅总有机酸相比,乌梅水提物的α-葡萄糖苷酶抑制活性均p《0.05;与乌梅总多糖和乌梅总有机酸相比,乌梅总黄酮的α-葡萄糖苷酶抑制活性均p《0.05)。
[0095]
实施例三α-糖苷酶抑制活性研究
[0096]
3.1、溶液的配制
[0097]
3.1.1、磷酸缓冲液的配制:精密称取磷酸二氢钠1.5601g,超纯水溶解并定容至100ml容量瓶中,配制成0.1mol/l磷酸二氢钠溶液,标记为a备用;精密称取磷酸氢二钠3.5814g,超纯水溶解并定容至100ml 容量瓶中,配制成0.1mol/l磷酸氢二钠溶液,标记为b备用;按a:b= 46.3:53.7的体积比混合得到100ml混合液,ph计测定混合液ph,即得到ph为6.8的0.1mol/l的磷酸缓冲液,置于4℃冰箱,备用。
[0098]
3.1.2、碳酸钠溶液的配制:精密称取2.12g无水碳酸钠,磷酸缓冲液溶解并定容至100ml容量瓶中,即得0.2mol/l的无水碳酸钠溶液。
[0099]
3.1.3、α-葡萄糖苷酶溶液的配制:精密称取0.134mg的α-葡萄糖苷酶,磷酸缓冲液溶解并定容至10ml容量瓶中,即得1u/ml的α-葡萄糖苷酶溶液,α-葡萄糖苷酶溶液需要现配现用。
[0100]
3.1.4、pnpg(底物)溶液的配制:精密称取pnpg适量,用磷酸缓冲液溶解并定容至10ml容量瓶中,配制成浓度为1.0mmol/l的pnpg 溶液,pnpg溶液需要现配现用。
[0101]
3.2、α-葡萄糖苷酶抑制活性测定方法:按照二倍稀释法将2.1.3中各样品母液稀释为5个浓度梯度,96孔板中分为4个组,分别为样品反应组、样品对照组、空白反应组以及空白对照组,每个样品组均设置三个复孔。加样方法以及加样顺序如表4所示。
[0102]
表4α-葡萄糖苷酶抑制活性的测定方法
[0103][0104][0105]
阳性对照药阿卡波糖的抑制活性测定方法同上,所有实验重复三次。按照下式计算抑制率并用graphpad prism 7作图,用spss计算出α-葡萄糖苷酶抑制活性的ic
50
值,结果用平均值
±
相对标准偏差(mean
±
sd)表示。抑制率(%)=1—(样品反应组od值—样品对照组od值)/(空白反应组od值-空白对照组od值)
×
100%
[0106]
3.3、α-葡萄糖苷酶抑制活性结果
[0107]
α-葡萄糖苷酶在酶浓度为1u/ml,底物pnpg为浓度1mmol/l时,测定并计算得到各样品不同浓度下α-葡萄糖苷酶的抑制率,结果如表5所示。从表5的α-葡萄糖苷酶抑制活性的ic
50
值可知,6个样品对α-葡萄糖苷酶均有一定的抑制活性,但均没有阳性对照药阿卡波糖的抑制活性高,显著低于阿卡波糖(p《0.05),其抑制活性的大小顺序为(以生药材计):乌梅总黄酮》水提物》醇提物》生物碱》总多糖》总有机酸。
[0108]
表5不同样品α-葡萄糖苷酶抑制活性的ic
50
值
[0109][0110]
注:与阿卡波糖比较:*p《0.05。
[0111]
对乌梅药材不同极性提取物及不同大类成分对α-葡萄糖苷酶抑制活性测定结果来看,乌梅总黄酮及水提物活性较强,而乌梅总多糖和乌梅总有机酸活性较弱(与乌梅总多糖和乌梅总有机酸相比,乌梅水提物的α-葡萄糖苷酶抑制活性均p《0.05;与乌梅总多糖和乌梅总有机酸相比,乌梅总黄酮的α-葡萄糖苷酶抑制活性均p《0.05)。
[0112]
实施例四大孔树脂不同部位对糖尿病小鼠的降血糖作用
[0113]
4.1、样品的制备
[0114]
将上述降血糖活性较好的乌梅水提物用d101大孔树脂分离纯化,乌梅水提物上柱后吸附过夜,分别用5倍体积的纯水、30%乙醇、70%乙醇以1-2ml/min流速洗脱,分别得到水部位(g0)、30%醇部位(g30)、 70%醇部位(g70)等部位,减压浓缩,水浴锅蒸干。将得到的不同大孔树脂段位样品置于研钵中研磨成细粉,将各样品细粉用0.5%的cmc-na 分散,得到g0、g30、g70部位的样品混悬液,于4℃保存,供后续动物实验使用。阳对照药:二甲双胍。
[0115]
4.2、动物模型的复制
[0116]
将河南省动物实验中心购买所得的80只体重为18-20g的雄性昆明小鼠随机分笼,每组10只,适应性喂养一周,备用。从中取出1组作为空白对照组(nc),其余组均用于造模。各组小鼠禁食不禁水12h,称空腹体重,计算给药剂量,注射剂量按照表3.1中的第2组条件注射,注射完alx后,各组小鼠均给与饮水,2h后给与饲料。各组小鼠于给药72 h后采用自动血糖测定仪测定小鼠禁食不禁水12h的空腹血糖浓度,血糖浓度在11.1-27.8mmol/l即为成功的糖尿病小鼠模型,血糖不符合要求的小鼠剔除。
[0117]
4.3、糖尿病模型小鼠的分组与给药
[0118]
4.3.1、糖尿病模型小鼠分组
[0119]
共造模成功50只,将50只模型小鼠按照血糖浓度分组,保证各组间血糖浓度差异
小,共分为5组,每组10只。分为模型对照组(mc)、阳性对照组(pc)、g0组、g30组、g70组,并将组内各小鼠用1%的苦味酸-乙醇溶液编号。
[0120]
4.3.2、各组小鼠给药
[0121]
各组小鼠采用灌胃法给药,每天1次,连续灌胃4周。nc及mc组每日按体重灌同等剂量的5%的cmc-na溶液,pc组给予二甲双胍 75mg/kg,其余各组均给与相同的剂量90mg/kg的大孔树脂分离纯化的样品。
[0122]
4.4、各项指标测定
[0123]
4.4.1、小鼠常规指标记录
[0124]
每日观察小鼠生存状态及死亡情况,监测其体重及饮水、饮食量,每隔1d测定各组小鼠体重并记录每日将各组小鼠水瓶中的水固定到250 ml,24h后记录剩余水量,二者之差除以小鼠总数即为每日每只小鼠平均饮水量。每日固定投放200g饲料,24h后记录剩余饲料量,二者之差除以小鼠总数即为每日每只小时平均饮食量。
[0125]
4.4.2、小鼠的空腹血糖值测定
[0126]
每隔7日禁食不禁水12h后用自动血糖仪检测各组小鼠的空腹血糖浓度。
[0127]
4.4.3、小鼠糖耐量实验
[0128]
末次给药后将各组小鼠禁水不禁食12h,测定血糖值(0min),称重,按照体重灌胃2.0g/kg葡萄糖水溶液,灌胃后30min、60min、120 min测定血糖值并按照下式计算各组小鼠auc。
[0129]
auc=(a+b)
×
0.25+(b+c)
×
0.25+(c+d)
×
0.5
[0130]
(a、b、c、d分别表示0min、30min、60min、120min的血糖值)
[0131]
4.4.4、小鼠病理切片
[0132]
将述剥离得到的胰腺组织用生理盐水洗去表面血水,滤纸吸干后浸入 4%多聚甲醛溶液中固定组织,脱水处理后,石蜡包埋,切片,he染色,置于200x、400x倒置显微镜下观察胰腺的病理变化,拍照记录并分析结果。
[0133]
4.4.5、小鼠肝组织中sod、mda以及gsh-px抗氧化三项指标的测定
[0134]
将上述小鼠摘眼球取全血,置于ep管中,在室温下自然凝固10-20 min,2000-3000r/min 4℃低温离心20min后仔细收集上清,注意要避免溶血。将所得上清置于-80℃冰箱中编号备用。各血清根据相关酶试剂盒说明书完成sod、mda以及gsh-px抗氧化三项的理化活性检测,记录数据并分析。
[0135]
4.4.6、小鼠血清中tc、tg、hdl-c以及ldl-c血脂三项指标的测定
[0136]
将上述小鼠摘眼球取全血,置于ep管中,在室温下自然凝固10-20 min,2000-3000r/min 4℃低温离心20min后仔细收集上清,注意要避免溶血。将所得上清置于-80℃冰箱中编号备用。各血清根据相关酶试剂盒说明书完成tc、hdl-c以及ldl-c血脂三项的理化活性检测,记录数据并分析。
[0137]
4.4.7、数据处理及分析
[0138]
数据处理及分析采用spss22.0软件,所有结果均使用平均值
±
标准差来表示,p<0.05代表有显著性差异,p<0.01代表有极显著性差异,具有统计学意义。
[0139]
4.5、实验结果与分析
[0140]
4.5.1、造模给药前后小鼠状态及饮食、饮水及体重
[0141]
给药期间,nc组小鼠毛发顺滑有光泽,垫料干燥,mc组小鼠垫料湿润,需一日更换两次垫料。给药期间,各给药的小鼠生存状态均有了一定的改善,其中以pc组、g70组的小鼠状态改善最为明显,其毛发变得顺滑有光泽,垫料相对干燥。
[0142]
给药第28d后各组小鼠饮食、饮水及体重值如图1所示。由图1可看出,给药第28d后,与nc组相比,mc组小鼠出现了明显的多饮、多食、体重减少的糖尿病小鼠特征,具有显著性差异(p《0.01),说明28d 内该模型稳定。与mc组相比,各给药组小鼠体重值均有一定上升,饮食饮水量均有一定下降,其中pc、g30及g70组对小鼠体重增重具有统计学意义(p《0.05)。实验结果提示pc、g30及g70组小鼠均能改善糖尿病小鼠多饮、多食、体重减少的特征。
[0143]
4.5.2、小鼠空腹血糖测定结果
[0144]
监测小鼠的空腹血糖值可以直观的评价各药物的降血糖作用。由图2a可看出,mc组的空腹血糖值约是nc组的4倍,整个4w内均保持较高水平(p《0.05),且随着实验周期延长,血糖有上升的趋势。由图2b 可看出,pc组血糖呈现下降趋势,从第2w开始与nc组具有显著性差异(p《0.05),图2f显示到4w时pc组的降糖率约为37%。由图2c可看出,g0组降血糖幅度较小,给药前3w与mc组相比,空腹血糖值无显著性差异,图2f显示到4w时降糖率约为5%。由图2d及图2f可看出,g70组血糖下降趋势优于g30组,与pc组相似,g70组从第2w开始与nc组具有显著性差异(p《0.05),图2f显示到4w时g30、g70组的降糖率分别约为20%、35%。
[0145]
小鼠空腹血糖值实验结果提示g70组对alx诱导的糖尿病小鼠具有积极的降血糖活性,可能为降血糖的活性成分。
[0146]
4.5.3、小鼠糖耐量实验结果
[0147]
口服葡萄糖耐量实验结果可作为药物降血糖的第二诊断指标,进一步证实药物的降血糖作用。由图3可看出,各给药组小鼠灌胃2g/kg的葡萄糖溶液后,在30min、60min、120min时间点时血糖值均低于mc组,其中pc、g30及g70组具有统计学意义(p《0.05),g0组无统计学意义。各组变化趋势相似,30min到达血糖高峰值,120min后将至基线水平。此外,为了比较整个120min期间血糖的绝对变化,计算各组的auc 值以显示血糖的总变化,见图3f。由图可看出,与mc组相比,各组的 auc显著降低(p《0.05),降低幅度pc》g70》g30》g0组,实验结果提示,与pc组相似,g70组可通过消除血液中外源葡萄糖起到有效改善糖尿病小鼠的糖耐量的作用。
[0148]
4.5.4、小鼠病理切片结果
[0149]
由病理切片的图4可以看出,nc组小鼠胰岛呈现椭圆的细胞团,核圆形,胰岛界限清除,胞浆丰富,无变形坏死,mc组可明显看出胰岛细胞萎缩,数量显著减少,细胞核呈溶解状,胞质疏松淡染,有明显空泡, pc组可见胰岛界限清晰,胰岛细胞分布正常,呈椭圆形,核圆形,胰岛细胞数量较mc组丰富,与nc组相当,胰岛细胞变性坏死较mc组有所减轻,g0、g30、g70组胰岛大小及数目依次增多,g70组岛细胞分布正常,呈椭圆形,核圆形,结构清楚,胰岛细胞数量较mc组丰富。
[0150]
综上,乌梅的g70组对四氧嘧啶诱导的糖尿病小鼠的胰腺具有较好的保护作用,增加胰岛细胞数量,改善胰岛细胞功能。
[0151]
4.5.5、抗氧化三项指标结果
[0152]
研究表明,体内的氧化应激水平产生的自由基与糖尿病的发生及其并发症密切相
关,sod和gsh-px是哺乳动物细胞中重要的抗氧化酶,其对预防氧化应激水平产生的自由基而引起的细胞损伤具有重要作用。从图5 可看出,与nc相比,mc组血清中的sod和gsh-px浓度显著降低 (p《0.05),而mda水平显著升高(p《0.05),实验结果提示pc组小鼠氧化损伤较为严重。与pc组相似,四周给药后各组血清中的sod、以及mda水平均有一定的恢复,除gsh-px指标外,其余两个指标均恢复到正常水平(p《0.05)。
[0153]
综上,实验结果说明pc组以及各给药组均能提高糖尿性小鼠的抗氧化能力,增强小鼠对活性氧的清除能力,更进一步说明乌梅各样品的降血糖机制可能与改善体内氧化应激水平有关,抑制体内抗氧化作用。
[0154]
4.5.6、血脂四项指标结果
[0155]
糖尿病患者由于胰岛受损,胰岛素的调节作用发生障碍,故糖代谢异常时往往伴随着血脂代谢紊乱,血脂紊乱引发的心脑血管等疾病是糖尿病并发症致死的原因之一,故监测血脂水平对防治糖尿病具有重要意义。由图6可看出,与nc相比,mc组小鼠的tc、tg以及ldl-c浓度均有明显升高(p《0.05),hdl-c浓度显著降低(p《0.05),说明alx诱导的糖尿病小鼠模型存在血脂代谢紊乱。给药28d后,与nc相比,pc组和乌梅各样品组均可降低其tc、tg含量,对tc的改善无显著性差异,对tg浓度的改善,除g0外,各组均具有统计学意义(p《0.05)。与nc 相比,pc组血清中的ldl-c浓度显著升高(p《0.05),此外,阳性组与各给药组的ldl-c浓度也有一定升高,与正常组相比有统计学意义 (p《0.05)。除nc组外,ldl-c水平以阳性组最低,g70次之,g30次之,最后是g0,各治疗组之间无显著性差异(p》0.05)。与nc相比, mc组血清中的hdl-c浓度显著降低(p《0.05),给药四周后,pc组及各治疗组的hdl-c浓度均有一定增高,其中阳性组、30%醇、70%醇部位组与模型对照组相比较有显著差异(p《0.01),三组之间无显著行差异(p》0.05)。
[0156]
综上,实验结果提示乌梅各给药组可使糖尿病小鼠的血脂环境得到一定改善,其中以70%醇作用显著。
[0157]
结语
[0158]
本发明对乌梅体外和体内降血糖的作用及其作用机制进行了研究。
[0159]
首先,采用加热回流提取法得到了乌梅水提物、95%乙醇提取物、总黄酮、总多糖、总有机酸、总生物碱6个不同给药活性部位,以上述6个样品为研究对象,研究了乌梅各样品对α-淀粉酶抑制活性的影响,抑制活性的大小顺序为(以生药材计):乌梅水提物》总黄酮》95%醇提物》总生物碱》总多糖》总有机酸,乌梅水提物的α-淀粉酶抑制活性ic
50
值(以生药材计)为4.69
±
1.27mg/ml;以上述6个样品为研究对象,研究了乌梅各样品对α-葡萄糖苷酶抑制活性的影响,各样品抑制活性的大小顺序为 (以生药材计):乌梅总黄酮》水提物》95%醇提物》生物碱》总多糖》总有机酸。综上,以乌梅总黄酮的抑制活性最好,其ic
50
值(以生药材计)为 2.40
±
1.14mg/ml。
[0160]
其次,成功复制出死亡率低、稳定性高的实验型糖尿病小鼠模型。结合文献研究与实验研究选择了3种不同的由alx诱导的糖尿病小鼠模型的方法,以小鼠死亡率、体重值、饮食量、饮水量、空腹血糖值以及造模成功率为评价指标,实验结果发现即先腹腔注射120mg/kg的alx,间隔 24h后,第2次注射100mg/kg的alx,注射前小鼠禁食不禁水12h的造模方法可得到死亡率低、稳定性高的实验型糖尿病小鼠模型,该方法的模型小鼠出现了明显的多饮、多食、多尿以及体重减少的特征,空腹血糖浓度在11.1-27.8mmol/l,实验结果提示本实验
的实验型糖尿病小鼠模型构建成功。
[0161]
最后,选择降血糖活性较好的乌梅水提物进行分离纯化,活性追踪。经d101型大孔树脂分离纯化,得到水部位、30%醇以及70%醇三个样品部位,以糖尿病小鼠为研究对象,考察相同剂量下各给药组对小鼠生存状态、体重变化、饮水量、饮食量、空腹血糖值、auc值等指标的影响确定降血糖活性成分,实验发现大孔树脂洗脱下来的70%醇部位降血糖活性较好。通过观察胰腺组织he染色以及免疫组化染色的病理切片图、测定血清中tc、tg、hdl-c、ldl-c浓度以及测定血清中gsh-px、sod、 mda含量来研究各组分的降血糖机制,实验结果提示70%醇部位通过保护胰岛细胞、改善糖尿病小鼠血脂代谢和/或增强机体抗氧化的起到辅助降血糖的作用。
[0162]
综上所述,乌梅具有一定的体内降血糖活性,可降低alx诱导的实验型糖尿病小鼠血糖作用,改善糖耐量,增强机体抗氧化的作用,改善血脂代谢,对糖尿病及其并发症的预防和治疗具有积极作用。其中作用最强的部位是乌梅水提物的大孔树脂分离纯化得到的70%醇部位,本发明的研究结果对天然产物治疗糖尿病具有一定的指导意义。
[0163]
以上所述的仅是本发明的实施例,方案中公知的具体结构及特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本发明要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
[0164]
以上对本发明实施例进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明仅用于帮助理解本发明的方法及其核心思想。同时,本领域技术人员依据本发明的思想,基于本发明的具体实施方式及应用范围上做出的改变或变形之处,都属于本发明保护的范围。综上所述,本说明书内容不应理解为对本发明的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1