细胞调节纳米组合物及使用方法与流程
本申请要求2014年2月10日提交的美国临时申请序号61/938,103的优先权,其全部内容通过引用并入本申请。
发明领域
本发明一般地涉及使用纳米组合物来调节细胞行为。
发明背景
现代细胞疗法通常涉及在体内或体外调节细胞行为,如刺激细胞增殖、诱导细胞分化和引导细胞迁移。然而,目前调节细胞行为的策略和方法是有限的。纳米技术在生物医学研究中的应用代表了基于纳米级水平的修饰来创建有意义的和创新的工具的一个极具吸引力的崭新方向。因此,需要开发使用纳米粒子调节细胞行为的纳米技术。
发明简述
本公开提供了纳米组合物以及此类纳米组合物的方法或用途。所述纳米组合物可以用于调节细胞行为,如细胞增殖、细胞分化、细胞活化和以浓度可控的方式获得纯的细胞群。
本公开的一个方面提供了一种用于细胞富集和调控的纳米组合物。所述纳米组合物包含纳米结构和与所述纳米结构可操作地连接的至少一种细胞调节剂。所述细胞调节剂能够与细胞表面上的分子相互作用。
在一些实施方式中,在所述纳米组合物中的纳米结构包含磁性材料。在一些实施方式中,所述磁性材料是铁磁性、亚铁磁性、顺磁性或超顺磁性材料。在一些实施方式中,所述磁性材料是超顺磁性氧化铁(SPIO)。
在一些实施方式中,在所述纳米组合物中的纳米结构在所述纳米结构的表面上具有硅烷化涂层。
在一些实施方式中,在所述纳米组合物中的纳米结构具有1nm至500nm的直径。
在一些实施方式中,与所述纳米结构可操作地连接的所述细胞调节剂包括特异性识别细胞表面上的分子的抗体。在一些实施方式中,所述细胞调节剂选自下组:抗CD3抗体、抗CD28抗体、抗CD81抗体及其任意组合。
在一些实施方式中,所述细胞调节剂是细胞表面上的受体的配体。在一些实施方式中,所述细胞调节剂包括选自由B7-1和B7-2组成的组的CD28天然配体的刺激性形式。
在一些实施方式中,所述细胞调节剂选自下组:CD137抗体、CD137配体蛋白、IL-15蛋白和IL-15受体抗体。
在一些实施方式中,所述细胞调节剂是疫苗。
在某些实施方式中,所述细胞调节剂与细胞相互作用,从而富集所述细胞的群或调节所述细胞的行为。在一些优选的实施方式中,所述细胞的行为是转化、增殖、重编程、分化或迁移。
在某些实施方式中,可以将所述细胞用于治疗。在一些优选的实施方式中,所述细胞能够产生嵌合的抗原受体。
在一些实施方式中,行为被调节的所述细胞是T细胞。在一些实施方式中,所述细胞是NK细胞。
在一些实施方式中,行为被调节的所述细胞是干细胞。在一些实施方式中,所述细胞是胚胎干细胞。
在一些实施方式中,所述细胞的可用性是因为其纯度。
在一些实施方式中,所述纳米组合物还包含可检测标记。在一些实施方式中,所述可检测标记是荧光分子、化学发光分子、生物发光分子、放射性同位素、MRI造影剂、CT造影剂、酶底物标记或着色剂。
在另一个方面,本公开提供了一种通过如下方式调节细胞行为的方法:使所述细胞与可操作地与纳米结构连接的至少一种细胞调节剂接触。所述细胞调节剂与所述细胞表面上的分子接触,并且所述细胞调节剂与所述分子之间的相互作用调节所述细胞的行为。在一些优选的实施方式中,所述方法还包括富集所述细胞群。
本发明的另一个方面涉及一种在对象中治疗疾病的方法。所述方法包括使细胞与可操作地与纳米结构连接的至少一种细胞调节剂接触。所述细胞调节剂与所述细胞表面上的分子相互作用。所述细胞调节剂与所述分子之间的相互作用调节所述细胞的行为。然后将经调节的细胞施用至所述对象。
附图简述
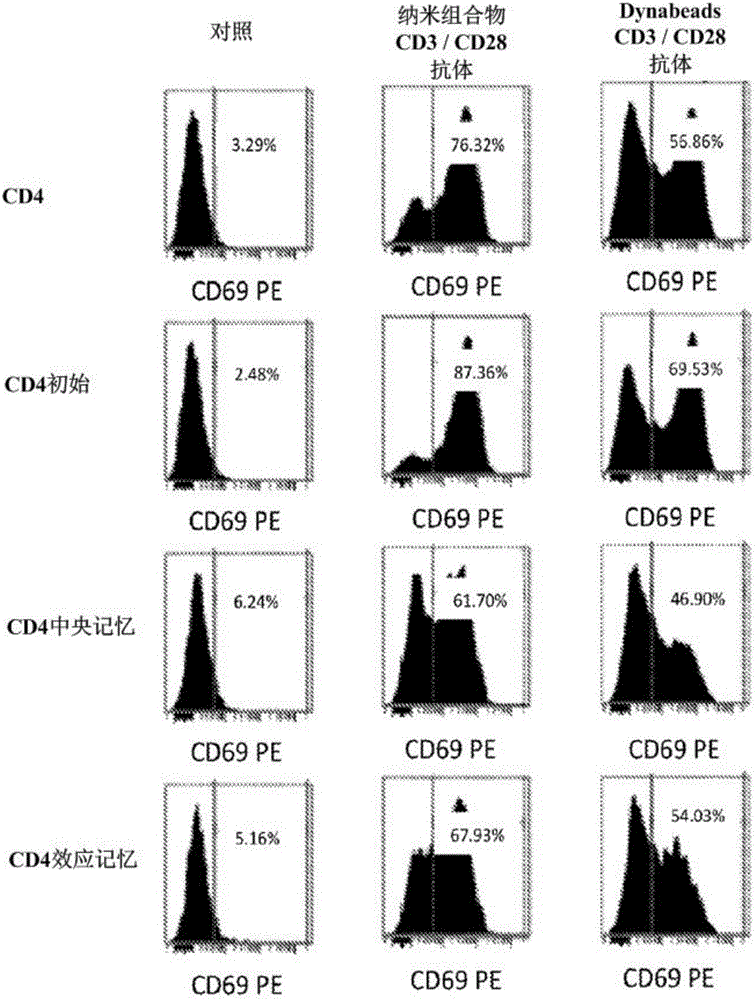
图1:使用偶联抗CD3/抗CD28抗体的纳米组合物刺激CD4+T细胞。
图2:使用纳米组合物分离和鉴定循环肿瘤细胞。
发明详述
在对本公开进行更加详细的描述之前,应理解本公开不限于所描述的特定实施方式,并且因此当然是可以改变的。还应理解本申请所使用的术语仅仅是用于描述特定实施方式的目的,并且并非旨在为限制性的,因为本公开的范围将仅由所附权利要求限定。当提供值的范围时,应理解在该范围上限和下限之间的每个中间值(除非上下文另有明确说明,否则到单位下限的十分之一)以及在该所示范围中的任意其他所示的值或中间的值均应包括在本公开中。这些较小范围的上限和下限可以独立地包括在该较小范围内,并且也包括在本公开中,同时满足在所示范围内的任意特异性排除的限值。当所示的范围包括一个或全部两个限值时,排除一个或全部两个这些所包括的限值的范围也包括在本公开中。
除非另有定义,本申请中使用的所有技术和科学术语均与本公开所属领域普通技术人员的通常理解具有相同含义。尽管与本申请所描述的那些相似或等同的任意方法和材料也能够用于实践或检测本公开,但是现对优选的方法和材料进行描述。
在本说明书中引用的所有出版物和专利均通过引用并入本申请,如同每个单独的出版物或专利被特别地和单独地指明通过引用并入并且其通过引用并入本申请以公开和描述与所引用的出版物相关的方法和/或材料。任何出版物的引用是为其在申请日之前公开的内容,并且不应被解释为承认由于此前的公开而导致本公开没有资格先于此类出版物。而且,所提供的出版日期可能不同于可能需要独立确证的实际出版日期。
如对于阅读本公开后的本领域技术人员而言显而易见,本申请所描述和解释的每个独立的实施方式具有分别的组分和特征,在不脱离本公开范围和主旨的前提下,所述分别的组分和特征可以容易地与任意其他若干实施方式的特征分离或者可以容易地与任意其他若干实施方式的特征组合。任何所述方法可以以所述事件的顺序或以在逻辑上可能的任意其他顺序实施。
除非另有说明,本公开的实施方式将使用在本领域范围内的化学、固态化学、无机化学、有机化学、物理化学、分析化学、材料化学、生物化学、生物学、分子生物学、重组DNA技术、药理学、成像等技术。在文献中对这些技术进行了充分的解释。
在对本公开的实施方式进行详细描述前,应理解除非另有说明,本公开不限于特定的材料、试剂、反应材料、生产工艺等,因此是可以改变的。还应理解本申请所使用的术语仅用于描述特定实施方式的目的,并且其并非旨在为限制性的。在本公开中也可能的是,在逻辑上可行的情况下可以以不同顺序执行步骤。
必须指出的是,如在本说明书和所附权利要求中所使用的,除非上下文另有明示,单数形式的“一个”、“一种”和“该”包括复数指示对象。因此,例如,提及“一种化合物”包括多种化合物。在本说明书和在随后的权利要求中,将提及若干术语,除非相反的指示是明显的,所述术语应该被定义为具有下述含义。
纳米组合物
本公开的一个方面提供了一种用于细胞富集和调节的纳米组合物,所述纳米组合物包含纳米结构和与所述纳米结构可操作地连接的至少一种细胞调节剂,其中所述细胞调节剂能够与细胞表面上的分子相互作用。
纳米结构
如在本申请中所使用的,术语“纳米结构”指具有范围从约1nm至约1500nm(例如从1nm至1200nm、从1nm至1000nm、从1nm至800nm、从1nm至500nm、从1nm至400nm等)的直径的粒子。在某些实施方式中,所述纳米结构包含单一粒子或一簇粒子。在某些实施方式中,所述纳米结构包含核纳米粒子和涂层。所述核纳米粒子可以是单一粒子或一簇粒子。所述涂层可以是本领域公知的任意涂层,例如聚合物涂层,如聚乙二醇、硅烷和多糖(例如葡聚糖及其衍生物)。
在一些实施方式中,本申请提供的纳米结构含有磁性材料。适宜的磁性材料包括例如亚铁磁性或铁磁性材料(例如铁、镍、钴、稀土金属的一些合金以及一些天然存在的矿物(如磁石))、顺磁性材料(如铂、铝)和超顺磁性材料(例如超顺磁性氧化铁或SPIO)。
磁性材料具有磁性,所述磁性使得所述纳米结构被磁体或在磁场中被拉引或吸引。磁性能够便于使用磁性相互作用对纳米结构进行操纵(例如分离、纯化或富集)。当受到所施加的磁场(例如来自高场和/或高梯度磁体的磁场)时,所述磁性纳米结构可被吸引至指定位点或被磁性引导至指定位点。例如,可以将磁体(例如磁栅)置于所述纳米结构附近,以便吸引所述磁性纳米结构。
可以使用本领域公知的具有磁性的任意纳米结构。在某些实施方式中,本申请所提供的纳米结构包含磁性纳米粒子,所述磁性纳米粒子含有磁性材料。例如,所述纳米结构的磁性纳米粒子是超顺磁性氧化铁(SPIO)纳米粒子。所述SPIO纳米粒子是氧化铁纳米粒子(磁赤铁矿(γ-Fe2O3)或磁铁矿(Fe3O4)),或者由这两相组成的纳米粒子。SPIO可以使用适宜的方法合成,并且作为胶体溶液分散在有机溶剂或水中。合成SPIO纳米粒子的方法是本领域公知的(参见例如Morteza Mahmoudi等,Superparamagnetic Iron Oxide Nanoparticles:Synthesis,Surface Engineering,Cytotoxicity and Biomedical Applications,Nova Science Pub Inc出版,2011)。在一个实施方式中,可以通过湿化学合成方法制备SPIO纳米粒子,所述方法涉及在存在碱性介质的条件下将Fe和Fe盐共沉淀。在合成过程中,可以引入氮气以控制氧化,可以加入表面活性剂和适宜的聚合物以抑制附聚或控制粒径,和/或可以使用乳液(如油包水微乳)来调节SPIO纳米粒子的物理性质(参见例如Jonathan W.Gunn,The preparation and characterization of superparamagnetic nanoparticles for biomedical imaging and therapeutic application,ProQuest出版,2008)。在另一个实施方式中,可以任选地在存在一种或多种表面活性剂(例如月桂酸和油酸)和/或氧化剂(例如三甲基胺-N-氧化物)的条件下,在适宜溶剂(例如二辛基醚或十六烷)中通过单独的五羰基铁的热分解或通过与过渡金属羰基化合物的组合的五羰基铁的热分解而产生SPIO纳米粒子(参见例如美国专利申请PG Pub 20060093555)。在另一个实施方式中,还可以通过气相沉积法制备SPIO纳米粒子,所述气相沉积法涉及在含有不同浓度氧气的氦气氛中铁的激光汽化(参见Miller J.S.等,Magnetism:Nanosized magnetic materials,Wiley-VCH出版,2002)。在某些实施方式中,所述SPIO纳米粒子是在美国专利申请PG Pub 20100008862中公开的那些。
在某些实施方式中,所述纳米结构还可以包含非SPIO纳米粒子。所述非SPIO纳米粒子包括例如金属纳米粒子(例如金或银纳米粒子(参见例如Hiroki Hiramatsu,F.E.O.,Chemistry of Materials 16,2509-2511(2004)))、半导体纳米粒子(例如具有单一或多个组分的量子点,如CdSe/ZnS(参见例如M.Bruchez等,Science 281,2013-2016(1998)))、掺杂的不含重金属的量子点(参见例如Narayan Pradhan等,J.Am.Chem.Soc.129,3339-3347(2007))或其他半导体量子点);聚合物纳米粒子(例如由PLGA(聚(乳酸-共-乙醇酸)(参见例如Minsoung Rhee等,Adv.Mater.23,H79-H83(2011))、PCL(聚己内酯)(参见例如Marianne Labet等,Chem.Soc.Rev.38,3484-3504(2009))、PEG(聚乙二醇)或其他聚合物中的一种或组合制备的粒子);含硅的纳米粒子;和非SPIO磁性纳米粒子(例如MnFe204(参见例如Jae-Hyun Lee等,Nature Medicine 13,95-99(2006))、合成的反铁磁性纳米粒子(SAF)(参见例如A.Fu等,Angew.Chem.Int.Ed.48,1620-1624(2009))和其他类型的磁性纳米粒子)。在某些实施方式中,所述非SPIO纳米粒子是有色纳米粒子,例如半导体纳米粒子,如量子点。
可以使用本领域公知的适宜方法制备或合成所述非SPIO纳米粒子,例如溶胶-凝胶合成法、油包水微乳法、气相沉积法等。例如,可以通过利用还原剂(如柠檬酸盐或丙酮二羧酸酯)还原氯金酸盐溶液(例如HAuCl4),从而制备金纳米粒子。举另一个例子,可以在二氧化硅粒子表面上由Cd(ClO4)2和Na2S制备CdS半导体纳米粒子。举另一个例子,可以基于在注射至热配位溶剂中之后有机金属试剂(如二甲基镉和三辛基硒)的热解来合成II-VI半导体纳米粒子(参见例如Gunter Schmid,Nanoparticles:From Theory to Application,John Wiley&Sons出版,2011)。可以采用成核掺杂策略制备掺杂的无重金属的量子点,例如掺杂Mn的ZnSe量子点,其中在高温下形成小尺寸的MnSe纳米簇作为核,并且ZnSe层包覆在核上。举另一个例子,可以通过如下方式制备聚合物纳米粒子:在两相溶剂系统中乳化聚合物,通过超声或均化诱导纳米尺寸的聚合物液滴,并蒸发有机溶剂以获得纳米粒子。举另一个例子,可以通过溶胶-凝胶合成来制备含硅纳米粒子,其中在存在酸或碱催化剂的条件下在水和乙醇的混合物中水解烷氧基硅前体(例如TMOS或TEOS),在剧烈搅拌下缩合经水解的单体,并且可以收集所得二氧化硅纳米粒子。举另一个例子,可以通过在高真空下使用离子束沉积,在非磁性间隔层(例如钌金属)两侧的每一侧上沉积铁磁性层以及可化学蚀刻的铜剥离层和保护性钽表面层,从而制备SAF(一种非SPIO磁性纳米粒子),并且在除去保护层和进行选择性铜蚀刻后释放所述SAF纳米粒子。
纳米粒子的尺寸为1nm至100nm(优选尺寸为1-50nm、2-40nm、5-20nm、1nm、2nm、3nm、4nm、5nm、6nm、7nm、8nm、9nm、10nm、11nm、12nm、13nm、14nm、15nm、16nm、17nm、18nm、19nm、20nm)。可以通过选择适宜的合成方法和/或系统来控制纳米粒子的尺寸。例如,为控制纳米粒子的尺寸,可以在极性溶剂中进行纳米粒子的合成,所述极性溶剂提供了能够吸附在纳米粒子表面上的离子种类,从而提供了静电作用和粒子-粒子斥力以帮助稳定纳米粒子并抑制纳米粒子的生长。举另一个例子,可以在微量非均质系统中合成纳米粒子,所述微量非均质系统能够将纳米粒子划入受限的空腔或域中。此类微量非均质系统可以包括液晶、单层和多层、直接胶束、反胶束、微乳和囊泡。为获得所需尺寸范围内的纳米粒子,可以适当控制或改变合成条件以提供例如所需的溶液浓度或所需的空腔范围(详细的综述可以参见例如Vincenzo Liveri,Controlled synthesis of nanoparticles in microheterogeneous systems,Springer出版,2006)。
纳米粒子的形状可以是球形、立方体、棒状(参见例如A.Fu等,Nano Letters,7,179-182(2007))、四角椎体形状(参见例如Manna等,Nature Materials,2,382-385(2003))、椎体、多臂、纳米管、纳米线、纳米纤维、纳米板或任意其他适宜的形状。在制备过程中控制纳米粒子形状的方法是本领域公知的(参见例如Waseda Y.等,Morphology control of materials and nanoparticles:advanced materials processing and characterization,Springer出版,2004)。例如,当采用自下而上的过程(即从分子至纳米粒子)制备纳米粒子时,可以加入强烈吸附于特定晶面上的形状控制剂以控制粒子的生长速率。
单个纳米结构可以包含单个纳米粒子或者多个微型纳米粒子或一簇微型纳米粒子(A.Fu等,J.Am.chem.Soc.126,10832-10833(2004),J.Ge等,Angew.Chem.Int.Ed.46,4342-4345(2007),Zhenda Lu等,Nano Letters 11,3404-3412(2011))。所述微型纳米粒子可以是均质的(例如由相同组合物/材料制得或具有相同尺寸)或者异质的(由不同组合物/材料制得或具有不同尺寸)。一簇均质微型纳米粒子指具有基本上相同的特征或特性或者由基本上相同的材料组成的一系列粒子。一簇异质微型纳米粒子指具有不同特征或特性或者由基本上不同的材料组成的一系列粒子。例如,异质微型纳米粒子可以包含在中心的量子点和与所述量子点连接的若干离散的金(Au)纳米晶。当纳米粒子与涂层(如下文所述)缔合时,在一系列异质纳米粒子中不同的纳米粒子不需要首先彼此之间缔合,而是能够单独和分别地与涂层缔合。
在某些实施方式中,所公开的纳米结构包含多个纳米粒子。例如,纳米结构含有2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、50、60、70、80、90、100、100s或1000s个纳米粒子。
在某些实施方式中,本申请所提供的纳米结构还包含涂层。至少一个核纳米粒子能够嵌入涂层或使用涂层涂覆。可以使用本领域公知的任意适宜涂层,例如聚合物涂层和非聚合物涂层。涂层通过如下与核纳米粒子相互作用1)分子内相互作用,如共价键(例如σ键、π键、δ键、双键、三键、四重键、五重键、六重键、3c-2e、3c-4e、4c-2e、抓氢键、弯曲键、偶极键、π反向键、共轭、超共轭、芳香性、哈普托数和反键)、金属键(例如与在核纳米粒子中的金属原子的螯合相互作用),或离子键(阳离子π键和盐键),和2)分子间相互作用,如氢键(例如双氢键、双氢配合物、低垒氢键、对称氢键)和非共价键(例如疏水性、亲水性、电荷-电荷或π-堆叠相互作用、范德华力、伦敦色散力、机械键、卤素键、亲金作用、嵌入、堆叠、熵力和化学极性)。
在某些实施方式中,涂层包含如美国临时申请61/589,777和美国专利申请12/460,007(本公开中引用的所有参考文献整体并入本申请)所公开的的低密度多孔性3D结构。
所述低密度多孔性3D结构指与现有介孔纳米粒子(例如孔尺寸为2nm至50nm的介孔纳米粒子)相比密度低得多(例如十几倍、二十几倍、三十几倍、五十几倍、七十几倍、100s倍)的结构。(A.Vincent等,J.Phys.Chem.C,2007,111,8291-8298;J.E.Lee等,J.Am.Chem.Soc,2010,132,552-557;Y.-S.Lin等,J.Am.Chem.Soc,2011,133,20444-20457;Z.Lu,Angew.Chem.Int.Ed.,2010,49,1862-1866.)。
在某些实施方式中,所述低密度多孔性3D结构指密度<1.0g/cc(例如<100mg/cc、<10mg/cc、<5mg/cc、<1mg/cc、<0.5mg/cc、<0.4mg/cc、<0.3mg/cc、<0.2mg/cc或<0.1mg/cc)的结构(例如,从0.01mg/cc至10mg/cc、从0.01mg/cc至8mg/cc、从0.01mg/cc至5mg/cc、从0.01mg/cc至3mg/cc、从0.01mg/cc至1mg/cc、从0.01mg/cc至1mg/cc、从0.01mg/cc至0.8mg/cc、从0.01mg/cc至0.5mg/cc、从0.01mg/cc至0.3mg/cc、从0.01mg/cc至1000mg/cc、从0.01mg/cc至915mg/cc、从0.01mg/cc至900mg/cc、从0.01mg/cc至800mg/cc、从0.01mg/cc至700mg/cc、从0.01mg/cc至600mg/cc、从0.01mg/cc至500mg/cc、从0.1mg/cc至800mg/cc、从0.1mg/cc至700mg/cc、从0.1mg/cc至1000mg/cc、从1mg/cc至1000mg/cc、从5mg/cc至1000mg/cc、从10mg/cc至1000mg/cc、从20mg/cc至1000mg/cc、从30mg/cc至1000mg/cc、从30mg/cc至1000mg/cc、从30mg/cc至900mg/cc、从30mg/cc至800mg/cc或者从30mg/cc至700mg/cc)。
可以使用本领域公知的多种方法确定3D结构的密度(参见例如Lowell,S.等,Characterization of porous solids and powders:surface area,pore size and density,Springer出版,2004)。示例性的方法包括Brunauer Emmett Teller(BET)法和氦比重计法(参见例如Varadan V.K.等,Nanoscience and Nanotechnology in Engineering,World Scientific出版,2010)。简言之,在BET法中,将待测3D结构的干燥粉末置于向其中供给氦气和氮气的检测箱中,记录温度变化,并对结果进行分析和外推以计算待测样品的密度。在氦比重计法中,使用氦气填充待测3D结构的干燥粉末,并研究由体积变化产生的氦气压力以提供密度。由于3D结构的超低密度,因此基于干燥粉末样品的测定密度不反映3D结构的实际密度,框架容易在干燥过程中坍塌,因此其在孔隙度测定中提供的数量比当3D结构完全伸展时(例如像当3D结构在缓冲溶液中完全伸展时)小得多。在某些实施方式中,可以使用3D结构的干重除以该3D结构在水溶液中的总体积来确定3D结构的密度。例如,可以分别确定具有和不具有3D结构的核粒子的干重,并且这两者之间的差值将是3D结构的总质量。类似地,可以分别确定在水溶液中具有和不具有3D结构的核粒子的体积,并且这两者之间的差值将是在水溶液中核粒子上3D结构的体积。
在某些实施方式中,多孔性纳米结构可以作为多个涂覆有3D结构的大纳米粒子在水溶液中分散,在这种情况下,3D结构的总体积可以计算为单个大纳米粒子的3D结构的平均体积乘以大纳米粒子的数量。对于每个单独的大纳米粒子而言,可以使用动态光散射(DLS)技术确定具有3D结构的粒子的尺寸(例如半径),并且可以在透射电子显微镜(TEM)下确定不具有3D结构的粒子核的尺寸(例如半径),因为3D结构在TEM下基本上是不可见的。相应地,可以通过从具有3D结构的粒子的体积中减去不具有3D结构的粒子的体积而获得在单独的大纳米粒子上的3D结构的体积。
可以使用任意适宜的方法计算对于给定核质量的大纳米粒子的数量。例如,单独的大纳米粒子可以由在TEM下可见的多个小纳米粒子组成。在这种情况下,可以基于在TEM下的测定结果确定小纳米粒子的平均尺寸和体积,可以通过将已知的核材料的密度乘以小粒子的体积确定小纳米粒子的平均质量。可以通过用核质量除以小纳米粒子的平均质量来估计小纳米粒子的总数。对于单独的大纳米粒子而言,可以在TEM下确定其中小纳米粒子的平均数量。相应地,可以通过小纳米粒子的总数除以在单独的大纳米粒子中的小纳米粒子的平均数量来估算对于给定核质量而言的大纳米粒子的数量。或者,所述低密度多孔性3D结构指在结构中具有40%-99.9%(优选50%至99.9%)的空的空间或孔的结构,其中80%的孔具有尺寸为1nm至500nm的孔半径。
可以通过气体/蒸汽吸附法表征3D结构的孔隙度。在这种技术中,通常,在其沸点下的氮气吸附于固体样品上。可以使用在特定分压下吸附的气体量,通过Brunauer、Emmit和Teller(BET)氮气吸附/解吸公式来计算材料的比表面积。通过Kelvin公式或经修订的Kelvin公式(BJH公式(参见例如D.Niu等,J.Am.chem.Soc.132,15144-15147(2010)))来计算孔尺寸。还可以通过压汞法表征3D结构的孔隙度(参见例如Varadan V.K.等,如上所示)。简言之,从3D结构中除去气体,然后将该结构浸入汞中。因为汞在室温下是不润湿的,施加外部压力逐渐迫使汞进入样品。通过监测每个施加压力下引入的汞的加入体积,基于Washburn公式计算孔尺寸。
或者,所述低密度多孔性3D结构指具有如下材料性质的结构,即所述多孔性结构(一个或多个核纳米粒子除外)在透射电子显微镜下不能明显地观察到或者基本上是透明的,例如即使当所述3D结构的特征尺寸在10s或100s纳米范围内时。在本申请中使用的术语“明显地观察到”或“基本上是透明的”指基于在TEM下3D结构的图像能够容易地估计或确定所述3D结构的厚度。可以通过本领域公知的方法观察或测定纳米结构(例如涂覆有低密度多孔性3D结构或嵌入低密度多孔性3D结构中/在其上具有低密度多孔性3D结构的纳米粒子)。例如,可以使用DLS法测定具有3D结构的纳米结构的尺寸(例如半径),可以在TEM下测定不具有3D结构的核粒子的尺寸(例如半径)。在某些实施方式中,3D结构的厚度通过DLS测得为10s、100s纳米范围,但是其在TEM下不能容易地确定。例如,当在透射电子显微镜(TEM)下观察本申请所提供的纳米结构时,可以鉴定纳米粒子,但是低密度多孔性3D结构不能被明显地观察到,或者其几乎是透明的。这将所述低密度多孔性3D结构与现有技术中报道的那些相区分,现有技术中报道的那些包含涂覆有交联的和尺寸可调的3D结构的纳米粒子,包括介孔二氧化硅纳米粒子或涂层(参见例如J.Kim等,J.Am.Chem..Soc,2006,128,688-689;J.Kim等,Angew.Chem.Int.Ed.,2008,47,8438-8441)。该特征也表明与本领域公知的其他涂覆的纳米粒子相比,所述低密度多孔性3D结构具有低得多的密度和/或高得多的多孔性。所述3D结构的多孔性还可以通过负载不同分子的能力进行评估(参见例如Wang L.等,Nano Research 1,99-115(2008))。因为本申请所提供的3D结构具有低密度,可以预计与其他涂覆的纳米粒子相比,更多的有效负载能够与所述3D结构缔合。例如,当3D结构负载有机荧光团(如罗丹明)时,一个纳米粒子的3D结构能负载超过105个罗丹明分子。
在某些实施方式中,所述低密度多孔性3D结构由含有硅烷的分子或硅烷样分子(例如硅烷、有机硅烷、烷氧基硅烷、硅酸盐及其衍生物)制得。
在某些实施方式中,含有硅烷的分子包括有机硅烷,有机硅烷也称为硅烷偶联剂。有机硅烷具有通式RxSiY(4-x),其中R基团是烷基、芳基或有机官能团。Y基团是甲氧基、乙氧基或乙酰氧基,x是1、2或3。R基团能够赋予特定功能,如使有机硅烷分子与核纳米粒子的表面或其他有效负载通过共价或非共价相互作用缔合。Y基团是可水解的,并且能够形成硅氧烷键以与另一种有机硅烷分子交联。示例性的R基团包括但不限于二硫烷基、氨基烷基、巯基烷基、乙烯基烷基、环氧基烷基和甲基丙烯酰基烷基、羧基烷基。在R基团中的烷基可以是亚甲基、亚乙基、亚丙基等。示例性的Y基团包括但不限于烷氧基,如OCH3、OC2H5和OC2H4OCH3。例如,有机硅烷可以是氨基-丙基-三甲氧基硅烷、巯基-丙基-三甲氧基硅烷、羧基-丙基-三甲氧基硅烷、氨基-丙基-三乙氧基硅烷、巯基-丙基-三乙氧基硅烷、羧基-丙基-三乙氧基硅烷、双-[3-(三乙氧基甲硅烷基)丙基]-四硫化物、双-[3-(三乙氧基甲硅烷基)丙基]-二硫化物、氨基丙基三乙氧基硅烷、N-2-(氨基乙基)-3-氨基丙基三甲氧基硅烷、乙烯基三甲氧基硅烷、乙烯基-三(2-甲氧基乙氧基)硅烷、3-甲基丙烯酰氧基丙基三甲氧基硅烷、2-(3,4-环氧基环己基)-乙基三甲氧基硅烷、3-环氧丙氧基-丙基三乙氧基硅烷、3-异氰酸酯基丙基三乙氧基硅烷和3-氰酸酯基丙基三乙氧基硅烷。
细胞调节剂
所述纳米结构与至少一种细胞调节剂可操作地连接。
在本申请中所使用的术语“可操作地连接”包括将细胞调节剂嵌入、掺入、整合、缔合、连接、组合、交联、混合和/或包覆于纳米结构。所述细胞调节剂可以与纳米结构通过非共价缔合(例如氢键、离子键、范德华力和疏水性相互作用)或共价结合可操作地连接。例如,所述细胞调节剂与纳米结构的表面混合和/或掺入其上,或者还能够载入纳米结构的孔中。
在本申请中所使用的“调节”(“Modulating”、“modulation”或“modulate”)指细胞的改变和/或调控。细胞的改变和/或调控可以通过将与细胞调节剂结合的细胞的性质与对照(即不与细胞调节剂结合的细胞)的性质进行比较而确定。可以基于细胞的各种性质来测定细胞的改变和/或调控,包括但不限于在细胞群中细胞的数量、细胞的形态、细胞的品系/类型(例如从一种细胞类型转化为另一种)、细胞的状态(例如DNA或染色体的重排或重组、RNA或蛋白的表达改变、蛋白的分泌或运输)、细胞的移动或迁移。可以使用本领域公知的适宜方法确定细胞的改变和/或调控,包括例如使用显微镜观察、细胞计数、细胞分选、免疫组化、免疫细胞化学、PCR、northern印迹、southern印迹、western印迹(参见例如Julio E.Celis等,Cell Biology,A Laboratory Handbook(3rd Ed.))。
本申请中使用的“相互作用”或“结合”指两个分子之间非随机的缔合。所述非随机的缔合可以由结合亲和性(Kd)表征,所述结合亲和性计算为当两个分子之间的结合达到平衡时的解离速率与缔合速率的比值(koff/kon)。当kon的测定结果例如由于一种分子的聚集而难以获得时,还可以使用在结合平衡时测得的解离速率(koff)。可以使用本领域公知的适宜方法适当地确定细胞调节剂与细胞表面上的分子之间的结合亲和性(例如Kd或koff),包括例如Biacore(参见例如Murphy,M.等,Current protocols in protein science,第19章,第19.14节,2006)和Kinexa技术(参见例如Darling,R.J.等,Assay Drug Dev.TechnoL,2(6):647-657(2004))。
在一些实施方式中,与纳米结构可操作地连接的细胞调节剂包括特异性识别细胞表面上的分子的抗体。举一个例子,所述细胞调节剂包括抗CD3抗体。举另一个例子,所述细胞调节剂包括抗CD28抗体。举另一个例子,所述细胞调节剂包括CD137抗体。举又一个例子,所述细胞调节剂包括IL-15受体抗体。
如在本申请中所使用的术语“抗体”旨在包括多克隆和单克隆抗体、嵌合抗体、半抗原和抗体片段,以及与抗原上的表位特异性结合而作为抗体等效物的分子。术语“抗体”包括任意同种型(IgA、IgG、IgE、IgD、IgM)的多克隆和单克隆抗体,或其抗原结合部分,包括但不限于F(ab)和Fv片段(如sc Fv)、单链抗体、嵌合抗体、人源化抗体和Fab表达库。
在一些实施方式中,细胞调节剂是细胞表面上的受体的配体。举一个例子,所述细胞调节剂包括CD28天然配体的刺激性形式,所述CD28天然配体选自由B7-1和B7-2组成的组。举另一个例子,所述细胞调节剂是CD137配体蛋白。举另一个例子,所述细胞调节剂是CD81配体蛋白。举另一个例子,所述细胞调节剂是IL-15蛋白。举另一个例子,所述细胞调节剂是细胞因子,包括趋化因子(例如CCL14、CCL19、CCL20、CCL21、CCL25、CCL27、CXCL12和CXCL13、IL-1、TNF-α、LPS、CXCL-8、CCL2、CCL3、CCL4、CCL5、CCL11、CXCL10)、干扰素(例如INF-α、INF-β、INF-γ)、白介素(例如IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-11、IL-12、IL-13、IL-15、IL-17)、淋巴因子(例如IL-2、IL-3、IL-4、IL-5、IL-6、粒细胞-巨噬细胞CSF、INF-γ)、肿瘤坏死因子(例如TNF-α、淋巴毒素-α、gp39(CD40L)、CD27L、CD30L、FASL、4-1BBL、OX40L、TNF相关凋亡诱导配体(TRAIL))。举另一个例子,所述细胞调节剂是激素,包括催乳素、加压素、催产素、心房利钠肽(ANP)、心房利钠因子(ANF)、胰高血糖素、胰岛素、促生长素抑制素、胆囊收缩素、胃泌素、瘦素、黄体生成素,卵泡刺激素或甲状腺刺激激素。举又一个例子,所述细胞调节剂是生长因子,包括肾上腺髓质素(AM)、血管生成素(ANG)、自分泌移动因子、骨形态发生蛋白(BMP)、脑源性神经营养因子(BDNF)、表皮生长因子(EGF)、促红细胞生成素(EPO)、成纤维细胞生长因子(FGF)、神经胶质细胞系来源的神经营养因子(GDNF)、粒细胞集落刺激因子(G-CSF)、粒细胞巨噬细胞集落刺激因子(GM-CSF)、生长分化因子-9(GDF9)、肝细胞生长因子(HGF)、肝癌来源的生长因子(HDGF)、胰岛素样生长因子(IGF)、迁移刺激因子、肌肉生长抑制素(GDF-8)、神经生长因子(NGF)和其他神经营养因子、血小板来源的生长因子(PDGF)、血小板生成素(TPO)、转化生长因子α(TGF-α)、转化生长因子β(TGF-β)、肿瘤坏死因子-α(TNF-α)、血管内皮生长因子(VEGF)、Wnt信号通路、胎盘生长因子(PGF)、胎牛生长激素(FBS)、IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7。
在某些实施方式中,所述细胞调节剂选自下组:抗CD3抗体、抗CD28抗体、抗CD81抗体、CD28配体的刺激形式、抗CD5抗体、抗CD4抗体、抗CD8抗体、抗CTLA-4抗体、抗PD-1抗体、抗PD-L1抗体、抗CD278抗体、抗CD27L抗体、抗CD137抗体、CD137配体蛋白、抗CD30L抗体、IL-2、IL-2受体抗体、IL-15蛋白、IL-15受体抗体、IL-12、IL-12受体抗体、IL-1、IL-1受体抗体、IFN-γ、IFN-γ受体抗体、TNF-α、TNF-α受体抗体、IL-4、IL-4受体抗体、IL-10、IL-10受体抗体及其任意组合。
在一些实施方式中,所述细胞调节剂是疫苗。疫苗是改善对特定疾病免疫性的分子。在一些实施方式中,所述细胞调节剂类似于引起疾病的微生物,并且由微生物的减弱或死亡形式、其毒素,或其表面蛋白中的一种制成。例如,所述细胞调节剂是针对腺病毒、炭疽热、活BCG、白喉、破伤风类毒素、无细胞百日咳、流感嗜血杆菌B、甲肝、乙肝、人乳头瘤病毒、甲型流感病毒(H1N1)、流感病毒、甲型流感病毒(HSN1)、日本脑炎病毒、麻疹、腮腺炎病毒、风疹病毒、脑膜炎球菌、鼠疫、肺炎球菌、脊髓灰质炎病毒、狂犬病毒、轮状病毒、天花、伤寒、水痘病毒、黄热病、带状疱疹。在一些实施方式中,所述细胞调节剂是癌症疫苗。例如,所述细胞调节剂是肿瘤抗原,即从癌细胞分离的蛋白。另一个例子,所述细胞调节剂可以是BiovaxID(治疗滤泡性淋巴瘤)、Provenge(治疗前列腺癌)、Tarmagens、黑色素瘤相关抗原3(MAGE-A3)、PROSTVAC、CDX110、CDX1307、CDX1401、CimaVax-EGF(治疗肺癌)、CV9104、Neuvenge、Neu Vax、Ax-37、ADXS11-001、ADXS31-001、ADXS31-164、GI-4000、GRNVAC1、GI6207、GI6301、IMA901、Stimuvax、Cvac、SCIB1。
细胞表面上的分子
所述细胞调节剂能够与细胞表面上的分子相互作用。分子组成型地或瞬时地存在于细胞表面上。在一些实施方式中,在细胞被本申请所述的纳米组合物调节后,所述分子在细胞表面上出现。
在一些实施方式中,在细胞表面上的分子是细胞表面受体。在一些实施方式中,细胞表面受体是特定的完整的膜蛋白,其参与细胞与环境之间的交流。在一些实施方式中,细胞表面上的分子是细胞因子受体,例如白介素受体、红细胞生成素受体、GM-CSF受体、G-CSF受体、生长激素受体、催乳素受体、制瘤素M受体、白血病抑制因子受体、干扰素α/β受体、干扰素γ受体、IL-1受体、CSF1、C-kit受体、IL-18受体、CD27、CD30、CD40、CD120、淋巴毒素β受体、IL-8受体、IL-17受体、CCR1、CXCR4、MCAF受体、NAP-2受体、TGFβ受体。在一些实施方式中,细胞表面上的分子是生长因子受体,例如降钙素受体、降钙素受体样受体、VEGF受体、EGF受体、FGF受体、BMP受体、BDNF受体、促红细胞生成素受体、GDNF受体、G-CSF受体、GM-CSF受体、GDF受体、HGF受体、HDGF受体、IGF受体、NGF受体、PDGF受体、TPO受体、TGF-α受体、TGF-β受体。在一些实施方式中,细胞表面上的分子是激素受体,例如胰岛素受体、甲状腺素刺激激素受体、卵泡刺激激素受体、促黄体激素受体。
在某些优选的实施方式中,与所述纳米结构可操作地连接的细胞调节剂包括与上文所述的细胞表面受体特异性结合的抗体。
在一些实施方式中,细胞表面上的分子是细胞粘附分子。在一些实施方式中,细胞粘附分子是位于细胞表面上的蛋白,其参与与其他细胞或与细胞外基质的结合,辅助细胞彼此之间粘附或与其周围粘附。在一些实施方式中,细胞表面上的分子是免疫球蛋白超家族细胞粘附分子,例如突触细胞粘附分子、神经细胞粘附分子、细胞间细胞粘附分子、血管细胞粘附分子、血小板内皮细胞粘附分子、L1蛋白、CHL1、神经束蛋白、NrCAM、髓鞘相关糖蛋白、CD22、CD83、CTX、连接粘附分子、BT-IgSF、柯萨奇病毒和腺病毒受体、VSIG、ESAM、连接素、连接蛋白样分子、CD2、CD48。在一些实施方式中,细胞表面上的分子是淋巴细胞归巢受体,例如CD34和GLYCAM-1。在一些实施方式中,细胞表面上的分子是整合素。在一些实施方式中,细胞表面上的分子是钙粘蛋白。在一些实施方式中,细胞表面上的分子是选择素,例如F-选择素、L-选择素和P-选择素。
被调节的细胞及其行为
细胞调节剂与细胞表面上的分子之间的相互作用调节细胞的行为、触发细胞的功能或性质的改变。所述细胞包括原核细胞和真核细胞。在一些实施方式中,所述细胞是动物细胞。在一些优选的实施方式中,所述细胞是哺乳动物细胞,例如小鼠细胞、大鼠细胞、家兔细胞、猴细胞、人细胞。所述细胞可以在体外分离和培养,或者存在于体内。
所述细胞可以是目标生物体内存在的任意类型,例如来源于内胚层的细胞(例如外分泌分泌细胞和激素分泌细胞)、来源于外胚层的细胞(例如上皮细胞、神经细胞)和来源于中胚层的细胞(例如代谢和贮存细胞、屏障功能细胞(肺细胞、肠细胞、外分泌腺细胞)、肾细胞、细胞外基质细胞、收缩性细胞(肌肉细胞)、血液和免疫系统细胞、生殖细胞、滋养细胞)。在一些实施方式中,所述细胞是免疫系统细胞,例如T细胞、B细胞、自然杀伤(NK)细胞、巨噬细胞。在一些优选的实施方式中,所述细胞是T细胞。在一些优选的实施方式中,所述细胞是NK细胞。
在一些实施方式中,所述细胞是干细胞,例如胚胎干细胞、诱导的多能干细胞、造血干细胞、乳房干细胞、肠干细胞、间充质干细胞、内皮干细胞、神经干细胞、神经嵴干细胞。
被调节的细胞的行为可以是细胞的任意功能或性质,包括但不限于细胞增殖、细胞生长、细胞分化、细胞活化、细胞转化、细胞迁移、细胞运动、细胞移动、细胞凋亡和细胞粘附、细胞纯度以及细胞用于治疗用途的能力。
在一些优选的实施方式中,被调节的细胞的行为是细胞增殖。例如,T细胞增殖可以通过施用与聚合物骨架或微珠偶联的抗CD3抗体而活化(参加美国专利号6,129,916)。类似地,T细胞增殖可以通过在体外将T细胞与抗CD3抗体和抗CD28抗体接触而活化,所述抗CD3抗体和抗CD28抗体均固定于固相表面上(参见美国专利号6,352,694)。T细胞增殖还可以通过与抗CD3抗体和CD28天然配体的刺激形式(如B7-1和B7-2)接触而活化,其中抗CD3抗体和CD28的天然配体均固定于固相表面上(参见美国专利号6,352,694)。NK细胞增殖可以通过将NK细胞与CD137配体蛋白、CD137抗体、IL-15蛋白或IL-15受体抗体接触而活化,其中CD137配体蛋白、CD137抗体、IL-15蛋白或IL-15受体抗体固定于固相支持物上(参见美国专利号8399645)。
在一些优选的实施方式中,被调节的细胞的行为是细胞分化。在一些实施方式中,可以通过将干细胞与能够诱导干细胞分化的分子接触而实现分化的调节,其中所述分子与纳米结构可操作地连接。例如,能够通过施用与微珠连接的IL-12而诱导CD34阳性细胞分化成NK细胞。
在一些优选的实施方式中,行为被调节的细胞可以用于治疗。在一些实施方式中,可以对细胞进行进一步调节以表达某种用于治疗的蛋白。在一些优选的实施方式中,所述细胞能够产生嵌合的抗原受体(CAR)。嵌合的抗原受体的示例参见美国专利号8,399,645(抗CD19单链可变片段结构域、4-1BB信号结构域和CD3zeta信号结构域嵌合受体);美国专利号5,686,281(T细胞受体CD28信号结构域嵌合受体);Geiger,T.L.等,Blood 98:2364-2371(2001);Hombach,A.等,J Immunol 167:6123-6131(2001)(CD28/CD3zeta信号受体);Maher,J.等,Nat Biotechnol 20:70-75(2002)(TCRzeta/CD28受体);Haynes,N.M.等,J Immunol 169:5780-5786(2002)(抗癌胚抗原单链可变片段/CD28zeta嵌合受体);Haynes,N.M.等,Blood 100:3155-3163(2002)(抗erbB2单链可变片段/CD28/TCR zeta嵌合受体);Till B.G.等,Blood 119(17):3940-50(2012)(具有CD28和4-1BB共刺激结构域的CD20特异性CAR);Haso W.等,Blood 121(7):1165-74(2013)(CD22特异性CAR)。这些参考文献在此并入本说明书。
显色的纳米结构
本申请所提供的纳米结构可以是显色的或非显色的。如在本申请中所使用的“显色的”指纳米结构在适宜条件下能够产生颜色信号。例如,在使用某种波长的光激发后,显色的纳米结构可以发射荧光颜色信号。或者,所述纳米结构可以是非显色的。当处于对于显色的纳米结构会诱导颜色信号的条件下时,非显色的纳米结构不发射颜色信号。
在某些实施方式中,显色的纳米结构是条形码编码的或与可检测试剂缔合以显示颜色。术语“条形码编码”或“条形码编码的”或“IDed”指所述纳米结构与能够鉴别所述纳米结构的已知编码或已知标签缔合。如在本申请中所使用的“编码”指能够产生将条形码编码或IDed的纳米结构彼此之间区分的可检测信号的分子。例如,所述显色的纳米结构可以包含显色的纳米粒子(例如量子点),所述显色的纳米粒子在已知波长下发射可检测的颜色信号。
在某些实施方式中,条形码编码的纳米结构的表征或鉴别是基于Han等,Nature Biotechnology,Vol.19,pp:631-635(2001)或US专利申请10/185,226公开的多路复用光编码系统。简言之,将多色半导体量子点(QD)嵌入纳米结构中。各QD具有给定强度(在例如0-10的水平内)和给定颜色(波长)。对于各单色编码而言,所述纳米结构取决于其中所嵌入的QD的数量而具有不同的QD强度。如果使用多种颜色(n种颜色)和多种强度(m种强度水平)的QD,则所述纳米结构可以具有等于m的n-1次方(mn-l)的独特标识或编码的总数。此外,由于多孔性结构能够与附加有效负载(例如荧光有机分子)缔合,如果可用的附加荧光颜色的数目为Y,则编码的总数可以是Yx(mn-l)。
在某些实施方式中,所述纳米粒子(具有或不具有条形码编码)通过与可检测试剂可操作地连接而显色。可检测试剂可以是荧光分子、化学发光分子、生物发光分子、放射性同位素、MRI造影剂、CT造影剂、酶底物标记和/或着色剂等。
荧光分子的示例包括但不限于荧光化合物(荧光团),其可以包括但不限于:1,5IAEDANS;1,8-ANS;4-甲基伞形酮;5-羧基-2,7-二氯荧光素;5-羧基荧光素(5-FAM);5-羧基萘荧光素;5-羧基四甲基罗丹明(5-TAMRA);5-FAM(5-羧基荧光素);5-HAT(羟基色胺);5-羟色胺(HAT);5-ROX(羧基-X-罗丹明);5-TAMRA(5-羧基四甲基罗丹明);6-羧基罗丹明6G;6-CR 6G;6-JOE;7-氨基-4-甲基香豆素;7-氨基放线菌素D(7-AAD);7-羟基-4-甲基香豆素;9-氨基-6-氯-2-甲氧基吖啶;ABQ;酸性品红;ACMA(9-氨基-6-氯-2-甲氧基吖啶);吖啶橙;吖啶红;吖啶黄(acridine yellow);吖啶黄(Acriflavin);富尔根氏吖啶黄(Acriflavin Feulgen)SITSA;水母素(发光蛋白);AFP-自体荧光蛋白-(量子生物技术);Fluor 350;Fluor 405;Fluor500;Alexa Fluor 430TM;Alexa Fluor 488TM;Alexa Fluor 532TM;Alexa Fluor 546TM;Alexa Fluor 568TM;Alexa Fluor 594TM;Alexa Fluor 633TM;Alexa Fluor 647TM;Alexa Fluor660TM;Alexa Fluor 680TM;茜素络合剂;茜素红;别藻蓝素(APC);AMC、AMCA-S;AMCA(氨基甲基香豆素);AMCA-X;氨基放线菌素D;氨基香豆素;氨基甲基香豆素(AMCA);苯胺蓝;Anthrocyl stearate;APC(别藻蓝素);APC-Cy7;APTRA-BTC;APTS;阿斯屈拉松(Astrazon)亮红4G;阿斯屈拉松(Astrazon)橙R;阿斯屈拉松(Astrazon)红6B;阿斯屈拉松(Astrazon)黄7GLL;阿的平;ATTO-TAGTMCBQCA;ATTO-TAGTMFQ;金胺;Aurophosphine G;Aurophosphine;BAO 9(双氨基苯基恶二唑);BCECF(高pH);BCECF(低pH);硫酸黄连素;β内酰胺酶;Bimane;双苯甲酰胺;双苯甲酰胺(赫司特公司(Hoechst));双-BTC;Blancophor FFG;Blancophor SV;BOBOTM-1;BOBOTM-3;氟硼荧492/515;氟硼荧493/503;氟硼荧500/510;氟硼荧505/515;氟硼荧530/550;氟硼荧542/563;氟硼荧558/568;氟硼荧564/570;氟硼荧576/589;氟硼荧581/591;氟硼荧630/650-X;氟硼荧650/665-X;氟硼荧665/676;氟硼荧Fl;氟硼荧FL ATP;氟硼荧Fl-神经酰胺;氟硼荧R6G SE;氟硼荧TMR;氟硼荧TMR-X偶联物;氟硼荧TMR-X,SE;氟硼荧TR;氟硼荧TR ATP;氟硼荧TR-X SE;BO-PROTM-1;BO-PROTM-3;磺基亮黄素(Brilliant Sulphoflavin)FF;BTC;BTC-5N;钙黄绿素;钙黄绿素蓝;深红钙TM;绿钙;绿钙-1Ca 2+染料;绿钙-2Ca 2+;绿钙-5N Ca 2+;绿钙-C18Ca2+;橙钙;卡尔科弗卢尔荧光增白剂(Calcofluor White);羧基-X-罗丹明(5-ROX);瀑布蓝(Cascade BlueTM);瀑布黄(Cascade Yellow);儿茶酚胺;CCF2(GeneBlazer商标);CFDA;叶绿素;色霉素A;色霉素A;CL-NERF;羧基荧光素双醋酸盐(CMFDA);香豆素鬼笔环肽;C-藻青素;CPM甲基香豆素;CTC;CTC甲臜;Cy2TM;Cy3.1 8;Cy3.5TM;Cy3TM;Cy5.1 8;Cy5.5TM;Cy5TM;Cy7TM;环AMP氟传感器(FiCRhR);Dabcyl;单磺酰;单磺酰胺;单磺酰尸胺;单磺酰氯;单磺酰DHPE;单磺酰氟;DAPI;Dapoxyl;Dapoxyl 2;Dapoxyl 3′DCFDA;DCFH(二氯二氢荧光素二乙酸酯);DDAO;DHR(二氢罗丹明123);二-4-ANEPPS;二-8-ANEPPS(未按照比例);DiA(4-二-16-ASP);二氯二氢荧光素二乙酸酯(DCFH);DiD-亲脂性示踪剂;DiD(DiIC18(5));DIDS;二氢罗丹明123(DHR);DiI(DiIC18(3));二硝基酚;DiO(DiOC18(3));DiR;DiR(DiIC18(7));DM-NERF(高pH);DNP;多巴胺;DTAF;DY-630-NHS;DY-635-NHS;ELF 97;曙红;赤藓红;赤藓红ITC;溴化乙锭;乙啶均二聚体-1(EthD-1);Euchrysin;EukoLight;氯化铕(III);EYFP;快蓝;FDA;富尔根(副品红):FIF(甲醛诱导的荧光);FITC;Flazo Orange;Fluo-3;Fluo-4;荧光素(FITC);荧光素二乙酸酯;Fluoro-Emerald;荧光金(羟芪巴脒);Fluor-Ruby;Fluor X;FM1-43TM;FM 4-46;Fura RedTM(高pH);Fura RedTM/Fluo-3;Fura-2;Fura-2/BCECF;Genacryl Brilliant Red B;Genacryl Brilliant Yellow 10GF;Genacryl Pink 3G;Genacryl Yellow 5GF;GeneBlazer(CCF2);Gloxalic Acid;粒状蓝;血卟啉;Hoechst 33258;Hoechst 33342;Hoechst 34580;HPTS;羟基香豆素;羟芪巴脒(荧光金);羟色胺;Indo-1,高钙;Indo-1,低钙;吲哚二碳菁(DiD);吲哚三碳菁(DiR);Intrawhite Cf;JC-1;JO-JO-1;JO-PRO-1;LaserPro;Laurodan;LDS 751(DNA);LDS 751(RNA);Leucophor PAF;Leucophor SF;Leucophor WS;丽丝胺罗丹明;丽丝胺罗丹明B;钙黄绿素/乙锭均二聚体;LOLO-1;LO-PRO-1;荧光黄;Lyso示踪蓝;Lyso示踪蓝-白;Lyso示踪绿;Lyso示踪红;Lyso示踪黄;Lyso传感器蓝;Lyso传感器绿;Lyso传感器黄/绿;Mag绿;萘红(根皮红B);Mag-Fura红;Mag-Fura-2;Mag-Fura-5;Mag-Indo-1;镁绿;镁橙;孔雀石绿;海蓝;Maxilon Brilliant Flavin 10GFF;Maxilon Brilliant Flavin 8GFF;血蓝蛋白;甲氧基香豆素;线粒体示踪绿FM;线粒体示踪橙;线粒体示踪红;光辉霉素;Monobromobimane;Monobromobimane(mBBr-GSH);Monochlorobimane;MPS(甲基氯派若宁二苯乙烯);NBD;NBD胺;尼罗红;Nitrobenzoxadidole;去甲肾上腺素;核快红;核黄;Nylosan Brilliant lavin E8G;俄勒冈绿;俄勒冈绿488-X;俄勒冈绿TM;俄勒冈绿TM488;俄勒冈绿TM500;俄勒冈绿TM514;太平洋蓝;副蔷薇胺(福尔根);PBFI;PE-Cy5;PE-Cy7;PerCP;PerCP-Cy5.5;PE-德克萨斯红[Red 613];根皮红B(麦哥达拉红);Phorwite AR;Phorwite BKL;Phorwite Rev;Phorwite RPA;磷化氢3R;光刻胶;藻红蛋白B[PE];藻红蛋白R[PE];PKH26(Sigma);PKH67;PMIA;Pontochrome Blue Black;POPO-1;POPO-3;PO—PRO-1;PO-PRO-3;樱草黄;普施安黄;碘化丙啶(PI);PYMPO;芘;派若宁;派若宁B;Pyrozal Brilliant Flavin 7GF;QSY 7;喹吖因氮芥;红613[PE-德克萨斯红];试卤灵;RH 414;Rhod-2;罗丹明;罗丹明110;罗丹明123;罗丹明5GLD;罗丹明6G;罗丹明B;罗丹明B 200;罗丹明B额外的;罗丹明BB;罗丹明BG;罗丹明绿;罗丹明Phallicidine;罗丹明鬼笔环肽;罗丹明红;罗丹明WT;玫瑰红;R-藻青蛋白;R-藻红蛋白(PE);S65A;S65C;S65L;S65T;SBFI;血清素;Sevron亮红2B;Sevron亮红4G;Sevron亮红B;Sevron橙;Sevron黄L;SITS;SITS(樱草黄);SITS(二苯乙烯异硫代磺酸);SNAFL钙黄绿素;SNAFL-1;SNAFL-2;SNARF钙黄绿素;SNARF1;钠绿;光谱浅绿;光谱绿;光谱橙;光谱红;SPQ(6-甲氧基-N-(3-硫代丙基)喹啉);二苯乙烯;硫代罗丹明B和C;硫代罗丹明额外;SYTO 11;SYTO 12;SYTO 13;SYTO 14;SYTO 15;SYTO 16;SYTO 17;SYTO 18;SYTO 20;SYTO 21;SYTO 22;SYTO 23;SYTO 24;SYTO 25;SYTO 40;SYTO 41;SYTO 42;SYTO 43;SYTO 44;SYTO 45;SYTO 59;SYTO 60;SYTO 61;SYTO 62;SYTO 63;SYTO 64;SYTO 80;SYTO 81;SYTO 82;SYTO 83;SYTO 84;SYTO 85;SYTOX蓝;SYTOX绿;SYTOX橙;四环素;四甲基罗丹明(TRITC);德克萨斯红TM;德克萨斯红-XTM偶联物;硫代二羰基菁(DiSC3);噻嗪红R;噻唑橙;硫代黄素5;硫代黄素S;硫代黄素TCN;Thiolyte;硫代噻唑橙;Tinopol CBS(Calcofluor White);TMR;TO-PRO-1;TO-PRO-3;TO-PRO-5;TOTO-1;TOTO-3;TriColor(PE-Cy5);TRITC四甲基罗丹明异硫氰酸酯;真蓝;真红;Ultralite;荧光素钠B;Uvitex SFC;WW 781;X-罗丹明;XRITC;二甲苯橙;Y66F;Y66H;Y66W;YO-PRO-1;YO-PRO-3;YOYO-1;YOYO-3;Sybr绿、噻唑橙(内部螯合染料(interchelating dye))、荧光半导体纳米粒子、镧系元素或其组合。
放射性同位素的示例包括123I、124I、125I、131I、35S、3H、111In、112In、14C、64Cu、67Cu、86Y、88Y、90Y、177Lu、211At、186Re、188Re、153Sm、212Bi、32P、18F、201Tl、67Ga、137Cs和其他放射性同位素。
酶底物标记的例子包括荧光素酶(例如萤火虫荧光素酶和细菌荧光素酶)、荧光素、2,3-二氢酞嗪二酮、苹果酸脱氢酶、脲酶、过氧化物酶如辣根过氧化物酶(HRPO)、碱性磷酸酶、-半乳糖苷酶、葡糖淀粉酶、溶菌酶、糖氧化酶(例如葡萄糖氧化酶、半乳糖氧化酶和葡萄糖-6-磷酸脱氢酶)、杂环氧化酶(如尿酸酶和黄嘌呤氧化酶)、乳过氧化物酶、微过氧化物酶等。
纳米组合物的使用方法
本公开的另一个方面提供了一种通过将所述细胞与同纳米结构可操作地连接的至少一种细胞调节剂接触而调节细胞行为的方法。所述细胞调节剂与细胞表面上的分子相互作用,并且所述细胞调节剂与所述分子之间的相互作用调节所述细胞的行为。
在一些实施方式中,所述细胞调节剂是与细胞表面上的受体特异性结合,以使得所述结合将导致所述细胞的功能或性质的改变的分子(例如抗体或配体)。可以使用本领域公知的适宜方法确定细胞的功能或性质的改变,包括例如使用显微镜观察、细胞计数、细胞分选、免疫组化、免疫细胞化学、PCR、northern印迹、southern印迹、western印迹(参见例如Julio E.Celis等,Cell Biology,A Laboratory Handbook(3rd Ed.))。可以使用本领域公知的方法对行为已被调节的细胞进行分离、富集或纯化以供进一步的研究或治疗应用。在一些优选的实施方式中,可以通过应用磁场以下拉细胞对行为已被调节的细胞进行富集。在此类实施方式中,与细胞调节剂可操作地连接的纳米结构包含磁性材料。在将纳米组合物施用至细胞并调节其行为后,可以通过应用磁场而下拉与纳米组合物特异性结合的细胞。在某些实施方式中,可以通过反复地再分散细胞并应用磁场下拉细胞而进一步纯化所富集的细胞。或者,包含细胞调节剂的纳米组合物不包含磁性材料。在细胞行为被调节后,施用包含特异性识别被调节细胞的试剂的另一个纳米组合物,并应用磁场以下拉被调节的细胞。可以预期的是,所述非磁性纳米粒子包括但不限于在美国临时申请61/589,777和美国临时申请12/460,007中公开的纳米粒子,只要所述非磁性纳米粒子能够携带细胞调节剂。
在某些实施方式中,在将细胞用于进一步的研究或治疗应用前,不需要对经富集、分离或纯化的被调节的细胞进行处理以除去纳米组合物。
在某些实施方式中,调节细胞行为的方法包括将细胞与两种或更多种细胞调节剂接触的步骤,所述两种或更多种细胞调节剂协同作用以调节细胞的行为。所述两种或更多种细胞调节剂可以与一个纳米结构可操作地连接。或者,所述两种或更多种细胞调节剂可以分别与不同纳米结构可操作地连接。
在某些实施方式中,公开了使用多种磁性纳米组合物调节细胞的方法。所述方法包括将细胞与同第一纳米结构可操作地连接的第一细胞调节剂接触的步骤。所述第一纳米结构包含顺磁性材料。在细胞被第一细胞调节剂调节后,通过应用强磁场而富集细胞。然后将与第二纳米结构可操作地连接的第二细胞调节剂进一步施用至所富集的细胞。所述第二纳米结构包含超顺磁性材料。在细胞被第二细胞调节剂调节后,然后通过应用磁场富集细胞,其中仅有与第二细胞调节剂结合的细胞而非与第一细胞调节剂结合的细胞被下拉。此类方法提供了在将被调节的细胞用于进一步的研究或治疗应用之前不需要将纳米组合物除去。
在某些实施方式中,用于调节细胞行为的方法包括向对象施用纳米组合物,从而在体内将细胞与细胞调节剂接触的步骤。例如,可以向对象施用包含疫苗的纳米组合物以提高对象针对特定疾病的免疫力。
在某些实施方式中,用于调节细胞行为的方法包括向对象施用被调节的细胞,并且追踪在对象体内被调节细胞的结果的步骤。在此类实施方式中,所述纳米组合物还包含与所述纳米结构可操作地连接的可检测标记。例如,所述可检测标记可以是荧光分子、化学发光分子、生物发光分子、放射性同位素、MRI造影剂、CT造影剂、酶底物标记或着色剂。
在某些实施方式中,当样品中细胞表面上的分子为亚纳克水平时,可以进行用于调节细胞行为的方法。
在某些实施方式中,术语“亚纳克水平”指不超过100ng、10ng、1ng或0.1ng的分子。例如亚纳克包括0.01ng、0.02ng、0.03ng、0.04ng、0.05ng、0.06ng、0.07ng、0.08ng、0.09ng、0.1ng、0.2ng、0.3ng、0.4ng、0.5ng、0.6ng、0.7ng、0.8ng、0.9ng、1.0ng或者任意上述水平之间的任意范围(例如0.01ng至100ng之间、0.01ng至10ng之间、0.01ng至1ng之间、0.01ng至0.1ng之间)。
在某些实施方式中,亚纳克水平指不超过1000pM、100pM、10pM、1pM、0.1pM、0.01pM、0.001pM(=1fM)或0.0001pM的分析物。例如,亚纳克包括0.001pM(=1fM)、0.002pM、0.003pM、0.004pM、0.005pM、0.006pM、0.007pM、0.008pM、0.009pM、0.01pM、0.02pM、0.03pM、0.04pM、0.05pM、0.06pM、0.07pM、0.08pM、0.09pM、0.1pM、0.1pM、0.2pM、0.3pM、0.4pM、0.5pM、0.6pM、0.7pM、0.8pM、0.9pM、1pM、2pM、3pM、4pM、5pM、6pM、7pM、8pM、9pM、10pM或者任意上述水平之间的任意范围(例如0.0001pM至1000pM之间、0.0001pM至100pM之间、0.0001pM至10pM之间、0.0001pM至1pM之间、0.0001pM至0.1pM之间、0.0001pM至0.01pM之间、0.0001pM至0.001pM之间)。
在某些实施方式中,亚纳克水平指样品中的单个细胞、多个细胞(例如2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200个细胞)。
在某些实施方式中,用于调节细胞的方法还包括富集所述细胞的群。
本发明的另一个方面涉及一种在对象中治疗疾病的方法。所述方法包括将细胞与同纳米结构可操作地连接的至少一种细胞调节剂接触。所述细胞调节剂与细胞表面上的分子相互作用。所述细胞调节剂与所述分子之间的相互作用调节所述细胞的行为。然后向所述对象施用被调节的细胞。在某些优选的实施方式中,所治疗的疾病是癌症。
如在本说明书中所使用的,术语“对象”指动物,优选地为哺乳动物,更优选地为人。所述“对象”不旨在在任何方面为限制性的,并且其可以是任何年龄、性别和身体状况。
制备纳米组合物的方法
本申请的另一个方面涉及形成纳米组合物的方法,所述纳米组合物包含纳米结构和与所述纳米结构可操作地连接的至少一种细胞调节剂,其中所述细胞调节剂可以与细胞表面上的分子相互作用,其中所述细胞调节剂与所述分子之间的相互作用调节所述细胞的行为。在某些实施方式中,所述细胞调节剂和/或可检测标记可以例如在溶液、分散体、悬浮体、乳液等中与易于形成的纳米结构混合,以使得所述细胞调节剂掺入所述纳米结构的多孔性隔室中,或者使得所述细胞调节剂与所述纳米结构上的官能团偶联。
在某些实施方式中,可以在所述纳米结构形成过程中或形成后引入细胞调节剂。例如,当通过硅烷化过程形成所述纳米结构时,可以将细胞调节剂引入硅烷化系统,以便在硅烷化过程中将所述细胞调节剂掺入所述纳米结构。举另一个例子,对于具有表面反应性基团(如链霉亲和素)的纳米结构而言,可以在有利于结合的条件下将包含所述反应性基团的结合伴侣(如生物素)的细胞调节剂与所述纳米结构混合。
制备纳米结构的方法
本申请的另一个方面涉及形成纳米结构的方法,所述纳米结构包含具有涂层的至少一个核纳米粒子。例如,所述纳米结构通过如下方式形成:使用涂层材料涂覆或包裹一个或多个核纳米粒子,使得所述一个或多个粒子嵌入所述涂层材料中。举另一个例子,在存在核纳米粒子的条件下通过交联前体而形成涂层材料,以使得所述纳米粒子嵌入交联的涂层材料中。
在某些实施方式中,所述方法还包括将一个或多个官能团引入纳米结构中或纳米结构表面上。可以在形成涂层材料的过程中引入所述官能团。例如,在交联过程中,特别是在交联过程的结束阶段过程中,可以加入含有此类官能团的前体。还可以在形成纳米结构后引入官能团,例如通过利用化学修饰将官能团引入纳米结构的表面。在某些实施方式中,官能团在纳米结构或在涂层材料中是固有的。官能团用作纳米结构与细胞调节剂之间的连接。所述官能团的示例包括但不限于氨基、巯基、羧基、膦酸酯、生物素、链霉亲和素、亲和素、羟基、烷基或其他疏水性分子、聚乙二醇或其他亲水性分子,以及光裂解性、热裂解性或pH响应性接头。
在某些实施方式中,所述方法还包括纯化所获得的纳米结构产物。所述纯化可以包括使用透析、切向流过滤、渗滤或其组合。
制备具有低密度多孔性3D结构的纳米结构的方法
本公开的另一个方面涉及形成具有低密度多孔性3D结构的包含至少一个核纳米粒子的纳米结构的方法。例如,通过如下方式形成所述纳米结构:用低密度多孔性3D结构涂覆或包裹一个或多个核纳米粒子,以使得所述一个或多个粒子嵌入所述3D结构中。
所述低密度多孔性3D结构通过如下方式形成:通过组装或交联含硅烷的分子或硅烷样分子而使其沉积或覆盖核纳米粒子的表面。可以通过在核纳米粒子表面上的硅烷化过程来制备所述低密度多孔性3D结构。
硅烷化过程包括例如在酸性或碱性条件下交联含硅烷的分子或硅烷样分子(例如烷氧基硅烷,如氨基-丙基-三甲氧基硅烷、巯基-丙基-三甲氧基硅烷,或硅酸钠)的步骤。
在某些实施方式中,在交联中使用酸性或碱性催化剂。示例性的酸性催化剂包括但不限于质子酸催化剂(例如硝酸、乙酸和磺酸)和Lewis酸催化剂(例如三氟化硼、三氟化硼单乙胺复合物、三氟化硼甲醇复合物、FeCl3、AlCl3、ZnCl2和ZnBr2)。示例性的碱性催化剂包括胺或季胺化合物,如四甲基氢氧化铵和氢氧化铵。硅烷化过程可以包括一个或多个阶段,例如:引发阶段,在此阶段中所述3D结构开始形成;生长阶段,在此阶段中硅质结构层易于在核纳米粒子上形成并且形成更多;和/或结束阶段,在此阶段中所述3D结构即将完成(例如所述3D结构的外表面即将形成)。在硅烷化过程中,可以在该过程的不同阶段加入一种或多种含硅烷的分子。例如,在引发阶段,可以加入有机硅烷(如氨基丙基三甲氧基硅烷或巯基丙基三甲氧基硅烷)以便引发核纳米粒子表面上的硅烷化。举另一个例子,可以在硅烷化的生长阶段将具有更少烷氧基(例如仅2个烷氧基)的硅烷分子加入反应中。举另一个例子,在硅烷化的结束阶段,可以加入具有一种或多种不同官能团的有机硅烷分子。这些官能团可以是氨基、羧基、巯基或膦酸酯基团,其可以进一步与其他分子(例如亲水性试剂、生物活性剂、可检测标记、光响应基团、电子响应基团、磁响应基团、酶促响应基团或pH响应基团,或者结合伴侣)偶联,以在稳定性、溶解度、生物相容性、进一步偶联或衍生的能力或与有效载荷亲和性方面进一步修饰3D结构。或者,所述官能团还可以是易于与其他分子(例如与生物活性试剂、热响应分子、光响应分子、电子响应分子、磁响应分子、pH响应分子、酶促响应分子、可检测标记或结合伴侣(如生物素或亲和素))偶联的基团。
为控制低密度硅质结构的形成,所述制备进一步包括降低密度的操作,如在反应或形成过程中引入空气气泡、增加反应温度、微波、超声、涡旋、摇动旋转和/或调节反应的化学组成以调节硅烷分子的交联度。不被理论所束缚,据信这些操作能够有助于使得反应介质均匀、分散良好并且促进具有增加的空腔或孔隙度的低密度多孔性3D结构的形成。在某些实施方式中,降低密度的操作包括将反应或形成混合物超声。可以适当地选择硅烷化过程中超声的条件(例如持续时间),以便在所得低密度多孔性3D结构中产生所需的孔隙度。例如,可以在硅烷化过程的某一阶段中应用超声。在硅烷化阶段中超声的持续时间可以持续例如至少1小时、1.5小时、2小时、2.5小时、3小时、3.5小时、4小时。在某些实施方式中,在硅烷化过程中的各阶段均应用超声。
在某些实施方式中,降低密度的操作包括向反应中引入至少一种醇。在某些实施方式中,所述醇具有至少3个(例如至少4个、至少5个或至少6个)碳原子。例如,所述醇可以具有3、4、5、6、7、8、9、10、11、12个或更多个碳原子。在某些实施方式中,所述醇可以是一元醇或多元醇。一元醇的说明性的例子包括丙醇、丁醇、戊醇、己醇等。
多元醇的说明性的例子包括丙二醇、丙三醇、苏糖醇、木糖醇等。在某些实施方式中,所述醇可以具有饱和的碳链或不饱和的碳链。具有饱和碳链的醇可以以化学式CnH(2n+2)O表示。在某些实施方式中,n不低于3,或者不低于4,或者不低于5(例如n=3、4、5、6、7、8、9、10、11、12或更多)。具有不饱和碳链的醇在两个碳原子之间具有双键或三键。在某些实施方式中,所述醇可以是环醇,例如环己醇、肌醇或薄荷醇。
在某些实施方式中,所述醇具有直链碳链(例如正丙醇、正丁醇、正戊醇、正己醇等)或支链碳链(例如异丙醇、异丁醇、叔丁醇等)。在某些实施方式中,所述醇以约30%至约70%(例如30%至约70%、约30%至约60%、约30%至约55%、约40%至约70%、约45%至约70%、约40%至约60%)的体积分数存在。在某些实施方式中,所述醇以50%左右(例如45%左右、46%左右、47%左右、48%左右、49%左右、50%左右、51%左右、52%左右、53%左右、54%左右、55%左右、56%左右、57%左右、58%左右、59%左右或60%左右)的体积分数存在。在某些实施方式中,降低密度的操作包括向反应中引入空气气泡。在某些实施方式中,所述空气气泡可以在反应过程中持续存在。可以通过任何适宜的方法将空气气泡引入反应中,例如通过向反应中通入气泡,或者通过向反应混合物中引入气体产生剂。
还可以优化其他实验条件,以提供所需低密度多孔性3D结构的形成。这种实验条件包括例如核纳米粒子的浓度、催化剂的浓度、催化剂与核纳米粒子的浓度比、低密度硅质结构形成的温度或有机硅烷的分子结构。
直接与纳米结构的尺寸相关的低密度多孔性3D结构的厚度能够通过例如改变含硅烷的分子(例如三烷氧基硅烷或硅酸钠)的量、反应时间以及反应步骤之间的时间间隔和这类反应参数而被控制(例如从1nm至1000nm)。
所述3D结构的厚度可以是约1至5nm厚。在某些实施方式中,所述厚度可以是约1至10nm厚。在某些实施方式中,所述厚度可以是约1至20nm厚。在某些实施方式中,所述厚度可以是约1至30nm厚。在某些实施方式中,所述厚度可以是约1至40nm厚。在某些实施方式中,所述厚度可以是约1至50nm厚。在某些实施方式中,所述厚度可以是约1至60nm厚。在某些实施方式中,所述厚度可以是约1至100nm厚。在某些实施方式中,所述厚度可以是约1至500nm厚。在某些实施方式中,所述厚度可以是约1至1000nm厚。
所述低密度多孔性3D结构在核纳米粒子表面上形成后,所述核纳米粒子被嵌入所述3D结构中。所得到的纳米结构能够具有约1至1000nm、1至100nm或者1至10nm的厚度(例如纳米结构的最长尺寸,或者如果所述结构是球形则为直径)。在另一个实施方式中,所述纳米结构能够具有约1至30nm的直径。在另一个实施方式中,所述纳米结构能够具有约500nm的直径。在另一个实施方式中,所述纳米结构能够具有约100nm的直径。在另一个实施方式中,所述纳米结构能够具有约50nm的直径。在另一个实施方式中,所述纳米结构能够具有约30nm的直径。在另一个实施方式中,所述纳米结构能够具有约10nm的直径。
可以使用本申请所述的方法和/或本领域公知的常规方法将本申请制备的具有低密度3D结构的纳米结构与一种或多种细胞调节剂可操作地连接。任选地,还可以表征所述细胞调节剂,如所述细胞调节剂的量。
实施例1
纳米组合物的制备
使用硅烷化包封的超顺磁性氧化铁纳米粒子制备纳米组合物。将纳米组合物的终浓度调整为1mg/ml。通过交联剂硫代-SMCC将0.3mg/ml链霉亲和素分子与纳米组合物共价偶联,孵育过夜后,通过磁性分离将纳米组合物-链霉亲和素偶联物从剩余的溶液中纯化。
首先使用市售生物素化试剂盒(Thermo Scientific)按照推荐的方案将抗CD3(克隆OKT3)、抗CD28(克隆28.2)或其他共刺激抗体生物素化。以确定的抗体/纳米组合物的量将经纯化的生物素化抗体与链霉亲和素-纳米组合物混合并且反应过夜,然后磁性纯化以形成所需的与抗体偶联的纳米组合物。
实施例2
使用与抗CD3/抗CD28偶联的纳米组合物的T细胞扩增
据报道,被固定的抗CD3和抗CD28抗体能够同时传递信号和共刺激信号,以刺激T细胞增殖(Baroja等(1989),Cellular Immunology,120:205-217)。在WO09429436A1中使用固相表面(如培养皿和珠粒)固定抗CD3和抗CD28抗体。通常情况下,在具有尺寸为4.5um直径的M-450上进行在小珠上的固定。
US2008/0317724A1公开了信号分子的空间表达能够显著影响T细胞对于那些信号分子的应答。例如,当抗CD3和抗CD28抗体位于底物上分别的预定区域上时,在该底物上孵育的T细胞分泌不同量的白介素-2和/或显示出钙尖峰,这不仅取决于这些信号分子的类型,还取决于这些分子的间距。例如,使用抗CD3和抗CD28抗体产生一种图案,其中抗CD3抗体占据中心特征,所述中心特征被抗CD28抗体的卫星特征围绕,所述抗CD28抗体的卫星特征与抗CD3中心特征的间距约1至2微米。与抗CD3和抗CD28抗体以“共定位”特征一起呈现给T细胞相比,当抗CD28抗体特征间隔开约1至2微米时,T细胞的白介素-2(IL-2)分泌增强。
Erin R Steenblock和Tarek M Fahmy(Molecular Therapy vol.16no.4,765-772April2008)报道了使用固体表面纳米粒子(130nm),并显示与微粒(8um)相比这些纳米粒子对T细胞的刺激更弱。作者指出,此前报道(Mescher,MF(1992).J Immunol 149:2402-2405.)的发现支持了这些发现,表明尺寸上接近于T细胞的微米尺寸的粒子提供了最佳的T细胞刺激。Mesher的研究表明大且连续的表面接触面积对有效的CTL活化的关键重要性。发现使用固定于粒径为4至5微米的乳胶微球上的I类同种异体抗原提供了最佳刺激。小于4微米时,应答随粒径的减小迅速降低,并且大量小粒子无法补偿不理想的尺寸。US8,012,750B2公开了一种用于活化T细胞的可生物降解的装置。根据US8,012,750B2,纳米球未提供足够的交联以活化初始T细胞,因此仅能够用于此前已活化的T细胞。使用共固定有抗CD3和抗CD28抗体的尺寸为4至24微米(平均7微米)的球再次产生实验数据。
在本实施例中,使用与抗CD4抗体偶联的纳米结构通过磁性分离从新鲜或冷冻的人PBMC中纯化CD4+T细胞。类似地,使用与抗CD8抗体偶联的纳米结构通过磁性纯化从新鲜或冷冻的人PBMC中制备CD8+T细胞。以2-4×106个细胞/ml接种CD4+或CD8+T细胞。将此记为第0天。在第1天,将与抗CD3/抗CD28偶联的纳米组合物加入细胞中。在第3天,将IL-2和更多培养基加入细胞中。在第5天,进行细胞计数,更换培养基并加入IL-2。在第7天和第10天,加入IL-2。在第12天,计数细胞数量。
如表1-4所示,使用具有不同浓度的偶联抗CD3/抗CD28抗体的纳米组合物刺激CD4+或CD8+T细胞扩增。
表1:CD4+T细胞的扩增
#对照:未与抗体偶联的纳米结构
表2:CD8+T细胞的扩增
表3:CD4+T细胞的再刺激
表4:CD8+T细胞的再刺激
实施例3
纳米组合物与的比较
将浓度为1mg/ml的与链霉亲和素偶联的磁性低密度纳米结构与1ug/ml生物素化的抗CD3抗体和10ug/ml生物素化的抗CD28抗体混合,以制备与抗CD3/抗CD28偶联的纳米组合物。先将抗CD3抗体加入纳米结构中并孵育30min,随后加入抗CD28抗体并将溶液置于旋转器上在4℃下过夜。次日,使用磁性分离从剩余溶液中纯化纳米结构-抗CD3/CD28抗体偶联物,并且将其再分散于PBS缓冲液中备用。将未经纯化的新鲜人PBMC调整为106个细胞/ml。将50ul 1mg/ml的抗-CD3/抗-CD28偶联的纳米组合物加入细胞中。按照其实验方案以1:1的珠粒/T细胞比例使用(Life Technologies)。每ml 106个T细胞使用25ul经洗涤的珠粒。
如图2和表5所示,与抗CD3/抗CD28偶联的相比,抗CD3/抗CD28偶联的纳米组合物显示出更强的T细胞刺激(CD69的表达)。不同T细胞亚群可具有不同的活化要求。特别地,在不存在辅助细胞的条件下难以活化初始T细胞。我们的结果显示所有T细胞亚群均能够被纳米组合物很好地活化。如图2和表5所示,与存在抗CD3/抗CD28偶联的相比,在存在抗CD3/抗CD28偶联的纳米组合物的条件下,更多CD4+T细胞、CD4+初始T细胞、CD4+中央记忆T细胞、CD+效应记忆T细胞被活化。
表5:使用与抗CD3/抗CD28抗体偶联的纳米组合物刺激CD4+T细胞
#对照:未与抗体偶联的纳米结构
实施例4
使用纳米组合物分离和鉴定循环肿瘤细胞
通过在硅烷化过程中包封SPIO和量子点而制备同时具有磁性和荧光性质的纳米结构。1mg/ml多功能荧光磁性纳米结构通过交联剂硫代-SMCC而与0.3mg/ml链霉亲和素偶联。磁性分离后,将经纯化的纳米结构-链霉亲和素偶联物分散于PBS缓冲液中。使用市售生物素化试剂盒根据标准方案将抗EpCAM抗体或抗CD19抗体生物素化。将1mg/ml纳米结构-链霉亲和素分别与20ug/ml生物素-抗EpCAM或20ug/ml生物素-抗CD19偶联,在4℃下孵育过夜后,将纳米结构-抗EpCAM或纳米结构-抗CD19磁性分离和纯化。最终的与抗体偶联的纳米组合物以1mg/ml的浓度储存于PBS缓冲液中。对于细胞分离,将20至500ul与抗体偶联的纳米组合物与在体积为0.5至7.5ml的全血样品中的10至1000个经CFSE或CMTMR预染色的示踪癌细胞混合。孵育1小时后,使用磁体将纳米组合物捕获的细胞从其余的全血样品中分离。
如图1所示,被捕获的细胞具有高纯度和高收率(均>90%)。荧光颜色标识细胞类型,并表示细胞表面分子位置和功能。使用具有多功能荧光和磁性性质的纳米组合物与两种不同类型循环肿瘤细胞的相互作用并将其从全血样品中分离。特异性相互作用来自于纳米结构表面偶联的抗体和细胞表面分子。红色荧光纳米结构(615nm发射)在表面上具有抗EpCAM抗体,其与H1650细胞(CFSE染色为绿色)相互作用。绿色荧光纳米结构(535nm发射)在表面上具有抗CD19抗体,其与Oc1-Ly8(CMTMR染色为樱红色)相互作用。这些多功能纳米组合物不仅与细胞相互作用,还通过荧光信号鉴定细胞类型或细胞表面标记物。
尽管本发明参照特定的实施方式(其中一些是优选的实施方式)进行了特别的显示和描述,本领域技术人员应理解在不脱离如本申请所述的本发明的主旨和范围的前提下可以对其形式和细节做出多种改变。
- 还没有人留言评论。精彩留言会获得点赞!