有机发光二极管材料的制作方法
本申请要求2014年5月14日提交的美国临时申请No.61/996,836、2014年6月5日提交的美国临时申请No.61/997,579、2014年7月23日提交的美国临时申请No.62/028,045、2014年8月6日提交的美国临时申请No.62/033,869、2014年9月10日提交的美国临时申请No.62/048,497、2014年10月8日提交的美国临时申请No.62/061,369、2014年10月8日提交的美国临时申请No.62/061,460、2014年11月5日提交的美国临时申请No.62/075,490、2014年12月17日提交的美国临时申请No.62/093,097、2015年2月17日提交的美国临时申请No.62/117,045、2015年3月27日提交的美国临时申请No.62/139,336、2015年5月1日提交的美国临时申请No.62/155,764的利益。上述各申请的全部教导通过引用合并于此。
发明背景
有机发光二极管(OLED)是其中有机化合物膜布置在两个导体之间并响应于激发(如电流)而发光的发光二极管(LED)。OLED可用于显示器如电视屏幕、电脑显示器、移动电话和平板电脑中。OLED显示器固有的问题是有机材料的有限寿命。特别地,发蓝光的OLED与绿光或红光OLED相比以显著提高的速率退化。
OLED材料依赖于由主体传输材料(host transport material)中电子和空穴的复合产生的分子激发状态(激子)的辐射衰减。激发的特性导致将激发状态分成亮的单重态(具有0的总自旋)和暗的三重态(具有1的总自旋)的电子和空穴之间的相互作用。由于电子和空穴的复合提供四种自旋状态(一个单重态和三个三重态次能级)的统计混合,常规OLED具有25%的最大理论效率。
迄今为止,OLED材料设计聚焦于从通常暗的三重态收获剩余能量到发射态中。最近产生高效磷光体(其从通常暗的三重态发射光)的工作已经得到绿色和红色OLED。但是,其它颜色如蓝色需要较高能量的激发态,这增强了OLED的退化过程。
对三重态-单重态跃迁速率的基本限制因素是参数|Hfi/Δ|2的值,其中Hfi是由于超精细或自旋轨道相互作用导致的耦合能,且Δ是单重态和三重态之间的能级裂距(energetic splitting)。传统磷光OLED依赖于由自旋轨道(SO)相互作用导致的单重态和三重态状态的混合,从而提高Hfi并提供重金属原子和有机配体之间共有的最低发射状态。这导致从所有较高单重态和三重态状态的能量收获,接着磷光(来自激发的三重态的相对短寿发射)。缩短的三重态寿命通过电荷和其它激子减少三重态激子淬灭。其它人的最近工作表明对磷光材料性能的限度已经达到。
技术实现要素:
因此,存在着对可以达到更高激发状态而无快速退化的OLED的需要。现在已经发现,热活化延迟荧光(TADF)(其依赖于Δ的最小化,与Hfi的最大化相反)可以以相关时间尺度(如,例如,110μs)迁移单重态能级和三重态亚能级之间的群体。本文描述的化合物能够以比之前描述的化合物更高的能量激发状态发荧光或发磷光。
因此,在一个实施方式中,本发明是由结构式(XII)表示的分子:
在本发明的结构式(XII)中:
E1、E2、E3、E4、E5和E6各自独立地是CH或N。
R1和R2各自独立地是H、C1-C6烷基、C6-C18芳基或(5-20)原子的杂芳基。
R21、R22、R23和R24各自独立地是H或C1-C3烷基。
F1和F2各自独立地是CR'或N,其中R'是H、C1-C6烷基、C6-C18芳基或-(Ar5)q-G。
Ar4或Ar5各自独立地是任选被一个至四个C1-C3烷基取代的苯基。
p是0、1或2。
q是0或1。
G是H或由以下结构式之一表示的部分:
其中E7、E8、E9和E10各自独立地是CH或N,且R3、R4、R5和R6各自独立地是C1-C3烷基、C6-C18芳基、卤素或-CN。
在本发明的结构式(XII)中,当E1、E2和E3各自是N且F1和F2各自是CR'时,各个R'不是由以下结构式表示的部分:
在另一实施方式中,本发明是包含至少一个受体部分A、至少一个供体部分D和任选地桥部分B的分子。各个部分A键合于部分B或部分D,各个部分B键合于部分A、部分D或第二部分B,且各个部分D键合于部分A或部分B。部分A独立地对于每次出现选自列表A1、列表A2、列表A3或其任何组合。部分D独立地对于每次出现选自列表D1、列表D2、列表D3或其任何组合。部分B独立地对于每次出现选自列表B1、列表B2或两者。该分子由表1-14中的任一结构式表示,其中表1-14中呈现的结构式中通过(*)表示的碳或杂原子是未取代的或被C1-C6烷基、-OH、-CN、卤素、C6-C12芳基、5-20原子的杂芳基、-N(R19)2或-N(R20)2取代。R19各自独立地是H、C1-C6烷基或C5-C12环烷基,和其中R20各自独立地是H或C6-C18芳基。条件是该分子不是由表1-14中的结构式B4、J68、J79、K39、K55、K57、K100、K177或N6表示。
在另一实施方式中,本发明是由结构式(II)-(XI)表示的分子:
在结构式(II)-(XI)中,Ar1和Ar3独立地对于每次出现选自列表M1,理解为Ar1和Ar3是不同的。Ar2独立地对于每次出现选自列表M2。该分子由表1-14中的任一结构式表示,其中表1-14中呈现的结构式中通过(*)表示的碳或杂原子是未取代的或被C1-C6烷基、-OH、-CN、卤素、C6-C12芳基、5-20原子的杂芳基、-N(R19)2或-N(R20)2取代。R19各自独立地是H或C1-C6烷基或C5-C12环烷基,和其中R20各自独立地是H或C6-C18芳基。条件是该分子不是由表1-14中的结构式B4、J68、J79、K39、K55、K57、K100、K177或N6表示。
在另一实施方式中,本发明有机发光器件,其包含第一电极、第二电极及第一电极和第二电极之间的有机层。有机层包含选自结构式(II)-(XII)或表1-14中呈现的结构式的至少一种发光分子。
附图说明
前述内容从以下如附图中阐明的本发明示例实施方式的更具体描述来看将是明显的,在附图中相似的附图标记在所有不同视图中指相同的部件。图形不必是按比例的,相反重点在于阐明本发明的实施方式。
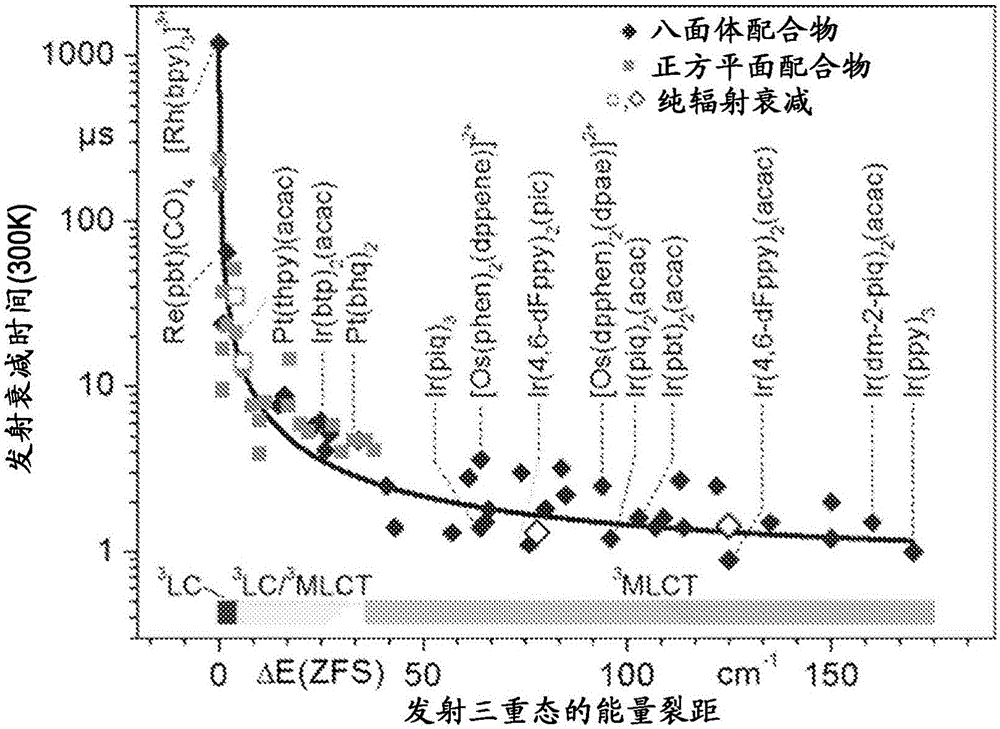
图1是阐明OLED亮度与激发后的衰减时间相比的关系的散点图。该图表阐明OLED的亮度随衰减时间增加而降低。
图2-30C是阐明本发明示例实施方式的合成的合成方案(方案1-31)。
图31A-44是表1-14,其阐明可用于本发明中的分子的示例实施方式的结构式。
图45A-45B是表15,其阐明本发明的示例实施方式的结构式。
图46A-46H是表16,其阐明某些化合物的结构式。
图47A-47CCC是表17,其阐明表1-14中示例化合物的发射数据。该数据包括计算的HOMO和LUMO值、垂直吸收、发射波长、单重态-三重态能隙和S1-S0振子强度。
图48A-48B是表18,其阐明某些化合物的结构式。
具体实施方式
本发明的示例实施方式的描述如下。
词汇表
如本文中使用的术语“烷基"是指具有指定的碳原子数的饱和脂族支链或直链单价烃基。因此,"C1-C6烷基"意思是直链或支链排列的具有1-6个碳原子的基团。"C1-C6烷基"的实例包括正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、正己基、2-甲基丁基、2-甲基戊基、2-乙基丁基、3-甲基戊基和4-甲基戊基。烷基可以任选地被卤素、-OH、C1-C6烷基、C1-C6烷氧基、-NO2、-CN和-N(R1)(R2)取代,其中R1和R2各自独立地选自-H和C1-C3烷基。
如本文中使用的术语"烯基"是指具有一个或多个碳-碳双键的直链或支链烷基。因此,"C2-C6烯基"意思是具有一个或多个双键的直链或支链排列的具有2-6个碳原子的基团。"C2-C6烯基"的实例包括乙烯基、丙烯基、丁烯基、戊烯基、己烯基、丁二烯基、戊二烯基和己二烯基。烯基可以任选地被以上对于烷基列举的取代基取代。
如本文中使用的术语"炔基"是指具有一个或多个碳-碳三键的直链或支链烷基。因此,"C2-C6炔基"意思是具有一个或多个三键的直链或支链排列的具有2-6个碳原子的基团。C2-C6"炔基"的实例包括乙炔基、丙炔基、丁炔基、戊炔基和己炔基。炔基可以任选地被以上对于烷基列举的取代基取代。
如本文中使用的术语"环烷基"是指含有3-12个碳环原子的饱和单环或稠合多环环系统。饱和单环环烷基环包括,例如,环丙基、环丁基、环戊基、环己基和环辛基。饱和双环和多环环烷基环包括,例如,降冰片烷、[2.2.2]双环辛烷、十氢化萘和金刚烷。环烷基可以任选地被以上对于烷基列举的取代基取代。
如本文中使用的术语"氨基"意思是"-NH2"、"NHRP"或"NRpRq"基团,其中Rp和Rq可以是烷基、烯基、炔基、烷氧基、环烷基、芳基和杂芳基。氨基可以是伯氨基(NH2)、仲氨基(NHRP)或叔氨基(NRpRq)。
如本文中使用的术语"烷基氨基"是指"NHRP"或"NRpRq"基团,其中Rp和Rq可以是烷基、烯基、炔基、烷氧基或环烷基。如本文中使用的术语"二烷基氨基"是指"NRpRq"基团,其中Rp和Rq可以是烷基、烯基、炔基、烷氧基或环烷基。
如本文中使用的术语"烷氧基"是指"烷基-O-"基团,其中烷基定义如上。烷氧基的实例包括甲氧基或乙氧基基团。烷氧基的"烷基"部分可以任选地被以上对于烷基列举的取代基取代。
如本文中使用的术语"芳基"是指由碳原子组成的芳族单环或多环环系统。因此,"C6-C18芳基"是含有6-18个碳原子的单环或多环环系统。芳基的实例包括苯基、茚基、萘基、薁基、庚搭烯基、联苯基、引达省基(indacenyl)、苊烯基、芴基、迫苯并萘基(phenalenyl)、菲基、蒽基、环戊环辛烯基或苯并环辛烯基。芳基可以任选地被卤素、-OH、C1-C6烷基、C2-C6烯基、C2-C6炔基、C1-C6卤代烷基、C1-C6烷氧基、C6-C18芳基、C6-C18卤代芳基、(5-20原子)的杂芳基、-C(O)C1-C3卤代烷基、-S(O)2-、-NO2、-CN和氧代。
如本文中使用的术语"卤素"或"卤代"是指氟、氯、溴或碘。
如本文中使用的术语"杂芳基"是指含有一个或多个杂原子(如氧、氮或硫)的单环或稠合多环芳香环。例如,杂芳基可以是"5-20原子的杂芳基",其意思是含有至少一个杂原子的5-20元单环或稠合多环芳香环。杂芳基的实例包括吡啶基、哒嗪基、咪唑基、嘧啶基、吡唑基、三唑基、吡嗪基、喹啉基(quinolyl)、异喹啉基(isoquinolyl)、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、噁唑基、异噻唑基、吡咯基、喹啉基(quinolinyl)、异喹啉基(isoquinolinyl)、吲哚基、苯并咪唑基、苯并呋喃基、噌啉基、吲唑基、中氮茚基、酞嗪基、哒嗪基、三嗪基、异吲哚基、嘌呤基、噁二唑基、噻唑基、噻二唑基、呋呫基、苯并呋呫基、苯并噻吩基(benzothiophenyl)、苯并三唑基、苯并噻唑基、苯并噁唑基、喹唑啉基、喹喔啉基、萘啶基、二氢喹啉基、四氢喹啉基、二氢异喹啉基、四氢异喹啉基、苯并呋喃基、呋喃并吡啶基、吡咯并嘧啶基(pyrolopyrimidinyl)和氮杂吲哚基。杂芳基可以任选地被以上对于芳基列举的相同取代基取代。
在其它实施方式中,"5-20元杂芳基"是指其中芳香环与杂环稠合的稠合多环环系统。这些杂芳基的实例包括:
如本文中使用的术语"卤代烷基"包括被一个或多个F、Cl、Br或I取代的烷基,其中烷基定义如上。卤代烷基的"烷基"部分可以任选地被以上对于烷基所述的取代基取代。
如本文中使用的术语"卤代芳基"包括被一个或多个F、Cl、Br或I取代的芳基,其中芳基定义如上。卤代芳基的"芳基"部分可以任选地被以上对于芳基所述的取代基取代。
如本文中使用的术语"氧代"是指=O。
如本文中使用的术语"硝基"是指-NO2。
如本文中使用的术语"对称分子"是指基团对称或合成对称的分子。如本文中使用的术语"基团对称的"是指根据分子对称性的基团理论具有对称性的分子。如本文中使用的术语"合成对称的"是指经选择以使得不需要区域选择性合成策略的分子。
如本文中使用的术语"供体"是指可以用于有机发光二极管中并很可能在激发时从其最高占据轨道向受体提供电子的分子片段。在示例的实施方式中,供体具有大于或等于-6.5eV的电离势。
如本文中使用的术语"受体"是指可以用于有机发光二极管中并很可能从已进行激发的供体接受电子至其最低未占据轨道中的分子片段。在示例的实施方式中,受体具有小于或等于-0.5eV的电子亲合性。
如本文中使用的术语"桥"是指可以包括在共价连接在受体和供体部分之间的分子中的π-共轭分子片段。桥可以例如进一步与受体部分、供体部分或两者缀合。非局限于任何特定的理论,据信桥部分可以将受体和供体部分空间限制于特定的构型中,从而防止供体和受体部分的共轭π系统之间的重叠。合适的桥部分的实例包括苯基、乙烯基和乙炔基。
如本文中使用的术语"多价"是指连接于至少两个其它分子片段的分子片段。例如,桥部分是多价的。
如本文中使用的是指两个原子之间的连接点。
OLED的原理
OLED通常由两个电极(阳极和阴极)之间的有机材料或化合物层构成。有机分子由于通过部分或全部分子上的共轭引起的π电子的离域而成为电传导性的。当施加电压时,来自阳极处存在的最高占据分子轨道(HOMO)的电子流入阴极处存在的有机分子的最低未占据分子轨道(LUMO)中。从HOMO移除电子也称为将电子空穴插入HOMO中。静电力将电子和空穴彼此靠拢直到它们复合并形成激子(其是电子和空穴的结合状态)。随着激发状态衰减和电子的能级驰豫,发射具有可见光谱中的频率的辐射。这一辐射的频率取决于材料的带隙,这是HOMO和LUMO之间的能量差异。
由于电子和空穴是具有半整数自旋的费米子,激子根据电子和空穴的自旋如何组合而可以处于单重态或三重态。统计上,对于各单重态形成三个三重态激子。从三重态的衰减是自旋禁阻的,这导致跃迁时程的增加并限制荧光装置的内部效率。磷光有机发光二极管利用自旋-轨道相互作用以促进单重态和三重态之间的系间窜跃,因此获得从单重态和三重态两者的发射并提高内部效率。
原型磷光材料是三(2-苯基吡啶)铱(Ir(ppy)3),其中激发态是从Ir原子到有机配体的电荷转移。这类方法减少三重态寿命至约1μs,比完全容许跃迁(如荧光)的辐射寿命慢几个数量级。Ir-基磷光体已证明对于许多显示器应用是可接受的,但由于大的三重态密度导致的损失仍然阻止OLED以更高的亮度应用于固态照明。
此外,最近的研究表明传统的铱基OLED可能已经达到物理性能极限。如图1中所示,OLED的亮度随着衰减时间的增加而降低。由于最高能量三重态是图1的Ir-基材料中发光跃迁的来源,通过额外的自旋-轨道耦合增加零场分裂将最终延长另外两个三重态的有效寿命。据信这一效应造成在约1μs处经验观察到的渐近线(asymptote)。
最近开发的热活化延迟荧光(TADF)试图最小化单重态和三重态之间的能级裂距(Δ)。交换分裂从0.4-0.7eV的典型值降低到热能级带隙(与kBT成比例,其中kB代表Boltzmann常数,和T表示温度)意味着热扰动(thermal agitation)可以在相关时间尺度内转移单重态能级和三重态亚能级之间的群体,即使状态之间的耦合是小的。
实例TADF分子由通过共价键直接连接或经由共轭的接头(或“桥”)连接的供体和受体部分组成。“供体”部分很可能在激发时从其HOMO转移电子至“受体”部分。“受体”部分很可能从“供体”部分接受电子到其LUMO中。TADF分子的供体-受体性质导致具有电荷转移特征的低位激发态(low-lying excited state),其表现出非常低的Δ。由于热分子运动可以随机地改变供体-受体系统的光学性质,供体和受体部分的刚性三维排列可以用于在激发寿命期间限制由内转换导致的电荷转移态的非辐射衰减。
因此,有利的是降低单重态和三重态之间的能级裂距(Δ),及产生能够利用三重态激子的具有提高的反向系间窜越(RISC)的系统。据信,这种系统将导致降低的发射寿命。具有这些特征的系统能够发射蓝光而不发生当前已知的蓝光OLED中普遍的快速退化。
本发明的化合物
本发明的分子在通过热或电子方式激发时可以产生可见光谱的蓝光或绿光区域的光。该分子包含包括至少一个供体部分、至少一个受体部分和任选地桥部分的分子片段。
本发明的示例分子的电子性质可以使用已知的从头量子力学计算来计算。通过针对特定量子性质扫描小化学化合物的文库,可以构建表现出上述所需自旋-轨道/热激活延迟荧光(SO/TADF)性质的分子。
例如,可能有利的是使用具有高于2.75eV的计算三重态的分子片段构建本发明的分子。因此,利用时间依赖性密度泛函理论使用已知为6-31G*的函数集作为基础集和使用Becke,3-参数,Lee-Yang-Parr杂化函数来解Hartree-Fock方程(TD-DFT/B3LYP/6-31G*),可以筛选具有高于特定阈值的HOMO和低于特定阈值的LUMO的分子片段(部分),且其中该部分的计算三重态高于2.75eV。
因此,例如,供体部分("D")可以因为其具有大于或等于-6.5eV的HOMO能量(例如,电离势)而选择。受体部分("A")可以因为其具有例如,低于或等于-0.5eV的LUMO能量(例如,电子亲和性)而选择。桥部分("B")可以是刚性的共轭体系,其可以,例如,空间限制受体和供体部分在特定构型中,从而防止供体和受体部分的共轭π体系之间的重叠。
因此,在第一方面,本发明是包含至少一个受体部分A、至少一个供体部分D和任选地桥部分B的分子。部分D独立地对于各次出现为具有5至20个原子的单环的或稠合多环的芳基或杂芳基,其任选被一个或多个取代基取代。部分A独立地对于各次出现为-CF3、-CN或者具有5至20个原子的单环的或稠合多环的芳基或杂芳基,其任选被一个或多个取代基取代。部分B独立地对于各次出现为任选被一至四个取代基取代的苯基。各个部分A共价连接于部分B或部分D,各个部分D共价连接于部分B或部分A,且各个部分B共价连接于至少一个部分A和至少一个部分D。在第一方面的示例实施方式中,各个部分A与部分B或部分D键合,各个部分B与部分A、部分D或第二部分B键合,且各个部分D与部分A或部分B键合。在第一方面的另一示例实施方式中,部分A不同于部分D。
前述连接规则意味着部分A不能连接于另一部分A,部分D不能连接于另一部分D,和各个部分B是多价的,且因此必须连接于至少两个其它部分(部分A、部分D或第二部分B)。应理解,在分子内,没有A代表的分子片段与D代表的任何分子片段相同。
在第二方面,本发明是包含至少一个受体部分A、至少一个供体部分D和任选地一个或多个桥部分B的分子,其中A、D和B如以上对于本发明的第一方面所定义。除了以上第一方面中所述的部分外,部分D可以是-N(C6-C18芳基)2。除了以上关于第一方面所述的部分外,部分A可以是-S(O)2-。除了以上关于第一方面所述的部分外,部分B可以是C2-C6烯基、C2-C6炔基或C5-C12环烷基,其任选被一至四个取代基取代。
在第三方面,本发明是通过结构式(I)限定的分子
(A)m-(B)l-(D)p (I)
其中A、B和D如以上关于第一和第二方面所定义,且
部分D独立地对于各次出现任选被一个或多个取代基取代,各取代基独立地选自C1-C6烷基、C2-C6烯基、C2-C6炔基、C6-C18芳基、(5-20原子)的杂芳基、C1-C6烷氧基、氨基、C1-C3烷基氨基、C1-C3二烷基氨基或氧代;
部分A独立地对于各次出现任选被一个或多个取代基取代,各取代基独立地选自C1-C6烷基、C2-C6烯基、C2-C6炔基、C6-C18芳基、(5-20原子)的杂芳基、C1-C6烷氧基、-C(O)C1-C3卤代烷基、-S(O2)H、-NO2、-CN、氧代、卤素或C6-C18卤代芳基;
部分B独立地对于各次出现任选被一至四个取代基取代,各取代基独立地选自C1-C6烷基、C2-C6烯基、C2-C6炔基、C6-C18芳基或(5-20原子)的杂芳基;
m是大于1的整数;
p是大于1的整数;和
l是0或大于1的整数。在示例实施方式中,l大于1。在另一示例实施方式中,l是0、1或2。
在第四方面,本发明是通过结构式(I)限定的分子
(A)m-(B)l-(D)p (I)
其中A、B和D如以上关于本发明的第一和第二方面所定义,且
部分D独立地对于各次出现任选被,除了以上关于本发明的第三方面所述的取代基外,-N(C6-C18芳基)2取代;
部分A独立地对于各次出现任选被以上关于本发明的第三方面所述的取代基取代;
部分B独立地对于各次出现任选被以上关于本发明的第三方面所述的取代基取代;
m是大于1的整数;
p是大于1的整数;和
l是0或大于1的整数。在示例实施方式中,l大于1。在另一示例实施方式中,l是0、1或2。
在第五方面,本发明是通过结构式(I)限定的分子
(A)m-(B)l-(D)p (I)
其中A、B和D如以上关于本发明的第一和第二方面所定义,且
部分D独立地对于各次出现任选如以上关于第三和第四方面所述被取代,且进一步其中烷基、烯基、炔基、芳基和杂芳基各自任选进一步被选自C1-C6烷基、5-20原子的杂芳基或-N(C6-C18芳基)2的一个或多个取代基取代;
部分A独立地对于各次出现任选如以上关于本发明的第三方面所述被取代;
部分B独立地对于各次出现任选如以上关于本发明的第三方面所述被取代;
m是大于1的整数;
p是大于1的整数;和
l是0或大于1的整数。在示例实施方式中,l大于1。在另一示例实施方式中,l是0、1或2。
在第六方面,本发明是如以上关于本发明的第一或第二方面所定义的分子,且其中部分D独立地对于各次出现可以选自列表D1。
列表D1
且其中部分D可以如以上关于本发明的第三、第四和第五方面所述任选被取代。
在第七方面,本发明是如以上关于本发明的第一或第二方面所定义的分子,且其中部分D独立地对于各次出现可以选自列表D1、列表D2或两者。
列表D2
且其中部分D可以如以上关于本发明的第三、第四和第五方面所述任选被取代。
在第八方面,本发明是如以上关于本发明的第一或第二方面所定义的分子,且其中部分D独立地对于各次出现可以选自列表D1、列表D2、列表D3或其任意组合。
列表D3
且其中部分D可以如以上关于本发明的第三、第四和第五方面所述任选被取代。
在第九方面,本发明是如以上关于本发明的第一或第二方面所定义的分子,且其中部分A独立地对于各次出现可以选自列表A1。
列表A1
且其中部分A可以如以上关于本发明的第三、第四和第五方面所述任选被取代。
在第十方面,本发明是如以上关于本发明的第一、第二、第三方面所定义的分子,且其中部分A独立地对于各次出现可以选自列表A1、列表A2或两者。
列表A2
O=S=O,
和≡N,且其中部分A可以如以上关于本发明的第三、第四和第五方面所述任选被取代。
在第十一方面,本发明是如以上关于本发明的第一或第二方面所定义的分子,且其中部分A独立地对于各次出现可以选自列表A1、列表A2、列表A3或其任意组合。
列表A3
且其中部分A可以如以上关于本发明的第三、第四和第五方面所述任选被取代。
在第十二方面,本发明是如以上关于本发明的第一或第二方面所定义的分子,且其中部分B独立地对于各次出现可以选自列表B1:
列表B1
且其中部分B可以如以上关于本发明的第三、第四和第五方面所述任选被取代。
在第十三方面,本发明是如以上关于本发明的第一或第二方面所定义的分子,且其中部分B独立地对于各次出现可以选自列表B1、列表B2或两者。
列表B2
且其中部分B可以如以上关于本发明的第三、第四和第五方面所述任选被取代。
在本发明第六方面的示例实施方式中,部分D独立地对于各次出现选自列表D4。
列表D4
其中,在各分子中:
Q是部分A或部分B0-2-A且各M是部分A或部分B0-2-A,
所有基团Q相同且所有基团M相同,和
各基团Q与任何基团M相同或不同,且部分A和B如以上关于本发明的第一、第二和第三方面所定义。
在本发明第七方面的示例实施方式中,部分D独立地对于各次出现选自列表D4、列表D5或两者。
列表D5
其中,在各分子中:
Q独立地选自部分A、部分B0-2-A、H、C1-C3烷基、C6-C18芳基、氧代、(5-20原子)的杂芳基和-N(C6-C18芳基)2,且其中部分A和B如以上关于本发明的第一、第二和第三方面所定义。
在本发明第七和第八方面的示例实施方式中,部分D独立地对于各次出现也可以选自列表D6。
列表D6
其中,在各分子中:
Q独立地选自部分A、部分B0-2-A、H、C1-C3烷基、C6-C18芳基、氧代、(5-20原子)的杂芳基和-N(C6-C18芳基)2,
M独立地选自部分A、部分B0-2-A、H、C1-C3烷基、C6-C18芳基、氧代、(5-20原子)的杂芳基和-N(C6-C18芳基)2,
Q和M中至少一个是部分B0-2-A,
所有基团Q相同且所有基团M相同,和
各基团Q与任何基团M相同或不同,且其中部分A和B如以上关于本发明的第一、第二和第三方面所定义。
在本发明第九方面的示例实施方式中,部分A独立地对于各次出现选自列表A4。
列表A4
其中,在各分子中:
W是部分D或部分B0-2-D且各个X是部分D或部分B0-2-D,
所有基团W相同且所有基团X相同,和
各基团W与任何基团X相同或不同,且其中部分D和B如以上关于本发明的第一、第二和第三方面所定义。
在本发明第十方面的示例实施方式中,部分A独立地对于各次出现可以选自列表A4、列表A5或两者。
列表A5
其中,在各分子中:
X选自部分D、部分B0-2-D、H、C1-C3烷基、C6-C18芳基、氧代、d-C3卤代烷基、-CN、-CF3、-C(O)C1-C3卤代烷基、-F和-S(O2)H,且其中部分D和B如以上关于本发明的第一、第二和第三方面所定义。
在本发明第十和第十一方面的示例实施方式中,部分A独立地对于各次出现可以选自列表A4、列表A5、列表A6或其任意组合。
列表A6
其中,在各分子中:
X选自部分B0-2-D、H、C1-C3烷基、C6-C18芳基、氧代、C1-C3卤代烷基、-CN、-CF3、-C(O)C1-C3卤代烷基、-F和-S(O2)H,
W选自部分B0-2-D、H、C1-C3烷基、C1-C3酰基烷基、C6-C18芳基、氧代、C1-C3卤代烷基、-CN、-CF3、-C(O)C1-C3卤代烷基、-F和-S(O2)H,
W和X中至少一个是部分B0-2-D,
所有基团W相同且所有基团X相同,和
各基团W与任何基团X相同或不同,且其中部分D和B如以上关于本发明的第一、第二和第三方面所定义。
在本发明第十二方面的示例实施方式中,部分B独立地对于各次出现选自列表B3。
列表B3
其中,在各分子中:
Y是部分A、部分B0-1-A、部分D或部分B0-1-D且各个Z是部分A、部分B0-1-A、部分D或部分B0-1-D,
在给定分子中,所有基团Y相同且所有基团Z相同,和
各基团Y与任何基团Z相同或不同,且其中部分A和D如以上关于本发明的第一、第二和第三方面所定义。
在本发明第十三方面的示例实施方式中,部分B也可以选自列表B3、列表B4或两者。
列表B4
其中,在各分子中:
Z独立地选自部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3烷基和C6-C18芳基,且其中部分A和D如以上关于本发明的第一、第二和第三方面所定义。
在本发明第十二和第十三方面的示例实施方式中,部分B也可以选自列表B3、列表B4、列表B5或其任意组合。
列表B5
其中,在各分子中:
Z是部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3烷基或C6-C18芳基,
Y是部分A、部分B0-1-A、部分D或部分B0-1-D且各个Z是部分A、部分B0-1-A、部分D或部分B0-1-D,
在给定分子中,所有基团Y相同且所有基团Z相同,和
各基团Y与任何基团Z相同或不同,且其中部分A和D如以上关于本发明的第一、第二和第三方面所定义。
在本发明第十二方面的示例实施方式中,部分B独立地对于各次出现选自列表B3、列表B4、列表B5、列表B6或其任意组合。
列表B6
其中,在各分子中:
Y是部分A、部分B0-1-A、部分D或部分B0-1-D且各个Z是部分A、部分B0-1-A、部分D或部分B0-1-D,
在给定分子中,所有基团Y相同且所有基团Z相同,和
各基团Y与任何基团Z相同或不同,且其中部分A和D如以上关于本发明的第一、第二和第三方面所定义。
在本发明第十三方面的示例实施方式中,部分B独立地对于各次出现选自列表B3、列表B4、列表B5、列表B6、列表B7或其任意组合。
列表B7
其中,在各分子中:
Z是部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3烷基或C6-C18芳基,且其中部分A和D如以上关于本发明的第一、第二和第三方面所定义。
在本发明第十二和第十三方面的示例实施方式中,部分B独立地对于各次出现选自列表B3、列表B4、列表B5、列表B6、列表B7、列表B8或其任意组合,
列表B8
其中,在各分子中:
Z是部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3烷基或C6-C18芳基,
Y是部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3烷基或C6-C18芳基,
在给定分子中,所有基团Y相同且所有基团Z相同,和
各基团Y与任何基团Z相同或不同,且其中部分A和D如以上关于本发明的第一、第二和第三方面所定义。
在如上所述的本发明第一至第十三方面中任一方面的示例实施方式中,部分D任选被一个或多个取代基取代,各取代基独立地选自C1-C3烷基、C6-C18芳基或氧代,且其中A、B和D如以上关于本发明的第一或第二方面所定义。
在如上所述的本发明第一至第十三方面中任一方面的示例实施方式中,部分D任选被一个或多个取代基取代,各取代基独立地选自(5-20原子)的杂芳基或-N(C6-C18芳基)2,且其中A、B和D如以上关于本发明的第一或第二方面所定义。
在如上所述的本发明第一至第十三方面中任一方面的示例实施方式中,部分D任选被一个或多个取代基取代,各取代基独立地选自C1-C3烷基、C6-C18芳基、氧代、(5-20原子)的杂芳基或-N(C6-C18芳基)2,且其中A、B和D如以上关于本发明的第一或第二方面所定义。
在如上所述的本发明第一至第十三方面中任一方面的示例实施方式中,部分A任选被一个或多个取代基取代,各取代基独立地选自C1-C3烷基、C6-C18芳基、氧代、C1-C3卤代烷基、-CN、-CF3、-C(O)C1-C3卤代烷基、-F和-S(O2)H,且其中A、B和D如以上关于本发明的第一或第二方面所定义。
在如上所述的本发明第一至第十三方面中任一方面的示例实施方式中,部分B任选被C1-C3烷基取代,且其中A、B和D如以上关于本发明的第一或第二方面所定义。
在如上所述的本发明第一至第十三方面中任一方面的示例实施方式中,部分B任选被C6-C18芳基取代,且其中A、B和D如以上关于本发明的第一或第二方面所定义。
在如上所述的本发明第一至第十三方面中任一方面的示例实施方式中,部分B任选被一个或多个取代基取代,各取代基独立地选自C1-C3烷基或C6-C18芳基,且其中A、B和D如以上关于本发明的第一或第二方面所定义。
在第十四方面,本发明是表1-14中显示的结构式之一的分子。表1-14的结构式中通过(*)指示的碳或杂原子是未取代的或被C1-C6烷基、-OH、-CN、卤素、C6-C12芳基、5-20原子的杂芳基、-N(R19)2或-N(R20)2取代,其中R19各自独立地为H或C1-C6烷基或C5-C12环烷基,且其中R20各自独立地为H或C6-C18芳基。
在本发明的第十五方面,分子不是通过表1-14中的结构式B4、J68、J79、K39、K55、K57、K100、K177或N6表示的分子。
在第十五方面的示例实施方式中,本发明是选自表15的分子。
在第十六方面,本发明是由结构式(II)-(XI)表示的分子:
在结构式(II)-(XI)中,Ar1和Ar3独立地对于各次出现选自列表M1。
列表M1
在结构式(II)-(XI)中,Ar2独立地对于各次出现选自列表M2。
列表M2
在本发明的第十七方面,分子具有表1-14中显示的结构式之一,其中表1-14中显示的结构式中通过(*)指示的碳或杂原子是未取代的或被C1-C6烷基、-OH、-CN、卤素、C6-C12芳基、5-20原子的杂芳基、-N(R19)2或-N(R20)2取代,其中R19各自独立地为H或C1-C6烷基且其中R20各自独立地为H或C6-C18芳基。
在本发明的第十七方面,分子不具有通过表1-14中的结构式B4、J68、J79、K39、K55、K57、K100、K177或N6表示的结构式之一。
在本发明第十七方面的示例实施方式中,Ar1和Ar3不同。
在第十八方面,本发明是通过结构式(XII)表示的分子:
在本发明的结构式(XII)中:
E1、E2、E3、E4、E5和E6各自独立地为CH或N。
R1和R2各自独立地为H、C1-C6烷基、C6-C18芳基或(5-20)原子的杂芳基。例如,R1和R2各自独立地为H或C6-C12芳基。
R21、R22、R23和R24各自独立地为H或C1-C3烷基。例如,R21、R22、R23和R24各自为H。
F1和F2各自独立地为CR'或N,其中R'是H、C1-C6烷基、C6-C18芳基或-(Ar5)q-G。例如,F1和F2各自为CR'。在另一示例实施方式中,F1是C-H和F2是C-G。
Ar4或Ar5各自独立地为任选被一至四个C1-C3烷基取代的苯基。例如,Ar4或Ar5各自独立地为由以下结构式表示的部分:
在另一实例中,Ar4是由以下结构式表示的部分:
p是0、1或2。例如,p是1。
q是0或1。例如,q是0。
G是H或由以下结构式之一表示的部分:
其中E7、E8、E9和E10各自独立地为CH或N,且R3、R4、R5和R6各自独立地为C1-C3烷基、C6-C18芳基、卤素或-CN。例如,G是H或由以下结构式表示的部分:
在本发明的结构式(XII)中,当El、E2和E3各自是N且F1和F2各自是CR'时,各个R'不是由结构式表示的部分:
在本发明第十八方面的示例实施方式中,R1和R2各自独立地为H或C6-C12芳基且p是1,且其中其余变量的值和示例值如以上关于结构式(XII)所述。
在本发明第十八方面的另一示例实施方式中,Ar4或Ar5各自独立地为由结构式表示的部分:
且其中其余变量的值和示例值如以上关于结构式(XII)所述。
在本发明第十八方面的另一示例实施方式中,F1和F2各自是CR',且其中其余变量的值和示例值如以上关于结构式(XII)所述。
在本发明第十八方面的另一示例实施方式中,q是0,且其中其余变量的值和示例值如以上关于结构式(XII)所述。
在本发明第十八方面的另一示例实施方式中,G是H或是由以下结构式表示的部分:
在本发明第十八方面的另一示例实施方式中,分子通过以下结构式表示:
其中R1和R2各自独立地为H或C6-C12芳基,且R10和R11各自独立地为H或由以下结构式表示的部分:
且其中其余变量的值和示例值如以上关于结构式(XII)所定义。
在本发明第十八方面的另一示例实施方式中,分子通过以下结构式表示:
在本发明第十八方面的另一示例实施方式中,分子通过以下结构式表示:
在第十九方面,本发明是包含第一电极、第二电极及布置在第一电极和第二电极之间的有机层的有机发光器件。在示例实施方式中,有机层包含如上所述的本发明第一至第十八方面中任一方面的分子。在另一示例实施方式中,有机层包含由选自表1-14的结构式表示的至少一种发光分子。在又一示例实施方式中,有机层包含由表15中的任一结构式表示的至少一种发光分子。
在第二十方面,本发明不是由表16中显示的结构式表示。
在第二十一方面,本发明不是由表18中显示的结构式表示。
在第二十二方面,本发明不是由表16或表18中显示的结构式表示。
在如上所述的本发明第一至第二十二方面中任一方面的示例实施方式中,部分A和部分D不同。
在如上所述的本发明第一至第二十二方面中任一方面的示例实施方式中,部分D具有高于-6.5eV的最高占据分子轨道(HOMO)能量且部分A具有低于-0.5eV的最低未占据分子轨道(LUMO)能量。
在如上所述的本发明第一至第二十二方面中任一方面的示例实施方式中,分子是基团对称的或合成对称的。
在如上所述的本发明第一至第二十二方面中任一方面的示例实施方式中,分子由以下结构式之一表示:
组合装配和筛选
具有所需性质(如可见光发射的颜色)的本发明示例分子可以使用以下所述的组合过程从上述受体、供体和桥部分构建。尽管以下仅说明了一些示例化合物,但应理解,不同部分的不同组合可以用于产生化合物的组合文库。以下的示例部分仅意图阐明本发明的概念,而不意图是限制的。
在第一步骤中,针对其用作受体或供体部分的能力筛选化学部分的文库。检验的示例性质包括所需的量子力学计算如最高占据分子轨道的电离势(即,"供体"部分)和最低未占据分子轨道的电子亲和性(即,"受体"部分)。在示例实施方式中,如果计算为电离势大于或等于-6.5eV,则可以选择供体部分。在另一示例实施方式中,如果计算为电子亲和性小于或等于-0.5eV,则可以选择受体部分。在筛选后选择的示例供体部分可以是:
且筛选后选择的示例受体部分可以是:
其中(*)表示供体和受体部分彼此或与桥部分的连接点。
在第二任选步骤中,如果选择的供体和/或受体是“多位点”的,多位点供体部分与单位点桥部分结合,和/或多位点受体部分与单位点桥部分结合。如果供体和/或受体部分是"单位点"部分,则多位点桥部分可以与所选择的部分结合。为了组合装配的目的,“位点”的数目是指多少个潜在不同的部分可以连接。例如,以下部分具有一个"位点":
因为标记Q的位置处连接的所有部分必须是相同的。类似地,以下部分具有两个"位点",因为Q和M可以相同或不同:
因此,分子中的氮原子是"多位点"的。
在来自第一步骤的示例部分中,两个部分都是单位点的。示例的"多位点"桥可以是:
其中在Y和Z处连接的部分是不同的。如果供体部分与桥结合和受体与桥结合,则产生以下部分:
在第三步骤中,第二步骤可以重复以连续地向分子添加桥部分。唯一限制是将生成的最终分子的大小。桥分子可以如上所示在位置Y或Z处添加,且可以是相同的桥部分或不同的桥部分。在一个示例实施方式中,桥部分的数目可以限制为0至3的数字。在另一实例中,供体部分和受体部分的数目或者分子的总分子量可能受到限制。在示例实施方式中,分子是对称的。对称性可以用于在组合过程中将分子限制为稳定的那些分子。因此,例如,从步骤2添加到该部分的另外的桥部分可以是:
在第四步骤中,桥部分上的未连接点仅与(1)不具有连接的桥部分的供体部分或受体部分或(2)与受体部分或供体部分连接的其它桥部分结合,使得不违反步骤3中的大小限制,且各分子包含至少一个供体部分和一个受体部分。
使用如上所述的示例部分和规则,可以产生以下示例分子:
在第五步骤中,组合的潜在供体、受体和桥可以基于量子力学计算(如所需的HOMO和LUMO值)以及垂直吸收(将分子从基态激发到激发态所需要的能量)、衰减率(S1-S0振子强度,例如,激发后分子的发射多快和/或多亮)、纳米级可见光发射的估计颜色和单重态-三重态能隙(最低单重态激发态S1,最低三重态激发态T1之间的能量差异)筛选。对于本发明中实现的分子的这些计算的实例在表17中提供。
示例
化合物J78
化合物J78可以由普通技术人员按照图2中显示的方案1合成。原料S1-1可从Alfa Aesar购得(CAS No.57102-42-8)。原料S1-2可从Acros Organics购得(CAS No.95-51-2)。在第一步骤中,化合物S1-1在120℃下甲苯中与化合物S1-2、叔丁醇钾、Pd(OAc)2和PtBu3组合24小时以形成化合物S1-3。在第二步骤中,化合物S1-3在180℃下DMA中与碳酸钾、Pd(OAc)2和PtBu3HBF4组合24小时以形成化合物S1-4。在第三步骤中,化合物S1-4在80℃下甲苯中与化合物S1-5(可从Acros Organics购得,CAS No.589-87-7)、K3PO4和碘化铜组合10分钟以形成化合物S1-6。在第四步骤中,化合物S1-6在己烷:环戊基甲基醚溶液中冷却到0℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S1-7。化合物S1-7与化合物S1-8(可从Tokyo Chemical Industry Co.购得,CAS No.3740-92-9)组合以形成化合物J78。应理解步骤1、2、3、4和5可以由本领域技术人员进行和优化而无需过度试验。
化合物K109
化合物K109可以由普通技术人员按照图3中显示的方案2合成。在第一步骤中,化合物S2-1(可从Acros Organics购得,CAS No.86-74-8)在80℃下甲苯中与化合物S2-2(可从Alfa Aesar购得,CAS No.116632-39-4)、K2CO3和CuI组合以形成化合物S2-3。在第二步骤中,化合物S2-3添加到己烷并冷却到0℃,之后逐滴添加nBuLi,接着添加B(OMe)3。反应可以允许搅拌,之后用HCl水溶液淬灭以形成化合物S2-4。在第三步骤中,化合物S2-4在45℃下THF中与化合物S2-5(可从Alfa Aesar购得,CAS No.3842-55-5)、Pd(OAc)2和K3PO4组合24小时以形成化合物K109。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物F57
化合物F57可以由普通技术人员按照图4中显示的方案3合成。在第一步骤中,化合物S3-1(可从Combi-Blocks,Inc.购得,CAS No.206559-43-5)在80℃下甲苯中与化合物S3-2(可从Acros Organics购得,CAS No.494-19-9)、K2CO3和CuI组合以形成化合物S3-3。在第二步骤中,化合物S3-3在己烷:环戊基甲基醚溶液中冷却到0℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S3-4。在第三步骤中,化合物S3-4在45℃下THF中与化合物S3-5(可从Matrix Scientific购得,CAS No.1700-02-3)、Pd(OAc)2和K3PO4组合24小时以形成化合物F57。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物G32
化合物G32可以由普通技术人员按照图5中显示的方案4合成。在第一步骤中,化合物S4-1(可从Alfa Aesar购得,CAS No.105946-82-5)在80℃下甲苯中与化合物S4-2(可从Acros Organics购得,CAS No.135-67-1)、K2CO3和CuI组合以形成化合物S4-3。在第二步骤中,化合物S4-3在45℃下THF中与化合物S4-4(可从Alfa Aesar购得,CAS No.681812-07-7)、Pd(OAc)2和K3PO4组合24小时以形成化合物G32。应理解步骤1和2可以由本领域技术人员进行和优化而无需过度试验。
化合物I25
化合物I25可以由普通技术人员按照图6中显示的方案5合成。在第一步骤中,化合物S5-1(可从Acros Organics购得,CAS No.589-87-7)在80℃下二氧六环中与化合物S5-2(可从ArkPharm,Inc.购得,CAS No.6267-02-3)、nBuONa和CuI组合6小时以形成化合物S5-3。在第二步骤中,化合物S5-3添加到己烷并冷却到0℃,之后逐滴添加nBuLi,接着添加B(OMe)3反应可以允许搅拌,之后用HCl水溶液淬灭以形成化合物S5-4。在第三步骤中,化合物S5-4可以在45℃下THF中与化合物S5-5(可从Acros Organics购得,CAS No 626-39-1)、Pd(OAc)2和K3PO4组合24小时以形成化合物S5-6。在第四步骤中,化合物S5-6可以在45℃下THF中与化合物S5-7(可从Acros Organics购得,CAS No 1692-15-5)、Pd(OAc)2和K3PO4组合24小时以形成化合物I25。应理解步骤1、2、3和4可以由本领域技术人员进行和优化而无需过度试验。
化合物L23
化合物L23可以由普通技术人员按照图7中显示的方案6合成。在第一步骤中,化合物S6-1(可从ArkPharm,Inc.购得,CAS No.57103-02-3)在45℃下THF:DMF中与化合物S6-2(可从Alfa Aesar购得,CAS No.201802-67-7)、Pd(OAc)2和K3PO4组合并搅拌24小时以得到化合物S6-3。在第二步骤中,化合物S6-3在80℃下甲苯中与化合物S6-4(可从Alfa Aesar购得,CAS No.105946-82-5)、K2CO3和CuI组合并允许搅拌6小时以得到化合物S6-5。在第三步骤中,化合物S6-5在45℃下THF中与化合物S6-6(可从Sigma-Alrdich Co.购得,CAS No.153435-63-3)和Pd(OAc)2组合并搅拌24小时以得到化合物L23。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物J70
化合物J70可以由普通技术人员按照图8中显示的方案7合成。在第一步骤中,化合物S7-1(可从Acros Organics购得,CAS No.1592-95-6)在THF中与的BOC酸酐和DMAP组合。获取混合物而不纯化,并在甲苯中与HNPh2、tBu3P和Pd2dba3组合。获取这一混合物而不纯化,并与TFA组合以产生化合物S7-2。在第二步骤中,化合物S7-2在80℃下甲苯中与化合物S7-3(可从Acros Organics购得,CAS No.589-87-7)、K3PO4和CuI组合并搅拌6小时以形成化合物S7-4。在第三步骤中,化合物S7-4在己烷溶液中冷却到-78℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S7-5。
在第四步骤中,化合物S7-7(可从Sigma-Aldrich,Co.购得,CAS No.41963-20-6)在甲苯中与氯化铵和AlMe3组合以得到化合物S7-8。在第五步骤中,化合物S7-8在甲醇中与化合物S7-9(化合物S7-9按照WO 1998004260中描述的方法制备)和NaOMe组合以形成化合物S7-6。在第六步骤中,化合物S7-6在45℃下THF中与化合物S7-5和Pd(OAc)2组合并搅拌24小时以得到化合物J70。应理解步骤1、2、3、4、5和6可以由本领域技术人员进行和优化而无需过度试验。
化合物M22
化合物M22可以由普通技术人员按照图9中显示的方案8合成。在第一步骤中,化合物S8-1(可从Acros Organics购得,CAS No.1592-95-6)在THF中与BOC酸酐和DMAP组合。获取混合物而不纯化,并在甲苯中与HNPh2、tBu3P和Pd2dba3组合。获取这一混合物而不纯化,并与TFA组合以产生化合物S8-2。在第二步骤中,化合物S8-2在80℃下甲苯中与化合物S8-3(可从Acros Organics购得,CAS No.589-87-7)、K3PO4和CuI组合并搅拌6小时以形成化合物S8-4。在第三步骤中,化合物S8-4在己烷溶液中冷却到-78℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S8-5。在第四步骤中,化合物S8-5在45℃下THF中与化合物S8-6(可从A-Tech Chemicals购得,CAS No.69231-87-4)和Pd(OAc)2组合并搅拌24小时以得到化合物M22。应理解步骤1、2、3和4可以由本领域技术人员进行和优化而无需过度试验。
化合物B5
化合物B5可以由普通技术人员按照图10中显示的方案9合成。在第一步骤中,化合物S9-1(可从A-Tech Chemicals购得,CAS No.187275-73-6)在80℃下甲苯中与HNPh2、K3PO4和CuI组合并搅拌6小时以形成化合物S9-2。在第二步骤中,化合物S9-2添加到己烷中并冷却到0℃,之后逐滴添加nBuLi,接着添加B(OMe)3。反应可以允许搅拌,之后用HCl水溶液淬灭以形成化合物S9-3。在第三步骤中,化合物S9-3在45℃下THF中与化合物S9-4(可从Matrix Scientific购得,CAS No.1700-02-3)、Pd(OAc)2和K3PO4组合24小时以形成化合物B5。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物H52
化合物H52可以由普通技术人员按照图11中显示的方案10合成。在第一步骤中,化合物S10-1(可从Acros Organics购得,CAS No.5570-19-4)在45℃下甲苯中与化合物S10-2(可从Acros Organics购得,583-53-9)、Pd(PPh3)4和K2CO3组合并搅拌24小时以形成化合物S10-3。在第二步骤中,化合物S10-4(可从Acros Organics购得,CAS No.5122-99-6)在45℃下DMF:H2O溶液中与化合物S10-5(可从Acros Organics购得,CAS No.90-90-4)、Pd(OAc)2和三乙胺组合并搅拌24小时以得到化合物S10-6。在第三步骤中,化合物S10-6和化合物S10-3在80℃下甲苯中与K2CO3和CuI组合并搅拌6小时以得到化合物H52。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物F33
化合物F33可以由普通技术人员按照图12中显示的方案11合成。在第一步骤中,化合物S11-1(可从Acros Organics购得,CAS No.589-87-7)在80℃下甲苯中与化合物S11-2(可从Acros Organics购得,CAS No.135-67-1)、K2CO3和CuI组合以形成化合物S11-3。在第二步骤中,化合物S11-3在45℃下THF中与化合物S11-4(可从Acros Organics购得,CAS 1692-15-5)、Pd(OAc)2和K3PO4组合24小时以形成化合物F33。应理解步骤1和2可以由本领域技术人员进行和优化而无需过度试验。
化合物E3
化合物E3可以由普通技术人员按照图13中显示的方案12合成。在第一步骤中,化合物S12-1与SOCl2组合。获取中间体而不纯化,并在0℃下THF中与PhMgBr组合和搅拌4小时以得到化合物S12-2。在第二步骤中,化合物S12-3(可从Sigma-Aldrich Co.购得,CAS No.78600-33-6)添加到己烷中并冷却到0℃,之后逐滴添加nBuLi。随后添加B(OiPr)3,且反应允许搅拌1小时,之后用HCl水溶液淬灭以得到化合物S12-4。在第三步骤中,化合物S12-4和化合物S12-3在45℃下THF中与Pd(OAc)2和K3PO4组合并搅拌24小时以得到化合物E3。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物H45
化合物H45可以由普通技术人员按照图14中显示的方案13合成。在第一步骤中,化合物S13-1(可从Acros Organics购得,CAS No.589-87-7)在80℃下甲苯中与化合物S13-2(可从Acros Organics购得,CAS No.135-67-14)、K2CO3和CuI组合6小时以形成化合物S13-3。在第二步骤中,化合物S13-3添加到己烷中并冷却到0℃,之后逐滴添加nBuLi,接着添加B(OMe)3。反应可以允许搅拌,之后用HCl水溶液淬灭以形成化合物S13-4。在第三步骤中,化合物S13-4可以在45℃下THF中与化合物S13-5(可从Acros Organics购得,CAS No 626-39-1)、Pd(OAc)2和K3PO4组合24小时以形成化合物S13-6。在第四步骤中,化合物S13-6可以在45℃下THF中与化合物S13-7(可从Acros Organics购得,CAS No 191162-39-7)、Pd(OAc)2和K3PO4组合24小时以形成化合物H45。应理解步骤1、2、3和4可以由本领域技术人员进行和优化而无需过度试验。
化合物J62
化合物J62可以由普通技术人员按照图15中显示的方案14合成。在第一步骤中,化合物S14-1(可从ArkPharm,Inc.购得,CAS No.57103-02-3)在THF中与BOC酸酐和DMAP组合。获取混合物而不纯化,并在甲苯中与HNPh2、tBu3P和Pd2dba3组合。获取这一混合物而不纯化,并与TFA组合以产生化合物S14-2。在第二步骤中,化合物S14-2在80℃下甲苯中与化合物S14-3(可从Alfa Aesar购得,CAS No.105946-82-5)、K3PO4和CuI组合并搅拌6小时以形成化合物S14-4。在第三步骤中,化合物S14-4在45℃下THF中与化合物S14-5(可从Acros Organics购得,CAS No.191162-39-7)、Pd(OAc)2和K2CO3组合并搅拌24小时以得到化合物J62。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物L59
化合物L59可以由普通技术人员按照图16中显示的方案15合成。在第一步骤中,化合物S15-1(可从ArkPharm,Inc.购得,CAS No.57103-02-3)在THF中与BOC酸酐和DMAP组合。获取混合物而不纯化,并在甲苯中与HNPh2、tBu3P和Pd2dba3组合。获取这一混合物而不纯化,并与TFA组合以产生化合物S15-2。在第二步骤中,化合物S15-2在80℃下甲苯中与化合物S15-3(可从Alfa Aesar购得,CAS No.105946-82-5)、K3PO4和CuI组合并搅拌6小时以形成化合物S15-4。在第三步骤中,化合物S15-4在45℃下THF中与化合物S15-5(可从Alfa Aesar购得,CAS No.1582-24-7)、Pd(OAc)2和K2CO3组合并搅拌24小时以得到化合物L59。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物I99
化合物I99可以由普通技术人员按照图17中显示的方案16合成。在第一步骤中,化合物S16-1(可从ArkPharm,Inc.购得,CAS No.23449-08-3)添加到己烷中并冷却到0℃,之后逐滴添加nBuLi。随后添加B(OiPr)3,且反应允许搅拌1小时,之后用HCl水溶液淬灭以得到化合物S16-2。在第二步骤中,化合物16-3(可从Combi-Blocs,Inc.购得,CAS No.206559-43-5)在80℃下甲苯中与化合物S16-4(可从Acros Organics购得,CAS No.494-19-9)、K2CO3和CuI组合并搅拌24小时以得到化合物S16-5。在第三步骤中,化合物16-5在45℃下THF中与化合物16-2、Pd(OAc)2和K3PO4组合并搅拌24小时以得到化合物I99。
化合物M31
化合物M31可以由普通技术人员按照图18中显示的方案17合成。在第一步骤中,化合物S17-1(可从Acros Organics购得,CAS No.1592-95-6)在THF中与BOC酸酐和DMAP组合。获取混合物而不纯化,并在甲苯中与HNPh2、tBu3P和Pd2dba3组合。获取这一混合物而不纯化,并与TFA组合以产生化合物S17-2。在第二步骤中,化合物S17-2在80℃下甲苯中与化合物S17-3(可从Acros Organics购得,CAS No.589-87-7)、K3PO4和CuI组合并搅拌6小时以形成化合物S17-4。在第三步骤中,化合物S17-4在己烷溶液中冷却到-78℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S17-5。在第四步骤中,化合物S17-6在45℃下THF中与化合物S17-5和Pd(OAc)2组合并搅拌24小时以得到化合物M31。应理解步骤1、2、3和4可以由本领域技术人员进行和优化而无需过度试验。
化合物K28
化合物K28可以由普通技术人员按照图19中显示的方案18合成。在第一步骤中,化合物S18-1(可从ArkPharm,Inc.购得,CAS No.57103-02-3)在THF中与BOC酸酐和DMAP组合。获取混合物而不纯化,并与甲苯中的HNPh2、tBu3P和Pd2dba3组合。获取这一混合物而不纯化,并与TFA组合以产生化合物S18-2。在第二步骤中,化合物S18-2在80℃下甲苯中与化合物S18-3(可从Acros Organics购得,CAS No.589-87-7)、K3PO4和CuI组合并搅拌6小时以形成化合物S18-4。在第三步骤中,化合物S18-4在80℃下甲苯中与化合物S14-5(可从Acros Organics购得,CAS No.95-14-7)、K2CO3和CuI组合并搅拌6小时以得到化合物K28。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物H32
化合物H32可以由普通技术人员按照图20中显示的方案19合成。在第一步骤中,化合物S19-1(可从Acros Organics购得,CAS No.589-87-7)在80℃下甲苯中与化合物S19-2(可从Acros Organics购得,CAS No.135-67-1)、K2CO3和CuI组合以形成化合物S19-3。在第二步骤中,化合物S19-3在45℃下THF中与化合物S19-4(可从Alfa Aesar购得,CAS No.913835-35-5)、Pd(OAc)2和K3PO4组合24小时以形成化合物H32。应理解步骤1和2可以由本领域技术人员进行和优化而无需过度试验。
化合物B231
化合物B231可以由普通技术人员按照图21中显示的方案20合成。在第一步骤中,化合物S20-1(可从Combi-Blocks,Inc.购得,CAS No.206559-43-5)在80℃下甲苯中与化合物S20-2(可从Acros Organics购得,CAS No.86-74-8)、K2CO3和CuI组合以形成化合物S20-3。在第二步骤中,化合物S20-3在己烷中冷却到0℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S20-4。在第三步骤中,化合物S20-4在45℃下THF中与化合物S20-5(可从Alfa Aesar购得,CAS No.3842-55-5)、Pd(OAc)2和K3PO4组合24小时以形成化合物B231。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物F31
化合物F31可以由普通技术人员按照图22中显示的方案21合成。在第一步骤中,化合物S21-1(可从Spectra Scientific购得,CAS No.149428-64-8)在80℃下甲苯中与化合物S21-2(可从Acros Organics购得,CAS No.86-74-8)、K2CO3和CuI组合以形成化合物S21-3。在第二步骤中,化合物S21-3在45℃下THF中与化合物S21-4(可从Arch Bioscience购得,CAS No.232275-35-3)、Pd(OAc)2和K3PO4组合24小时以形成化合物F31。应理解步骤1和2可以由本领域技术人员进行和优化而无需过度试验。
化合物I27
化合物I27可以由普通技术人员按照图23中显示的方案22合成。在第一步骤中,化合物S22-1(可从Acros Organics购得,CAS No.589-87-7)在80℃下二氧六环中与化合物S22-2(可从ArkPharm,Inc.购得,CAS No.6267-02-3)、nBuONa和CuI组合6小时以形成化合物S22-3。在第二步骤中,化合物S22-3添加到己烷中并冷却到0℃,之后逐滴添加nBuLi,接着添加B(OMe)3。反应可以允许搅拌,之后用HCl水溶液淬灭以形成化合物S22-4。在第三步骤中,化合物S22-4可以在45℃下THF中与化合物S22-5(可从Acros Organics购得,CAS No 626-39-1)、Pd(OAc)2和K3PO4组合24小时以形成化合物S22-6。在第四步骤中,化合物S22-6可以在45℃下THF中与化合物S22-7(可从Anichem,Inc.购得,CAS No.1443112-43-3)、Pd(OAc)2和K3PO4组合24小时以形成化合物I27。应理解步骤1、2、3和4可以由本领域技术人员进行和优化而无需过度试验。
化合物K103
化合物K103可以由普通技术人员按照图24中显示的方案23合成。在第一步骤中,化合物S23-1(可从Acros Organics购得,CAS No.1592-95-6)在THF中与BOC酸酐和DMAP组合。获取混合物而不纯化,并与甲苯中的HNPh2、tBu3P和Pd2dba3组合。获取这一混合物而不纯化,并与TFA组合以产生化合物S23-2。在第二步骤中,化合物S23-2在80℃下甲苯中与化合物S23-3(可从Acros Organics购得,CAS No.589-87-7)、K3PO4和CuI组合并搅拌6小时以形成化合物S23-4。在第三步骤中,化合物S23-4在己烷溶液中冷却到-78℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S23-5。在第四步骤中,化合物S23-5在45℃下THF中与化合物S23-6(可从eNovation Chemicals购得,CAS No.40000-20-2)和Pd(OAc)2组合并搅拌24小时以得到化合物K103。应理解步骤1、2、3和4可以由本领域技术人员进行和优化而无需过度试验。
化合物L3
化合物L3可以由普通技术人员按照图25中显示的方案24合成。在第一步骤中,化合物S24-1(可从Combi-Blocs,Inc.购得,CAS No.19752-57-9)在80℃下甲苯中与HNPh2、K3PO4和CuI组合并搅拌6小时以形成化合物S24-2。在第二步骤中,化合物S24-2在己烷中冷却到-78℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S24-3。在第三步骤中,化合物24-3在45℃下THF中与化合物24-4(可从Aces Pharma购得,CAS No.23589-95-9)和Pd(OAc)2组合并允许搅拌24小时以得到化合物L3。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物K45
化合物K45可以由普通技术人员按照图26中显示的方案25合成。在第一步骤中,化合物S25-1(可从ArkPharm,Inc.购得,CAS No.57103-02-3)在THF中与BOC酸酐和DMAP组合。获取混合物而不纯化,并在甲苯中与HNPh2、tBu3P和Pd2dba3组合。获取这一混合物而不纯化,并与TFA组合以产生化合物S25-2。在第二步骤中,化合物S25-2在80℃下甲苯中与化合物S25-3(可从Alfa Aesar购得,CAS No.202865-85-8)、K3PO4和CuI组合并搅拌6小时以形成化合物S25-4。在第三步骤中,化合物S25-4在己烷溶液中冷却到-78℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S25-5。在第四步骤中,化合物25-5在45℃下THF中与化合物S25-6(可从Acros Organics购得,CAS No.106-37-6)和Pd(OAc)2组合并搅拌24小时以得到化合物S25-6。在第五步骤中,化合物S25-6在己烷溶液中冷却到-78℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S25-7。在第六步骤中,化合物S25-7在45℃下THF中与化合物S25-8(可从eNovation Chemicals购得,CAS No.40000-20-2)和Pd(OAc)2组合并搅拌24小时以得到化合物K45。应理解步骤1、2、3、4、5和6可以由本领域技术人员进行和优化而无需过度试验。
化合物M53
化合物M53可以由普通技术人员按照图27中显示的方案26合成。在第一步骤中,化合物S26-1(可从Acros Organics购得,CAS No.95-55-6)在DMSO中与化合物S26-2(可从Matrix Chemicals购得,CAS No.50670-58-1)组合以形成化合物26-3。在第二步骤中,化合物26-4(可从ArkPharm购得,CAS No.57103-02-3)在THF中与BOC酸酐和DMAP组合。获取混合物而不纯化,并与化合物26-5(可从Sigma-Aldrich Co.购得,CAS No.201802-67-7)组合。获取这一混合物而不纯化,并与TFA组合以产生化合物S26-6。在第三步骤中,化合物26-6在80℃下甲苯中与化合物26-3、K3PO4和CuI组合并搅拌24小时以得到M53。应理解步骤1、2和3可以由本领域技术人员进行和优化而无需过度试验。
化合物J64
化合物J64可以由普通技术人员按照图28中显示的方案27合成。在第一步骤中,化合物S27-1(可从ArkPharm购得,CAS No.31574-87-5)与H2O2、H2O和AcOH搅拌以形成化合物S27-2。在第二步骤中,化合物S27-3(可从Alfa Aesar购得,CAS No.57102-42-8)在120℃下甲苯中与化合物S27-4(可从Acros Organics购得,CAS No.95-51-2)、tBuOK、Pd(OAc)2和PtBu3组合并搅拌24小时以形成化合物S27-5。在第三步骤中,化合物S27-5在180℃下DMA中与K2CO3、Pd(OAc)2、PtBu3和HBF4组合并搅拌24小时以形成化合物S27-6。
在第四步骤中,化合物27-6在80℃下甲苯中与化合物27-7(可从Acros Organics购得,CAS No.589-87-7)、K3PO4和CuI组合10分钟以形成化合物S27-8。在第五步骤中,化合物S27-8在己烷:环戊基甲基醚溶液中冷却到0℃,之后逐滴添加nBuLi和随后逐滴添加Bu3SnCl以形成化合物S27-9。在第六步骤中,化合物27-9在45℃下THF中与化合物S27-2和Pd(OAc)2组合并搅拌24小时以形成化合物J64。
化合物S28-8
化合物S28-8是用于图30A-C中所述的反应方案的原料。化合物S28-8可以由普通技术人员按照图29中显示的方案28合成。在第一步骤中,化合物S28-1(可从Sigma-Aldrich Co.购得,CAS No.108-67-8)在室温下氯仿中与溴和Fe组合。反应允许搅拌24小时而以90%的产率产生化合物S28-2。在第二步骤中,化合物28-2在二氯乙烷中与溴组合,加热到100℃,并暴露于光。反应允许搅拌12小时而以95%的产率产生化合物S28-3。在第三步骤中,化合物S28-3在乙酸中与KOAc组合并加热到140℃。反应允许搅拌24小时以产生化合物S28-4。在第四步骤中,化合物S28-4在水中与KOH组合并加热到100℃。反应允许搅拌12h以形成化合物S28-5。在第五步骤中,化合物S28-5在水中与KMnO4组合并加热到100℃。反应允许搅拌12小时以形成化合物S28-6。在第六步骤中,化合物S28-6在THF中与SOCl2组合而以100%的产率形成化合物S28-7。在第七步骤中,化合物S28-7在0℃下与ΝΗ3·H2O组合并允许搅拌6小时以形成化合物S28-8。在第八步骤中,化合物S28-8与POCl3组合以形成化合物S28-9。应理解步骤1、2、3、4、5、6、7和8可以由本领域技术人员进行和优化而无需过度试验。
化合物N1、N3、N4和M141
化合物N1-N8和M141可以由普通技术人员按照图30A中显示的方案29合成。原料S28-9在THF/H2O中与S29-1、S29-2、S29-3或S29-7和Pd/K2CO3组合并加热到85℃。反应可以允许搅拌12小时以分别产生化合物N1、N3、N4和M141。应理解这些步骤可以由本领域普通技术人员进行和优化而无需过度试验。
化合物N6和N8
化合物N6和N8可以由普通技术人员按照图30B中显示的方案30合成。原料S28-9在DMF中与S29-4或S29-6和CuI/Cs2CO3组合并加热到100℃。反应可以允许搅拌12小时以分别产生化合物N6和N8。应理解这些步骤可以由本领域普通技术人员进行和优化而无需过度试验。
化合物N7
化合物N7可以由普通技术人员按照图30C中显示的方案31合成。原料S28-9在1,4-二氧六环中与S29-5和TEA组合并加热到80℃。反应可以允许搅拌24小时以产生化合物N7。应理解这些步骤可以由本领域普通技术人员进行和优化而无需过度试验。
本文中引用的所有专利、公开的申请和参考文献的教导通过引用全文并入。
尽管本发明已经特别地参照其示例实施方式进行显示和说明,但本领域技术人员应理解,可以对其进行形式和细节上的各种改变而不脱离所附权利要求涵盖的本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!