一种用于提取块茎、块根高质量RNA的方法与流程
本发明属于基因工程领域,具体地说,涉及一种用于提取块茎、块根高质量RNA的方法。
背景技术:
目前常采用的植物总RNA提取方法主要有异硫氰酸胍法、CTAB法、SDS法、Trizol法,而针对马铃薯块茎、甘薯块根、山药块茎的RNA提取研究中,所用方法各异,试剂配制繁琐,没有统一的针对这些地下生长材料的高质量RNA提取方法。
针对块茎、块根部位基因表达的研究增多,而获得高质量RNA是其中的关键环节之一。目前这些块茎、块根类材料RNA提取存在如下问题:第一,马铃薯、甘薯、山药、魔芋等地下块茎、块根类材料液氮速冻后硬度大,研磨难;第二,块茎、块根材料淀粉、多糖含量高并且含有较多的次生代谢产物,如多酚、色素等。多糖会和RNA形成黏稠状物质,使其难溶于水;多酚类在研磨时被释放出来被氧化成醌类物质,它们能与RNA稳定结合,影响RNA分离。这些因素会影响总RNA提取质量,不利于后续分子生物学研究。
技术实现要素:
有鉴于此,本发明针对以上的问题,提供了一种用于提取块茎、块根高质量RNA的方法,本技术从取样方式、去多糖等方面,研究开发出一套提取块茎、块根类RNA的方法,本方法统一规范取样方式、取样量和速冻等环节,通过低浓度乙醇、高盐、冻融等多种方式去除淀粉和多糖的影响,开发出一套能提取含多糖、多酚、淀粉材料的总RNA提取方法,该方法能稳定且高效提取RNA用于后续的northern blot,高通量测序等实验。
为了解决上述技术问题,本发明公开了一种用于提取块茎、块根高质量RNA的方法,包括以下步骤:
1)取样:用直径3mm的硬质塑料管沿块根、块茎打孔,获得直径3mm,长5mm圆柱体,8个装1管置于液氮中速冻后保存于-80℃的环境中;
2)研磨:取口部的内径为8.5cm的研钵加入3勺液氮冻冷,再加入第4勺时取出已冻好的样品倒入研钵,在液氮挥发过程中小心压碎样品块,液氮挥发完时迅速磨成细粉;迅速将粉末装入EP管中,加1mL Trizol,剧烈混匀,室温放5-10min;
3)将步骤2)得到的混合物进行离心并用有机溶剂提取纯化RNA。
进一步地,步骤3)中的将步骤2)得到的混合物进行离心并用有机溶剂提取纯化RNA具体为:
3.1)4℃、12000rpm离心5min,直接倒上清入已加200μL氯仿的新管中,上下颠倒15s混匀,室温放5min;
以下在冰上操作:
3.2)4℃、12000rpm离心10min,就近吸取上清到新管,加入等体积酚/氯仿/异戊醇,颠倒混匀;
3.3)4℃、12000rpm离心20min,吸取上清到新管,逐滴加入无水乙醇至乙醇终浓度为12%,上下颠倒混匀后迅速离心;
3.4)4℃、12000rpm离心10min,吸取上清到新管,加入0.7倍体积异丙醇颠倒混匀,并加入0.2倍体积1M NaAc-20℃沉淀30-60min;
3.5)4℃、12000rpm离心15min,弃上清,加入1mL 75%乙醇,洗沉淀3遍;
3.6)倒掉上清,超净台上吹风10min,加入80μLDEPC处理水,立即放入55℃水浴5min,-80℃冻60min,重复2次冻融;
3.7)4℃,12000rpm离心20min,小心吸取上清60-70μL,注意不接触沉淀,-80℃保存至少半年不降解。
与现有技术相比,本发明可以获得包括以下技术效果:
1)所用试剂简单常见,不需要配制复杂危险的溶液;
2)能稳定且高效地获得硬质、高淀粉、高多糖的块茎、块根类材料的RNA;
3)提取的RNA纯度高、完整性好,能用于后续分子实验,并能在-80℃保存至少半年时间。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是本发明用于提取块茎、块根高质量RNA的方法的取样方式和研磨及用量要求;
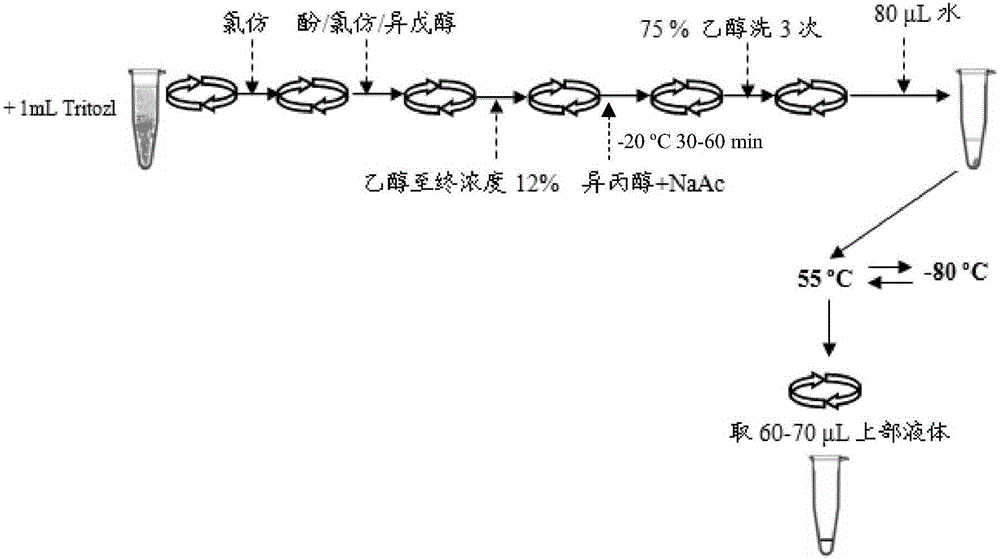
图2是本发明用于提取块茎、块根高质量RNA的方法的工艺流程图;
图3是本发明的实施例2-5中的电泳图;其中,1-4分别代表:马铃薯、甘薯、山药、魔芋样品提取的RNA。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
实验准备包括常规的用0.1%DEPC处理EP管和枪头,DEPC处理水,配制酚/氯仿/异戊醇(25:24:1),1M醋酸钠50mL(称取6.804g,加水至50mL,加50μLDEPC,37℃,150rpm,7-8h后再121℃高温处理20min),Trizol提取试剂。
实施例1用于提取块茎、块根高质量RNA的方法
用于提取块茎、块根高质量RNA的方法的工艺流程图如图1所示,包括以下步骤:
1)取样:用直径3mm的硬质塑料管沿块根、块茎打孔,获得直径3mm,长5mm圆柱体,8个装1管置于液氮中速冻后保存于-80℃。
取样的方式及用量:用硬质容器(塑料管)统一打孔成小圆柱体,便于对不同部位精确取样(如芽眼部位、薄壁组织、维管组织、髓部),同时利于研磨。
2)研磨:取口部的内径为8.5cm的研钵加入3勺液氮冻冷,再加入第4勺时取出已冻好的样品倒入研钵(液氮基本装满研钵),在液氮挥发过程中小心压碎薯块,液氮将挥发完时迅速磨成细粉。迅速将粉末(6-7勺即可)装入EP管中,加1mL Trizol,剧烈混匀,室温放5-10min。
3)提取纯化RNA,过程如图2所示,
3.1)4℃、12000rpm离心5min,直接倒上清入已加200μL氯仿的新管中,上下颠倒15s混匀,室温放5min;
以下在冰上操作:
3.2)4℃、12000rpm离心10min,就近吸取上清到新管,加入等体积酚/氯仿/异戊醇,颠倒混匀;
3.3)4℃、12000rpm离心20min,吸取上清到新管,逐滴加入无水乙醇至乙醇终浓度为12%,上下颠倒混匀后迅速离心;
3.4)4℃、12000rpm离心10min,吸取上清到新管,加入0.7倍体积异丙醇颠倒混匀,并加入0.2倍体积1M NaAc-20℃沉淀30-60min;
3.5)4℃、12000rpm离心15min,弃上清,加入1mL 75%乙醇,洗沉淀3遍;
3.6)倒掉上清,超净台上吹风10min,加入80μLDEPC处理水,立即放入55℃水浴5min,-80℃冻60min,重复2次冻融;
3.7)4℃,12000rpm离心20min,小心吸取上清60-70μL,注意不接触沉淀,-80℃可保存至少半年不降解。
其中,酚/氯仿/异戊醇用于进一步除蛋白,低浓度乙醇利于沉淀多糖,NaAc用于防止多糖与RNA一起沉淀出来,75%乙醇多次清洗以除去盐,55℃和-80℃反复冻融可以促进一些融于水的多糖析出,同时使被多糖包裹的RNA溶解。
实施例2马铃薯块茎芽眼部位RNA提取
按上述方法,以芽眼部位为中心取样8个,研磨后迅速装入粉末7勺,加1mL Trizol,剧烈混匀,室温放5min。4℃、12000rpm离心5min,直接倒上清入已加200μL氯仿的新管中,上下颠倒15s混匀,室温放5min。4℃、12000rpm离心10min,就近吸取上清600μL到新管,加入等体积酚/氯仿/异戊醇,颠倒混匀。4℃、12000rpm离心20min,吸取上清500μL到新管,逐滴加入无水乙醇70μL,上下颠倒混匀后迅速离心。4℃、12000rpm离心10min,吸取450μL到新管,加入315μL异丙醇上下颠倒混匀,并加入90μL 1M NaAc,-20℃沉淀1h。4℃、12000rpm离心15min,弃上清,加入750μL无水乙醇,250μLDEPC处理水,洗沉淀,4℃、8500rpm离心3min倒掉上清液,再重复洗2遍。倒掉上清,尽量吸除多余液体,超净台上吹风10min,加入80μLDEPC处理水,立即放入55℃5min,-80℃60min后,反复2次。4℃,12000rpm离心20min,小心吸取上清60μL,注意不接触沉淀,-80℃贮藏。
样品质量检测:2μL样品+6μL 1.5×Loading Buffer,1%琼脂糖,核酸染料为Gel Red,80V,30min,1×TAE缓冲液,电泳结果如图3示。石英比色杯中加入2mL去离子水,待测样品比色怀中加入5μL(1:400)的RNA样品,用枪头搅拌均匀。用紫外分光光度计测定OD230、OD260和OD280的数值。RNA浓度=OD260*40*400,单位ng/μL,结果见表1。
实施例3甘薯块根芽眼部位RNA提取
按上述方法,以芽眼部位为中心取样8个,研磨后迅速装入粉末7勺,加1mL Trizol,剧烈混匀,室温放5min。4℃、12000rpm离心5min,直接倒上清入已加200μL氯仿的新管中,上下颠倒15s混匀,室温放5min。4℃、12000rpm离心10min,就近吸取上清700μL到新管,加入等体积酚/氯仿/异戊醇,颠倒混匀。4℃、12000rpm离心20min,吸取上清550μL到新管,逐滴加入无水乙醇75μL,上下颠倒混匀后迅速离心。4℃、12000rpm离心10min,吸取500μL到新管,加入350μL异丙醇上下颠倒混匀,并加入100μL 1M NaAc,-20℃沉淀1h。4℃、12000rpm离心15min,弃上清,加入750μL无水乙醇,250μLDEPC处理水,洗沉淀,4℃、8500rpm离心3min倒掉上清液,再重复洗2遍。倒掉上清,尽量吸除多余液体,超净台上吹风10min,加入80μLDEPC处理水,立即放入55℃5min,-80℃60min后,反复2次。4℃,12000rpm离心20min,小心吸取上清60μL,注意不接触沉淀,-80℃贮藏。样品质量检测同实施例2。
实施例4山药块茎薄壁组织的RNA提取
按上述方法,将山药横切后取中央部位的薄壁组织样品8个,研磨后迅速装入粉末6勺,加1mL Trizol,剧烈混匀,室温放10min。4℃、12000rpm离心5min,直接倒上清入已加200μL氯仿的新管中,上下颠倒15s混匀,室温放5min。4℃、12000rpm离心10min,就近吸取上清500μL到新管,加入等体积酚/氯仿/异戊醇,颠倒混匀。4℃、12000rpm离心20min,吸取上清400μL到新管,逐滴加入无水乙醇54μL,上下颠倒混匀后迅速离心。4℃、12000rpm离心10min,吸取300μL到新管,加入210μL异丙醇上下颠倒混匀,并加入60μL 1M NaAc,-20℃沉淀30min。4℃、12000rpm离心15min,弃上清,加入750μL无水乙醇,250μLDEPC处理水洗沉淀,4℃、8500rpm离心3min倒掉上清液,再重复洗2遍。倒掉上清,尽量吸除多余液体,超净台上吹风10min,加入70μLDEPC处理水,立即放入55℃5min,-80℃60min后,反复2次。4℃,12000rpm离心20min,小心吸取上清60μL,注意不接触沉淀,-80℃贮藏。样品质量检测同实施例2。
实施例5魔芋球茎RNA提取
按上述方法,取新鲜魔芋球茎沿表皮部位向内打孔取样8个,研磨后迅速装入粉末6勺,加1mL Trizol,剧烈混匀,室温放5min。4℃、12000rpm离心5min,直接倒上清入已加200μL氯仿的新管中,上下颠倒15s混匀,室温放5min。4℃、12000rpm离心10min,就近吸取上清500μL到新管,加入等体积酚/氯仿/异戊醇,颠倒混匀。4℃、12000rpm离心20min,吸取上清400μL到新管,逐滴加入无水乙醇54μL,上下颠倒混匀后迅速离心。4℃、12000rpm离心10min,吸取300μL到新管,加入210μL倍体积异丙醇上下颠倒混匀,并加入60μL 1M NaAc,-20℃沉淀60min。4℃、12000rpm离心15min,弃上清,加入750μL无水乙醇,250μLDEPC处理水洗沉淀,4℃、8500rpm离心3min倒掉上清液,再重复洗2遍。倒掉上清,尽量吸除多余液体,超净台上吹风10min,加入70μLDEPC处理水,立即放入55℃5min,-80℃60min后,反复2次。4℃,12000rpm离心20min,小心吸取上清60μL,注意不接触沉淀,-80℃贮藏。样品质量检测同实施例2。
表1四种材料RNA的质量检测
其中,1-4分别代表:马铃薯、甘薯、山药、魔芋样品提取的RNA
由表1可以看出,OD260/230均大于2.0,说明没有盐污染;OD260/280介于1.8到2.2之间,说明没有DNA和蛋白等有机物的污染,纯度好;若是用于后续的高通量测序试验,一般要求浓度≥400ng/μL,RNA总量≥20μg,实施例中获得的RNA浓度和总量均较高,完全满足要求。因此采用本方法可以从块茎、块根中获得高质量的RNA。由图3可知,能清楚看到28S和18S两条亮带,且28S:18S≥1.0,说明RNA完整性好且没有DNA和蛋白污染,提取的RNA质量高。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!