用于电穿孔的一次性药筒的制作方法
本发明涉及一种用于执行细胞的电穿孔的一次性装置、一种利用一次性用品电穿孔细胞的工艺以及包括该一次性用品的封闭系统。
背景技术:
电穿孔或者电通透是一种分子生物学技术,其中将电场施加于细胞以便增加细胞膜的渗透性,从而允许将核酸引入细胞中。
电穿孔用于将核酸引入细胞中,尤其是哺乳动物细胞。转移的核酸能够用于瞬时蛋白质表达。尤其mRNA电穿孔被用于瞬时地表达所关注的蛋白质。质粒能够用于瞬时表达以及用于稳定整合。能够通过引入双链断裂和同源序列来改善质粒到基因组中的整合,其中双链断裂和同源序列将通过同源重组来取代断裂的基因组片段。另一个可能性是使用转座酶来将两侧伴有转座酶动势(motivs)的遗传信息整合到基因组中。转移的核酸还能够为核酸酶编码。位点特定的核酸酶是通过非同源性末端连接来敲除基因的常用工具。
因此,电穿孔能够用在生产敲除或者转基因细胞的过程中。利用动物胚胎细胞,转基因或者敲除细胞也能够用于培育转基因或者敲除动物。通过核酸电穿孔修改的细胞用于肿瘤治疗、基因疗法或者其它基于细胞的疗法。
电穿孔用电穿孔仪执行,电穿孔仪是针对特定目的建造的器具,其产生被施加于包含待转移到细胞中的核酸的细胞悬液的电场。通常地,细胞悬液由移液管被移到在侧部具有两个电极的玻璃或者塑料试管中。在电穿孔之前,将细胞悬液与待转化的核酸混合。用移液管将该混合物移到试管中,设定电压和电容,并且将该试管插入电穿孔仪中。电穿孔仪将施加电场。电场由场强度(例如,电极的单位距离上施加的电压、时间和电容)限定。对于指数式衰减脉冲,电压和电容的固定的,并且由于电流穿过细胞悬液,因此电场衰减。对于方波脉冲,使用高电容并且在给定时间中施加电场。由于该高电容,因此由电流穿过细胞悬液所引起的电场的衰减应是最小的。在电穿孔期间,电场在细胞膜中生成孔,从而也允许像核酸那样的更大分子穿过细胞膜。像细胞膜那样的双层脂质膜能够受到强跨膜电势的干扰,如文献Tsong, T.Y., “Electroporation of cell membranes”, Biophys J, 1991. 60(2): p. 297-306中所公开的那样。如果跨膜电场超过细胞膜的介电强度,则膜的电导率急剧地增加。Tsong等人已经报导了对于厚度为5 nm的脂质双层在μs至ms的场持续时间中,该击穿电势在150 mV与500 mV之间。这说明介电强度为300 V/cm至1000 V/cm。文献Rols, M.P. and J. Teissie, “Electropermeabilization of mammalian cells to macromolecules: control by pulse duration”. Biophys J, 1998. 75(3): p. 1415-23中已经针对>0.3 -0.4 kV/cm的电场强度对低分子量分子的穿透进行了检测。文献Wolf, H., et al., “Control by pulse parameters of electric field-mediated gene transfer in mammalian cells”, Biophys J, 1994. 66(2 Pt 1): p. 524-31中已描述了用于膜通透的阈值场强为580 V/cm。
细胞膜遇到的电势差已被描述为:
因此,电势差与初始电场强度E0和细胞的半径r成比例(文献Neumann, E., et al., Gene transfer into mouse lyoma cells by electroporation in high electric fields. Embo J, 1982. 1(7): p. 841-5)。
对于5 μm的典型细胞半径,能够由>400 V/cm的电场强度实现例如300 mV的通透阈值。对于更小的细胞(r=1 μm),所需的场强度能够估算为至少2000 V/cm。
除了核酸被动扩散至细胞中之外,还能够在电场中应用额外的核酸电泳。电泳所需的电场小于电穿孔所需的电场。指数式衰减脉冲很可能在开始时用高电场来通透细胞膜,并且衰减的场随后将核酸运输到细胞内。对于方波脉冲,能够生成两个或者更多个脉冲以结合电穿孔和电泳。
核酸能够是DNA或者RNA。因为DNA更加稳定,因此将例如质粒的DNA与细胞悬液混合在一起通常不伤害DNA。不同地,RNA易于例如由细胞分泌的或者来自被污染的缓冲剂的RNases(核糖核酸酶)降解。因此,通常在电穿孔步骤之前添加RNA,以使在RNA能够进入细胞之前RNA降解的风险最小化。在细胞内,RNA受到核酸结合蛋白和翻译机械(translation machinery)的保护。
对于自动化电穿孔装置,核酸(尤其是RNA)也应当恰好在电穿孔之前与细胞悬液混合。目前,尚不能自动地执行电穿孔步骤之前的核酸与细胞悬液的混合。尽管存在许多用于半自动或者自动电穿孔的装置,但样品制备(例如,核酸与细胞悬液的混合)必须在电穿孔过程之前执行。混合过程包括以恒定比率添加两种溶液(例如,细胞悬液和核酸溶液)以产生均匀混合物。
在电穿孔过程期间,核酸的浓度至关重要,并且为了得到可重现的结果,需要在该过程期间维持限定的比率。针对混合物的均匀性,也同样如此。为了均匀的细胞电穿孔,对于所有细胞,局部核酸浓度应当相同。均匀混合将产生细胞与无核酸、少量核酸和大量核酸的混合物。由于电穿孔的细胞通常在电穿孔之后被培养或者甚至给予病患,因此必须在无菌环境中执行混合和电穿孔过程。
因此,本领域中需要一种允许混合核酸和细胞且能够实现无菌条件下的细胞电穿孔的装置。
技术实现要素:
本发明涉及一种用于细胞的电穿孔的一次性用品,该一次性用品包括:
在该一次性用品的内部的流体隔室;
第一流体端口,其用于向流体隔室提供细胞悬液;以及第二流体端口,其用于向流体隔室递送包括待被电穿孔到细胞中的至少一种化合物的流体;
第一电极和第二电极,该第一电极和该第二电极设置在流体隔室中;
至少一个出口端口,其从流体隔室递送流体,第一流体端口和第二流体端口与混合通道流体连通,混合通道与流体隔室流体连通。
一次性药筒允许以给定比率混合至少两种流体,以实现均匀的结合的流体。这种混合由限定体积混合比率并且能够实现均匀流体混合的微流体装置完成。药筒能够安装在管道套件中从而允许无菌细胞处理。蠕动泵或者真空泵用于使流体运动进出电穿孔组件,从而使泄漏或者缺陷的风险最小化。管道套件也能够与其它细胞处理步骤(比如细胞分离或者细胞培育)相结合。
附图说明
参照以下附图描述各种示例性细节,附图中:
图1是一次性电穿孔药筒组件的一般实施例的透视图;
图2是一次性电穿孔药筒组件的侧视图;
图3是从上方观察的一次性电穿孔药筒组件的透视图;
图4a是图3的一次性电穿孔药筒组件的下半部分的外表面的平面图;图4b是图1的一次性电穿孔药筒组件的下半部分的内表面的平面图;
图5a是图3的一次性电穿孔药筒组件的上半部分的外表面的平面图;图5b是图3的一次性电穿孔药筒组件的上半部分的内表面的平面图;
图6a是图1的一次性电穿孔药筒组件的下表面的平面图;图6b是图1的一次性电穿孔药筒组件的上表面的平面图;以及
图7是图3的一次性电穿孔药筒组件的下表面的透视图。
图8示出混合比率与电穿孔试管内的真空的依赖关系。
图9示出用由mCherry/eGFP表达监测的转染率对Jurkat细胞进行电穿孔的结果。
应理解的是,附图不一定按照比例绘制,并且同样的标记可以指代同样的特征。
具体实施方式
本发明的装置能够通过以下方式实现细胞的转染:通过按照预定的体积混合比率来混合至少两种流体(该至少两种流体包括细胞和待被电穿孔到细胞中的至少一种化合物)并且向混合流体施加电场。
待被电穿孔到细胞中的化合物能够是本领域中已知的对电穿孔有用的任何化合物,比如核酸、低聚核苷酸、多聚核苷酸、DNA、RNA、肽、蛋白质以及小分子(比如激素、细胞因子、趋化因子、药物或者药物前体)。在下文中,术语“核酸”作为待被电穿孔的化合物被用作所有这种待被电穿孔的化合物(比如,低聚核苷酸、多聚核苷酸、DNA、RNA、肽、蛋白质以及小分子(比如激素、细胞因子、趋化因子、药物或者药物前体))的同义词。
为了在均匀混合的流体上执行电穿孔并且防止通道中的层流,一次性用品的混合通道具有蛇形形状和/或包括搅拌器元件和/或混合室。在将细胞悬液与核酸溶液混合之后,施加电场,该电场在细胞膜中引发孔。然后核酸能够通过扩散或者电泳中的任一者通过该孔进入细胞。
在该装置的一个实施例中,至少两种流体的体积混合比率由具有不同微流体阻力的至少两个微流体通道限定,即,第一流体端口和第二流体端口设有对流体具有不同微流体阻力的通道。
每种流体的流动取决于相应通道(例如,图4a中的通道112和122)的阻力。与具有更低阻力的至少另一个通道相比,更少的流体将经过带有更高阻力的通道。因此,混合比率能够由至少两个输入通道的阻力之比来限定。优选地,第一流体端口和第二流体端口设有具有微流体阻力以将第一流体与第二流体的混合比率维持为1:5至1:10的通道。利用不同的体积导致每种溶液的流体静压力的变化。因此,流体静压力差异破坏了由微流体通道阻力限定的混合比率。
流体可以被泵送或者抽吸到装置中。因此,一次性用品的第一流体端口和第二流体端口与将流体递送到流体隔室内的至少一个泵流体连通,并且/或者至少一个出口端口与至少一个真空源流体连通,从而将流体抽吸到流体隔室内。
泵或者真空源应当在一侧上的第一流体端口和第二流体端口与另一侧上的流体中的至少一个出口端口之间提供至少100 mbar的压力差。优选地,压力差在100 mbar与800 mbar之间,尤其在200 mbar与500 mbar之间。
该压力差迫使混合的流体进入装置的两个电极板之间的流体隔室内。能够通过测量第一电极与第二电极之间的电容来控制和/或自动化填装过程(即,流体隔室的填装水平)。填装可以继续进行直到例如达到第一电极与第二电极之间的最大容量。在替代方案中,接地电极(如后文将解释的)之间的电阻能够用于确定流体隔室的填装水平。在替代方案中,填装水平可以通过控制施加至流体隔室的压力差来确定。通过控制流体隔室的填装水平,能够以半连续模式操作装置。
在填满电极板之间的体积之后,施加电场。该电场通常被给予为电脉冲。脉冲的形状能够是指数式衰减、方波或者不同的组合。重要地,电场强度必须足以在细胞膜中形成孔。然后核酸能够通过扩散或者电泳中的任一者进入细胞。然后从装置清除电穿孔的细胞,可选地用于进一步的处理,比如,某些细胞子集的检测、富集和/或排出,以及/或者细胞培养。为了对更多细胞(更大量的细胞或者更大体积的细胞悬液)进行电穿孔,可以重复填装、混合、电穿孔和清除的过程。此外,电穿孔过程本身能够在有或者没有洗涤、培养或者分离步骤的情况下在相同的细胞样品上重复进行。
所施加的电场能够毁坏由比如铝的金属制成的电极。为了允许利用相同的电极板的装置进行多个电穿孔顺序(sequence),能够用耐电化学腐蚀的金属涂覆该电极板。像贵金属(例如,金)那样的导电涂层能够用于保护电极板。在变型中,本发明的一次性用品包括由覆盖有一层金的钛制成的第一金属电极和第二金属电极。为了避免电极之间存在不同的场强,电极应平行地布置并且在电极的整个表面上彼此相距恒定的距离。优选地,第一金属电极和第二金属电极在并行布置中分隔开2 mm至4 mm的距离,并且距离的变化小于+/-20 μm。此外,电极的表面应当尽可能平滑,并且没有针孔或者峰。具有1 μm至10 μm的粗糙度Rz的电极是优选的。
图1是简化的一次性电穿孔药筒的透视图。该药筒中的元件是输入端口11、第二输入端口12及其混合柱13。在输入端口11、第二输入端口12和混合柱13上包括通向一次性药筒10的输入元件。当离开混合柱13时,样品流体接着进入包括第一电极21和第二电极23的腔中。电极21和23可以是平行平面电容器,使得元件21和23是由小间隙分隔开的平坦平面或者导电结构。电压由突舌20和22施加至板21和23,并且流体通过出口端口15离开该一次性药筒。
流体样品可以通过输入端口11被引入;诸如,例如RNA的附加元素通过第二输入端口12进入。例如,细胞悬液可以通过输入端口11被引入,并且核酸溶液经由第二输入端口12被填装。细胞悬液和核酸溶液在混合通道13中混合并且被引入包含静电板21和23的腔内。
已经与核酸溶液混合的细胞悬液流过板21和23之间的间隙,并且经受施加在这两个板之间的电场。如本领域中众所周知的,该电场在细胞膜中生成孔,从而允许核酸扩散进入细胞中。在电穿孔之后,能够通过出口端口15从一次性用品移除修改的细胞。
根据本发明的一次性用品优选地通过连结一次性用品的两个半部分(分别包括第一电极或者第二电极的半部分)来形成。图2中以侧视图更加详细地示出该实施例。一次性电穿孔药筒10可以由两个部分(上表面100和下部分200)组成。这两个部分可以由模制塑料制成,并且通过激光辐射或者HF(高频)场焊接在一起。一次性电穿孔药筒10可以进一步包括附加端口160和两个出口端口140和150,它们的功能将在下文描述。最后,一次性电穿孔药筒100还可以包括由间隙分隔开的两个电极板210和220。将根据施加的电压和所需的电场选取两个电极之间的距离(间隙)。常用的电极距离是2 mm至4 mm。对于能够实现大于2 kV/cm的高电场,更小的间隙可以是有利的,例如,100 μm。此外,间隙必须足以允许进入流体的流动并且不应伤害细胞(例如,通过剪切应力)。在一些实施例中,电场可以为约2 kV/cm。
图3是组装的一次性电穿孔药筒10的透视图。该组装的视图包括一起示出的上表面100和下表面200,并且图3还示出该下表面100中的两个输入端口110和120,以及也在下表面100中的第一电极板210。
上表面200中是两个出口端口140和150,以及第二电极板220。应当理解的是,术语“上”和“下”是任意的,并且可以沿任何任意取向观察药筒10。图3也示出在上表面200上的输出端口140和150。最后,上表面200还可以包括,如能够在图3中看到的,连接至第一输入通道110的混合通道130,以及第二输入通道120。该混合通道旨在混合两个输入通道的内容物。混合通道130可以是蛇形状或者支持两种流体合并的任何其它结构。混合通道130将混合的流体引入包含电极板210和220的腔内。混合通道130可以包括五至15个蛇形转弯。该蛇形转弯引起两种成分(细胞悬液和核酸溶液)的无序混合。
流体隔室的形状优选地能够实现无气泡填装和排放。因此,混合通道和至少一个出口端口可以位于流体隔室的最相对侧处,即,在流体隔室的最高位置和最低位置处。此外,流体隔室以及电极板220和230可以具有避免死空间(比如,钝角和/或锐角)的具体形状。如在图3中图示的,流体隔室以及可选的电极板可以具有平行四边形或者梯形形状。
应理解的是,这种平行四边形是示例性实施例,并且流体隔室和电极的形状可以是任何任意形状,包括矩形、圆形、梯形,或者根据装置的无气泡填装要求的任何其它形状。
在本发明的另一个实施例中,一次性用品进一步包括至少一个附加电极,其向第一流体端口、第二流体端口或者出口端口中的至少一个施加地电势。图3至图5中示出该实施例,并且具有接地突舌230和240。这些突舌可以用于向通道112和122中的进入流体并且相应地向离开通道140和150的流体施加地电势。输入和离开包含电极板的腔的流体可以处于地电势下。
图4A和图4B更加详细地图示了图3中示出的上表面100的一些特征。图4A示出上件100的外表面,并且图4B示出该上部分100的内表面。如图4A中所示,上部分100可以包括两个输入端口110和120以及电极板210。最后,该上部分还可以包括接地突舌240。
图4B具有与这些结构相关联的拓扑结构。例如,上结构100的内表面可以具有与输入端口110相关联的通道112。该通道112可以用于将流体从输入端口110递送至混合通道130。类似地,上部分100的内表面还可以具有与第二输入端口120相关联的另一个通道122。通道122用于将通过第二端口120引入的附加材料递送至混合通道130。通道112和122的直径和长度限定微流体阻力。微流体阻力的比例用于限定分别通过输入端口110和120递送的两种流体的比率。在绘出的组件中,相比于狭窄部分更短的通道110,通道112包括更长的狭窄部分。
如先前描述的那样,混合通道130可以具有蛇形形状,这用于混合通道122的内容物与通道112的内容物。在一次性用品的该变型中,通道122的内容物与通道112的内容物通过混合室114进一步增强。混合室114提供一定体积,流体的可能层流在该体积中转变为湍流。
在一个示例性实施例中,第二输入通道110用于将核酸递送至被输入至输入通道112的细胞悬液。该核酸溶液与包含在被引至输入端口120的输入流体中的靶细胞混合。在混合通道130处,核酸与靶细胞混合,使得进入腔的流体具有这些组合的元素。
图4B中也示出电极板210的封装(footprint)。在该视图中,电极板210的下角能够示出为联接至输出端口160。
图4B中还示出金属突舌240。该突舌可以用于相应地向出口端口140和150施加地电势。从包含电极板的腔离开的流体可以处于地电势下。
图5A和图5B示出下部分200的内表面和外表面。像图4A和图4B那样,图示中包括电极以及输出端口和输入端口。并且特别地下部分200可以包括电极220及其相关联的金属突舌220,以及金属突舌230。如先前所描述的,电极板220可以用作由电极板210和电极板220形成的平行板电容器的电极板210的相对板。
最后,下表面200还可以包含出口端口140和150。如图5A中所示,出口端口150可以联接至腔的升高肩部,而出口端口140可以联接至腔的下肩部。如此,出口端口150可以用于从腔排空空气(例如,气泡)。
图6A和图6B是完成的药筒组件的平面图。图6A示出从下方观察的视图,而图6B示出从上方观察的视图。再次,应理解的是,术语“下方”和“上方”是任意的,并且可以为容易清晰保持药筒,然而,图6A被称为从下方观察的视图,图6B被称为从上方观察的视图。在任何一种情况中,药筒均示出为已组装,并且上部分100连接至下部分200。再次,组件中包括两个输入端口110和120以及出口端口140、150和160。也示出的是接地突舌230和240,以及电极板220和210。
如上文简要地描述的,一次性药筒组件10可以由比如聚苯乙烯、聚乙烯、聚丙烯或者聚碳酸酯的注射模制塑料构造。各种结构(包括电极板210和220)的轮廓可以形成在塑料材料中。此外,针对接地突舌定位区域。如图6那样,两个输入端口110和120示出为附连至上部分100,并且出口端口140和150示出为联接至下部分200。此外,接地突舌230和240在从下方观察的视图中最佳地示出。流体孔口110、120、140、150和160可以形成在注射模制塑料材料中。同时,混合通道的蛇形结构和/或搅拌器元件以及可选的混合室也可以形成在一次性用品的恰当部分中。所有金属部件(包括接地带230和240以及电极板220和210)的定位区域均可以形成在恰当元件中。注射模制的塑料可以带有用于这些部件中的每一个的安置区域。金属零件能够直接模制成该零件。替代性地,可以将胶粘剂施加至塑料材料并且可以将金属结构胶合在恰当位置中。一旦电极板220形成在下部分200中,且电极板210形成在上部分100中,就可以将上部分和下部分组装在一起。该组件可以通过激光焊接、HF焊接、等离子粘接、胶合或者适合于将两个塑料零件固定在一起的任何其它技术来固定。
在制造之后,可以将其它流体元件(比如,管道)连结至两个输入端口110和120,以及出口端口140、150和160。气动源可以联接至排出端口160。该气动元件可以用于将流体抽吸到电极之间的间隙中。
电压供给300可以联接至金属突舌210和220,以便在两个电极板210和220之间施加电压电势。然后将真空施加至出口端口140和150以及因此也施加至通道130和输入端口110,以及第二输入端口120。流体的极端在混合通道130中混合,并且允许该流体穿过腔以及电极210和220之间。在电极之间的空间已填满之后,能够施加电场。该电场在细胞膜内引发孔,从而允许核酸通过扩散或者电泳进入靶细胞。当通过出口端口160离开时,流体流包括负载有核酸的靶细胞。发生该过程的总时间将取决于应用,但可以大约为10分钟至20分钟。总的腔体积可以为大约0.05 ml至5 ml。
本发明的另一目的是一种在已经公开的一次性用品中进行细胞的电穿孔的工艺,其中,将细胞悬液作为第一流体提供至第一流体端口,并且将包括待被电穿孔至细胞中的至少一种化合物的流体作为第二流体提供至第二流体端口;通过以下方式将第一流体和第二流体按照预定混合比率提供至流体隔室:通过在第一流体端口和第二流体端口与至少一个出口端口之间施加压力差;在第一电极与第二电极之间施加电场,从而用至少一种化合物对细胞进行电穿孔;以及从流体隔室移除流体。
本发明的工艺可以以若干变型进行。为了实现自动的连续或者半连续处理,将第一流体和第二流体提供至流体隔室达到预定填装水平。可以通过测量第一电极与第二电极之间的电容(例如测量电容直到达到最大容量)来确定流体隔室的填装水平。在另一变型中,通过测量接地电极(图3中的230和240)之间的电阻来确定填装水平。此外,可以经由施加至一次性用品的压力差来控制填装水平。
在工艺的另一个变型中,在从流体隔室移除流体之后,检测电穿孔的细胞并且从流体排出电穿孔的细胞。可以进一步处理和/或培育因此浓缩的电穿孔的细胞。电穿孔的细胞的检测及其排出可以由本领域技术人员已知的用于细胞分选(比如FACS或者磁性分选)的方法来完成。另一方面,可以将未电穿孔的细胞(从电穿孔的细胞排出)提供至另一个电穿孔工艺步骤以提高电穿孔的总产量。
在工艺的另一个变型中,在从流体隔室移除流体之后,培育电穿孔的细胞。本领域技术人员已知的任何方法均可以用于培育。在优选实施例中,如例如在WO2009072003A2和/或WO2013072288A1中公开的那样,在离心室中执行培育。对于本发明的这种变型,能够使用细胞培养的领域中已知的各种细胞培养液(培养基),包括以下培养基中的一种或者多种:DMEM、HBSS、DPBS、RPMI、Iscove's培养基、X-VIVOTM,每种培养基可选地增补有例如胎牛血清、人血清或者血清替代品,或者其它营养物或像细胞因子那样的细胞刺激物。培养基能够是像上文提及的培养基那样的标准细胞培养基,或者是特殊培养基以便例如原代人细胞培养(例如,用于内皮细胞、肝细胞或者角质成形细胞)或者干细胞(例如,树突状细胞成熟,造血干细胞扩增,角质形成细胞、间充质干细胞或者T细胞扩增)。培养基可以具有本领域中众所周知的增补物或者试剂,例如,白蛋白和转运蛋白、氨基酸和维生素、抗生素、附着因子、生长因子和细胞因子、激素或者增溶剂。各种培养基是能够商业获得的,例如从LifeTechnologies或者Sigma-Aldrich商业地获得。
能够针对已经被电穿孔的细胞类型根据需要控制和调节培育过程期间的温度。此外,可以根据需要并且如本领域技术人员已知的那样向细胞供应诸如O2、N2和CO2的气体。如果在离心室中执行细胞培育步骤,则可以在离心室的旋转期间向细胞供应细胞培养液和气体。
并未具体地限制待电穿孔的细胞类型。用本发明的方法,能够处理尤其是真核细胞,该真核细胞可以源于任何哺乳动物源或者人类源,诸如,肿瘤、血液、组织、骨髓或者细胞系。适合的是例如选自由以下细胞组成的集合的细胞类型:人类细胞、成纤维细胞、胚胎干细胞、诱导性多功能干细胞、角质形成细胞、黑素细胞、间充质干细胞、上皮细胞、T细胞、调节性T细胞、B细胞、NK细胞、神经元细胞、树突状细胞、干细胞(成人、胚胎、造血),以及源自以下组织的细胞:上皮、外胚层、内胚层、内皮、中胚层、上皮组织、基膜、脉管系统、结缔组织、纤维组织、肌肉组织、内脏肌或者平滑肌、骨骼肌、心肌、神经组织、脑、脊髓、颅神经、脊神经或者运动神经元。
本发明的装置和方法能够用于细胞的连续或者半连续电穿孔过程,可选地继之以电穿孔的细胞的培育(扩增)步骤。为了减少细胞损失和/或污染,提出一种封闭(对于环境封闭)系统。因此,本发明的另一目的是一种用于细胞的电穿孔的系统,该系统包括如所公开的一次性用品;包含细胞悬液的第一储存容器;包含包括待被电穿孔至细胞中的至少一种化合物的流体的第二储存容器;用于电穿孔的细胞的第三储存容器;泵和/或真空源;以及在储存容器与一次性用品之间提供流体连通的管道套件,其中,该系统对外部大气封闭。优选地,第三储存容器配置为培育室。如果必要,可以提供用于排出/富集的细胞碎片、洗涤流体、培育介质或者废物的其它储存容器。
术语“对外部大气封闭”指的是被配置为排斥进入系统的任何流体或者气体交换的系统,例如,通过利用比如塑料袋等封闭容器作为储存容器,并且该储存容器设有通向管道套件的机械连接器(比如,Luer连接器),以及如果必要,设有恰当的无菌过滤器。就该工艺而言,术语“对外部大气封闭”指的是配置为在整个电穿孔过程期间维持无菌的系统。
尽管已经结合上文概述的示例性实施方式描述了各种细节,但在回顾上述公开时,各种替代方案、修改、变型、改进和/或实质上的等价物(不论已知还是目前尚未或可能未预见到),可以变得显而易见。此外,与具体方法、尺寸、材料使用、形状、制造技术等有关的细节旨在是仅说明性的,并且本发明不限于这些实施例。诸如顶部、底部、左、右、后、前等描述语是任意的,因为应当理解的是,可以以任何取向执行系统和方法。因此,上文陈述的示例性实施方式旨在是说明性的,而非限制性。
示例
由阻力通道(resistance channel)限定的混合比率
为了利用微流体通道来确定混合比率,使用磷酸盐缓冲溶液来模拟细胞悬液并且使用墨水溶液来模拟核酸溶液。如图1至图7中示出的电穿孔药筒通过连接至真空管线来填装这些溶液并且因此再次从药筒移除混合的溶液。对于若干填装步骤,已经收集了混合溶液,并且根据通过混合不同比例的缓冲剂和墨水确定的标准值来确定混合比率。
为了确定样品和标准样品的混合比率,利用光学光度计来测量墨水的吸收。将15 ml至20 ml的磷酸盐缓冲溶液填装在由短管连接至电穿孔药筒的输入端口120的袋中。填装有约3 ml至4 ml墨水的第二袋由另一短管连接至电穿孔药筒的第二输入端口110。每个管的流体由穿孔阀(punch valve)控制。蠕动泵经由另一管连接至出口端口140。泵至电穿孔药筒的连接也能够由另一穿孔阀控制。连接至出口端口160的第四管用于收集两种溶液的混合物。出口流体也由穿孔阀控制。约1 ml填装在电穿孔药筒中,并且测量每种清除的(cleared)混合物的吸收率。
如图8中所示,如果当蠕动泵启动时两个输入阀和出口阀140同时打开,则混合比率从约1:7增加至超过1:60。随着袋和输入管中的流体水平减少,流体静压力差发生变化并且因此微流体混合比率被破坏(虚线)。当蠕动泵提前生成低真空并且然后阀门打开时,我们仍观察到混合比率的增加,但更不明显。使真空进一步增加至少于-100 mbar给出1:5.1的恒定混合比率。
电穿孔
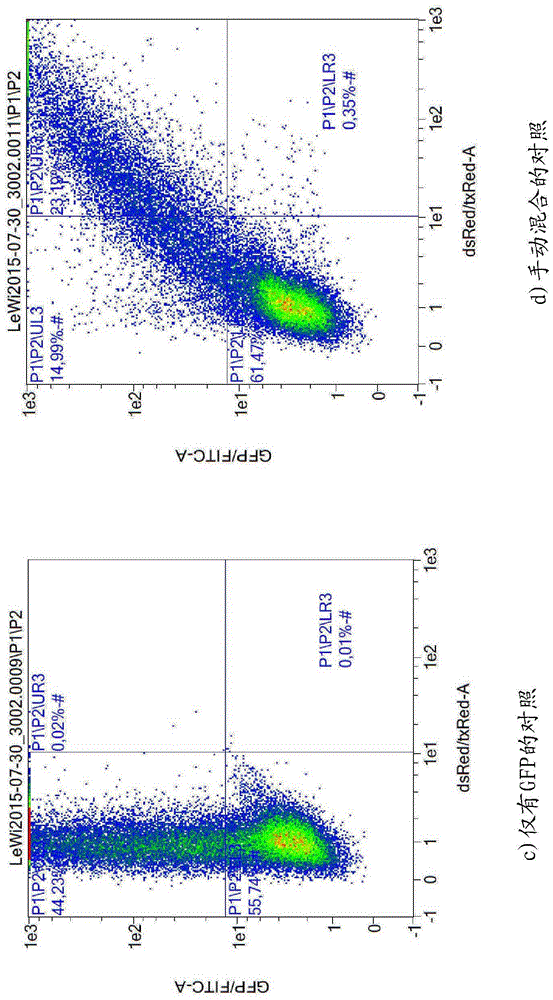
为了证明本发明的装置的可靠性,对Jurkat细胞的悬液进行电穿孔,并且在电穿孔之后,由流式细胞仪分析细胞。结果在图9a至图9g中示出,并且其中,a)没有质粒的对照(control)电穿孔,b)仅带有mCherry质粒的对照电穿孔。c)仅带有eGFP质粒的对照电穿孔。d)在电穿孔之前手动地混合mCherry和eGFP质粒的对照电穿孔。e)在没有微流体混合的情况下与mCherry质粒预先混合且随后添加eGFP质粒的细胞的电穿孔。f)通过微流体混合与添加的mCherry质粒和eGFP质粒预先混合的细胞的电穿孔。以下参照图9:
在没有任何核酸的情况下,未检测到荧光(a)。手动地混合细胞与编码红色荧光蛋白mCherry的质粒,如能够由红色荧光检测到的,约35%的细胞表达红色荧光蛋白。混合细胞与编码绿色荧光蛋白GFP的质粒,如能够由绿色荧光检测到的,约44%的细胞表达绿色荧光蛋白。当手动地将这两种质粒与细胞悬液混合时,电穿孔的细胞荧光呈红色和绿色。手动地将细胞与编码红色荧光蛋白mCherry的质粒混合并且将其施加至由短管连接至电穿孔药筒的输入端口120的袋。填装有包含编码绿色荧光蛋白GFP的质粒的溶液的第二袋由另一个短管连接至电穿孔药筒的第二输入端口110。每个管的流体由穿孔阀控制。蠕动泵经由另一个管连接至出口端口140。泵到电穿孔药筒的连接也能够由另一个穿孔阀控制。连接在出口端口160上的第四管被用于收集两种溶液的混合物。出口流体也由穿孔阀控制。约0.8 ml的细胞悬液被填装在电穿孔药筒中,继之以约0.2 ml的核酸溶液。然后施加电脉冲。在电穿孔之后,收集细胞悬液并且由流式细胞仪分析细胞。
如能够在图9e中看到的,除了表达两种荧光蛋白的细胞之外,约7%的细胞仅表达红色荧光蛋白。这些细胞未与编码绿色荧光蛋白的质粒良好地混合。接着,手动地将已使用的细胞与编码红色荧光蛋白mCherry的质粒混合并且将该混合物施加至由短管连接至电穿孔药筒的输入端口120的袋中。填装有包含编码绿色荧光蛋白GFP的质粒的溶液的第二袋由另一个短管连接至电穿孔药筒的第二输入端口110。每个管的流体由穿孔阀控制。蠕动泵经由另一个管连接至出口端口140。泵至电穿孔药筒的连接也能够由另一个穿孔阀控制。连接在出口端口160上的第四管被用于收集两种溶液的混合物。出口流体也由穿孔阀控制。利用微流体混合通道和微流体混合元件130,将约1 ml填装在电穿孔药筒中。然后施加电脉冲。在电穿孔之后,收集细胞悬液并且由流式细胞仪分析细胞。图9f)示出电穿孔的细胞表达两种荧光蛋白,表明细胞与编码绿色荧光蛋白的质粒的核酸溶液的均匀混合。
- 还没有人留言评论。精彩留言会获得点赞!