环介导的级联放大策略用于高灵敏检测DNA甲基转移酶活性的制作方法
本发明涉及酶活性检测领域,具体涉及一种环介导的级联放大策略用于高灵敏检测dna甲基转移酶活性的方法。
背景技术:
dna甲基转移酶是一种表观遗传学修饰酶,在调节基因表达、发育和基因组印记方面起重要作用。其通过在腺嘌呤或胞嘧啶上共价添加甲基而催化dna甲基化。研究表明dna甲基转移酶活性异常和疾病的产生和发展有关。显然,dna甲基转移酶活性被认为是一种潜在的癌症生物标志物和癌症治疗中的药物作用靶点。因此,灵敏检测dna甲基转移酶活性对于dna甲基转移酶相关的癌症治疗和诊断至关重要。
用于dna甲基转移酶活性检测的传统方法包括放射性标记法、凝胶电泳和高效液相色谱。为了提高检测的灵敏度和特异性,许多新的方法包括电化学、化学发光、比色和荧光方法已用于dna甲基转移酶活性检测。在这些方法中,荧光方法作为有力的生物分析工具用于dna甲基转移酶活性受到广泛的关注。通常情况下,荧光方法通过使用双链探针或含悬垂链的发夹探针用于目标物识别和信号转导。其中,信号转导链被部分地封闭在双链探针或发夹探针茎部。经dna甲基转移酶识别作用,双链探针或发夹探针释放信号转导链,且该信号转导链触发随后的信号输出过程。这种部分封闭方式会导致由探针泄漏所引起的非特异性扩增,产生假阳性信号。而在dna甲基转移酶不存在时,双链探针或发夹探针与报告探针间会发生竞争性杂交,致使非特异性背景扩增,影响检测的灵敏度和精确度。
技术实现要素:
为了解决以上问题,基于链置换放大和指数滚环扩增,我们发展了一种环介导的级联放大策略用于高灵敏荧光检测dna甲基转移酶活性。我们设计了一种长茎环探针,其包括用于dna甲基转移酶识别的甲基化位点、用于确保探针稳定的长茎部和用于引发后续放大的环部。长茎环探针中环部和小部分的茎部作为触发链用于后续的信号输出过程。该触发链被长茎部完全封闭在探针的环部,避免探针泄漏所引起的非特异性放大。长茎环探针被dna甲基转移酶甲基化,且随后被甲基化敏感型限制性内切酶特异性地切割,产生触发链。接下来,该触发链引发链置换放大和指数滚环扩增,合成大量富含g的序列。最后,其与染料选择性相互作用,获得增强的荧光信号。
本发明采用的技术方案如下:
本发明的第一个目的是提供一种用于检测dna甲基转移酶活性的长茎环探针,该探针包括长茎部和环部,所述长茎部包括紧靠环部的缓冲区域、dna甲基转移酶特异性识别位点序列和长茎部区域;其中所述缓冲区域的碱基对为1~7个。
常规茎环结构的设计是本领域技术人员熟知的技术内容,其包括茎部和环部,茎部通常是由若干个互补的碱基对构成的杂交双链dna序列,环部通常是由寡聚核酸形成的单链序列。本领域的技术人员应当知晓构成茎环结构中的环部的常规序列,优选的,本发明中环部序列的碱基数为10~25个。在本发明中的某些实施中,环部的序列可以为表1中斜体序列所示:5′-atacgactcacta-3′,但并不仅仅限于以上序列,只要能够满足成环的条件即可。
本发明的长茎环探针中,dna甲基转移酶特异性识别位点序列与环部之间的序列(即为所述的缓冲区域)是合理的长茎环探针设计的重要因素。合理的设计可以有效地降低背景信号且dna甲基转移酶存在时显著地增强荧光信号。本发明所述缓冲区域是由1~7个互补的碱基对构成的杂交双链dna序列,当大于7个时,经过限制性内切酶切割后所产生的新发夹探针相对稳定,不易发生构象转变为单链用于后续的扩增反应。优选的,所述缓冲区域的碱基对为2~5个;最优选的,所述缓冲区域的碱基对为3个。
本发明中所述的dna甲基转移酶包括dam、m.sssi、alui、haeiii或hhai甲基转移酶等。每个类型的dna甲基转移酶有其各自的甲基转移酶特异性识别位点序列,如dam甲基转移酶的识别位点序列可为5′-gatc-3′,本领域的技术人员知晓和确定每个类型的dna甲基转移酶的特异性识别位点序列。
本发明中所述的长茎部区域是由若干个互补的碱基对构成的长双链dna序列。根据本发明的长茎环探针的作用,将其设计为18~30个碱基对。长茎环探针中的环部和小部分的茎部(小部分的茎部是指缓冲区域)作为触发链用于后续的信号输出过程。该触发链被所述长茎部区域完全封闭在探针的环部以及部分茎部,避免探针泄漏所引起的非特异性放大。
优选的,所述长茎环探针序列为seqidno:1、seqidno:3、seqidno:5、seqidno:7或seqidno:9所示:
最优选的,所述探针为seqidno:5所示。
根据本发明中长茎环探针的序列介绍,其制备方法为本领域技术人员常规知晓的,可以通过序列合成公司进行合成。
本发明的第二个目的是提供上述长茎环探针在用于检测dna甲基转移酶活性或在制备用于筛选dna甲基转移酶抑制剂/拮抗剂的试剂中的应用。
本发明的第三个目的是提供一种检测dna甲基转移酶活性的方法,当待测样品中存在dna甲基转移酶时,所述长茎环探针被dna甲基转移酶甲基化,且随后被甲基化敏感型限制性内切酶特异性地切割,产生触发链;在聚合酶和切割酶的协同作用下,所产生的触发链引发链置换放大反应,产生大量引物;所产生的引物引发指数滚环扩增,合成大量g-四倍体序列;其与染料相互作用而获得增强的荧光信号。
进一步的,a、当待测样品中存在dna甲基转移酶时,所述dna甲基转移酶特异性识别和催化所述长茎环探针发生甲基化,形成具有甲基化的长茎环;
b、甲基化敏感型限制性内切酶将甲基化的长茎环切割成两部分,一部分为双链dna,另一部分为新发夹探针,所述新发夹探针结构不稳定,发生构象转变成单链dna形成触发链;
c、所述触发链与链置换模板发夹探针杂交,并在链置换扩增活性的聚合酶和切割酶的作用下引发聚合和切割反应,释放出多个引物;
d、在dna连接酶的作用下所释放的引物与挂锁探针杂交得到环状探针;
e、所释放的引物在滚环扩增活性的聚合酶作用下触发滚环扩增,合成含多个串联的富含g序列的长dna产物;
f、切割酶切割所述长dna产物和挂锁探针杂交所形成的双链dna,产生富含g的序列和所述引物,所述引物继续用于引发下级滚环扩增;
g、在金属离子的作用下,富含g的序列折叠成g-四倍体结构,其选择性与染料作用的得到增强的荧光信号,即可测得dna甲基转移酶的活性。
所述方法为非疾病诊断与治疗方法。
而当待测样品中不存在dna甲基转移酶时,长茎环探针保持原有的稳定结构,无法引发链置换放大和指数滚环扩增;则无法产生与染料相互作用的g-四倍体,致使低的背景信号。
步骤b中,所述甲基化敏感型限制性内切酶为各种类型dna甲基转移酶所对应的限制性内切酶,如dam甲基转移酶对应的甲基化敏感型限制性内切酶为dpni限制性内切酶。
步骤c中,所述链置换模板发夹探针为辅助探针,目的是引发链置换放大反应和释放滚环扩增时的引物。所述发夹探针包括茎环序列和连接在其茎部序列上的悬垂单链;其中,所述茎环序列中包括释放滚环扩增时的引物的互补序列和切割酶特异性识别序列,所述悬垂单链与触发链互补,可以进行杂交。
所述链置换扩增活性的聚合酶为klenowfragment聚合酶,也可以为其它具有链置换扩增活性的聚合酶。
对切割酶的种类并没有特殊限定,所述切割酶可为nt.bbvci酶或其它切割酶;当其为一种特定的切割酶时,那么在设计的发夹探针中的切割酶特异性识别序列与切割酶的类型相对应。
所释放出的引物序列能够特异性滚环扩增出所述挂锁探针互补序列富含g的序列。
步骤d中,所述dna连接酶为t4连接酶。
所述挂锁探针,也称扣锁探针或可成环探针或锁式探针,一种人工合成的低聚核苷酸链分子大约有70-100个碱基,形成环型分子后的挂锁探针可作为一种特定的信号源被滚环扩增法来快速放大与检测。在满足形成环型分子的基础上,本发明的挂锁探针的特点是包括若干个富含c序列,相邻的富含c序列之间为切割酶的特性识别位点序列。在本发明的某些实施例中,其序列如seqidno:13所示。
步骤e中,所述滚环扩增活性的聚合酶为phi29dna聚合酶,也可以为其它滚环扩增活性的聚合酶。
步骤f中,对切割酶的种类并没有特殊限定,所述切割酶可为nt.bbvci酶或其它切割酶。
步骤g中,所述金属离子为k+,所述染料为n-甲基卟啉二丙酸ix(nmm)。一般g-四倍体结构的形成需要一定的离子强度和ph条件下,这种条件的摸索可以常规得到。
具体包括以下操作步骤:
(1)向待测样品中加入长茎环探针和甲基化敏感型限制性内切酶进行孵育;
(2)向步骤(1)反应得到的体系中加入发夹探针、链置换扩增活性的聚合酶、切割酶和扩增原料dntps进行孵育,发生链置换反应,释放用于后续扩增的引物;然后进行酶失活;
(3)向步骤(2)反应得到的体系加入dna连接酶和挂锁探针进行孵育,所释放的引物与挂锁探针杂交得到环状探针;
(4)向步骤(3)反应得到的体系中加入滚环扩增活性的聚合酶、切割酶和扩增原料dntps进行孵育,发生滚环扩增反应;
(5)向步骤(4)反应得到的体系中加入金属离子和染料进行孵育,然后检测荧光信号。
本发明的第四个目的是提供一种进行dna甲基化转移酶抑制剂/拮抗剂筛选的方法,其特点是:加入候选抑制剂/拮抗剂和所述长茎环探针,进行孵育,然后加入dna甲基化转移酶;后续步骤与所述检测dna甲基转移酶活性的方法相同。
本发明的第五个目的是提供一种检测dna甲基转移酶活性或筛选dna甲基化转移酶抑制剂/拮抗剂的试剂盒,该试剂盒包括所述长茎环探针;
所述甲基化敏感型限制性内切酶;
链置换反应体系:包括链置换模板发夹探针、所述链置换扩增活性的聚合酶、切割酶和所述扩增原料dntps;
滚环扩增反应体系:包括用于滚环扩增的挂锁探针、所述dna连接酶、所述滚环扩增活性的聚合酶、切割酶和扩增原料dntps。
上述技术方案中的一个技术方案具有如下有益效果:
(1)基于链置换放大和指数滚环扩增,本发明发展了一种环介导的级联放大荧光策略用于高灵敏检测dna甲基转移酶活性。
(2)用于后续放大的触发链被长茎环探针的长茎部区域完全封闭,有效地避免探针泄漏所引起的非特异性扩增。
(3)通过链置换放大和指数滚环扩增相结合,该方法可灵敏检测dna甲基转移酶,检测限能达到8.1×10-5u/ml,低于大多数报道的dna甲基转移酶活性检测方法。
(4)此外,该方法能够很好的区分dam甲基转移酶与其他甲基转移酶,具有良好的选择性。
(5)此外,该方法成功的用于评估抑制剂对dna甲基转移酶活性的抑制作用,尤其是成功的使用两种抗菌药物(庆大霉素和青霉素g)和一种抗癌药物(5-氟尿嘧啶)用于评估dna甲基转移酶的抑制作用。结果表明,通过有效的结合长茎环探针设计和环介导的级联放大策略,该系统在早期癌症诊断和治疗中具有潜在的应用。
附图说明
图1:环介导的级联放大策略用于高灵敏检测dam甲基转移酶活性的原理。
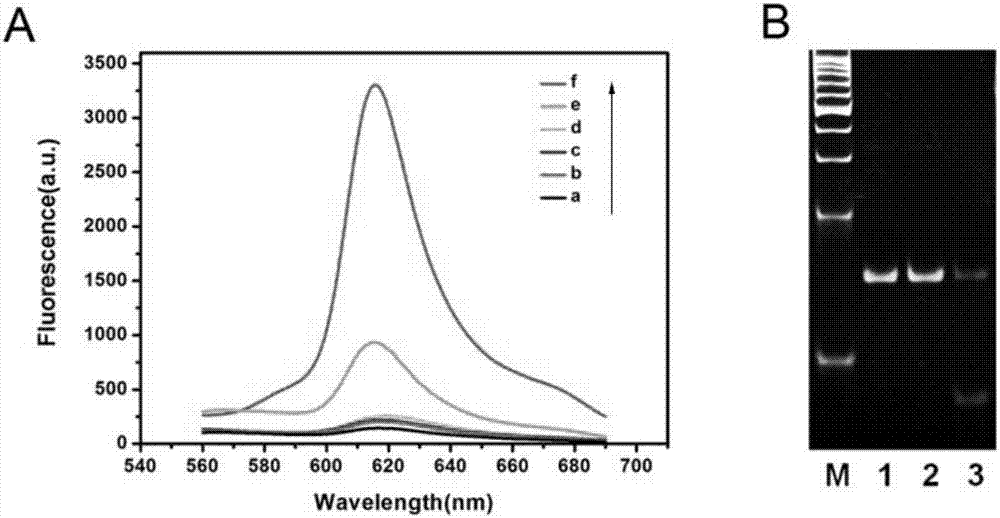
图2:(a)不同条件下,dam甲基转移酶检测策略的荧光发射光谱。(b)聚丙烯酰胺凝胶电泳表征分析dam甲基转移酶。1-3条带分别是长茎环探针、dpni+长茎环探针和dam+dpni+长茎环探针。
图3:缓冲区域长度对f/f0的影响。
图4a和图4b:dam甲基转移酶与δf的线性关系。
图5:不同甲基转移酶对荧光强度的影响。
图6:(a)1μm三种抑制剂对甲基转移酶活性的抑制作用;(b)不同浓度的5-氟尿嘧啶对甲基转移酶活性的抑制作用。
具体实施方式
下面结合实施例和附图对本发明进一步说明。
本发明的试剂和仪器的说明如下:
dam、m.sssi、haeiii、hhai和alui甲基转移酶、dpni限制性内切酶、klenowfragment(3′–5′exo-)聚合酶、nt.bbvci切割酶、s-腺苷甲硫氨酸和t4dna连接酶从neb购得。庆大霉素、青霉素g和5-氟尿嘧啶从上海生工生物技术有限公司购得。phi29dna聚合酶从fermentas获得。实验中所用化学品都为分析纯,且使用过程中无需进一步的纯化。所有的溶液均采用超纯水制备(>18.25mω·cm)。该工作中的寡核苷酸由上海生工生物技术有限公司合成和纯化,其序列在表格1中列出。
所有样品的荧光光谱测量在日立f-7000荧光分光光度仪上进行。发射光谱范围为560~690nm,激发波长为399nm。618nm处的荧光强度用于评估该传感系统的性能。激发和发射的狭缝宽度均为5nm,激发电压为700v。
表1.该工作中所使用的寡核苷酸序列
注释:探针1-6中,标注下划线的序列为长茎环探针的茎部,斜体的序列为长茎环探针的环部,探针1~6中序列(gatc)为dna甲基转移酶的识别位点。探针和发夹中的加粗显示为两者的互补杂交序列。
实施例1
1、dam甲基转移酶活性分析
向10μl甲基转移酶缓冲液(50mmnacl,10mmtris-hcl,10mmmgcl2,1mmdithiothreitol,ph7.5)中加入160μmsam(sam为辅助因子)、20nm长茎环探针、2udpni和不同量的dam甲基转移酶,37℃孵育2h。随后,向上述混合液中加入40nm发夹探针、1uklenowfragment(3′–5′exo-)、2unt.bbvci和0.6mmdntps和1×cutsmart(50mmkac,20mmtris-hac,10mmmg(ac)2,100μg/mlbsa,ph7.9),37℃孵育30min。将反应系统于85℃加热20min使酶失活,然后缓慢冷却至30℃。之后,向反应混合液中加入120ut4dna连接酶、800nm挂锁探针和1×t4ligasebuffer(50mmtris-hcl,10mmmgcl2,10mmdithiothreitol,1mmatp,ph7.5),37℃孵育1h。随后加入1mmdntps、3uphi29dna聚合酶、4unt.bbvci和1×cutsmart,37℃孵育3h。将反应系统于75℃加热20min使酶失活,然后缓慢冷却至30℃。最后,加入200nmkcl和3μmnmm,37℃孵育30min。
2、凝胶电泳分析
凝胶电泳实验用于验证该传感系统的可行性。制备好的样品和1×loadingbuffer混合,然后使用15%非变性聚丙烯酰胺凝胶电泳将裂解产物从底物中分离出。使用1×tbe(89mmtris,89mmboricacid,2.0mmedta,ph8.3)作为电泳缓冲液,在恒定电流为30ma的条件下电泳2h。凝胶使用溴化乙锭染色5min,在蒸馏水中去染色5min。
3、药物对dam甲基转移酶活性的影响
为了进一步研究该方法的抑制剂筛选能力,该工作中使用三种抑制剂,庆大霉素、青霉素g和5-氟尿嘧啶,评估了其对dam甲基转移酶活性的抑制作用。甲基化实验在10μl甲基转移酶缓冲液中进行,包含8u/mldam甲基转移酶和不同浓度的抑制剂,37℃孵育2h。剩余的步骤和上述描述的相同。dam甲基转移酶的相对活性使用下面的公式进行估算:相对活性=(f2–f0)/(f1–f0)。其中,f2和f1分别为存在或不存在抑制剂时,8u/mldam甲基转移酶的荧光强度;f0为0u/mldam甲基转移酶的荧光强度。
实施例2
1、原理分析
所提出的甲基转移酶活性分析的原理如图1所示。dam甲基转移酶存在时,其特异性地识别和催化长茎环探针发生甲基化,形成甲基化的长茎环。随后,dpni限制性内切酶特异性地将甲基化的长茎环切割成两部分。一部分为双链dna,一部分为新发夹探针。在实验条件下,新发夹探针结构不稳定,发生构象转变生成单链。在klenowfragment聚合酶和nt.bbvci作用下,该单链dna引发聚合和切割反应,释放出多个引物。t4dna连接酶作用下,所释放的引物与挂锁探针杂交得到环状探针。随后,该引物在phi29dna聚合酶作用下触发滚环扩增,合成含多个串联序列的长dna产物。接下来,nt.bbvci切割长dna产物和挂锁探针杂交所形成的双链,产生大量富含g的序列和引物。该引物可用于引发下级滚环扩增。通过phi29dna聚合酶和切割酶的协同作用,最终可实现指数扩增,得到丰富的富含g的序列。通过加入k+,富含g的序列折叠成g-四倍体结构,其选择性与nmm作用的得到增强的荧光信号。而dam甲基转移酶不存在时,长茎环探针保持原有的稳定结构,无法引发链置换放大和指数滚环扩增。则无法产生于nmm相互作用的g-四倍体,致使低的背景信号。该方法的优势有以下几点:(1)长茎环探针中,触发链被长茎部的完全封闭,有效地避免由探针泄漏所引起的背景信号;(2)用于链置换反应中的模板为含悬垂链的发夹探针,避免由线型模板折叠所引起的非特异性放大;(3)连接反应依赖于所产生的引物,有效地改善了特异性;(4)环状探针包含三个切割酶的识别位点和两个富含g序列的互补序列,有效地增加信号输出;(5)链置换放大和指数滚环扩增的有效结合确保了dam甲基转移酶活性分析的高灵敏度。
2、该传感系统的可行性
我们通过观察荧光发射光谱以验证该策略的可行性,如图2a所示。系统中只存在nmm时,荧光信号极弱(曲线a)。当发夹探针或dpni不存在时,荧光强度也很弱(曲线b和c),表明切割和放大反应需要dpni和发夹探针。与甲基转移酶不存在时的低荧光信号相比(曲线d),甲基转移酶加入引起增强的荧光信号(曲线e),表明甲基化和切割反应发生了,且所产生的单链dna引发后续的链置换放大和滚环扩增。与之相比,当甲基转移酶和足够的nt.bbvci加入时,荧光信号的显著增加(曲线f)。这种结果表明甲基化和切割反应发生了,且所产生的单链dna引发后续的链置换放大和指数滚环扩增。此外,聚丙烯酰胺凝胶电泳用于进一步的验证dam甲基转移酶的甲基化过程。如图2b所示,当dam甲基转移酶和dpni限制性内切酶都不存在时,只有长茎环的一条亮带(条带1),表明无甲基化和切割事件发生。当只有dpni限制性内切酶存在时,可以观察到一条相似的条带(条带2)。与之相比,当dam甲基转移酶和dpni限制性内切酶都存在时,可以观察到明亮的条带变暗且低分子量的新条带产生(条带3),表明长茎环探针发生甲基化且甲基化的探针被dpni限制性内切酶切割。实验结果和上述描述的荧光发射光谱实验结果相一致。
3、长茎环探针设计的优化
长茎环探针中,dam甲基转移酶识别位点和环部的序列长度(称为缓冲区域)是合理的长茎环探针设计的重要因素。合理的设计可以有效地降低背景信号且dam甲基转移酶存在时显著地增强荧光信号。在此,我们设计了六种具有不同缓冲区域长度的长茎环探针。如图3所示,随着缓冲区域的长度从1增加到3个碱基(探针1、探针2和探针3),传感系统的f/f0逐渐地增加,表明缓冲区域长度的增加利于dam甲基转移酶识别碱基对的杂交,以促进高效的酶反应。然而,当缓冲区域的长度进一步的从4增加到7个碱基(探针4、探针5和探针6),f/f0降低,表明经dpni限制性内切酶切割后所产生的新发夹探针相对稳定,不易发生构象转变为单链用于后续扩增反应。因此,我们选择3个碱基长度的缓冲区域为最优的设计。
4、该传感系统的分析性能
为了评估该方法的分析性能,我们在最优条件下测量了不同浓度的dam甲基转移酶。如图4a所示,随着dam甲基转移酶浓度的增加,荧光强度增加。这和事实相一致,更高浓度的dam甲基转移酶可以产生更多的g-四倍体结构。所产生的g-四倍体结构与nmm作用,产生增强的荧光强度。当dam甲基转移酶浓度高于1.0×10-2u/ml时,荧光强度增长速度变小。其原因为,dam甲基转移酶浓度较高时,几乎所有的探针都发生甲基化。如图4b的内插图所示,净信号δf与dam甲基转移酶浓度(4.0×10-4~1.0×10-2u/ml)的对数呈线性关系,检测限为8.1×10-5u/ml,检测限低于现有报道的大多数检测限。表明该方法是一种有效的检测dam甲基转移酶活性的方法。该方法令人满意的灵敏度可能归因于以下两个因素:(1)长茎环探针的低背景泄漏;(2)链置换放大和连接反应改善的特异性;(3)链置换反应和指数滚环扩增的高放大效率。
5、选择性
为了考察该方法的选择性,我们选择四种不同的甲基转移酶作为潜在的干扰酶,包括m.sssi、alui、haeiii和hhai甲基转移酶,其识别序列分别为5′-ccgg-3′、5′-agct-3′、5′-ggcc-3′和5′-gcgc-3′。如图5所示,8u/mldam甲基转移酶可以诱导显著的荧光强度增加。相反,其余的甲基转移酶不能诱导显著的荧光强度变化。该结果表明该方法对于dam甲基转移酶具有良好的选择性。
精密度和重现性是衡量分析方法实际应用的重要参数,我们通过计算日内和日间实验的相对标准偏差(rsd)来评估方法的精密度和重现性(n=3)。选择的高、中、低三个浓度分别为8.0×10-4u/ml、2.0×10-3u/ml和8.0×10-3u/ml。日内rsd分别为3.2%、2.8%和1.2%。相同浓度下,日间rsd分别为4.6%、2.8%和2.2%。这些结果表明该方法具有可接受的精密度和重现性。
6、复杂生物样品的分析
为了评估该方法在复杂生物样品中的实际应用,对10%稀释的人血清样品加标不同浓度的dam甲基转移酶进行了考察。选择的高、中、低三个浓度分别为8.0×10-4u/ml、2.0×10-3u/ml和8.0×10-3u/ml。其回收率分别为98.7%、95%和98.7%,且rsd分别为4.1%、3.0%和2.6%。这些结果表明,该方法在复杂生物样品中准确定量dam甲基转移酶方面具有很大的潜力。
7、dna甲基转移酶活性的抑制评估
为了评估该方法潜在的抑制剂筛选能力,我们选择庆大霉素、青霉素g和5-氟尿嘧啶为典型的甲基转移酶抑制剂。如图6a所示,1μm三种抑制剂中,5-氟尿嘧啶由于具有高毒性而对dam甲基转移酶具有更好的抑制效率。且从图6b可看出,随5-氟尿嘧啶浓度增加,系统相对活性降低。5-氟尿嘧啶的ic50值(降低50%酶活性所需的抑制剂浓度)约为0.8μm。这些结果表明,该方法在研究抗癌药物对dna甲基转移酶活性的抑制影响和筛选dna甲基转移酶抑制剂方面具有潜在的应用。
总结:
简而言之,基于链置换放大和指数滚环扩增,我们发展了一种环介导的级联放大荧光策略用于高灵敏检测dam甲基转移酶活性。用于后续放大的触发链被长茎环探针的长茎部完全封闭,有效地避免探针泄漏所引起的非特异性扩增。通过链置换放大和指数滚环扩增相结合,该方法可灵敏检测dam甲基转移酶,检测限为8.1×10-5u/ml,低于大多数报道的dna甲基转移酶活性检测方法。此外,该方法能够很好的区分dam甲基转移酶与其他甲基转移酶,具有良好的选择性。此外,该方法成果的用于评估抑制剂对dna甲基转移酶活性的抑制作用。上述结果表明,该系统在早期癌症诊断和治疗中具有潜在的应用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!