一种基于含氮杂环硫醇配体的一价铜化合物及其制备方法与应用与流程
本发明属于催化化学技术领域,涉及一种基于含氮杂环硫醇配体的一价铜化合物以及制备方法与应用。
背景技术:
醇的选择性氧化所产生的羰基类化合物,广泛用于化学化工、农药、医药等领域。它们主要的合成工艺有利用无机氧化物对醇的氧化、金属催化的有氧氧化等,然而这些方法本身存在不足之处,如原子利用率较低、产生大量有毒有害的废弃物,容易造成环境污染等缺点。为了克服上述缺点,越来越多的研究都集中在利用过渡金属催化剂催化的醇的无受体脱氢反应来实现羰基类化合物的绿色合成。比如,Ru、Rh、Ir等贵金属可以高效地催化醇的无受体脱氢反应,得到相应的醛或酮,但催化剂比较昂贵,成本较高。近几年来,结构精巧的PNP钳型的均相双功能Co,Fe催化剂也可以高效地催化醇的无受体脱氢反应,但此类催化剂需要具有毒性的含膦有机配体。至今,还没有见到利用含氮杂环硫醇配体一价铜化合物催化醇的无受体脱氢反应的报道。
技术实现要素:
本发明的目的是公开一种包含氮杂环硫醇配体的一价铜化合物及其制备方法以及在催化醇的无受体脱氢中的应用。
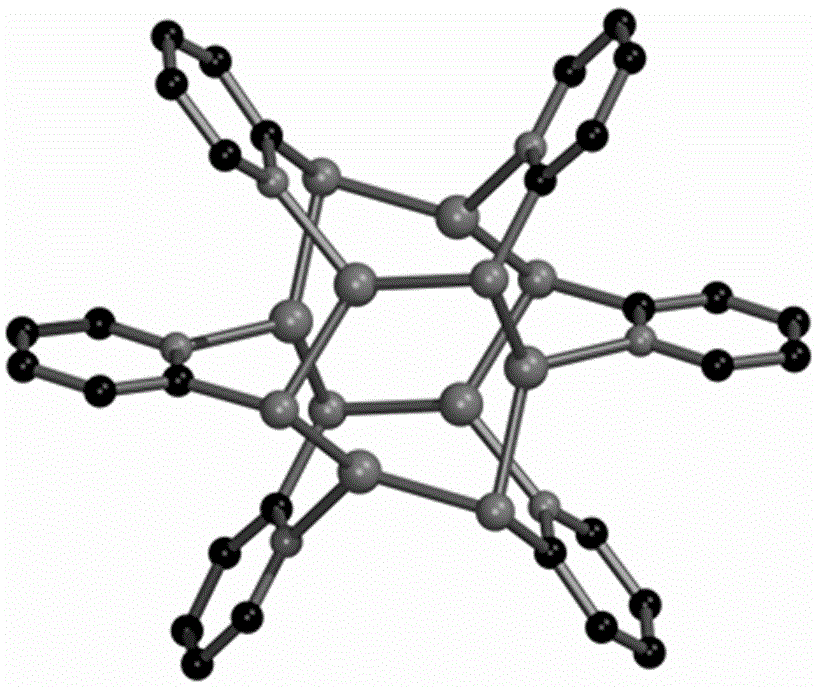
本发明公开了一种基于含氮杂环硫醇配体的一价铜化合物,其化学式为[Cu6(pyt)6],其中(pyt)6为C30H24N6S6;具有以下化学结构式:
本发明进一步公开了上述基于含氮杂环硫醇配体的一价铜化合物的制备方法,包括以下步骤,将2-巯基吡啶加入有机溶剂中,然后滴加三乙胺,得到配体液;然后在搅拌下将配体液滴加入一价铜盐溶液中,得到基于含氮杂环硫醇配体的一价铜化合物。
优选的,按照1:2的摩尔比,将碘化亚铜和2-巯基吡啶分别加入到两个含有乙腈溶剂的烧杯中,其中向含有2-巯基吡啶的烧杯中缓慢滴加三乙胺,直至配体完全溶解。在搅拌条件下,将配体的乙腈溶液缓慢滴加至含有碘化亚铜的乙腈溶液中,会有大量沉淀产生。收集沉淀,乙腈洗涤3次,无水乙醚洗涤3次,真空干燥,得到基于含氮杂环硫醇配体的一价铜化合物。
本发明的基于含氮杂环硫醇配体的一价铜化合物作为催化剂在溶剂比如甲苯溶剂中,碱存在下,比如KOH,可以高效的实现一级醇以及二级醇分别到醛和酮的转化,并且在该反应体系中底物的范围可以延伸至各种各样的二级和一级的苄基、烯丙基以及脂肪的醇化合物,催化的选择性很高,未发现过氧化的产物存在。
因此本发明公开了上述基于含氮杂环硫醇配体的一价铜化合物在催化醇的无受体脱氢反应中的应用。
优选的,所述无受体脱氢反应在稳定的氮气流下进行。
优选的,所述无受体脱氢反应在无水、无氧的甲苯溶剂中进行。
优选的,所述无受体脱氢反应以KOH为碱。
优选的,所述醇为一级醇或者二级醇;所述基于含氮杂环硫醇配体的一价铜化合物的用量为醇摩尔量的10%。
进一步的,醇的无受体脱氢反应可以制备羰基化合物,因此本发明公开了上述基于含氮杂环硫醇配体的一价铜化合物在制备羰基化合物中的应用。
本发明还公开了一种醇无受体脱氢反应的方法,在基于含氮杂环硫醇配体的一价铜化合物催化下,醇进行无受体脱氢反应;所述基于含氮杂环硫醇配体的一价铜化合物的化学式为C30H24N6S6。优选的,氮气气氛中,在碱存在下,在有机溶剂中,在基于含氮杂环硫醇配体的一价铜化合物催化下,醇进行无受体脱氢反应;所述醇为一级醇或者二级醇。
本发明还公开了一种羰基化合物的制备方法,在基于含氮杂环硫醇配体的一价铜化合物催化下,醇进行无受体脱氢反应制备羰基化合物;所述基于含氮杂环硫醇配体的一价铜化合物的化学式为C30H24N6S6;所述醇为一级醇或者二级醇。优选的,氮气气氛中,在碱存在下,以醇为反应物,基于含氮杂环硫醇配体的一价铜化合物为催化剂,在有机溶剂中进行无受体脱氢反应制备羰基化合物。
与现有技术相比,本发明具有下列优点:本发明首次公开了一种一价铜化合物[Cu6(pyt)6]的简单合成方法,以2-巯基吡啶Hpyt、三乙胺、碘化亚铜为试剂,在乙腈中反应得到,滴加完成即反应完成,具有合成时间短、成本低、操作简单等优点。以本发明的铜化合物C30H24N6S6作为催化剂,可以高效地实现一级和二级的苄基、烯丙基以及脂肪的醇化合物分别到相应醛和酮的转化,并且催化的选择性很高。
附图说明
图1为C30H24N6S6的其结构示意图;
图2为C30H24N6S6的X射线衍射图。
具体实施方式
下面将结合具体的实施例对本发明做出进一步的描述。除非另有说明,下列实施例中所使用的试剂、材料、仪器等均可通过商业手段获得。
实施例1:[Cu6(pyt)6]的制备
将2-巯基吡啶Hpyt(222mg,2.0 mmol)加入到含有10 mL乙腈的烧杯中,在不断搅拌的条件下,缓慢滴加三乙胺,直至Hpyt完全溶解;然后将该含有配体的乙腈溶液缓慢滴加至10 mL 含有碘化亚铜(190 mg,1.0 mmol)的乙腈溶液中,不断搅拌,有大量橙红色沉淀析出。收集沉淀,乙腈洗涤3次,无水乙醚洗涤3次,真空干燥,得到产物基于含氮杂环硫醇配体的一价铜化合物为C30H24N6S6,图1为其结构示意图,图2为其X射线衍射图;产率91%;元素分析(%):C30H24N6S6Cu6,简称[Cu6(pyt)6],理论值:C, 34.57; H, 2.32; N, 8.06%;实验值:C, 34.51; H, 2.436; N, 8.261%;红外光谱(KBr压片,cm-1):1577 (s), 1548 (m), 1449 (s), 1414 (s), 1267 (w), 1149 (w), 1125 (s), 1084 (w), 1046 (w), 1000 (w), 755 (s), 721 (m), 489 (w)。
实施例2:[Cu6(pyt)6]催化二苯甲醇的无受体脱氢
在手套箱中,将二苯甲醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物二苯甲酮(产率94%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.81 (d, J = 7.5 Hz, 4H), 7.59 (t, J = 7.3 Hz, 2H), 7.49 (t, J = 7.6 Hz, 4H). 13C NMR (151 MHz, CDCl3, ppm): δ 196.7, 137.6, 132.4, 130.0, 128.2。
实施例3:[Cu6(pyt)6] 催化1-苯乙醇的无受体脱氢
在手套箱中,将1-苯乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物苯乙酮(产率92%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.95 (d, J = 7.3 Hz, 2H), 7.56 (t, J = 6.8 Hz, 1H), 7.46 (d, J = 7.4 Hz, 2H), 2.60 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 198.2, 137.2, 133.2, 128.6, 128.4, 26.7。
实施例4:[Cu6(pyt)6] 催化对甲基-1-苯乙醇的无受体脱氢
在手套箱中,将对甲基-1-苯乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物对甲基苯乙酮(产率95%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.86 (d, J = 7.7 Hz, 2H), 7.26 (d, J = 7.5 Hz, 2H), 2.58 (s, 3H), 2.41 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 196.7, 163.5, 130.6, 130.3, 113.7, 55.5, 26.3。
实施例5:[Cu6(pyt)6] 催化对甲氧基-1-苯乙醇的无受体脱氢
在手套箱中,将对甲氧基-1-苯乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物对甲氧基苯乙酮(产率96%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.93 (d, J = 8.5 Hz, 2H), 6.93 (d, J = 8.5 Hz, 2H), 3.86 (s, 3H), 2.55 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 197.8, 144.0, 134.8, 129.3, 128.5, 26.6, 21.7。
实施例6:[Cu6(pyt)6] 催化对二甲氨基-1-苯乙醇的无受体脱氢
在手套箱中,将对二甲氨基-1-苯乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物对二甲氨基苯乙酮(产率97%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.87 (d, J = 8.7 Hz, 2H), 6.66 (d, J = 8.7 Hz, 2H), 3.05 (s, 6H), 2.51 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 196.4, 153.3, 130.5, 125.5, 110.8, 40.1, 26.0。
实施例7:[Cu6(pyt)6] 催化对氯-1-苯乙醇的无受体脱氢
在手套箱中,将对氯-1-苯乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物对氯苯乙酮(产率72%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.86 (d, J = 8.3 Hz, 2H), 7.40 (d, J = 8.2 Hz, 2H), 2.56 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 196.8, 139.5, 135.4, 129.7, 128.9, 26.5。
实施例8:[Cu6(pyt)6] 催化对溴-1-苯乙醇的无受体脱氢
在手套箱中,将对溴-1-苯乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物对溴苯乙酮(产率83%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.81 (d, J = 8.3 Hz, 2H), 7.60 (d, J = 8.3 Hz, 2H), 2.58 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 197.1, 136.0, 132.0, 130.0, 128.4, 26.7。
实施例9:[Cu6(pyt)6] 催化间甲基-1-苯乙醇的无受体脱氢
在手套箱中,将间甲基-1-苯乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物间甲基苯乙酮(产率93%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.75 (d, J = 10.7 Hz, 2H), 7.42 – 7.29 (m, 2H), 2.59 (s, 3H), 2.41 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 198.4, 138.3, 137.2, 133.9, 128.8, 128.4, 125.6, 26.7, 21.3。
实施例10:[Cu6(pyt)6] 催化邻甲基-1-苯乙醇的无受体脱氢
在手套箱中,将邻甲基-1-苯乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物邻甲基苯乙酮(产率89%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.69 (d, J = 7.6 Hz, 1H), 7.37 (t, J = 7.4 Hz, 1H), 7.25 (dd, J = 11.4, 7.7 Hz, 2H), 2.58 (s, 3H), 2.53 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 201.7, 138.4, 137.6, 132.0, 131.5, 129.3, 125.7, 29.5, 21.6。
实施例11:[Cu6(pyt)6] 催化邻氨基-1-苯乙醇的无受体脱氢
在手套箱中,将邻氨基-1-苯乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物邻氨基苯乙酮(产率81%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.71 (d, J = 8.1 Hz, 1H), 7.26 (t, J = 7.5 Hz, 1H), 6.65 (d, J = 6.1 Hz, 2H), 6.15 (s, 2H), 2.57 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 200.5, 150.2, 134.4, 132.0, 118.3, 117.2, 115.8, 27.8。
实施例12:[Cu6(pyt)6] 催化1-苯丙醇的无受体脱氢
在手套箱中,将1-苯丙醇 (1.0 mmol)、[Cu6(pyt)6] (0.08 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物1-苯丙酮(产率86%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 7.95 (d, J = 7.4 Hz, 2H), 7.52 (d, J = 7.3 Hz, 1H), 7.44 (t, J = 6.9 Hz, 2H), 2.99 (q, J = 7.0 Hz, 2H), 1.22 (t, J = 7.1 Hz, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 200.7, 136.9, 132.9, 128.5, 128.0, 31.8, 8.2。
实施例13:[Cu6(pyt)6] 催化1-茚醇的无受体脱氢
在手套箱中,将1-茚醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物1-茚酮(产率85%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3 ppm): δ 7.76 (d, J= 7.6 Hz, 1H), 7.58 (t, J = 7.3 Hz, 1H), 7.48 (d, J = 7.6 Hz, 1H), 7.37 (t, J= 7.3 Hz, 1H), 3.17 – 3.11 (m, 2H), 2.71 – 2.65 (m, 2H). 13C NMR (151 MHz, CDCl3, ppm): δ 207.0, 155.1, 137.1, 134.6, 127.3, 126.7, 123.7, 36.2, 25.8。
实施例14:[Cu6(pyt)6] 催化2-茚醇的无受体脱氢
在手套箱中,将2-茚醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物2-茚酮(产率78%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3 ppm): δ 7.28 (d, J= 6.2 Hz, 4H), 3.56 (s, 4H). 13C NMR (151 MHz, CDCl3, ppm): δ 215.1, 137.8, 127.4, 125.0, 44.1。
实施例15:[Cu6(pyt)6] 催化环己醇的无受体脱氢
在手套箱中,将环己醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物环己酮(产率71%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 2.34 (t, J = 6.3 Hz, 4H), 1.86 (d, J = 5.6 Hz, 4H), 1.73 (d, J = 4.5 Hz, 2H). 13C NMR (151 MHz, CDCl3, ppm): δ 212.2, 42.0, 27.1, 25.0。
实施例16:[Cu6(pyt)6] 催化2-噻吩乙醇的无受体脱氢
在手套箱中,将2-噻吩乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物2-乙酰基噻吩(产率77%)。
所得催化产物的核磁谱分析数据:1H NMR (600 MHz, CDCl3, ppm): δ 7.70 (dd, J = 3.8, 1.0 Hz, 1H), 7.64 (dd, J = 4.9, 1.0 Hz, 1H), 7.13 (dd, J = 4.9, 3.8 Hz, 1H), 2.57 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 190.7, 144.6, 133.8, 132.5, 128.1, 26.9。
实施例17:[Cu6(pyt)6] 催化3-吡啶乙醇的无受体脱氢
在手套箱中,将3-吡啶乙醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物3-乙酰基吡啶(产率74%)。
所得催化产物的核磁谱分析数据:1H NMR (600 MHz, CDCl3, ppm): δ 9.17 (d, J = 1.7 Hz, 1H), 8.79 (dd, J = 4.8, 1.5 Hz, 1H), 8.24 (dt, J = 7.9, 1.9 Hz, 1H), 7.44 (dd, J = 7.9, 4.9 Hz, 1H), 2.65 (s, 3H). 13C NMR (151 MHz, CDCl3, ppm): δ 196.7, 153.5, 149.9, 135.5, 132.3, 123.6, 26.7。
实施例18:[Cu6(pyt)6] 催化苯甲醇的无受体脱氢
在手套箱中,将苯甲醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物苯甲醛(产率86%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 9.99 (s, 1H), 7.86 (d, J = 8.2 Hz, 2H), 7.63 – 7.57 (m, J = 8.2 Hz, 1H), 7.50 (t, J = 7.5 Hz, 2H). 13C NMR (101 MHz, CDCl3, ppm): δ 192.5, 136.5, 134.6, 129.8, 129.1。
实施例19:[Cu6(pyt)6] 催化对甲基苯甲醇的无受体脱氢
在手套箱中,将对甲基苯甲醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物对甲基苯甲醛(产率90%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 9.96 (s, 1H), 7.77 (d, J = 8.0 Hz, 2H), 7.33 (d, J = 7.9 Hz, 2H), 2.44 (s, 3H). 13C NMR (101 MHz, CDCl3, ppm): δ137.3, 135.3, 129.1, 127.9, 71.8, 21.2。
实施例20:[Cu6(pyt)6] 催化对甲氧基苯甲醇的无受体脱氢
在手套箱中,将对甲氧基苯甲醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物对甲氧基苯甲醛(产率92%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 9.73 (s, 1H), 7.68 (d, J = 12.0 Hz, 2H), 6.86 (d, J = 12.0 Hz, 2H), 3.73 (s, 3H). 13C NMR (151 MHz, DMSO-d6, ppm): δ 185.9, 159.8, 127.1, 125.1, 109.5, 50.7。
实施例21:[Cu6(pyt)6] 催化对叔丁基苯甲醇的无受体脱氢
在手套箱中,将对叔丁基苯甲醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物对叔丁基苯甲醛(产率88%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, DMSO-d6, ppm): δ 9.97 (s, 1H), 7.84 (d, J = 8.1 Hz, 2H), 7.63 (d, J = 7.8 Hz, 2H), 1.31 (s, 9H). 13C NMR (151 MHz, CDCl3, ppm): δ 192.6, 157.8, 134.0, 129.48, 126.0, 35.0, 30.7。
实施例22:[Cu6(pyt)6] 催化对溴苯甲醇的无受体脱氢
在手套箱中,将对溴苯甲醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物对溴苯甲醛(产率83%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, DMSO-d6, ppm): δ 9.99 (s, 1H), 7.87 – 7.81 (m, 4H). 13C NMR (151 MHz, DMSO-d6, ppm): δ 192.8, 135.6, 132.7, 131.7, 129.1。
实施例23:[Cu6(pyt)6] 催化邻甲基苯甲醇的无受体脱氢
在手套箱中,将邻甲基苯甲醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物邻甲基苯甲醛(产率80%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, DMSO-d6, ppm): δ 10.23 (s, 1H), 7.82 (d, J = 7.5 Hz, 1H), 7.55 (t, J = 7.3 Hz, 1H), 7.41 (t, J = 7.4 Hz, 1H), 7.33 (d, J = 7.5 Hz, 1H), 2.61 (s, 3H). 13C NMR (101 MHz, DMSO-d6, ppm): δ 193.3, 140.1, 133.9, 133.7, 131.7, 131.3, 126.4, 18.9。
实施例24:[Cu6(pyt)6] 催化间甲基苯甲醇的无受体脱氢
在手套箱中,将间甲基苯甲醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物间甲基苯甲醛(产率80%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 9.96 (s, 1H), 7.66 (d, J = 5.2 Hz, 2H), 7.39 (t, J = 7.5 Hz, 2H), 2.41 (s, 3H). 13C NMR (101 MHz, CDCl3, ppm): δ 192.6, 138.9, 136.5, 135.3, 130.0, 128.9, 127.2, 21.2。
实施例25:[Cu6(pyt)6] 催化1-萘甲醇的无受体脱氢
在手套箱中,将1-萘甲醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物间1-萘甲醛(产率87%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, DMSO-d6, ppm): δ 10.37 (s, 1H), 9.16 (d, J = 8.5 Hz, 1H), 8.20 (d, J = 8.2 Hz, 1H), 8.11 (d, J = 7.0 Hz, 1H), 8.01 (d, J = 8.1 Hz, 1H), 7.68 (q, J = 7.2 Hz, 2H), 7.60 (t, J = 7.5 Hz, 1H). 13C NMR (151 MHz, DMSO-d6, ppm): δ 194.1, 136.6, 135.1, 133.2, 130.8, 129.7, 128.9, 128.6, 126.8, 125.2, 124.1。
实施例26:[Cu6(pyt)6] 催化胡椒醇的无受体脱氢
在手套箱中,将胡椒醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物间胡椒醛(产率94%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, DMSO-d6, ppm): δ 9.80 (s, 1H), 7.53 (d, J = 7.9 Hz, 1H), 7.31 (s, 1H), 7.13 (d, J = 7.9 Hz, 1H), 6.17 (s, 2H). 13C NMR (151 MHz, DMSO-d6, ppm): δ 191.3 153.2, 148.8, 131.9, 128.9, 109.0, 106.7, 102.8。
实施例27:[Cu6(pyt)6] 催化肉桂醇的无受体脱氢
在手套箱中,将肉桂醇 (1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于70℃下反应24 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物肉桂醛(产率85%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, DMSO-d6, ppm): δ 9.68 (d, J = 7.8 Hz, 1H), 7.74 (dd, J = 9.6, 6.0 Hz, 3H), 7.50 – 7.45 (m, 3H), 6.88 (dd, J = 16.0, 7.8 Hz, 1H). 13C NMR (151 MHz, DMSO-d6, ppm): δ194.6, 153.6, 134.5, 131.6, 129.5, 129.2, 128.9。
实施例28:[Cu6(pyt)6] 催化苯乙醇的无受体脱氢
在手套箱中,将苯乙醇(1.0 mmol)、[Cu6(pyt)6] (0.1 mmol)、KOH (1.0 mmol) 加入到装有磁力搅拌子的具支试管中,然后加入2.0 mL干的甲苯溶剂。密闭反应管后,拿出手套箱。向支管口通入小而稳定的氮气流,等气流稳定后,于100℃下反应48 h;反应结束后,用乙酸乙酯萃取(3×5 mL),合并有机相,用无水硫酸钠干燥,过滤,用旋转蒸发仪浓缩滤液后,再用硅胶色谱柱法进行分离纯化,得到目标产物苯乙醛(产率78%)。
所得催化产物的核磁谱分析数据:1H NMR (400 MHz, CDCl3, ppm): δ 9.71 (s, 1H), 7.36 (t, J = 7.3 Hz, 2H), 7.29 (s, 1H), 7.19 (s, 2H), 3.66 (s, 2H). 13C NMR (151 MHz, CDCl3, ppm): δ 199.5, 131.9, 129.7, 129.0, 127.4, 50.5。
- 还没有人留言评论。精彩留言会获得点赞!