一种诱导脱矿牙釉质再矿化的短肽及其应用的制作方法
本发明属于牙釉质仿生矿化领域,涉及一种短肽及其作为诱导脱矿牙釉质再矿化的仿生材料的应用
背景技术:
牙体缺损是口腔中常见的疾病之一,无论是来自口腔内的菌斑产酸,或外来食物中的酸性物质,均可以导致牙体的缺损。针对这一临床问题开展具有诱导牙釉质矿化能力材料的基础研究具有重要意义和很大的临床实用前景。牙釉质主要无机成分是羟基磷灰石,还含有结合水、蛋白质、脂肪等有机物。在细菌产生的酸性物质或者外源性酸性物诸如酸性饮料的作用下,口腔内pH下降,釉质中钙离子、磷酸根离子从表面逸出脱矿,造成牙釉质缺损。唾液中的钙磷离子在适宜的条件下可以再次沉积在牙釉质的表面,形成矿化层。可见牙釉质表层的状态取决于脱矿和再矿化两者之间的平衡。利用具有诱导牙釉质矿化作用的材料改善脱矿和再矿化两者之间的平衡可以达到牙齿修复的目的。
有关诱导牙釉质矿化的材料种类繁多,例如树枝状大分子、五倍子中药类、生物凝胶等。这些材料普遍存在合成和制备工艺复杂、使用方法复杂、成本高、过量使用会造成生物毒性等问题。目前对于早期脱矿牙釉质再矿化治疗,已经投入临床应用的主要是氟化物类材料。但现有氟化物再矿化对牙釉质缺乏亲和力,氟离子在牙齿表面停留时间较短,同时存在氟过量引起氟化物中毒反应的隐患。因此研究一种对牙釉质亲和力好、具有诱导牙釉质矿化作用且使用安全方便的牙釉质修复材料具有重要意义。
技术实现要素:
本发明的目的在于针对现有技术的不足,提供一种诱导脱矿牙釉质再矿化的短肽,并证明该短肽能够靶向吸附于牙釉质表面,并诱导脱矿牙釉质再矿化,是一种使用安全的牙齿修复仿生材料。
本发明所述诱导脱矿牙釉质再矿化的短肽,命名为Peptide-7,其氨基酸序列为序列表中SEQ ID NO.1所述,序列表中的七个氨基酸依次为天冬氨酸、天冬氨酸、天冬氨酸、谷氨酸、谷氨酸、赖氨酸、半胱氨酸。该短肽的结构式如下,
上述短肽可通过本领域市场中的合成公司根据其氨基酸序列结构定制合成。合成过程使用全自动多肽合成仪,通过固相合成方法合成。
试验表明,本发明所述短肽能靶向吸附于牙釉质表面,并具有诱导早期脱矿牙釉质再矿化的作用。因此,本发明所述短肽可作为诱导脱矿牙釉质再矿化的仿生材料应用。
与现有技术相比,本发明具有以下有益效果:
1.本发明为牙齿修复提供了一种新的具有诱导脱矿牙釉质再矿化的仿生材料。
2.本发明所述短肽对羟基磷灰石有较强的吸附作用,156h存留率保持在60%以上;在偏酸性条件对羟基磷灰石有更快的吸附速度,更高的吸附量;吸附到羟基磷灰石表面后可以吸引钙磷离子,加速矿化和成核的过程,具有诱导脱矿牙釉质再矿化的作用,且形成的矿化层有良好的机械性能,从而修复缺损牙体。
3.本发明所述短肽作为诱导脱矿牙釉质再矿化的仿生材料具有良好的生物相容性,同时序列结构简单,仅为7个氨基酸序列,制备简单方便,成本低廉。
4.本发明所述短肽有效的克服了氟离子修复在口腔中不能停留较长的时间的缺点,且安全无毒,使用安全性高。
附图说明
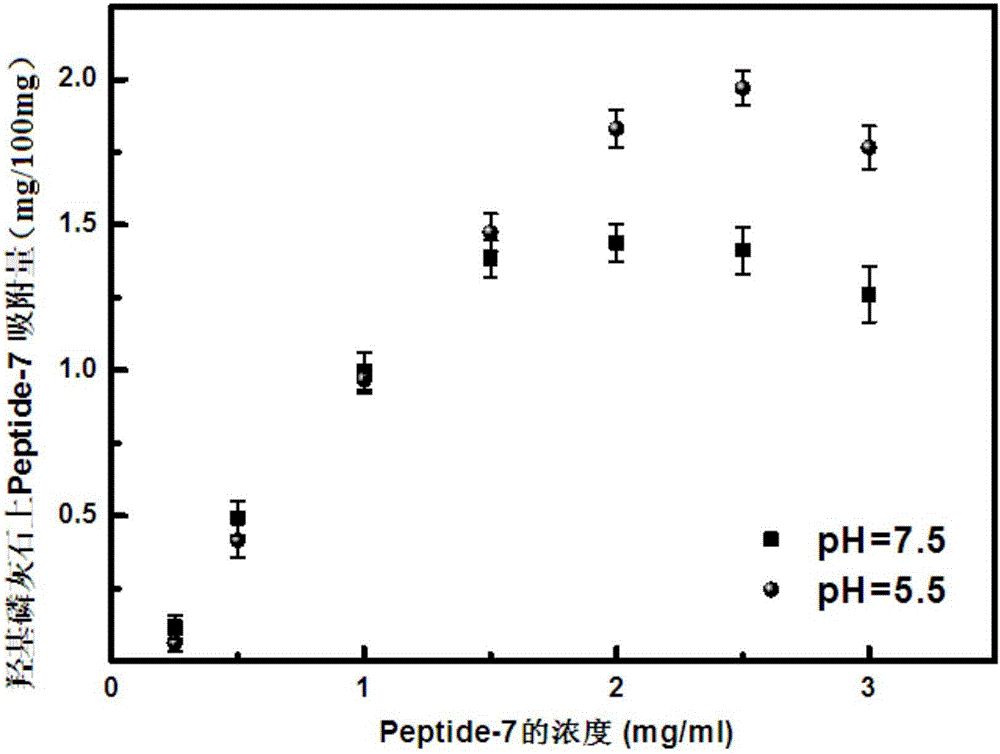
图1是在pH=5.5(人类口腔牙釉质临界脱矿pH值)和pH=7.5(人类口腔唾液中性条件pH)下Peptide-7的表观吸附量曲线;
图2是吸附在HA上的Peptide-7的释放曲线;
图3是吸附在HA上的Peptide-7QCMD微观表征中频率和耗散随时间的变化曲线(图3a为pH=7.5组,图3b为pH=5.5组);
图4是吸附在HA上的Peptide-7QCMD微观表征中Peptide-7吸附层质量随时间的变化曲线(图4a为pH=7.5组,图4b为pH=5.5组);
图5是吸附在HA上的Peptide-7QCMD微观表征中Peptide-7吸附层粘弹性的拟合图(图5a为pH=7.5组,图5b为pH=5.5组);
图6是HA表面吸附Peptide-7后诱导矿化能力的QCMD表征结果图(图6a为实验组,图6b为对照组);
图7是Peptide-7诱导脱矿牙釉质再矿化的功效评价实验后牙釉质块的SEM图(图7a1、a2为酸蚀后牙釉质组,图7b1、b2为空白处理组,图7c1、c2为Peptide-7处理组,图7d1、d2为NaF处理组);
图8是Peptide-7诱导脱矿牙釉质再矿化的功效评价实验附着力测试结果图(图8a为空白处理组,图8b为NaF处理组,图8c为Peptide-7处理组)。
图9是Peptide-7的生物安全性(细胞毒性)评价实验结果图。
图10是本发明所述短肽的高效液相色谱图。
图11为本发明所述短肽的飞行时间质谱图。
具体实施方式
下面通过实施例对本发明所述短肽及其诱导脱矿牙釉质再矿化的用途做进一步说明。
以下实施例中使用的短肽Peptide-7,其氨基酸序列为序列表中SEQ ID NO.1所述,由上海波肽公司根据其氨基酸序列定制合成,合成过程使用全自动多肽合成仪器合成,具体方法如下:
(1)称量一定量的王树脂(wang resin),使用DMF浸泡洗涤5次,将C端(羧基端)第一个氨基酸Fmoc-Cys(TRT)-OH(芴甲氧羰酰基半胱氨酸-S-三苯甲硫醚)带氨基保护基团的半胱氨酸)的羧基使用缩合剂DCC链接到王树脂上,反应24小时之后,将多余的氨基酸和DCC清洗除去,得到半胱氨酸-树脂。
(2)将上述氨基酸-树脂加入其质量30%的哌啶溶液反应10分钟,将氨基保护基团fmoc脱除。
(3)添加下一个氨基酸Fmoc-Lys(BOC)-OH(芴甲氧羰酰基赖氨酸-ε-叔丁氧羰酰基),使用bop和hobt缩合剂将这个氨基酸与半胱氨酸的氨基进行缩合,反应30分钟,反应结束后将多余的氨基酸和缩合剂用DMF清洗除去,得到半胱氨酸-赖氨酸-树脂。
按照上述步骤,根据本发明所述短肽的氨基酸序列依次逐步添加其余的氨基酸进行缩合反应,得到带本发明所述短肽的树脂,再通过三氟乙酸将接好的多肽与王树脂(wang resin)分离开,得到本发明所述短肽粗产品。将所得粗产品经高效液相色谱反复分析纯化,纯化后的产品进行飞行质谱分析,纯度在99.5%以上,其高效液相色谱图和飞行时间质谱图分别见图10、图11。
实施例1 Peptide-7表观吸附量的测定
(1)用pH=5.5(人类口腔牙釉质临界脱矿pH值)的磷酸缓冲盐溶液(PBS溶液)配制Peptide-7浓度分别为0.5mg/ml、1.0mg/ml、1.5mg/ml、2.0mg/ml、2.5mg/ml、3.0mg/ml的六种不同浓度的Peptide-7溶液。分别在10ml的离心管内加入200mg的HA粉末和2ml Peptide-7溶液,每种浓度的Peptide-7溶液设置6个平行组以减少实验误差。将不同Peptide-7浓度的各组试样在37℃下搅拌12h,1000rpm下离心3min。然后取各组试样的上清液采用紫外分光光度计进行紫外吸收测定,固定波长为Peptide-7特征波长260nm。根据表观吸附量的公式,通过吸附前和吸附后的溶液中Peptide-7的浓度变化确定HA上Peptide-7的吸附量。用origin软件绘制pH=5.5下Peptide-7的表观吸附量曲线,见图1。
表观吸附量的公式:
式中,ma:吸附质(HA)的质量;Vs:吸附剂(Peptide-7)溶液的体积;w0:吸附前吸附剂溶液的浓度;w:吸附后吸附剂溶液的浓度;x:吸附在HA表面的吸附剂总质量。
(2)使用pH=7.5(人类口腔唾液中性条件pH)的PBS溶液,进行同(1)的操作,用origin软件绘制pH=7.5下Peptide-7的表观吸附量曲线,见图1。
从图1可知,pH=5.5的酸性条件下,Peptide-7吸附量更多,为每100mg的HA粉末吸附约2mg Peptide-7;pH=7.5的中性条件下Peptide-7吸附量为每100mg的HA粉末吸附约1.5mg Peptide-7。Peptide-7浓度为2.5mg/ml时,吸附量不再随浓度的升高而上升,即达到饱和(由此确定2.5mg/ml即为后面实验的应用最高浓度),达到饱和吸附后曲线略有下降,可能为溶剂的吸附作用。应需要指出的是,此实验吸附量包括了特异性吸附(HA表面对Peptide-7的吸附)和非特异性吸附(溶液中游离的Peptide-7和已经沉积在HA表面的Peptide-7之间的作用)的总和。
实施例2 Peptide-7吸附持久性测定
取实施例1中用Peptide-7浓度为2.5mg/ml、pH为5.5和7.5两种Peptide-7溶液获得的已吸附有Peptide-7的HA粉,用去离子水初步冲洗掉残留的溶液并离心,自然干燥后分别放入10ml离心管中。配制人工唾液(CaCl2 1.5mM、KH2PO4 0.9mM、KCl 130mM、HEPES 20mM、NaN3 5mM)。分别向离心管中加入10ml人工唾液,使用半透膜(截留分子量为1000)将离心管封口后将整个离心管悬浮于装有35mL人工唾液的大离心管(规格为50ml)中透析,磁力搅拌转速设定为300rmp。按照设定的时间点12h、36h、60h、84h、108h、132h、156h取2mL透析液,每次取透析液后将10ml离心管重新置入35mL新的人工唾液中透析。释放的Peptide-7经紫外分光光度计在260nm处测试。计算累计释放量,绘制Peptide-7的释放曲线,见图2。
从图2可知,吸附有Peptide-7的HA在长达六天的人工唾液冲洗环境中,Peptide-7在pH=5.5下在HA上的脱吸附量接近0.7mg(pH=5.5时总吸附量约2mg);Peptide-7在pH=7.5下在HA上的脱吸附量接近0.5mg(pH=7.5时总吸附量约1.5mg),因此可以计算在pH=5.5和pH=7.5条件下,Peptide-7均保持了60%以上的存有率,说明Peptide-7在HA上的吸附持久性良好。由于冲洗掉的Peptide-7中非特异性吸附占得比重比特异性吸附多,可见在pH偏酸性的环境下,HA对Peptide-7的特异性吸附和非特异性吸附均较多。
实施例3 Peptide-7吸附HA的QCMD微观表征
石英微晶天平(QCMD)是一种研究微观的吸附和自组装薄膜的精密仪器,通过对石英微晶芯片的频率和耗散改变的测定,可以反映微观蛋白质吸附层的质量、厚度、粘弹性的指标。本实施例中采用的QCMD为德国3T公司旗下的产品,提供配套的镀有HA薄层的石英芯片。
实验方法:连接好石英微晶天平,在pH=7.5的条件下(组A)分别依次进行以下操作:(i)开始,通入浓度为0.3mg/ml的Peptide-7溶液;(ii)通入PBS;(iii)通入浓度为0.6mg/ml的Peptide-7溶液;(iv)通入PBS;(v)通入人工唾液;(vi)通入PBS。
在pH=7.5的条件下(组B)分别依次进行以下操作:(i)开始,通入浓度为0.1mg/ml Peptide-7溶液;(ii)通入PBS;(iii)通入浓度为0.3mg/ml Peptide-7溶液;(iv)通入PBS;(v)通入人工唾液;(vi)通入PBS。
得到数据后,使用3T-QCMD分析软件进行质量分析和频率耗散拟合分析,见图3、4、5。
从图可知,pH偏酸性的环境下HA对Peptide-7的特异性吸附和非特异性吸附均较多,且形成的Peptide-7吸附层致密,粘弹性大。
实施例4 HA表面吸附Peptide-7后诱导矿化能力的QCMD表征
实验方法:实验组使用吸附有Peptide-7的石英芯片,对照组为没有吸附Peptide-7的石英芯片。实验装置为石英微晶天平(QCMD),将实验装置连接好后,对装置内按照60ul/ml的恒定速度通入人工唾液,通入时长为12h,以模拟人一天内刷牙的间隔时长。记录频率的变化。绘制曲线后见图6。
从图6可知,吸附有Peptide-7的HA芯片在12h后频率下降的值为115.41Hz,对照组为68.73Hz,说明Peptide-7吸附在HA表面后具有加速钙盐定向沉积,提高矿化的速率的作用。
实施例5 Peptide-7诱导脱矿牙釉质再矿化的功效评价实验
收集因正畸拔除的正常磨牙,肉眼观察大小均匀、色泽相近、无龋坏、无白斑、无隐裂,于30min内除去牙根、牙髓,置于含0.1wt%麝香草酚的生理盐水溶液中于4℃保存备用。用高速硬组织切割机将牙冠切成4×4×2mm大小的牙齿块,切割釉质面暴露,其余部分用甲基丙烯酸甲酯树脂包埋。暴露面依次用800#-1200#-2400#碳化硅砂纸在流水下磨平、抛光,去除约150μm表层,以消除表面有机污染物和表面的不规则,得到实验用牙釉质块,自然干燥后置于含0.1wt%麝香草酚的生理盐水溶液中备用。人工唾液(CaCl2 1.5mM、KH2PO40.9mM、KCl 130mM、HEPES 20mM、NaN3 5mM)。
使用37%wt磷酸溶液酸蚀牙釉质块试样30s后,将试样随机分为三组:NaF处理组、Peptide-7处理组、空白处理组,将各组试样均置于等量人工唾液环境中。其中,NaF处理组使用浓度1000ppm的NaF溶液每天处理2次,Peptide-7组使用浓度2.5mg/ml的Peptide-7(pH=7.5)溶液每天处理两次,空白组使用去离子水每天处理两次,处理方式为,滴加NaF溶液、Peptide-7溶液或去离子水于牙釉质表层,10min后用去离子水冲洗。每天需更换人工唾液,矿化时间为8d。实验结束后,使用SEM表征试样的形貌,使用附着力测试表征新形成的矿化层与原牙釉质层的结合能力。实验结果见图7、8。
结果表明:通过形貌的观察,Peptide-7诱导脱矿牙釉质矿化的机理可能与F离子完全不同,形貌各异,其中NaF处理组可以见到晶体中有大量的微米级缺陷,而Peptide-7组则比较致密。新形成的矿化层和原牙釉质的结合力在58.47N左右,和F离子组63.8N没有统计学差别,说明对于Peptide-7处理后的牙釉质,新形成的矿化层与原基底层结合更加紧密,能够抵抗口腔内复杂的咀嚼和摩擦,具有很大的临床意义。
实施例6 Peptide-7生物安全性(细胞毒性)评价实验
用含10%胎牛血清培养液的DMEM培养HOK人类口腔上皮细胞。细胞贴壁生长后,更换新鲜的培养基,当细胞达到80%的聚集程度时,将细胞以104/孔的密度接种在96孔板上并培养24h。然后将培养基更换成含有不同浓度的Peptide-7(125μg/ml、250μg/ml、500μg/ml、1000μg/ml、2000μg/ml、3000μg/ml、4000μg/ml)的同类培养基,每种浓度为一个实验组,并设立对照组和空白组,各组均设立五个平行组,再次培养24h。其中,对照组为不加Peptide-7的同类培养基,空白组为不加Peptide-7和细胞的同类培养基。
细胞毒性使用CCK-8试剂盒来检测。在450nm波长下通过酶标仪测出各组吸光度。
相对细胞存活率(%)=([A]实验组-[A]空白组)/([A]对照组-[A]空白组)*100%,
其中,[A]实验组为实验组的吸光度值,[A]对照组为对照组的吸光度值,[A]空白组为空白组的吸光度值。
实验结果见图9。从图9可知,各实验组的相对细胞存活率均高,说明本发明所述Peptide-7无细胞毒性,使用安全。
序列表
<110> 四川大学
<120>一种诱导脱矿牙釉质再矿化的短肽及其应用
<160> 1
<170> PatentIn Version 3.2
<210> 1
<211> 7
<212> PRT
<213> 人工序列
<222> (1)…(5)
<400> 1
Asp Asp Asp Glu Glu Lys Cys
5
- 还没有人留言评论。精彩留言会获得点赞!