地特胰岛素晶体的洗涤方法与流程
本发明涉及地特胰岛素晶体的洗涤方法,属于地特胰岛素晶体的制备领域。
背景技术:
糖尿病已成为继心脑血管疾病、恶性肿瘤后的第三大威胁人类健康的慢性非传染性疾病。世卫组织2016年年度全球糖尿病报告中指出,中国糖尿病患病率呈爆炸式增长。2010年中国糖尿病的患病率已达到9.7%,2015年中国的糖尿病患者数量已超过1.1亿。中国每年投入超过1700亿人民币用于糖尿病管理;用于糖尿病的直接医疗支出更是占到中国医疗总支出的13%。世界卫生组织预计,若不尽快采取行动,到2040年中国的糖尿病患者将增至1.5亿人,给国人健康和社会经济带来严重影响。
地特胰岛素,即赖氨酸b29n(ε-十四酰)去(b30)人胰岛素,是第一个采用化学修饰的方法,用能与血液中的白蛋白可逆结合的脂肪酸酰化肽链上的氨基酸而产生。地特胰岛素作为一种中性的、可溶的、长效胰岛素类似物,是通过酰化作用在b29位的赖氨酸上结合了一个14碳的脂肪酸而形成。酰化的脂肪酸可稳定胰岛素分子的自身聚集,且与白蛋白可逆性结合,使地特胰岛素从皮下注射部位吸收缓慢,作用持续时间延长,在控制血糖的同时能减少低血糖的风险。地特胰岛素2004年在欧盟上市,2005年在美国上市,2013年销售额20.57亿美元,2014年销售额25.21亿美元,2015年销售额超过32亿美元,近三年年均增长超过25%。
以固态晶体形式存在的胰岛素,相比较于非结晶形式的沉淀粉末及溶液状态保存的样品,在产品稳定性、方便性方面均有优势,同时也利于后续的制剂配方设计。由于结晶体系中含有高盐、有机溶剂和其它试剂,这些物质含量远高于原料药和制剂药的质量标准,需要进行有效洗涤后才可成为合格的原料药品。根据胰岛素类产品不易溶于水的性质,同时参考中国专利cn102219851a晶体洗涤工艺,发现低速离心并使用注射用水进行洗涤,得到的晶体蛋白易碎裂,晶型均一性差,洗涤过程晶体沉降慢,部分晶体易溶解,得率低。中国专利cn102219851b,使用ph7.8浓度0.02mol/l的乙酸铵进行晶体洗涤,采用溶液替换的方法进行,洗涤过程中也发现晶体难以沉降,替换后30分钟观察沉降晶体明显减少,取晶体镜检发现地特胰岛素晶体蛋白大部分溶解且晶体破裂明显。因此,亟待开发一种新的地特胰岛素晶体的洗涤方法,将结晶后的地特胰岛素晶体蛋白高效洗涤。
技术实现要素:
本发明所要解决的技术问题是提供一种地特胰岛素晶体的洗涤方法,该方法能够将经过结晶操作后的地特胰岛素晶体蛋白高效洗涤,洗涤后的地特胰岛素晶体保持完整,样品收率高、对样品纯度无任何影响,且操作简单。
为解决上述技术问题,本发明所采取的技术方案是:
本发明公开了一种地特胰岛素晶体的洗涤方法,包括以下步骤:
(1)结晶反应完成后,将结晶溶液从结晶反应产物中移除,加入弱酸盐溶液对留下的地特胰岛素晶体进行第一次洗涤;
(2)移除第一次洗涤产生的洗涤液,加入弱酸盐溶液对留下的地特胰岛素晶体进行第二次洗涤;
(3)移除第二次洗涤产生的洗涤液,加入注射用水对留下的地特胰岛素晶体进行第三次洗涤;
(4)移除洗涤液,将地特胰岛素晶体冷冻冻干。
其中,步骤(1)或步骤(2)中所述的洗涤是将弱酸盐溶液与地特胰岛素晶体混合,搅拌,静置;步骤(3)所述的洗涤是将注射用水与地特胰岛素晶体混合,搅拌,静置;
更优选的,所述的搅拌是轻微的搅拌,所述的静置时间优选为≥2小时,更优选为2-4小时,最优选为3小时;
优选的,步骤(1)-(3)中的洗涤操作是在4-8℃的温度条件下进行洗涤。
优选的,所述的注射用水的温度为4-8℃;
为了达到更佳的洗涤效果,步骤(1)中最好将大部分或全部的结晶溶液移除,所加入的弱酸盐溶液与所移除的结晶溶液的体积相等;步骤(2)中最好也是将大部分或全部的洗涤液移除,所加入的弱酸盐溶液与所移除的洗涤液的体积相等;其中,所述的“大部分”是指占总体积的70%或以上。
步骤(3)中所所加入的注射用水的体积最好不低于第二次洗涤产生的洗涤液总体积的1/3;优选的,所加入的注射用水的体积为第二次洗涤产生的洗涤液的体积的1/3倍-1倍。
为了达到更佳的洗涤效果,可以在进行第三次洗涤后接着再进行第四次洗涤;其中,所述的第四次洗涤包括:移除第三次洗涤产生的洗涤液,加入注射用水对留下的地特胰岛素晶体进行第四次洗涤;在进行第四次洗涤后再接着进行第五次洗涤,所述的第五次洗涤包括:移除第四次洗涤产生的洗涤液,加入注射用水对留下的地特胰岛素晶体进行第五次洗涤;第四次以及第五次的洗涤方式与第三次的洗涤操作可以完全相同;如果需要进一步提高洗涤效果,还可以用注射用水作为洗涤液完全按照第三次的洗涤方法进行多次的洗涤。
优选的,在进行第四次洗涤时,所加入注射用水的体积最好不低于第二次洗涤产生的洗涤液体积的1/3;同样的,在进行第五次洗涤时,所加入注射用水的体积最好不低于第二次洗涤产生的洗涤液体积的1/3;更优选的,在进行第四次或第五次洗涤时,所加入的注射用水的体积为第二次洗涤产生的洗涤液的体积的1/3倍-1倍。
步骤(1)中所述的弱酸盐溶液的ph值为2.8-4.5,为了达到较佳的洗涤效果,所述的弱酸盐溶液的ph值优选为3.0-4.0,更优选为3.5;所述弱酸盐溶液选自磷酸盐、柠檬酸盐、碳酸盐或醋酸盐中的任意两种按照任意比例组成的混合溶液或两种以上按照任意比例组成的混合溶液;
优选的,所述弱酸盐溶液(盐溶液a)的浓度为0.02-0.06mol/l。
所述弱酸盐溶液由磷酸盐和柠檬酸盐按照任何比例组成的混合溶液;优选的,在混合溶液中,磷酸盐的浓度为0.01-0.03mol/l,柠檬酸盐的浓度为0.01-0.03mol/l;更优选的,在混合溶液中,磷酸盐的浓度为0.02mol/l,柠檬酸盐的浓度为0.015mol/l;
优选的,所述磷酸盐为磷酸氢二钠,更优选的,所述柠檬酸盐为柠檬酸铵。
步骤(2)中所述的弱酸盐溶液(盐溶液b)的ph值为4.0-7.0,为了达到更佳的效果,优选为5.0-6.0,更优选为5.6;
步骤(2)中所述弱酸盐溶液可以选自磷酸盐、柠檬酸盐、碳酸盐或醋酸盐中的任意一种或一种以上按照任意比例混合的弱酸盐溶液;优选的,所述弱酸盐溶液的浓度为0.01-0.03mol/l,所述弱酸盐溶液最好为柠檬酸盐溶液;其中,柠檬酸盐的浓度最好为0.015mol/l;所述柠檬酸盐可以为柠檬酸铵。
本发明地特胰岛素晶体的洗涤方法,将地特胰岛素结晶后的结晶溶液或洗涤液大部分都移除,然后加入下一步适量体积的洗涤溶液。本发明中被移除部分溶液的体积根据最初的结晶体积确定,剩余溶液不超过移除前溶液体积的3%,根据结晶总体积进行调整,剩余溶液越少,洗涤效果越好。
地特胰岛素结晶的方法在本领域内是已知的,例如可以参见中国专利cn104761632a中公开的方法。本发明所述地特胰岛素结晶样品为参考中国专利cn104761632a中公开的方法制备获得,因此结晶后溶液中含有地特胰岛素、酚类物质、有机溶剂、锌离子、柠檬酸三钠以及其他盐等。
具体的,地特胰岛素结晶的制备包括:(1)纯化获得纯度为99.5%地特胰岛素溶液0.7l,浓度10.4g/l;(2)称取氯化钠20.45g,柠檬酸三钠二水102.92g,6%苯酚溶液40.8ml,加水溶解并定容至2.8l,配制得到盐溶液;(3)地特胰岛素样品溶液与盐溶液混合,并用2m氢氧化钠调节ph至8.6,加入0.5m乙酸锌19.7ml,加2m盐酸调节ph至7.8,室温搅拌6小时,转移至4℃环境,静置12小时,即得。所得的晶体形态为细长型柱状晶体,长度60-100um;结晶的溶液含有约0.5mol/l钠盐,7.2%乙腈(v/v)、0.07%苯酚(w/v)。
由于不同胰岛素的性质和结构差异较大,且不同胰岛素的结晶工艺也有很大的差异,因此胰岛素的结晶样品洗涤工艺不具有普适性,而是要根据胰岛素的结构、性质、结晶环境等采用专属性的方法进行洗涤。
本发明地特胰岛素晶体的洗涤方法,通过溶液替换的方式达到洗涤晶体的效果,洗涤前后晶型没有质的差异,样品纯度没有变化、苯酚含量低至7×10-7-1.2×10-6(w/v),钠盐含量为1-2.1×10-4mmol/l,洗涤损失率为0.54-0.87%。本发明洗涤方法,用适宜缓冲液或注射用水充分洗掉晶体环境中的高盐成分和有机溶剂,使地特胰岛素晶体中盐成分和有机溶剂等含量在在原料药的质量标准范围内,且洗涤操作中样品收率稳定在99%以上,也不会降低样品纯度,将为下一步的制剂配制准备好原料。
本发明实验表明,直接采用注射用水进行地特胰岛素晶体的洗涤,晶体易溶解,晶型易破坏,不易沉降;而采用甘精胰岛素结晶后样品的洗涤操作,即用ph7.8、浓度0.2mol/l的乙酸铵进行地特胰岛素晶体的洗涤,晶体沉降慢,晶体溶解、变小、碎裂。证明,其他胰岛素的洗涤方法不适用于地特胰岛素的洗涤。
本发明技术方案与现有技术相比,具有以下有益效果:
本发明通过采用合适ph的低浓度弱酸盐进行地特胰岛素晶体的两次洗涤,用酸性或偏酸性的溶液洗涤碱性条件下析出的晶体,保持晶体的完整性,同时洗涤的损失率控制在1%以下,且样品纯度不会受到任何影响。本发明地特胰岛素晶体的洗涤方法,操作简单,可处理样品量大,所使用的洗涤溶液环保易得,后续处理简单,节省成本;而且整个洗涤过程低温可控,能够避免在洗涤过程中的样品发生不利反应,如脱氨反应等,从而避免影响样品纯度和收率,适于工业化的放大性生产。经本发明方法洗涤后的地特胰岛素晶体可直接进行冻干操作,冻干后样品可直接进行地特胰岛素制剂操作,制剂样品符合质量标准。
附图说明
图1为预备实施例制备的地特胰岛素结晶在显微镜下200倍放大图;
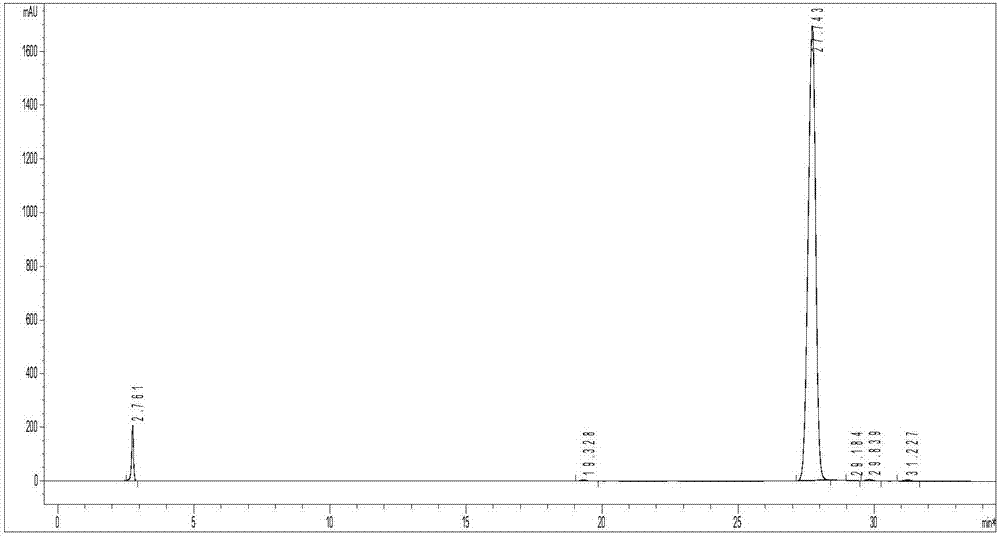
图2为预备实施例中反相收集的地特胰岛素液相检测图;
图3为实施例1洗涤后的地特胰岛素结晶在显微镜下200倍放大图;
图4为实施例2洗涤后的地特胰岛素结晶在显微镜下200倍放大图;
图5为实施例3洗涤后的地特胰岛素结晶在显微镜下200倍放大图;
图6为实施例3一次洗涤时移除的结晶上清液相检测图;
图7为实施例3完成所有洗涤步骤后的样品液相检测图;
图8实施例4洗涤后的地特胰岛素结晶在显微镜下200倍放大图;
图9实施例5洗涤后的地特胰岛素结晶在显微镜下200倍放大图;
图10实施例6洗涤后的地特胰岛素结晶在显微镜下200倍放大图。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
1、试验材料及仪器
磷酸盐等缓冲剂物质、醋酸锌和苯酚等购自sigma公司,柠檬酸三钠二水、氯化钠(nacl)购自国药集团化学试剂有限公司;火焰光度计为上海傲普at1200;分析型色谱柱(4.6mm×150mm)填料为
晶型、样品纯度、有关物质残余和洗涤损失率的检测方法:
晶体洗涤前后晶型对比通过高倍显微镜观察记录,仪器为leicadmi3000b。
晶体洗涤前后样品纯度对比采用反相层析方法对进行检测,仪器为安捷伦1260分析型高效液相,柱子采用kromasilc4-3.5μm色谱柱(4.6mm×250mm)。流动相a相:10mm无水硫酸钠-乙腈(按体积比75:25混合),采用盐酸调节ph至3.5;流动相b相:乙腈-水(按体积比55:45混合)。流速为1.0ml/min,柱温为40℃,检测波长为214nm。25-50%b相梯度洗脱35min。纯度计算采用面积归一法。
晶体洗涤后的苯酚含量可以根据液相检测结果计算(标准曲线法),钠盐含量可以采用火焰光度计检测确定。
洗涤损失率根据所有洗涤移除的上清中地特胰岛素的含量以及洗涤液体积进行统计。
预备实施例地特胰岛素晶体制备
地特胰岛素晶体均参考以下方法制备,同时下述各晶体洗涤实施例均以此预备实施例相同方法获得的样品晶体作为出发样品。
具体操作步骤:
(1)参考中国专利申请公布号cn105111305a进行样品纯化获得纯度为99.5%地特胰岛素溶液0.7l,浓度10.4g/l。
(2)配制盐溶液:称取氯化钠20.45g,柠檬酸三钠二水102.92g,6%苯酚溶液40.8ml,加水溶解并定容至2.8l。
(3)地特胰岛素样品溶液与盐溶液混合,并用2m氢氧化钠调节ph至8.6,加入0.5m乙酸锌19.7ml,加2m盐酸调节ph至7.8,室温搅拌6小时,转移至4℃环境,静置12小时。
所制备的地特胰岛素结晶见图1;反相收集的地特胰岛素液相检测结果见图2。
实施例1地特胰岛素晶体的洗涤方法
地特胰岛素晶体(预备实施例制备,下同)形态为细长型柱状晶体,长度60-100um。结晶的溶液含有约0.5mol/l钠盐,7.2%乙腈(v/v)、0.07%苯酚(w/v);参考中国专利申请公布号cn102219851a将晶体低速离心,去除大部分上清,再用冷的注射用水进行洗涤。洗涤后晶体完全溶解。
具体步骤为:
(1)低速离心:分装晶体及上清于各离心瓶中,4℃,600g,离心15min。
(2)注射用水洗涤:低速离心后样品去掉上清,采用预冷的注射用水3.5l洗涤晶体样品,晶体在加入注射用水半小时后完全溶解。
低速离心后取少量晶体镜检,晶体碎裂较多(图3)。
实施例2地特胰岛素晶体的洗涤方法
地特胰岛素晶体形态为细长型柱状晶体,长度60-100um。结晶的溶液含有约0.5mol/l钠盐,7.2%乙腈(v/v)、0.07%苯酚(w/v);参考中国专利cn102219851b进行晶体洗涤:使用ph7.8浓度0.02mol/l的乙酸铵进行晶体洗涤,结果显示晶体大部分溶解。
具体乙酸铵洗涤步骤为:
采用约3.4l乙酸铵溶液(ph7.8、0.02mol/l)等体积替换结晶溶液,乙酸铵溶液与晶体混合后轻微搅拌,静置过程发现晶体沉降慢,同时晶体变少。
静置0.5-1小时,取少量晶体镜查看晶体状态,晶体溶解、变小、碎裂(图4)。
实施例3地特胰岛素晶体的洗涤方法
地特胰岛素晶体形态为细长型柱状晶体,长度60-100um。结晶的溶液含有约0.5mol/l钠盐,7.2%乙腈(v/v)、0.07%苯酚(w/v);晶体洗涤溶液:盐溶液a为磷酸氢二钠(0.02mol/l),柠檬酸铵(0.015mol/l),ph3.5;盐溶液b为柠檬酸铵(0.015mol/l),ph5.6,第三次洗涤液至第五次洗涤液均为预冷注射用水(4-8℃)。洗涤操作都需在4-8℃冷室进行。
具体步骤为:
(1)一次洗涤:采用3.4l盐溶液a等体积替换结晶溶液,盐溶液a与晶体混合后轻微搅拌,静置3小时。
(2)二次洗涤:采用3.4l盐溶液b等体积替换一次洗涤液,盐溶液b与晶体混合后轻微搅拌,静置3小时。
(3)注射用水洗涤:采用1.8l注射用水替换二次洗涤液,注射用水与晶体混合后轻微搅拌,静置3小时。相同条件的操作重复三次,最后一次洗涤静置后,转移大部分上清即可冷冻冻干样品。
结晶后、一次洗涤前取少量晶体镜检,洗涤结束后、冻干前取少量晶体镜检,对比晶型状态,冻干后取少量冻干晶体溶解,检测纯度、钠盐、苯酚含量等指标,结果显示(图5、图6、图7):洗涤前后晶型没有质的差异,液相检测结果样品纯度没有变化、苯酚含量已低至8×10-7%(w/v),钠盐含量为1.2×10-4mmol/l,洗涤损失率为0.54%。
实施例4地特胰岛素晶体的洗涤方法
地特胰岛素晶体形态为细长型柱状晶体,长度60-100um。结晶的溶液含有约0.5mol/l钠盐,7.2%乙腈(v/v)、0.07%苯酚(w/v);晶体洗涤溶液:盐溶液a为磷酸氢二钠(0.015mol/l),醋酸钠(0.018mol/l),ph3.0;盐溶液b为醋酸钠(0.015mol/l),ph5.0,第三次洗涤液至第五次洗涤液均为预冷注射用水(4-8℃)。洗涤操作都需在4-8℃冷室进行。
具体步骤为:
(1)一次洗涤:采用3.4l盐溶液a等体积替换结晶溶液,盐溶液a与晶体混合后轻微搅拌,静置2小时。
(2)二次洗涤:采用3.4l盐溶液b等体积替换一次洗涤液,盐溶液b与晶体混合后轻微搅拌,静置2小时。
(3)注射用水洗涤:采用1.5l注射用水替换二次洗涤液,注射用水与晶体混合后轻微搅拌,静置2小时。相同条件的操作重复三次,最后一次洗涤静置后,转移大部分上清即可冷冻冻干样品。
结晶后、一次洗涤前取少量晶体镜检,洗涤结束后、冻干前取少量晶体镜检,对比晶型状态,冻干后取少量冻干晶体溶解,检测纯度、钠盐、苯酚含量等指标,结果显示(图8):洗涤前后晶型没有质的差异,液相检测结果样品纯度没有变化、苯酚含量已低至1×10-6%(w/v),钠盐含量为2×10-4mmol/l,洗涤损失率为0.87%。
实施例5地特胰岛素晶体的洗涤方法
地特胰岛素晶体形态为细长型柱状晶体,长度60-100um。结晶的溶液含有约0.5mol/l钠盐,7.2%乙腈(v/v)、0.07%苯酚(w/v);晶体洗涤溶液:盐溶液a为醋酸钠(0.02mol/l),柠檬酸铵(0.015mol/l),ph3.9,盐溶液b为柠檬酸铵(0.015mol/l),ph5.2,三次洗涤液至五次洗涤液均为预冷注射用水(4-8℃)。洗涤操作都需在4-8℃冷室进行。
具体步骤为:
(1)一次洗涤:采用3.4l盐溶液a等体积替换结晶溶液,盐溶液a与晶体混合后轻微搅拌,静置4小时。
(2)二次洗涤:采用3.4l盐溶液b等体积替换一次洗涤液,盐溶液b与晶体混合后轻微搅拌,静置4小时。
(3)注射用水洗涤:采用2.5l注射用水替换二次洗涤液,注射用水与晶体混合后轻微搅拌,静置4小时。相同条件的操作重复三次,最后一次洗涤静置后,转移大部分上清即可冷冻冻干样品。
结晶后一次洗涤前取少量晶体镜检,洗涤结束后冻干前取少量晶体镜检,对比晶型状态,冻干后取少量冻干晶体检测纯度、钠盐、苯酚含量等指标,结果显示(图9):洗涤前后晶型没有质的差异,液相检测结果样品纯度没有变化、苯酚含量已低至7×10-7%(w/v),钠盐含量为1×10-4mmol/l,洗涤损失率为0.81%。
实施例6地特胰岛素晶体的洗涤方法
地特胰岛素晶体形态为细长型柱状晶体,长度60-100um。结晶的溶液含有约0.5mol/l钠盐,7.2%乙腈(v/v)、0.07%苯酚(w/v);晶体洗涤溶液:盐溶液a为碳酸钠(0.02mol/l),柠檬酸铵(0.015mol/l),ph4.0,盐溶液b为醋酸铵(0.015mol/l),ph6.0,三次洗涤液至五次洗涤液均为预冷注射用水(4-8℃)。洗涤操作都需在4-8℃冷室进行。
具体步骤为:
(1)一次洗涤:采用3.4l盐溶液a等体积替换结晶溶液,盐溶液a与晶体混合后轻微搅拌,静置3小时。
(2)二次洗涤:采用3.4l盐溶液b等体积替换一次洗涤液,盐溶液b与晶体混合后轻微搅拌,静置3小时。
(3)注射用水洗涤:采用1.2l注射用水替换二次洗涤液,注射用水与晶体混合后轻微搅拌,静置3小时。相同条件的操作重复三次,最后一次洗涤静置后,转移大部分上清即可冷冻冻干样品。
结晶后一次洗涤前取少量晶体镜检,洗涤结束后冻干前取少量晶体镜检,对比晶型状态,冻干后取少量冻干晶体检测纯度、钠盐、苯酚含量等指标,结果显示(图10):洗涤前后晶型没有质的差异,液相检测结果样品纯度没有变化、苯酚含量已低至1.2×10-6%(w/v),钠盐含量为2.1×10-4mmol/l,洗涤损失率为0.69%。
- 还没有人留言评论。精彩留言会获得点赞!