人hsa‑miR‑124a‑3pPCR检测方法及其在DS妊娠风险预测中的应用与流程
本发明属于分子生物学技术领域,具体涉及一种人hsa-mir-124a-3ppcr检测方法及其在ds妊娠风险预测中的应用。
背景技术:
唐氏综合征(down'ssyndrome,ds)是人类最常见的一种导致新生儿智力缺陷和发育障碍的遗传性疾病,也称为21-三体综合征(trisomy21,t21)或者先天愚型,其在出生胎儿中的发病率大约为1/700,而我国ds的发生率约为(1.53-2.40)/万。大多数ds胎儿在宫内即停止发育或引发流产,因此,ds实际发病率应远高于1/700。并且随着妇女妊娠年龄的增大,尤其是我国现阶段人口生育政策的变化,大龄或高龄孕妇增多以及辅助生育技术的进一步推广和应用,ds发病率有继续升高的趋势。ds患儿除了智力缺陷外,还常伴有先天性心脏病、甲状腺疾病、精神和体格发育迟滞以及器官和组织的多发性畸形等疾病。目前,做好ds患儿的产前早期筛查,避免其出生是最有效的预防ds方案。
ds的产前检查方案主要分为无创产前检查(noninvasiveprenataltesting,nipt)和有创产前检查,其中nipt主要包括唐氏筛查和无创dna检测,有创性检查主要包括羊膜腔液体穿刺检查、绒毛膜穿刺检查和胎儿脐带血检查。唐氏筛查是目前应用最广的ds产前筛查手段,主要结合了超声检查和孕妇血清标志物检验。唐氏筛查安全性高,但是特异性较差,虽然胎儿颈项透明层(nuchaltranslucency,nt)>2.5mm时,ds患病率高达84%,但是仍不能达到确诊的要求,唐氏筛查高危的孕妇仍然需要后续检查确诊。无创dna检测是近年来兴起的ds产前检测手段,又称为无创产前dna检查或者无创胎儿染色体非整倍体检查,主要依靠检测母体血液中胎儿游离dna(cellfreefetaldna,cffdna),并对其进行序列分析以获得胎儿的遗传信息,从而诊断ds、帕陶氏综合征(patausyndrome,ps)和爱德华综合征(edwardssyndrome,es),其安全性和灵敏度均较高,但是检查费用较高,技术操作复杂,检查周期较长,目前卫生主管部门对其实行资质认证管理,多在第三方的医疗检测机构应用,不易在临床特别是基层医疗机构推广。羊膜腔液体穿刺检查、绒毛膜穿刺检查和胎儿脐带血检查均通过侵袭性操作获得胎儿脱落细胞并对其进行染色体核型分析,达到确诊的目的,虽特异性较高,但是侵袭性操作对操作者的临床经验要求高,且有1%导致流产的机率。目前,染色体核型分析虽然是产前诊断ds的金标准,但是其检测技术复杂、条件要求高且检测周期长,故仅局限于唐氏筛查的高危孕妇。因此,建立一种安全、价格合理又特异的ds产前检测手段仍旧是产前诊断领域探索的方向,而与cffdna同属于血液常见分子的微小rna(micrornas,mirna)分子开始引起人们的重视。
mirna是一类长度约为20-25个碱基的非编码rna小分子,其主要生理作用是调控基因的表达。mirna可以耐受血液中rna酶的降解,可以在循环血液中长期稳定的存在,同时mirna还可以耐受外界强酸、强碱的处理,为mirna的检测带来了方便。此外,mirna还具有很强的组织和器官的特异性,为其成为理想的疾病循环血液学标志物奠定了坚实的基础。目前研究显示,健康胎儿和唐氏患儿孕中期母体血浆存在135种表达差异的mirna分子,其中,hsa-mir-124a-3p是表达量显著性升高的mirna分子中差异值最大的分子。
技术实现要素:
针对以上问题,本发明提供一种操作简单、结果准确可靠的人hsa-mir-124a-3ppcr检测方法及其在ds妊娠风险预测中的应用。
本发明实现其目的所采用的技术方案如下:
一种人hsa-mir-124a-3ppcr检测方法,包括如下步骤:
1)提取待测人血浆样品的总rna;
2)对提取的rna利用rt-qpcr进行检测:
a、rt反应:rt引物序列为:
5′-gtcgtatccagtgcgtgtcgtggagtcggcaattgcactggatacgacggcattc-3′,rt反应程序:16℃30min,42℃30min,85℃5min;
b、qpcr反应:qpcr反应程序为:50℃2min,95℃10min;95℃15s,60℃60s,35个循环;
3)建立标准曲线,计算待测样品中的hsa-mir-124a-3p浓度。
在上述技术方案中,rt反应体系为:rt反应混合物7μl、0.1pmol/μl的hsa-mir-124a-3p标准品5μl、100pmol/μl的rt引物3μl,其中rt反应混合物由如下组分组成:0.15μldntps、1μl50u/μl的multiscribetmreversetranscriptase、1.5μl10×reversetranscriptionbuffer、0.19μl20u/μl的rnaseinhibitor、4.16μlrnase-freewater;qpcr反应体系由如下组分组成:1μl
一种上述的人hsa-mir-124a-3ppcr检测方法在ds妊娠风险预测中的应用,将采用权利要求1所述的方法测得的待测样品的hsa-mir-124a-3p浓度应用到ds妊娠风险预测中,将10-5至10-3pmol/μl确定为权利要求1所述的检测方法的ds高危风险的区间值。
本发明的有益效果是:成功构建了血浆hsa-mir-124a-3p的rt-qpcr检测方法,该方法的检测线性范围宽、检测灵敏度高、检测特异性、重复性较好,可用于临床标本中微量hsa-mir-124a-3p的定量检测。同时检测hsa-mir-124a-3p的rt-qpcr方法具有操作相对简单、检测快速、成本低廉等优点,有望应用于ds的产前筛查。本发明实验证明hsa-mir-124a-3p在ds妊娠风险预测的价值比常规血清唐氏筛查方法高,为hsa-mir-124a-3p在ds妊娠产前筛查中的应用奠定了基础。
附图说明
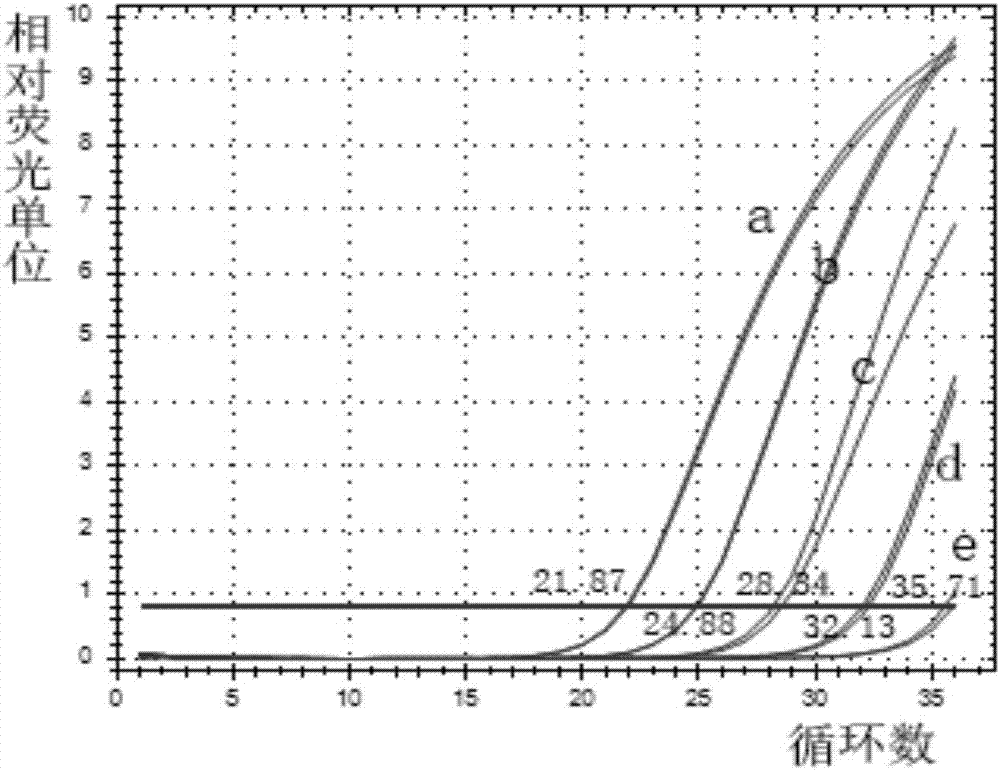
图1是不同浓度hsa-mir-124a-3p逆转录cdna的qpcr扩增曲线图,其中,曲线a、b、c、d、e分别为10-2、10-3、10-4、10-5和10-6pmol/μl的hsa-mir-124a-3p逆转录cdna的扩增曲线。
图2是hsa-mir-124a-3pqpcr标准曲线图。
图3是hsa-mir-124a-3prt-qpcr检测方法的灵敏度、特异性及重复性检测图,其中,图a、b、c分别为30、35、40个循环时hsa-mir-124a-3p标准品实验组和rnase-freewater阴性对照组的扩增曲线。
图4是hsa-mir-124a-3p诊断ds妊娠的roc曲线图。
图5是hsa-mir-124a-3p检测法和血清唐氏筛查的ds风险预测roc曲线图,其中,a、b分别为hsa-mir-124a-3p检测法和唐氏筛查的ds风险预测roc曲线。
具体实施方式
下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
相关试剂
(1)逆转录试剂:multiscribetmreversetranscriptase(50u/μl)、10×reversetranscriptionbuffer、dntpmix(100mmtotal)、rnaseinhibitor(20u/μl)均购于上海市爱普拜斯应用生物系统贸易有限公司;hsa-mir-124a-3p逆转录引物由上海市生物工程有限公司合成;tebuffer由上海市聪诚实业有限公司提供。
(2)荧光定量pcr扩增试剂:
(3)血浆mirna提取试剂:trzolls购自上海玉博生物科技有限公司。
(4)逆转录试剂:multiscribetmreversetranscriptase(50u/μl)、10×reversetranscriptionbuffer、dntpmix(100mmtotal)、rnaseinhibitor(20u/μl)均购于上海市爱普拜斯应用生物系统贸易有限公司;hsa-mir-124a-3p逆转录引物由上海市生物工程有限公司合成;u6snrna逆转录引物由赛默飞世尔科技公司提供;tebuffer由上海市聪诚实业有限公司提供。
(5)荧光定量pcr扩增试剂:
(6)唐氏筛查试剂:afp、βhcg和ue3检测试剂盒由罗氏公司提供。
(7)其他试剂:hsa-mir-124a-3p标准品由大连宝生物工程有限公司合成。
实施例1、hsa-mir-124a-3p的rt-qpcr检测
一、hsa-mir-124a-3prt反应
(1)hsa-mir-124a-3p标准品的合成:登录http://www.mirbase.org/网站,获取hsa-mir-124a-3p的碱基序列为5′-uaaggcacgcggugaaugcc-3′(如seqidno:1所示)。将获得的hsa-mir-124a-3p序列送至大连宝生物工程有限公司合成hsa-mir-124a-3p标准品(12.8nmols)。
(2)不同浓度hsa-mir-124a-3p标准品的配制:将1.28mlrnase-freewater加入12.8nmol数的hsa-mir-124a-3p标准品中,配制成10pmol/μl的hsa-mir-124a-3p标准品溶液,作为标准品的储存液。然后继续用rnase-freewater将10pmol/μl的hsa-mir-124a-3p标准品以10倍浓度梯度稀释至1和0.1pmol/μl2种浓度。
(3)hsa-mir-124a-3prt引物的设计:将hsa-mir-124a-3p序列中的u全部替换为t,得到序列为5′-taaggcacgcggtgaatgcc-3′,其互补序列为5′-ggcattcaccgcgtgcctta-3′,将其5′端的7个碱基做为rt引物粘附序列,可得rt引物5′-gtcgtatccagtgcgtgtcgtggagtcggcaattgcactggatacgacggcattc-3′(如seqidno:2所示)。
(4)hsa-mir-124a-3prt反应混合物的配制:各组分比例如表1所示:
表1rt反应混合物配制比例
(5)hsa-mir-124a-3prt反应
hsa-mir-124a-3prt反应体系:rt反应混合物7μl、hsa-mir-124a-3p(0.1pmol/μl)5μl、rt引物(100pmol/μl)3μl。
hsa-mir-124a-3prt反应程序:16℃30min,42℃30min,85℃5min,4℃保存。
二、hsa-mir-124a-3pqpcr反应
(1)qpcr反应体系的配制:以hsa-mir-124a-3prt反应产物为阳性实验组、以相同量的rnase-freewater为阴性对照组,分别配制qpcr反应体系(表2)。
表2qpcr反应体系
(2)qpcr反应程序设置:如表3所示。
表3qpcr反应程序
(3)hsa-mir-124a-3p标准品的质量验证:观察实验组和对照组的扩增曲线和循环阈值(cyclethreshold,ct),验证hsa-mir-124a-3p标准品的完整性。
三、hsa-mir-124a-3prt-qpcr检测方法标准曲线的建立和评价
将hsa-mir-124a-3p标准品稀释为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6pmol/μl等浓度,分别在同样条件下进行qpcr扩增反应,发现标准品浓度在1×10-2至1×10-6pmol/μl范围时,其对应的扩增曲线呈典型的对数扩增(如图1所示),且两相邻扩增曲线的间距较为接近,故以1×10-2、1×10-3、1×10-4、1×10-5和1×10-6pmol/μl这五种浓度的对数值(lg值)为横坐标,对应扩增曲线的ct值为纵坐标,作标准曲线(如图2所示)。从图中观察发现,标准曲线的ct值与起始浓度存在良好的线性关系,经计算可得r2=0.998>0.98,说明标准曲线的线性程度符合要求,故将1×10-2至1×10-6pmol/μl定为hsa-mir-124a-3prt-qpcr检测方法的线性范围。计算两相邻循环数差值分别为3.01、3.46、3.79、3.58,其相邻循环稀释浓度分别为8.06、11.00、13.83、11.96,均值为11.21与标准品的实际稀释浓度倍数10相接近。计算可得qpcr扩增效率为93.3%,介于90%-105%之间,说明反应条件已优化。
四、hsa-mir-124a-3prt-qpcr方法学评价
分别用建立的hsa-mir-124a-3prt-qpcr方法检测hsa-mir-124a-3p标准品为模板的阳性实验组和相同量的rnase-freewater的阴性对照组,发现该方法能够重复且稳定检测出hsa-mir-124a-3p的最低浓度为1×10-6pmol/μl。分别在30、35、40循环数下用hsa-mir-124a-3prt-qpcr检测hsa-mir-124a-3p标准品和rnase-freewater的阴性对照组,发现该方法能够特异的检测出hsa-mir-124a-3p的循环数为35(如图3所示,其中实验组和对照组分别设有2个平行管)。此外,平行管扩增曲线显示二者ct值差异较小,说明本方法重复性好。
实施例2、母体血浆hsa-mir-124a-3p在唐氏综合征产前筛查中的临床应用
一、血浆中总rna的提取
临床标本收集及分组:收集第三军医大学第一附属医院妇产科产前诊断中心20~35岁妊娠健康胎儿的妊娠中期(13-27周)孕妇血浆36例为正常对照组;确诊妊娠ds胎儿的妊娠中期孕妇血浆11例为ds妊娠组;血液标本采用edta抗凝,在25℃条件下3000r/min,离心3min后吸取上层血浆,-80℃储存备用。提取血浆中总rna。
二、rt-qpcr反应
按照实施例1中的方法对提取的血浆rna进行rt-qpcr方法检测各组临床标本中的hsa-mir-124a-3p的含量。同时以相同量的rnase-freewater为阴性对照,加入u6snrnart反应产物作为实验内参阳性对照,每个样品设置2个平行检测管。利用u6snrna内参在相同量的样本中表达较为一致的特点,对计算所得hsa-mir-124a-3p浓度进行校正。
三、基于时间分辨荧光免疫分析的血清唐氏筛查实验
(1)用碘伏消毒肱静脉表面皮肤,抽取本研究所有标本来源孕妇孕中期空腹静脉血5ml,不抗凝,在25℃条件下3000r/min,离心3min,吸取上层血清,-80℃储存备用。
(2)在96孔微孔板第一孔中加入βhcg标准品25μl,然后依次分别加入25μl待测血清,所有加样孔内均加入抗βhcg试剂稀释液200μl。
(3)另取一96孔微孔板,在第一孔中加入afp标准品25μl,然后依次分别加入25μl待测血清,所有加样孔内均加入抗afp试剂稀释液200μl。
(4)将两个微孔板缓慢震荡3h,震荡期间分别洗板6次。
(5)再取一96孔微孔板,第一孔中加入ue3标准品100μl,然后依次分别加入100μl待测血清,缓慢震荡15min后所有加样孔内均加入100μlue3示踪稀释液,缓慢震荡1h,震荡期间分别洗板6次。
(6)在三个微孔板的反应孔中依次加入增强液200μl,缓慢震荡5min,预热时间分辨免疫荧光分析仪15min后,上机检测afp、βhcg和ue3的浓度。
(7)筛查报告:将孕妇的胎数,人种,年龄,体重,孕周,是否胰岛素依赖型糖尿病,afp、hcg和ue3检查结果输入产前筛查软件,得到唐氏筛查报告。记录血清唐氏筛查报告为ds妊娠高风险和低风险的孕妇信息。
四、染色体核型分析
(1)以0.6mm内径的长针,在超声波的引导下,穿过孕妇腹部,经过子宫壁,到达羊膜腔,然后抽取20ml羊水,1500r/min,离心10min,吸取上清液作其他检验,将余下0.5ml沉淀轻柔吹打混匀后接种在含有0.9ml小牛血清和2.1mlf10培养液的培养瓶中,摇匀,37℃培养6d后更换培养液,37℃培养6d后加入秋水仙碱,摇匀,使秋水仙碱的终浓度达到3μg/ml,继续37℃孵育4h。
(2)取出细胞悬液,0.002%的胰蛋白酶溶液2ml中消化5min,1500r/min,离心5min,弃去上清后加入0.4%枸橼酸钠和0.4%氯化钾比例为1:1溶液5滴,37℃孵育5min。
(3)取出离心管,加入甲醇和冰醋酸比例为3:1的固定液7滴,轻柔吹打混匀,1500r/min,离心5min,弃去上清后再加入甲醇和冰醋酸比例为3:1的固定液4ml,轻柔吹打混匀,静置40min,再次1500r/min,离心5min,弃去上清后加入甲醇和冰醋酸比例为3:1的固定液2ml,轻柔吹打混匀,静置20min。1500r/min,离心5min,弃去上清后将加3滴固定液将沉淀制成混悬液。
(4)将2滴上述混悬液滴在处理后的载玻片上,轻柔吹气,使混悬液均匀分布并晾干。将载玻片置于90℃烤箱拷片45min后放入0.002%的胰蛋白酶溶液中消化60s,随后用giemsa染液染色5min,流水冲洗载玻片并在空气中晾干。
(5)在显微镜下观察染色体条带,并对其进行计数。其中46,xn表示染色体核型正常的胎儿,n代表x或y染色体中的一条。47,xn,+21代表多了一条21号染色体的ds胎儿。
五、统计学分析
(1)将所有的检测结果录入excel表,建立数据库,应用spss23.0统计软件对健康胎儿和ds患儿母体血浆hsa-mir-124a-3p检测结果进行独立样本t检验,计算二者均数倍值,将所得结果与前期研究结果相比较。
(2)以染色体核型分析作为金标准,将hsa-mir-124a-3p的检测结果以10-8至10-7pmol/μl作为程度1,10-7至10-6pmol/μl作为程度2,依次类推,以10倍浓度区间内结果出现的次数作为频数,作roc曲线,选择约登指数(youdenindex,yi)最大值所对应的频数对应的hsa-mir-124a-3p浓度范围作为rt-qpcr检测方法预测孕中期ds高危风险的区间值。
(3)以染色体核型分析作为金标准,分别作唐氏筛查和rt-qpcr检测方法预测ds风险的结果作roc曲线,比较二者预测ds风险的价值。
六、结果
1、健康胎儿和ds胎儿母体血浆hsa-mir-124a-3p检测结果的比较
利用hsa-mir-124a-3prt-qpcr检测方法分别对36例健康胎儿和11例ds患儿母体血浆hsa-mir-124a-3p的表达水平进行了检测(表4)。已知hsa-mir-124a-3prt-qpcr检测方法的检测下限为1×10-6pmol/μl,因实际检测了200μl血浆中hsa-mir-124a-3p浓度,故临床应用检测下限为1×10-8pmol/μl。若将正常组低于检测下限的值假定为1×10-8pmol/μl,对正常组和ds组hsa-mir-124a-3p浓度进行独立样本t检验可得:p=0.021<0.05,说明正常组和ds组hsa-mir-124a-3p浓度差异存在统计学意义,正常组hsa-mir-124a-3p浓度显著小于ds组hsa-mir-124a-3p浓度,与前期研究结果符合。另外,经计算可得正常组和ds组hsa-mir-124a-3p浓度均值差异倍数为:1659.7459,对比前期研究差异倍数918.7662,本研究所得差异倍数偏大,分析原因可能是与前期研究采用检测方法不同所致。
表4健康胎儿和ds患儿母体血浆hsa-mir-124a-3p浓度
2、hsa-mir-124a-3p预测ds妊娠高危风险的区间值
以染色体核型分析作为金标准,将hsa-mir-124a-3p10-8至10-7pmol/μl作为程度1,10-7至10-6pmol/μl作为程度2,依次类推,以10倍浓度区间内结果出现次数作为频数绘制表5,再根据表5结果作对应的roc曲线(图4),根据统计学分析结果可得该roc曲线的标准误为0.042,p=0.000,95%的置信区间为(0.833,0.998),roc曲线下面积为0.915。计算可得该roc曲线最大的yi为0.735,而其所对应的程度为4.5,说明hsa-mir-124a-3p浓度在10-5至10-3pmol/μl时对ds的诊断价值最大,故将10-5至10-3pmol/μl定为hsa-mir-124a-3prt-qpcr检测方法预测ds高危风险的区间值。
表5rt-qpcr检测结果
3、hsa-mir-124a-3prt-qpcr检测方法与唐氏筛查的比较
由上述结果分析可知,将孕中期妇女血浆hsa-mir-124a-3p浓度在10-5至10-3pmol/μl区间者定为ds高风险。以此作为ds妊娠高危风险区间值,并以染色体核型分析作为金标准,将血清唐氏筛查结果与hsa-mir-124a-3p检测结果进行比较(表6)。同时分别对hsa-mir-124a-3p检测和唐氏筛查的ds风险预测情况作roc曲线(图5)。其中rt-qpcr法相应的标准误为0.093,p=0.006,95%的置信区间为(0.594,0.959),曲线下面积为0.777,表示rt-qpcr法对ds风险预测中等。而唐氏筛查相应的标准误为0.097,p=0.171,95%置信区间为(0.448,0.827),曲线下面积为0.638,表示其风险预测价值较低。结果提示hsa-mir-124a-3p在ds妊娠风险预测的价值比常规血清唐氏筛查方法高。
表6血清唐氏筛查和hsa-mir-124a-3p检测的结果比较
序列表
<110>中国人民解放军第三军医大学第一附属医院
<120>人hsa-mir-124a-3ppcr检测方法及其在ds妊娠风险预测中的应用
<130>1
<160>2
<210>1
<211>20
<212>rna
<213>人工序列
<223>hsa-mir-124a-3p
<400>1
uaaggcacgcggugaaugcc20
<210>2
<211>55
<212>dna
<213>人工序列
<223>rt引物
<400>2
gtcgtatccagtgcgtgtcgtggagtcggcaattgcactggatacgacggcattc55
- 还没有人留言评论。精彩留言会获得点赞!