一种具有双磷光发射性质的离子型铱配合物及其制备方法和应用与流程
本发明属于本发明属于有机光电功能材料技术领域,具体涉及一种具有双磷光发射性质的离子型铱配合物及其制备方法和应用。
背景技术:
地球上的生命史是一部氧气生产和利用的编年史。约25亿年前,原始光合生物一项惊人的技能:捕获太阳能量并将其储存在葡萄糖内的化学键中;约15亿年前,获得了另一项非凡的技能:将葡萄糖完全氧化成二氧化碳和水;约10亿年前,植物和动物出现区别:一组(植物)专门从事葡萄糖光合作用,而另一种(动物)则专门用于消费植物和其他有机体产生的氧气;约5亿年到今天,动物们学会从大气中获得氧气。
分子氧对于维持生命活动是十分重要而且必不可少的,它几乎参与了所有生物的所有形式的生命活动,并起着重要作用。生物体呼吸作用消耗氧气,而且氧分子参与线粒体内三磷酸腺苷(atp)的产生和消耗。在健康的器官、组织和细胞中氧气含量会保持在某个确定的范围。在人体正常的细胞中,氧气的含量维持在21%(相应的分压(po2)~150mmhg)左右的水平。生物学家在细胞组织培养时通常保持在20%o2(95%空气和5%二氧化碳)浓度。尽管大多数人体细胞处在低于正常需要的氧气水平的环境下,为维持细胞正常的生理活动,正常的稳态机制总会使体内氧气浓度维持在一定的范围内。
乏氧指细胞、组织或有机体可用的氧气量的减少。乏氧可以是持续发生的,就像个体长期在海拔高的地方时;或者间歇性地,就像那些患有睡眠呼吸暂停症的人一样,气道阻塞导致暂时性的供氧不足,从而导致血液迅速减少(血氧不足),乏氧是许多疾病产生时的一种最重要的特征,包括肿瘤、炎症、心肌缺血等。富氧状态是过多氧气供应,富氧会产过多的活性氧/氮物质(rons)和氧中毒及其并发综合症,可能会导致肺、眼睛和某些神经系统的损伤。因此,准确检测生物环境中氧气含量对于早期诊断并发现这些疾病十分重要。
在生物检测应用中,对磷光强度的分析可反应出被分析物的存在或浓度,但是配合物的磷光强度除了和环境中的分析物浓度有关,还取决于配合物本身的浓度。细胞或活体内的配合物浓度很难控制,目前也没有简单有效测量浓度的方法。配合物浓度的差异极大地影响了分析物的检测结果。
技术实现要素:
为了克服现有技术中的不足,本发明提供一种具有双磷光发射性质的离子型铱配合物及其制备方法和应用;发明提供的双磷光发射配合物探针的乏氧和抚养检测中具有很好的应用。相对于传统的灰度传感来说,本发明的具有双磷光发射性质的离子型铱配合物作为比率型探针应用于氧气检测方法利用两个变量比率的变化作为检测信号,从而更准确地量化分析物,可以克服很多方面的影响。
为了实现上述发明目的,本发明采用了以下技术方案:
一种具有双磷光发射性质的离子型铱配合物,具有如下结构通式:
一种具有双磷光发射性质的离子型铱配合物的制备方法,包括以下步骤:通过苯基吡啶衍生物与三水合三氯化铱的配位反应制备得到二氯桥,再通过二氯桥与联吡啶衍生物或碳酸钠的配位反应制备得到具有双磷光发射性质的离子型铱配合物;所述苯基吡啶衍生物作为c^n主配体;联吡啶衍生物作为n^n辅助配体。
优选地,所述联吡啶衍生物的制备方法为:通过一步氧化反应和一步酯化/氧化反应和一步酰胺化反应得到联吡啶衍生物,具体步骤如下:
1)第一步氧化反应以浓硫酸为溶剂,重铬酸钾为氧化剂,先在65℃下缓慢加入氧化剂,后65℃反应8-12h,
2)第二步酸和醇的酯化反应以甲醇为溶剂和反应原料,浓硫酸为催化剂,氮气保护条件下105℃反应24h;
3)第三步酯的酰胺化反应以dcm为溶剂,氮气保护条件下40℃搅拌24h;
1)第一步氧化反应以1,4-二氧六环为溶剂,二氧化硒为氧化剂,在102℃反应24h;
2)第二步将醛基氧化成酸的反应以95%的乙醇至完全溶解4-醛基-4’-甲基-2,2’-联吡啶,再在避光条件下加入硝酸银水溶液,最后加入氢氧化钠水溶液,25℃反应15h;
3)第三步酸的酰胺化反应以dmf为溶剂,edc、nhs为缩合剂,三乙胺为缚酸剂,氮气保护条件下25℃搅拌24h。
优选地,苯基吡啶衍生物的制备方法为:通过两步偶联反应和一步溴代反应和一步胺化反应得到苯基吡啶衍生物,具体步骤如下:
1)第一步偶联反应以1,4-二氧六环为溶剂,1,1,-双二苯基膦二茂铁二氯化钯为催化剂,在醋酸钾的碱性环境下85℃反应12h;
2)第二步偶联反应以乙醇、甲苯和饱和碳酸钾水溶液为溶剂,四(三苯基膦)钯为催化剂,氮气保护条件下105℃反应24h;
3)第三步溴代反应以四氯化碳为溶剂,以aibn为引发剂,nbs为溴化剂,氮气保护条件下85℃搅拌8h;
4)第四步胺化反应以丙酮为溶剂,碳酸钾碱性环境下,氮气保护40℃搅拌16h。
优选地,所述二氯桥和联吡啶衍生物或碳酸钠的配位反应以二氯甲烷和甲醇为混合溶剂,氮气保护条件下回流反应4小时,然后室温条件下进行离子交换。
一种具有双磷光发射性质的离子型铱配合物的应用于乏氧或富氧检测。
一种具有双磷光发射性质的离子型铱配合物的应用于细胞成像或生物检测。
一种具有双磷光发射性质的离子型铱配合物的应用于活细胞或活体内同时用于乏氧和富氧检测。
本发明合成的:1)具有双磷光发射金属配合物对氧气具有响应性;2)通过调节配合物溶剂中氧气浓度能够有效调控了配合物的光物理性质,实现该系列配合物不仅能够发生发射波长的改变,而且能够引起发射寿命的改变;3)利用双磷光发射的离子型铱配合物特殊的发光性质,使用比率法对乏氧进行检测,提高了准确度;4)利用双磷光发射的离子型铱配合物特殊的发光性质,使用比率法对富氧进行检测,提高了准确度;5)时间分辨技术实现对短寿命细胞背景荧光信号的有效扣除,降低了背景信号对探针光信号的干扰,从而得到更加灵敏、可靠的检测结果;6)利用探针能够对细胞体内同时进行乏氧和富氧的比率法检测;7)利用双磷光发射的离子型铱配合物对活体(斑马鱼和小鼠)体内进行乏氧和富氧同时进行检测;8)利用双磷光发射的离子型铱配合物,有助于实现探针在复杂环境中的准确检测。这些结果表明,基于这种双磷光发射的离子型铱配合物及的诊断治疗一体化多功能探针在未来生物医学应用中具有很大的潜力。
附图说明
图1本发明实施例1-3中离子型铱配合物在甲醇中的紫外吸收光谱;
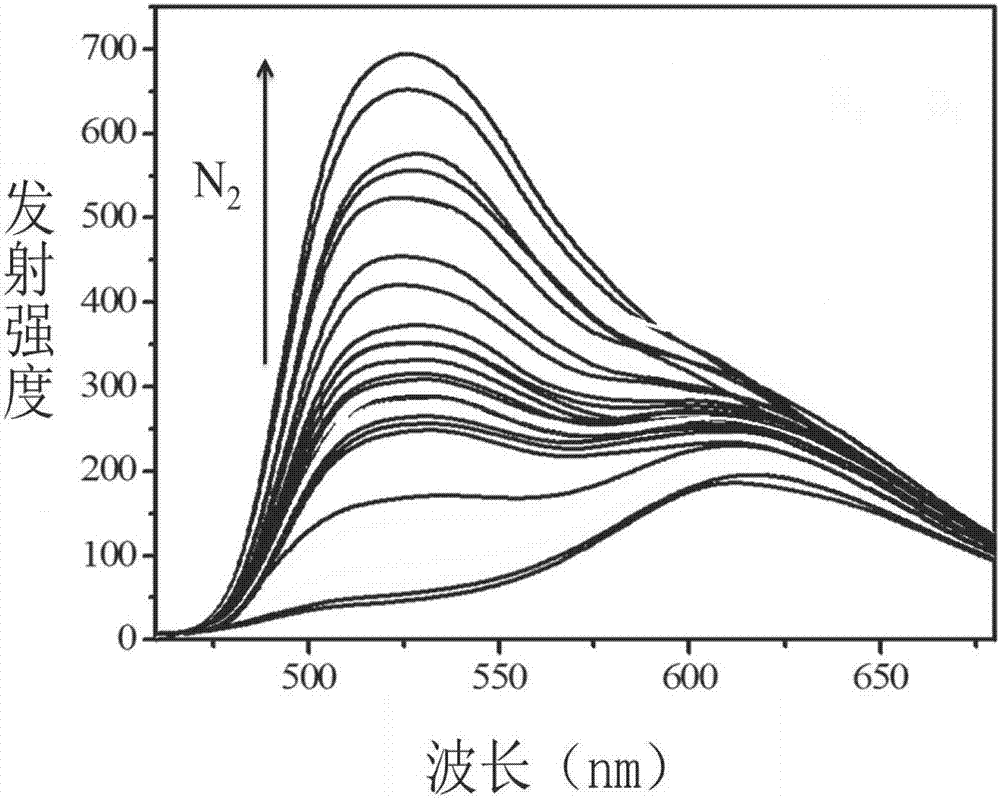
图2本发明实施例3中双磷光配合物乏氧和富氧条件下的发射光谱;
图3本发明实施例3中双磷光发射的离子型铱配合物在hepg-2细胞中乏氧和富氧生物检测;
图4本发明实施例3中双磷光发射的离子型铱配合物在活体(斑马鱼)中的乏氧和富氧检测。
具体实施方式
为了更好地理解本发明专利的内容,下面通过具体的实例来进一步说明本发明的技术方案,但这些实施实例并不限制本发明。
实施例1:
(1)4-甲基-4’-乙酰胺-2,2’-联吡啶的合成
4-甲基-4’-醛基-2,2’-联吡啶的合成:称取4,4’-二甲基-2,2’-联吡啶5.27g(28mmol),seo23.84g(34.6mmol),加入1,4-二氧六环260ml,抽真空,在102℃氮气保护下反应24h后称热过滤;将滤液旋干,并且溶解在500ml的乙酸乙酯中,然后再次过滤,除去不溶的固体,得到黄色溶液,使用1.0mna2co3(2×100ml)进行萃取2次,取有机相;然后使用0.3m(3×100ml)na2s2o5取无机相,用na2co3调节无机相ph值至10,然后用ch2cl2萃取(4×100ml),旋干得到2.5g白色固体,产率45%。1hnmr(400mhz,cdcl3,δ):10.1(1h,s),8.80(1h,d),8.73(1h,s),8.49(1h,d),8.18(1h,s),7.63(1h,d),7.11(1h,d),2.37(3h,s).
4-甲基-4’-羧基-2,2’-联吡啶的合成:称取4-甲基-4’-醛基-2,2’-联吡啶198.2mg(1mmol),加入20ml95%的乙醇溶液,然后加入8ml硝酸银溶液,快速搅拌得到黄色的悬浮液后在20min内缓慢加入naoh溶液,得到深黑色的反应混合溶液,使用锡箔纸包好避光在25℃下反应15h,反应结束冷却抽滤(除去ag和ag2o),滤液用二氯甲烷(3×100ml)萃取,取水相,然后使用1mhcl溶液调节ph至3.5,放置于冰箱内冷冻一夜,抽滤得到固体,然后干燥得到固体白色粉末,产率80%。1hnmr(400mhz,d2o,δ):8.89(1h,d),8.60(1h,s),8.58(1h,s),8.44(1h,s),8.04(1h,s),7.83(1h,d),2.6(3h,s).
4-甲基-4’-乙酰胺-2,2’-联吡啶的合成:称取4-甲基-4’-羧基-2,2’-联吡啶300mg(1.4mmol)和1-(3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐(edc·hcl)296mg(1.64mmol)以及n-羟基琥珀酰亚胺(nhs)161mg(1.4mmol),抽真空,氮气保护,然后加入6ml干燥的dmf和0.4ml干燥的三乙胺在25℃下反应12h后加入1.5ml乙胺和0.6ml三乙胺,在25℃下继续反应24h。反应结束,减压蒸馏,使用二氯甲烷(3×100ml),取有机相,旋干装入硅胶粉柱子,分离提纯,产率30%。1hnmr(400mhz,cdcl3,δ)8.79(d,j=5.0hz,1h),8.59–8.57(m,1h),8.54(d,j=5.0hz,1h),8.27(s,1h),7.79(dd,j=5.0,1.7hz,1h),7.18(d,j=4.9hz,1h),6.52(s,1h),3.59–3.47(m,2h),2.46(s,3h),1.27(dd,j=7.3,0.6hz,3h).
(2)2-(4-(哌啶-1-甲基)苯基)吡啶的合成
1)2-(4-(溴甲基)苯基)吡啶的合成:称取2-(对甲苯基)吡啶1.0g(5.9mmol),加入nbs1.16g(6.5mmol)和aibn50mg(0.3mmol)加入反应瓶中,加入20mlccl4,避光、氮气保护,在85℃,反应8h,反应完毕,使用二氯甲烷(3×100ml)萃取,取有机相,旋干装入硅胶粉柱子,分离提纯,得到2-(4-(溴甲基)苯基)吡啶,产率83%。
2)2-(4-(哌啶-1-甲基)苯基)吡啶的合成:称取2-(4-(溴甲基)苯基)吡啶190mg(0.77mmol)和碳酸钾133mg(0.97mmol)加入反应瓶中,密封,抽真空,氮气保护,加入六氢吡啶65mg(0.76mmol),加入15ml丙酮做为反应溶剂,然后在30℃下反应16h,反应结束,使用二氯甲烷(3×100ml)萃取,取有机相,旋干装入硅胶粉柱子,分离提纯,得到2-(4-(哌啶-1-甲基)苯基)吡啶,产率54%。1hnmr(400mhz,cdcl3,δ)8.67(dt,j=4.8,1.4hz,1h),7.92(d,j=8.3hz,2h),7.74–7.69(m,2h),7.43(s,1h),7.41(s,1h),7.20(ddd,j=6.2,4.9,2.4hz,1h),3.52(s,2h),2.39(s,4h),1.57(dd,j=11.2,5.6hz,4h),1.43(d,j=4.8hz,2h).
(3)二氯桥的合成
用天平准确称取1mmol2-(4-(哌啶-1-甲基)苯基)吡啶,2mmol三水合三氯化铱,加入磁子,冷凝管,密封,反复多次鼓氮,抽真空,加入乙二醇乙醚:水=3:1,在110℃,反应24h。待反应结束后,反应液冷却到室温,抽滤,得到二氯桥,产率80%。
(4)具有双磷光发射性质的离子型铱配合物的合成:
称取二氯桥1mmol和4-甲基-4’-乙酰胺-2,2’-联吡啶2.2mmol加入反应瓶中,抽真空,氮气保护,在40℃下反应10h,后加入kpf630mmol反应2h,旋干,使用二氯甲烷(3×150ml)萃取,取有机相,旋干装入硅胶粉柱子,分离提纯,,得到具有双磷光发射性质的离子型铱配合物,产率74%。1hnmr(400mhz,cdcl3,δ)8.80(s,1h),8.54(s,1h),8.08(t,j=6.3hz,3h),7.90(dd,j=10.9,4.8hz,2h),7.83(d,j=1.6hz,1h),7.83–7.79(m,1h),7.74(dd,j=5.7,1.6hz,1h),7.59(s,2h),7.43(s,1h),7.37(d,j=5.6hz,1h),7.10–7.02(m,4h),6.24(dd,j=11.5,1.5hz,2h),3.70(qd,j=13.4,3.6hz,4h),3.44(dd,j=7.2,5.7hz,2h),2.67(s,8h),2.58(s,3h),1.61(d,j=4.9hz,8h),1.50(d,j=11.1hz,4h),1.23(d,j=7.2hz,3h).
实施例2
(1)4,4’-二丁酰胺-2,2’-联吡啶的合成:
1)4,4’-二羧基-2,2’-联吡啶的合成:称取4,4-二甲基-2,2,-联吡啶1.0g(5.4mmol)加入反应瓶中,缓慢滴加浓硫酸18ml并搅拌,过程大量放热,待到溶液冷却至室温后加入重铬酸钾3.3g(11.3mmol),此时溶液变成墨绿色,然后在65℃下反应6h。反应结束,冷却至室温,将反应物加入1000ml水中,此时有大量白色絮状沉淀产生,抽滤,并用依次用水和甲醇洗涤白色沉淀至滤液澄清,然后在60℃真空干燥箱中干燥18h,产率98%。
4,4’-二甲酸二甲酯-2,2’-联吡啶的合成:称取4,4’-二羧基-2,2’-联吡啶500mg(2.05mmol)加入反应瓶中,加入100ml甲醇,缓慢滴加浓硫酸8ml并搅拌,然后在105℃下反应12h。反应结束,冷却至室温,后将反应物加入500ml水中,使用饱和naoh溶液调节ph至9。调节ph后加入200ml二氯甲烷溶液并静止,此时有白色絮状沉淀,将上层液倒出,下层液使用二氯甲烷和水(3×100ml)萃取,取有机相,旋干,得到产物,产率76%。
4,4’-二丁酰胺-2,2’-联吡啶的合成:称取4,4’-二甲酸二甲酯-2,2’-联吡啶200mg(0.74mmol)加入反应瓶中,抽真空,氮气保护,加入无水正丁胺7.5ml、无水二氯甲烷20ml和无水三乙胺1.0ml,在45℃的条件下反应24h。反应结束,冷却至室温,旋干,后使用二氯甲烷和乙醚重结晶,得到白色粉末,产率45%。1hnmr(400mhz,dmso,δ)8.94(d,j=5.7hz,1h),8.84(d,j=5.0hz,1h),8.77(s,1h),7.83(dd,j=5.0,1.5hz,1h),3.34(m,2h),1.62–1.43(m,2h),1.39–1.27(m,2h),0.97–0.79(m,3h).
(2)2-(4-(丁胺-1-甲基)苯基)吡啶的合成
1)2-(4-(溴甲基)苯基)吡啶的合成:称取2-(对甲苯基)吡啶1.0g(5.9mmol),加入nbs1.16g(6.5mmol)和aibn50mg(0.3mmol)加入反应瓶中,加入20mlccl4,避光、氮气保护,在85℃,反应8h,反应完毕,使用二氯甲烷(3×100ml)萃取,取有机相,旋干装入硅胶粉柱子,分离提纯,产率83%。
2)2-(4-(丁胺-1-甲基)苯基)吡啶的合成:称取2-(4-(溴甲基)苯基)吡啶200mg(0.81mmol)和碳酸钾140mg(1.01mmol)加入反应瓶中,密封,抽真空,氮气保护,加入正丁胺59mg(0.81mmol),加入7ml乙腈作为反应溶剂,然后在30℃下反应16h,反应结束,使用二氯甲烷(3×100ml)萃取,取有机相,旋干装入硅胶粉柱子,分离提纯,产率62%。1hnmr(400mhz,cdcl3,δ)8.70–8.66(m,1h),7.96(d,j=8.3hz,2h),7.77–7.69(m,2h),7.45(d,j=8.3hz,2h),7.22(ddd,j=6.7,4.8,1.9hz,1h),3.87(s,2h),2.69–2.63(m,2h),1.90(s,1h),1.54(dt,j=14.6,7.3hz,2h),1.35(dd,j=15.1,7.3hz,2h),0.91(t,j=7.3hz,3h).
(3)二氯桥的合成
用天平准确称取1mmol2-(4-(丁胺-1-甲基)苯基)吡啶,2mmol三水合三氯化铱,加入磁子,冷凝管,密封,反复多次鼓氮,抽真空,加入乙二醇乙醚:水=3:1,在110℃,反应24h。待反应结束后,反应液冷却到室温,抽滤,得到二氯桥,产率80%。
(4)具有双磷光发射性质的离子型铱配合物的合成:
称取二氯桥1mmol和4,4’-二丁酰胺-2,2’-联吡啶2.2mmol加入反应瓶中,抽真空,氮气保护,在40℃下反应10h,后加入kpf630mmol反应2h,旋干,使用二氯甲烷(3×150ml)萃取,取有机相,旋干装入硅胶粉柱子,分离提纯,得到具有双磷光发射性质的离子型铱配合物,产率55%。1hnmr(400mhz,cdcl3,δ)9.46(s,2h),8.07(d,j=5.7hz,2h),8.02(d,j=5.6hz,2h),7.89(d,j=8.1hz,2h),7.77(dd,j=11.3,4.3hz,2h),7.62(d,j=8.0hz,2h),7.39(d,j=5.2hz,2h),7.01(d,j=8.1hz,2h),6.95(t,j=6.0hz,2h),6.19(s,2h),3.58–3.52(m,4h),3.33–3.19(m,4h),2.05(s,2h),1.75(dd,j=15.1,7.4hz,4h),1.43(d,j=2.5hz,8h),1.25(d,j=2.5hz,8h),0.94(t,j=7.4hz,6h),0.86(dt,j=9.7,6.5hz,6h).
实施例3
(1)4,4’-二丁酰胺-2,2’-联吡啶的合成:
1)4,4’-二羧基-2,2’-联吡啶的合成:称取4,4-二甲基-2,2,-联吡啶1.0g(5.4mmol)加入反应瓶中,缓慢滴加浓硫酸18ml并搅拌,过程大量放热,待到溶液冷却至室温后加入重铬酸钾3.3g(11.3mmol),此时溶液变成墨绿色,然后在65℃下反应6h。反应结束,冷却至室温,将反应物加入1000ml水中,此时有大量白色絮状沉淀产生,抽滤,并用依次用水和甲醇洗涤白色沉淀至滤液澄清,然后在60℃真空干燥箱中干燥18h,产率98%。
4,4’-二甲酸二甲酯-2,2’-联吡啶的合成:称取4,4’-二羧基-2,2’-联吡啶500mg(2.05mmol)加入反应瓶中,加入100ml甲醇,缓慢滴加浓硫酸8ml并搅拌,然后在105℃下反应12h。反应结束,冷却至室温,后将反应物加入500ml水中,使用饱和naoh溶液调节ph至9。调节ph后加入200ml二氯甲烷溶液并静止,此时有白色絮状沉淀,将上层液倒出,下层液使用二氯甲烷和水(3×100ml)萃取,取有机相,旋干,得到产物,产率76%。
4,4’-二丁酰胺-2,2’-联吡啶的合成:称取4,4’-二甲酸二甲酯-2,2’-联吡啶200mg(0.74mmol)加入反应瓶中,抽真空,氮气保护,加入无水正丁胺7.5ml、无水二氯甲烷20ml和无水三乙胺1.0ml,在45℃的条件下反应24h。反应结束,冷却至室温,旋干,后使用二氯甲烷和乙醚重结晶,得到白色粉末,产率45%。1hnmr(400mhz,dmso,δ)8.94(d,j=5.7hz,1h),8.84(d,j=5.0hz,1h),8.77(s,1h),7.83(dd,j=5.0,1.5hz,1h),3.34(m,2h),1.62–1.43(m,2h),1.39–1.27(m,2h),0.97–0.79(m,3h).
(2)2-(4-(哌啶-1-甲基)苯基)吡啶的合成
1)2-(4-(溴甲基)苯基)吡啶的合成:称取2-(对甲苯基)吡啶1.0g(5.9mmol),加入nbs1.16g(6.5mmol)和aibn50mg(0.3mmol)加入反应瓶中,加入20mlccl4,避光、氮气保护,在85℃,反应8h,反应完毕,使用二氯甲烷(3×100ml)萃取,取有机相,旋干装入硅胶粉柱子,分离提纯,得到2-(4-(溴甲基)苯基)吡啶,产率83%。
2)2-(4-(哌啶-1-甲基)苯基)吡啶的合成:称取2-(4-(溴甲基)苯基)吡啶190mg(0.77mmol)和碳酸钾133mg(0.97mmol)加入反应瓶中,密封,抽真空,氮气保护,加入六氢吡啶65mg(0.76mmol),加入15ml丙酮做为反应溶剂,然后在30℃下反应16h,反应结束,使用二氯甲烷(3×100ml)萃取,取有机相,旋干装入硅胶粉柱子,分离提纯,得到2-(4-(哌啶-1-甲基)苯基)吡啶,产率54%。1hnmr(400mhz,cdcl3,δ)8.67(dt,j=4.8,1.4hz,1h),7.92(d,j=8.3hz,2h),7.74–7.69(m,2h),7.43(s,1h),7.41(s,1h),7.20(ddd,j=6.2,4.9,2.4hz,1h),3.52(s,2h),2.39(s,4h),1.57(dd,j=11.2,5.6hz,4h),1.43(d,j=4.8hz,2h).
(3)二氯桥的合成
用天平准确称取1mmol2-(4-(哌啶-1-甲基)苯基)吡啶,2mmol三水合三氯化铱,加入磁子,冷凝管,密封,反复多次鼓氮,抽真空,加入乙二醇乙醚:水=3:1,在110℃,反应24h。待反应结束后,反应液冷却到室温,抽滤,得到二氯桥,产率80%。
(5)具有双磷光发射性质的离子型铱配合物的合成:
称取二氯桥1mmol和4,4’-二丁酰胺-2,2’-联吡啶2.2mmol加入反应瓶中,抽真空,氮气保护,在40℃下反应10h,后加入kpf630mmol反应2h,旋干,使用二氯甲烷(3×150ml)萃取,取有机相,旋干装入硅胶粉柱子,分离提纯,制得具有双磷光发射性质的离子型铱配合物,产率60%。1hnmr(400mhz,cdcl3,δ)10.42(s,2h),9.46(s,2h),8.07(d,j=5.3hz,2h),8.02(d,j=5.3hz,2h),7.89(d,j=8.0hz,2h),7.81–7.72(m,2h),7.62(d,j=7.8hz,2h),7.40(d,j=4.9hz,2h),7.01(d,j=7.5hz,2h),6.96(d,j=6.5hz,2h),6.19(s,2h),3.55(d,j=5.9hz,4h),3.30(dd,j=27.6,13.7hz,4h),2.20(s,8h),2.00(s,4h),1.79–1.71(m,4h),1.44(d,j=7.8hz,8h),1.36(s,4h),0.93(t,j=7.2hz,6h).
实施例4
用天平准确称取80mg(0.06mmol)的实施例1制备的二氯桥,200mg(2.1mmol)碳酸钠;加入磁子,冷凝管,密封,反复多次鼓氮,抽真空,保证无水无氧环境,45℃,反应10h。待反应结束后,反应液冷却到室温,蒸干反应液,萃取,保留有机相,蒸干溶液,中性氧化铝层析柱提纯,产率47.8%。1hnmr(400mhz,cdcl3,δ)8.48(d,j=5.6hz,2h),7.81(d,j=8.2hz,2h),7.77(t,j=7.2hz,2h),7.52(d,j=7.9hz,2h),7.17(t,j=6.5hz,2h),6.81(d,j=8.0hz,2h),6.12(s,2h),5.22(s,1h),3.49–3.47(m,4h),2.47–2.40(m,4h),1.98–1.94(m,4h),1.78(s,6h),1.57(s,2h),0.83(d,j=7.3hz,6h).
实施例5
用天平准确称取88mg(0.06mmol)实施例2制备的二氯桥,200mg(2.1mmol)碳酸钠;加入磁子,冷凝管,密封,反复多次鼓氮,抽真空,保证无水无氧环境,45℃,反应10h。反应结束,蒸干反应液,萃取,蒸干溶液,中性氧化铝层析柱提纯,产率37.4%。1hnmr(400mhz,cdcl3,δ)8.48(d,j=5.0hz,2h),7.81(d,j=7.9hz,2h),7.75–7.69(m,2h),7.45(d,j=7.9hz,2h),7.15–7.10(m,2h),6.72(dd,j=8.0,1.4hz,2h),6.08(d,j=1.1hz,2h),5.23(s,1h),3.18(s,4h),2.11(s,6h),1.79(s,4h),1.73(s,8h),1.44–1.39(m,8h).
将实施例1-3中所得的具有双磷光发射性质的离子型铱配合物在甲醇中进行紫外吸收光谱;所得结果如图1所示:配合物1、2和3在250-300nm范围内都会有强的吸收峰,通常把这个位置的吸收归属于配体自旋允许的il(π-π*)跃迁。而在长波方向的吸收强度较低的吸收峰,一般归属为自旋允许的金属到配体的电荷转移1mlct(dπ(ir)-π*跃迁)和自旋禁阻的3mlct(dπ(ir)-π*跃迁。吸收光谱数据说明了我们后续的研究中可以使用<420nm的激发该配合物发光。
测定实施例3中所得的具有双磷光发射性质的离子型铱配合物在乏氧和富氧条件下的发射光谱;所得结果如图2所示:随着氮气浓度的增加500-550nm的发射逐渐增强,600-650nm的发射变化较小,能够通过对强度的测定来检测氧气浓度,实现对乏氧和富氧的检测。
将实施例3中所得的具有双磷光发射性质的离子型铱配合物在hepg-2细胞中乏氧和富氧生物检测;所得结果如图3所示:在500-550nm通道,乏氧情况下的细胞的发射强度变大,绿光较强;富氧的情况下600-650nm通道的发射强度增大,红光变强,通过细胞中的材料的颜色和发射变化能够实现对乏氧和富氧同时进行检测。
将实施例3中所得的具有双磷光发射性质的离子型铱配合物在活体(斑马鱼)中的乏氧和富氧检测。所得结果如图4所示::在500-550nm通道,乏氧情况下的细胞的发射强度变大,绿光较强;富氧的情况下600-650nm通道的发射强度增大,红光变强,通过活体(斑马鱼)中的材料的颜色和发射变化能够实现对乏氧和富氧同时进行检测。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!