辅因子再生分枝杆菌及其在油水双液相发酵中的应用的制作方法
技术领域:
本发明属于生物催化技术领域,具体涉及一种具有辅因子再生功能的分枝杆菌基因工程菌及其在双液相发酵系统中的应用。
背景技术:
:
雄烯二酮,雄甾-4-烯-3,17-二酮(ad)和雄甾-1,4-二烯-3,17-二酮(add),是生产可的松、盐皮质激素类药物、常规口服避孕药和蛋白同化激素等其他甾体激素类药物的重要中间体,可以通过微生物降解植物甾醇侧链获得。植物甾醇,为疏水性化合物,溶解度很低,易聚集在水相表面,而甾体转化酶属于胞内酶,底物只有扩散进入细胞才能与酶接触而进行转化反应,这就导致植物甾醇与转化酶不能很好的接触,造成转化率偏低,发酵时间长等问题。针对以上问题目前提高雄烯二酮产量的方法主要集中于:1、植物甾醇代谢途径中酶的改造;2、提高底物植物甾醇的溶解性及利用率。
关于植物甾醇代谢途径中酶的改造,主要集中于通过过表达或敲除植物甾醇氧化途径中的酶来提高ad(d)生产效率及产量。例如过表达胆固醇氧化酶及3β-羟基甾体脱氢酶等,或失活3-酮甾体-9α-羟化酶(ksh)以及3-酮甾体-1-脱氢酶(kstd)。研究结果显示敲除某基因以后,会在不同程度上降低植物甾醇的转化率和产率,即造成菌体整体生产强度的下降,限制了工业化生产的应用。所以,目前需要从菌体整体代谢调控方面深入探索、系统研究,以寻求提高雄烯二酮生产效率的方法。
双液相发酵的研究是指在发酵液中加入一种与水不相溶的有机相,促进植物甾醇的溶解。由于环境约束及适应绿色化学的倡导,有机溶剂在工业生产中的利用减少成为趋势,天然油作为“绿色溶剂”是有机溶剂很好的替代物。但是迫于油相体系的植物甾醇转化效率不高,影响了它在雄烯二酮生产中的广泛应用。
一般代谢工程研究主要集中于特定代谢途径中酶编码基因的基因改造,包括基因的过表达或基因敲除。然而,对代谢途径中酶编码基因的直接改造并不一定能带来预期的效果。辅因子依赖的代谢途径不仅受代谢途径中酶的控制,而且还受辅因子浓度及辅因子氧化还原态比值的控制。因此,对代谢工程来说,辅因子改造是一种潜在的强有力的改造菌株的方法。辅因子工程即采用分子生物学手段,改造胞内辅因子再生途径,近而调控微生物胞内辅因子的形式及浓度,定向改变和优化细胞代谢功能,实现代谢流最大化、快速化导向目标代谢产物的工程。它被认为是代谢工程的一个新分支,已经引起了越来越多的关注。
技术实现要素:
:
本发明所要解决的技术问题为克服植物甾醇生物转化过程中菌株代谢缓慢及底物溶解度低的问题,将辅因子再生系统引入到甾体转化微生物中,以提高重组微生物在油水双液相发酵系统中雄烯二酮的转化效率,为解决菌体植物甾醇代谢缓慢提供了新方法,并为油水双液相发酵系统在工业生产雄烯二酮中的广泛应用提供可能。
本发明实现上述目的的技术方案如下:一株产雄烯二酮的基因工程菌,是以新金分枝杆菌为宿主细胞,异源表达nadh氧化酶基因nox-2获得的;
所述nox-2的核苷酸序列如序列表seqidno.1所示
优选地,所述宿主细胞为新金分枝杆菌(mycobacteriumsp.)mnrm3,可从中国工业微生物菌种保藏管理中心(简称cicc)购买获得,编号cicc21097,以cicc21097为宿主细胞,异源表达nadh氧化酶基因nox-2获得的基因工程菌命名为mnrm3n2。
所述基因工程菌mnrm3n2的构建方法,具体如下:
(1)将nox-2基因(seqidno.1)和表达质粒pmv261通过酶切,连接,构建pmv261-nox-2重组质粒;
(2)将重组质粒pmv261-nox-2导入mnrm3的感受态细胞中,获得的阳性转化子即为本发明新构建菌株mnrm3n2。
本发明提供的技术方案之二,是利用上述构建的mnrm3n2菌株在油水双液相体系中发酵生产雄烯二酮的方法,具体如下:
将mnrm3n2按5-10%(v/v)的接种量接种入油水双液相发酵培养基中,28-32℃,130-250r/min,ph6.5-7.8条件下,发酵4-8天;
所述油水双液相发酵培养基组成如下:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,油相10-20%(v/v),其余为水,ph6.5-7.8;
所述油相为植物油,选自大豆油、葵花油、菜籽油、花生油、米糠油或妥尔油中的至少一种;
进一步地,所述油水双液相发酵培养基中还添加0.5-8g/l的乳化剂;
所述的乳化剂为卵磷脂、tween80、span80、蔗糖酯以及单甘酯中的至少一种。
有益效果:
(1)本发明通过对胞内nadh氧化系统进行改造构建了用于植物甾醇生物转化的基因工程菌,解决了油水双液相发酵系统中雄烯二酮转化效率低的问题,并为油水双液相发酵系统在工业生产雄烯二酮中的广泛应用提供可能。
(2)本发明构建的基因工程菌mnrm3n2在油水双液相系统发酵法降解植物甾醇制备雄烯二酮过程中,可使ad(d)产量提高1.4-2.9倍。
附图说明:
图1nox-2基因扩增电泳图;
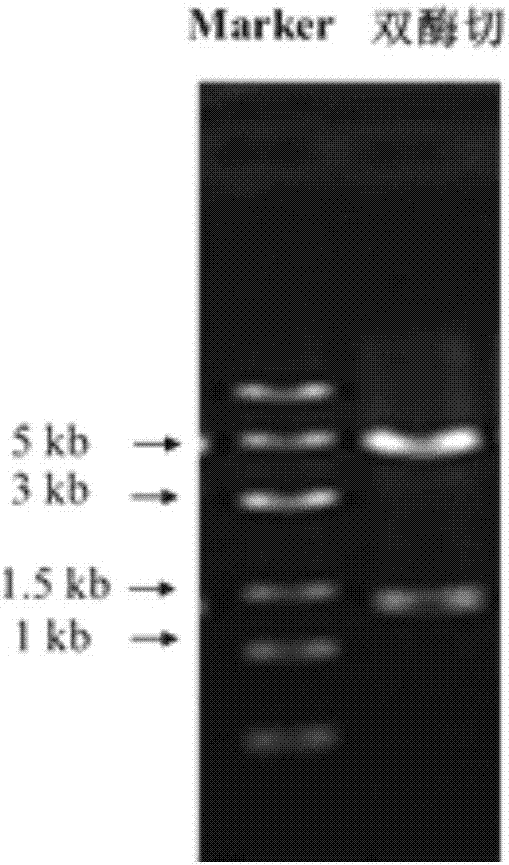
图2阳性转化子pmv261-nox-2质粒双酶切验证图。
具体实施方式:
为了使本专利的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本专利进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本专利,并不用于限定本发明。
实施例1重组菌株mnrm3n2的构建
1、构建pmv261-nox-2质粒,其过程包括:
(1)合成目的基因,根据乳酸乳球菌乳脂亚种(lactococcuslactissubsp.cremoris)nz9000nadh氧化酶基因nox-2的核苷酸序列(geneid:13019046,seqidno.1),将酶切位点(bamhi及sali)添加于nox-2序列的两端,将所设计的序列交由金唯智公司进行基因合成;
(2)pcr扩增目的基因片段nox-2基因(验证图为图1),目的片段nox-2及表达质粒pmv261分别用bamhi和sali双酶切,纯化,连接获得重组质粒pmv261-nox-2。
2、构建菌株mnrm3n2:
(1)分枝杆菌mnrm3感受态细胞制备:一级种子培养至od600为1.0左右,按10%接种量转接到种子培养基中进行二级种子培养;24h后加入2%甘氨酸继续培养24h。离心收集菌体,分四次用10%预冷甘油冲洗悬浮菌体并离心,最后加入甘油悬浮菌体,并分装保存;
种子培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,硝酸铵2g/l,甘油20g/l,葡萄糖5g/l,caco310g/l,其余为水,ph7.2;
(2)电转化:10μl步骤1所得重组质粒加入100μl感受态菌体中放置10min,电击条件如下:1.5kv条件下电转两次,每次4-5ms;
(3)重组子筛选与验证:电转产物加入种子培养基复苏培养3-5h后,涂布于含有卡那霉素(50mg/l)种子培养基平板上,30℃静置培养7d,挑取单菌落至液体种子培养基培养,提取质粒进行双酶切验证(验证图为图2),双酶切理论出现4500bp与1300bp大小的两条带,酶切验证正确的阳性转化子即为重组菌mnrm3n2。
实施例2重组菌mnrm3n2中nad(h)含量及nad+/nadh比例的比较。
1、菌种活化培养:
将重组菌mnrm3n2及原始菌mnrm3转接于新鲜斜面培养基上,29℃培养2-4d,用20ml0.5%的tween80无菌水溶液洗下斜面培养基上的菌种得洗脱液,吸取1ml洗脱液加入到30ml种子培养基中,在29℃,200r/min条件下摇床培养36h得种子液;
斜面培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,硝酸铵2g/l,甘油20g/l,葡萄糖5g/l,caco310g/l,琼脂20g/l,其余为水,ph7.2;
种子培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,硝酸铵2g/l,甘油20g/l,葡萄糖5g/l,caco310g/l,其余为水,ph7.2。
2、菌种酶活及辅酶测定
按7%的接种量,将种子液接种至含有发酵培养基的250ml挡板瓶中,在30℃,150r/min条件下进行培养96小时得发酵液。
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,其余为水,ph7.2。
(1)nadh氧化酶酶活测定:
收集发酵液菌体细胞进行超声破碎,4℃12000r/min离心30min,取上清液即为粗酶液。
酶促反应体系:1ml反应体系由100微升粗酶液,800微升0.1m磷酸盐缓冲液(ph7.0),100微升0.1mmnadh组成;加入上述各组分后启动反应,在340nm吸光度下检测吸光值的变化(nadh在波长340nm之间有特殊吸收峰,而在nadh氧化酶的氧化作用下,其产物nad+却没有吸收峰。因此,测定在340nm波长处样品的吸光值,通过计算反应物溶液在340nm处吸光度的减少量,可以得到nadh氧化酶粗酶酶活。);
1单位nadh氧化酶活(u)性定义为1min氧化1微摩尔nadh所需的酶量。
(2)胞内nad(h)的测量:
①辅因子的提取:
nadh的提取:800μl发酵液里加入400μl预冷的0.3mol/lkoh,留在冰上10min,30℃水浴10min后放回冰上,逐滴加入0.3mol/lhcl中和ph在7.5-8.0间,放置冰上10min,4℃,12000r/min,离心10min,上清液待测。
nad+的提取:800μl发酵液里加入400μl预冷的0.3mol/lhcl,留在冰上10min,50℃水浴10min后放回冰上,逐滴加入0.3mol/lkoh中和ph在7.2-7.4间,放置冰上10min,4℃,12000r/min,离心10min,上清液待测。
②测定及分析方法:
采用酶循环法,向96孔板中加入270μl辅因子循环液(组成为:16.3g/lbicinebuffer,1.52g/ledta,11.2g/lpes,0.17g/lmtt,10%乙醇),30μl步骤①所述上清液(nadh提取上清液或nad+提取上清液),10μl乙醇脱氢酶(250u/ml)引发反应,用酶标仪测定反应液在570nm吸光度随时间的变化曲线,求得酶促反应速率;酶反应速率与辅因子浓度呈线性关系,据此,通过与标准品的反应速率进行对比,能够准确测得样品中辅因子浓度。
3、结果比较
如表1所示,重组分枝杆菌mnrm3n2与原始菌株相比nadh氧化酶酶活有所提高。胞内nadh含量降低,nad+/nadh比例提高。与对照相比,mnrm3n2中nad+/nadh比例提高192%。
表1胞内nadh氧化酶酶活及nad(h)含量测定
实施例3mnrm3n2菌株在水相体系中催化植物甾醇生产雄烯二酮
1、菌种活化培养:
将重组菌mnrm3n2及原始菌mnrm3分别转接于新鲜斜面培养基上,29℃培养3d,用20ml0.5%的tween80无菌水溶液洗下斜面培养基上的菌种,混合均匀得洗脱液,吸取1ml洗脱液加入到30ml种子培养基中,在29℃,200r/min条件下摇床培养36h得种子培养液;
斜面培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,硝酸铵2g/l,甘油20g/l,葡萄糖5g/l,caco310g/l,琼脂20g/l,其余为水,ph7.2;
种子培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,硝酸铵2g/l,甘油20g/l,葡萄糖5g/l,caco310g/l,其余为水,ph7.2。
2、植物甾醇微生物转化:
将步骤1中活化的种子培养液以7%的接种量转接于装有含有5g/l植物甾醇及25mm羟丙基β-环糊精的50ml发酵培养基的250ml挡板瓶中,在29℃,150r/min条件下摇床培养120h;
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,其余为水,ph7.2。
3、雄烯二酮摩尔生成率的检测:
用乙酸乙酯超声萃取发酵液,离心,取乙酸乙酯相0.1ml于1.5ml管中,自然风干后加1ml的流动相,溶解,离心后进行hplc分析。色谱条件:c18柱,流动相为甲醇:水(4:1),流速为1ml/min,柱温为30℃,检测波长为254nm。
4、结果比较:
如表2所示,生物转化48h后,工程菌株mnrm3n2ad(d)生成量为0.68g/l,是原始菌株的1.13倍;72h后,工程菌株mnrm3n2ad(d)生成量为1.85g/l,是原始菌株的0.94倍;96h后,工程菌株mnrm3n2ad(d)生成量为2.50g/l,是原始菌株的1.02倍;120h后,工程菌株mnrm3n2ad(d)生成量为2.81g/l,是原始菌株的1.01倍。表明,在水相体系中,工程菌nadh氧化酶的表达对分枝杆菌转化植物甾醇的能力几乎没有影响。
表2羟丙基β-环糊精体系中ad(d)产量(g/l)
实施例4mnrm3n2菌株在水油双液相体系中催化植物甾醇生产雄烯二酮
1、菌种活化培养同实施例3
2、植物甾醇微生物转化:
将活化的种子培养液以7%的接种量转接于装有含有5g/l植物甾醇的50ml发酵培养基的250ml挡板瓶中,在29℃,150r/min条件下摇床培养192h。
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,大豆油16%(v/v),其余为水,ph7.2。
3、雄烯二酮摩尔生成率的检测:
油相、水相分别取样,离心后按油相:水相=16:84(v/v)混合,再加乙酸乙酯超声萃取发酵液,离心,取乙酸乙酯相0.1ml于1.5ml管中,自然风干后加1ml的流动相,溶解,离心后进行hplc分析。色谱条件:c18柱,流动相为甲醇:水(4:1),流速为1ml/min,柱温为30℃,检测波长为254nm。
4、结果比较:
如表3所示,48h后,工程菌株mnrm3n2ad(d)生成量为0.08g/l,是原始菌株的0.26倍;96h后,工程菌株mnrm3n2ad(d)生成量为0.87g/l,是原始菌株的1.14倍;144h后,工程菌株mnrm3n2ad(d)生成量为1.46g/l,是原始菌株的1.51倍;192h后,工程菌株mnrm3n2ad(d)生成量为1.61g/l,是原始菌株的1.63倍。表明在水油双液相体系中,nadh氧化酶的表达可以明显提高分枝杆菌转化植物甾醇的能力。
表3油相体系中ad(d)产量(g/l)
实施例5mnrm3n2菌株在含有乳化剂的水油双液相体系中催化植物甾醇生产雄烯二酮
1、菌种活化培养同实施例3;
2、植物甾醇微生物转化:
将活化的种子培养液以7%的接种量转接于装有含有5g/l植物甾醇的50ml发酵培养基的250ml挡板瓶中,在29℃,150r/min条件下摇床培养192h。
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,大豆油(16%,v/v),吐温803g/l,其余为水,ph7.2。
3、雄烯二酮摩尔生成率的检测:
油相、水相分别取样,离心后按油相:水相=16:84(v/v)混合,再加乙酸乙酯超声萃取发酵液,离心,取乙酸乙酯相0.1ml于1.5ml管中,自然风干后加1ml的流动相,溶解,离心后进行hplc分析。色谱条件:c18柱,流动相为甲醇:水(4:1),流速为1ml/min,柱温为30℃,检测波长为254nm。
4、结果比较:
如表4所示,48h后,工程菌株mnrm3n2ad(d)生成量为0.38g/l,是原始菌株的1.41倍;96h后,工程菌株mnrm3n2ad(d)生成量为1.51g/l,是原始菌株的1.99倍;144h后,工程菌株mnrm3n2ad(d)生成量为2.88g/l,是原始菌株的2.44倍;192h后,工程菌株mnrm3n2ad(d)生成量为2.90g/l,是原始菌株的2.38倍。表明在水油双液相体系中添加乳化剂(吐温80)后,原始菌及工程菌转化植物甾醇的能力都提高,且从产量比率来看,较实施例4未添加乳化剂时,nadh氧化酶的表达对提高分枝杆菌转化植物甾醇的能力的作用更为明显。
表4豆油及吐温80联用体系中ad(d)产量(g/l)
实施例6mnrm3n2菌株在含有乳化剂的水油双液相体系中催化植物甾醇生产雄烯二酮
1、菌种活化培养同实施例3;
2、植物甾醇微生物转化:
将活化的种子培养液以5%的接种量转接于装有含有5g/l植物甾醇的50ml发酵培养基的250ml挡板瓶中,在29℃,150r/min条件下摇床培养192h。
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,葵花油(10%,v/v),卵磷脂0.5g/l,其余为水,ph7.2。
3、雄烯二酮摩尔生成率的检测:
油相、水相分别取样,离心后按油相:水相=10:90(v/v)混合,再加乙酸乙酯超声萃取发酵液,离心,取乙酸乙酯相0.1ml于1.5ml管中,自然风干后加1ml的流动相,溶解,离心后进行hplc分析。色谱条件:c18柱,流动相为甲醇:水(4:1),流速为1ml/min,柱温为30℃,检测波长为254nm。
4、结果比较:
如表5所示,48h后,工程菌株mnrm3n2ad(d)生成量为0.35g/l,是原始菌株的1.52倍;96h后,工程菌株mnrm3n2ad(d)生成量为1.58g/l,是原始菌株的2.25倍;144h后,工程菌株mnrm3n2ad(d)生成量为2.67g/l,是原始菌株的2.42倍;192h后,工程菌株mnrm3n2ad(d)生成量为2.80g/l,是原始菌株的2.15。表明在水油双液相体系中添加乳化剂(卵磷脂)后,原始菌及工程菌转化植物甾醇的能力都提高,且从产量比率来看,较实施例4未添加乳化剂时,nadh氧化酶的表达对提高分枝杆菌转化植物甾醇的能力的作用更为明显。
表5葵花油及卵磷脂联用体系中ad(d)产量(g/l)
实施例7mnrm3n2菌株在含有乳化剂的水油双液相体系中催化植物甾醇生产雄烯二酮
1、菌种活化培养同实施例3;
2、植物甾醇微生物转化:
将活化的种子培养液以7%的接种量转接于装有含有5g/l植物甾醇的50ml发酵培养基的250ml挡板瓶中,在28℃,250r/min条件下摇床培养192h。
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,菜籽油(18%,v/v),span803g/l,其余为水,ph7.2。
3、雄烯二酮摩尔生成率的检测:
油相、水相分别取样,离心后按油相:水相=18:82(v/v)混合,再加乙酸乙酯超声萃取发酵液,离心,取乙酸乙酯相0.1ml于1.5ml管中,自然风干后加1ml的流动相,溶解,离心后进行hplc分析。色谱条件:c18柱,流动相为甲醇:水(4:1),流速为1ml/min,柱温为30℃,检测波长为254nm。
4、结果比较:
如表6所示,48h后,工程菌株mnrm3n2ad(d)生成量为0.4g/l,是原始菌株的2倍;96h后,工程菌株mnrm3n2ad(d)生成量为1.78g/l,是原始菌株的2.23倍;144h后,工程菌株mnrm3n2ad(d)生成量为2.5g/l,是原始菌株的2.1倍;192h后,工程菌株mnrm3n2ad(d)生成量为2.80g/l,是原始菌株的2.3倍。表明在水油双液相体系中添加乳化剂(span80)后,原始菌及工程菌转化植物甾醇的能力都提高,且从产量比率来看,较实施例4未添加乳化剂时,nadh氧化酶的表达对提高分枝杆菌转化植物甾醇的能力的作用更为明显。
表6菜籽油及span80联用体系中ad(d)产量(g/l)
实施例8mnrm3n2菌株在含有乳化剂的水油双液相体系中催化植物甾醇生产雄烯二酮
1、菌种活化培养同实施例3;
2、植物甾醇微生物转化:
将活化的种子培养液以5%的接种量转接于装有含有5g/l植物甾醇的50ml发酵培养基的250ml挡板瓶中,在32℃,130r/min条件下摇床培养192h。
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,葵花油(10%,v/v),乳化剂3g/l(乳化剂组成tween80:span80=1:1),其余为水,ph7.2。
3、雄烯二酮摩尔生成率的检测:
油相、水相分别取样,离心后按油相:水相=10:90(v/v)混合,再加乙酸乙酯超声萃取发酵液,离心,取乙酸乙酯相0.1ml于1.5ml管中,自然风干后加1ml的流动相,溶解,离心后进行hplc分析。色谱条件:c18柱,流动相为甲醇:水(4:1),流速为1ml/min,柱温为30℃,检测波长为254nm。
4、结果比较:
如表7所示,48h后,工程菌株mnrm3n2ad(d)生成量为0.45g/l,是原始菌株的1.84倍;96h后,工程菌株mnrm3n2ad(d)生成量为1.60g/l,是原始菌株的2.0倍;144h后,工程菌株mnrm3n2ad(d)生成量为2.90g/l,是原始菌株的2.42倍;192h后,工程菌株mnrm3n2ad(d)生成量为2.88g/l,是原始菌株的2.30倍。表明在水油双液相体系中添加乳化剂(tween80及span80)后,原始菌及工程菌转化植物甾醇的能力都提高,且较实施例4未添加乳化剂时,nadh氧化酶的表达对提高分枝杆菌转化植物甾醇的能力的作用更为明显。
表7葵花油及tween80/span80联用体系中ad(d)产量(g/l)
实施例9mnrm3n2菌株在含有乳化剂的水油双液相体系中催化植物甾醇生产雄烯二酮
1、菌种活化培养同实施例3;
2、植物甾醇微生物转化:
将活化的种子培养液以10%的接种量转接于装有含有5g/l植物甾醇的50ml发酵培养基的250ml挡板瓶中,在29℃,200r/min条件下摇床培养192h。
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,花生油(20%,v/v),蔗糖酯3g/l,其余为水,ph7.2。
3、雄烯二酮摩尔生成率的检测:
油相、水相分别取样,离心后按油相:水相=20:80(v/v)混合,再加乙酸乙酯超声萃取发酵液,离心,取乙酸乙酯相0.1ml于1.5ml管中,自然风干后加1ml的流动相,溶解,离心后进行hplc分析。色谱条件:c18柱,流动相为甲醇:水(4:1),流速为1ml/min,柱温为30℃,检测波长为254nm。
4、结果比较:
如表8所示,48h后,工程菌株mnrm3n2ad(d)生成量为0.45g/l,是原始菌株的1.54倍;96h后,工程菌株mnrm3n2ad(d)生成量为1.70g/l,是原始菌株的1.80倍;144h后,工程菌株mnrm3n2ad(d)生成量为2.5g/l,是原始菌株的2.08倍;192h后,工程菌株mnrm3n2ad(d)生成量为2.70g/l,是原始菌株的1.93倍。表明在水油双液相体系中添加乳化剂(蔗糖酯)后,原始菌及工程菌转化植物甾醇的能力都提高,且从产量比率来看,较实施例4未添加乳化剂时,nadh氧化酶的表达对提高分枝杆菌转化植物甾醇的能力的作用更为明显。
表8花生油及蔗糖酯联用体系中ad(d)产量(g/l)
实施例10mnrm3n2菌株在含有乳化剂的水油双液相体系中催化植物甾醇生产雄烯二酮
1、菌种活化培养同实施例3;
2、植物甾醇微生物转化:
将活化的种子培养液以8%的接种量转接于装有含有5g/l植物甾醇的50ml发酵培养基的250ml挡板瓶中,在29℃,150r/min条件下摇床培养192h。
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,米糠油(20%,v/v),乳化剂5g/l(乳化剂组成:蔗糖酯:单甘酯:span=7:2:1),其余为水,ph7.2。
3、雄烯二酮摩尔生成率的检测:
油相、水相分别取样,离心后按油相:水相=20:80(v/v)相比混合,再加乙酸乙酯超声萃取发酵液,离心,取乙酸乙酯相0.1ml于1.5ml管中,自然风干后加1ml的流动相,溶解,离心后进行hplc分析。色谱条件:c18柱,流动相为甲醇:水(4:1),流速为1ml/min,柱温为30℃,检测波长为254nm。
4、结果比较:
如表9所示,48h后,工程菌株mnrm3n2ad(d)生成量为0.38g/l,是原始菌株的2.53倍;96h后,工程菌株mnrm3n2ad(d)生成量为1.46g/l,是原始菌株的2.65倍;144h后,工程菌株mnrm3n2ad(d)生成量为2.53g/l,是原始菌株的2.53倍;192h后,工程菌株mnrm3n2ad(d)生成量为2.65g/l,是原始菌株的2.28倍。表明在水油双液相体系中添加乳化剂(蔗糖酯:单甘酯:span)后,原始菌及工程菌转化植物甾醇的能力都提高,且较实施例4未添加乳化剂时,nadh氧化酶的表达对提高分枝杆菌转化植物甾醇的能力的作用更为明显。
表9米糠油及蔗糖酯/单甘酯/span联用体系中ad(d)产量(g/l)
实施例11mnrm3n2菌株在含有乳化剂的水油双液相体系中催化植物甾醇生产雄烯二酮
1、菌种活化培养同实施例3;
2、植物甾醇微生物转化:
将活化的种子培养液以5%的接种量转接于装有含有5g/l植物甾醇的50ml发酵培养基的250ml挡板瓶中,在29℃,150r/min条件下摇床培养192h。
发酵培养基组成:k2hpo40.5g/l,mgso4·7h2o0.5g/l,柠檬酸铁铵0.05g/l,柠檬酸2g/l,磷酸氢二铵3.5g/l,葡萄糖10g/l,妥尔油(20%,v/v),单甘酯8g/l,其余为水,ph7.2。
3、雄烯二酮摩尔生成率的检测:
油相、水相分别取样,离心后按油相∶水相=20∶80(v/v)混合,再加乙酸乙酯超声萃取发酵液,离心,取乙酸乙酯相0.1ml于1.5ml管中,自然风干后加1ml的流动相,溶解,离心后进行hplc分析。色谱条件:c18柱,流动相为甲醇:水(4:1),流速为1ml/min,柱温为30℃,检测波长为254nm。
4、结果比较:
如表10所示,48h后,工程菌株mnrm3n2ad(d)生成量为0.23g/l,是原始菌株的1.28倍;96h后,工程菌株mnrm3n2ad(d)生成量为1.20g/l,是原始菌株的2.22倍;144h后,工程菌株mnrm3n2ad(d)生成量为2.20g/l,是原始菌株的2.50倍;192h后,工程菌株mnrm3n2ad(d)生成量为2.50g/l,是原始菌株的2.31倍。表明在水油双液相体系中添加乳化剂(单甘酯)后,原始菌及工程菌转化植物甾醇的能力都提高,且较实施例4未添加乳化剂时,nadh氧化酶的表达对提高分枝杆菌转化植物甾醇的能力的作用更为明显。
表10妥尔油及单甘脂联用体系中ad(d)产量(g/l)
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本专利构思的前提下,上述各实施方式还可以做出若干变形、组合和改进,这些都属于本专利的保护范围。因此,本专利的保护范围应以所附权利要求为准。
序列表
<110>天津科技大学
<120>辅因子再生分枝杆菌及其在油水双液相发酵中的应用
<130>1
<141>2017-10-25
<160>1
<170>siposequencelisting1.0
<210>1
<211>1341
<212>dna
<213>乳酸乳球菌乳脂亚种(lactococcuslactissubsp.cremorisnz9000)
<400>1
atgaaaatcgtagttatcggtacaaaccacgcaggcattgctacagcgaatacattactt60
gaacaatatcccgggcatgaaattgtcatgattgaccgtaatagcaacatgagttatcta120
ggttgtggcacagcaatttgggttggaagacaaattgaaaaaccagatgaattattttat180
gccaaagcagaggattttgaggcaaaaggggtaaaaattttgactgaaacagaagtttca240
gaaattgattttgctaataagaaagtttatgcaaaaactaaatctgatgatgaaataatt300
gaagcttacgacaagcttgttttagcaacaggttcacgtccaattattcctaatctacca360
ggcaaagaccttaagggaattcattttctgaaactttttcaagaaggtcaagcaattgac420
gcagaatttgccaaagaaaaagtcaagcgtatcgcagtcattggtgcaggatatatcggt480
acagagattgcggaagcagctaaacgtcggggtaaagaagttcttctctttgacgctgaa540
aatacttcacttgcatcatattatgatgaagaatttgccaaaggaatggatgaaaacctt600
gctcaacatggaattgaacttcattttggagaactggccaaagaatttaaagcgaatgag660
gaaggttatgtatcacaaatcgtaaccaacaaggcgacttatgatgttgatcttgtcatc720
aattgtattggttttactgccaacagtgccttggcaagtgataagttagctaccttcaaa780
aatggcgcaatcaaggtggataagcatcaacaaagtagtgatccagatgtttacgcggta840
ggtgatgttgcgacaatttattctaatgccttgcaagattttacttatatcgctcttgcc900
tcaaacgctgttcggtcaggaattgtcgcaggacacaatattggtggaaaagaattagaa960
tctgttggtgttcaaggttctaatggtatttcgatttttggttacaatatgacttctaca1020
ggactttctgttaaagctgctaaaaaattaggtttagaagtttcatttagtgattttgaa1080
gataaacaaaaagcttggtttcttcatgaaaacaacgatagtgtgaaaattcgtatcgta1140
tatgagacaaaaagtcgcagaattattggagcacaacttgctagtaaaagtgagataatt1200
gcaggaaatataaatatgttcagtttagcgattcaagagaaaaaaacaattgatgaacta1260
gctttgcttgatttattctttctcccccacttcaacagtccatataattatatgacagtt1320
gcagctttgaatgccaaataa1341
- 还没有人留言评论。精彩留言会获得点赞!