一种简单高效产生乙型肝炎病毒重组cccDNA的细胞系统的制作方法
本发明属于微生物动物细胞系领域,涉及一种产生乙型肝炎病毒重组cccdna的细胞系统,具体涉及一种能简单高效产生乙型肝炎病毒(r)cccdna的细胞系统及其建立方法和用途。
背景技术:
现有技术公开了乙型肝炎病毒(hepatitisbvirus,hbv)感染引起的乙型肝炎是严重危害人类健康的重大传染病。据统计,全球有约20亿人感染或曾经感染hbv,其中2.4亿为慢性乙型肝炎(chronichepatitisb,chb)感染患者。据调查显示,慢乙肝患者罹患肝硬化、肝衰竭和肝癌的风险显著增高。虽然近年来慢乙肝的治疗取得了一定的进展,但治疗疗程、耐药及停药后复发等一系列问题仍是目前困扰临床的难题,业内认为,其中一个重要的原因即是hbv特征性的结构分子“共价闭合环状dna(covalentlyclosedcirculardna,cccdna)”的持续存在和难以清除。
研究公开了hbvcccdna由其前体松弛环状dna(rcdna)在宿主dna聚合酶等的作用下形成,其中rcdna可来源于新感染的病毒颗粒或病毒复制过程中新合成的病毒核心颗粒。hbvcccdna在胞核内与病毒core蛋白、宿主组蛋白及多种调控蛋白形成微小染色体(minichromosome)的结构,可转录生成病毒mrna,其中前基因组rna(pregenomicrna,pgrna)是病毒蛋白翻译和逆转录复制的模板,因此,只有清除了细胞核内的cccdna,才有实现完全治愈慢性乙型肝炎的可能;而现有抗病毒药物的作用机制均不直接靶向cccdna,对肝细胞内cccdna的影响较为有限。
受限于体内体外实验模型的局限,目前对cccdna的形成、活性调控和降解等生物学特性的认识仍存在若干空白。目前用于研究hbv的体外细胞模型中,人原代肝细胞获得困难,价格昂贵;hepg2.2.15、hepad38和hepdes19等非感染模型中cccdna形成均很少甚至没有,在这些模型中,质粒替代cccdna成为病毒复制的主要模板;而在heparg、hepg2/huh7-ntcp等感染系统中形成的cccdna仍然很少,难以用southern印迹杂交(southernblot)检测到信号,并且这些感染细胞模型的培养操作比较复杂耗时,限制了它们在高通量筛选中的应用。
近期,中国科学院上海巴斯德研究所邓强课题组报道了一种基于cre/loxp介导的位点特异性重组诱导生成重组cccdna(rcccdna)的策略。
基于现有技术的基础,本发明拟提供一种简单高效产生乙型肝炎病毒重组cccdna的细胞系统,将用于hbvcccdna相关生物学特性研究和抗hbv药物,特别是直接靶向于cccdna的新型药物的筛选评价。
技术实现要素:
本发明的目的在于克服现有hbvcccdna研究模型的不足,建立一种可以简便高效地产生hbv(r)cccdna的细胞系统,将用于hbvcccdna相关生物学特性研究和抗hbv药物的筛选评价。
本发明结合了转座子和cre/loxp两个系统,建立了一种新型的hbv(r)cccdna细胞模型,为hbvcccdna相关研究和药物筛选特别是直接靶向于cccdna的新型药物的筛选评价提供了一个高效的平台。
本发明的目的通过下述技术方案施现:
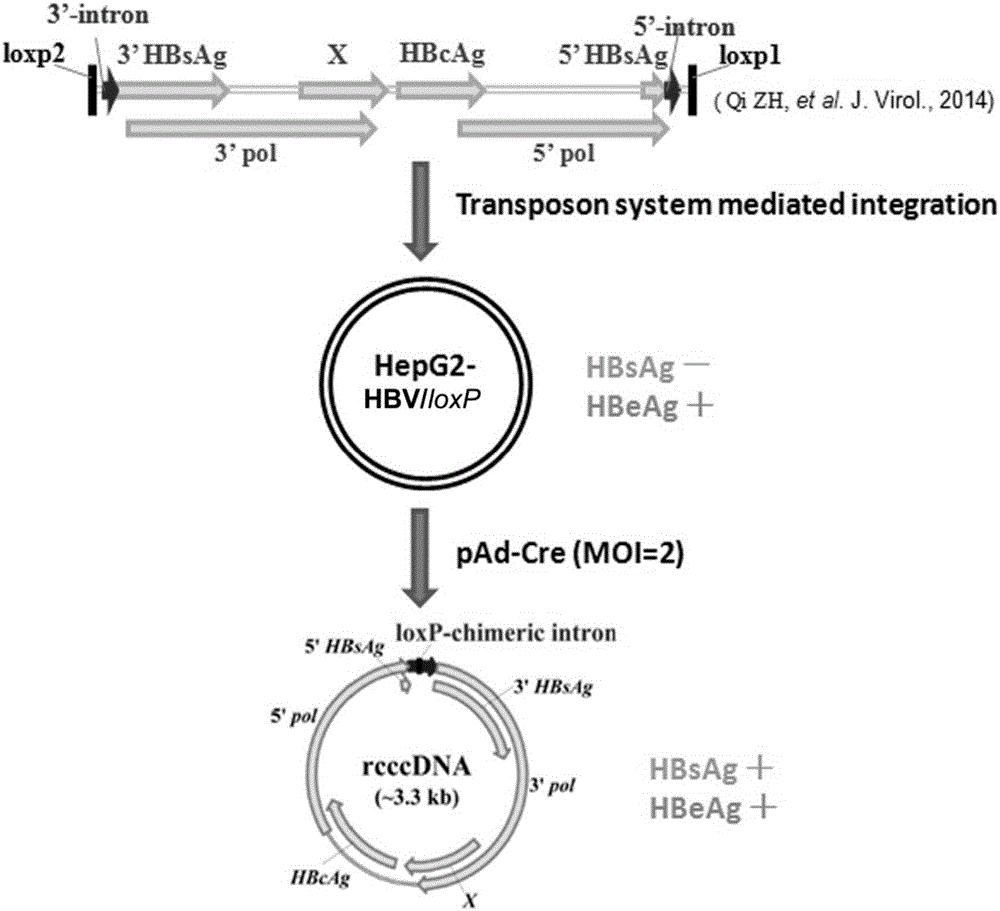
1.采用转座子系统,将两端带有loxp位点的hbv单拷贝基因组整合入hepg2细胞,建立hepg2-hbv/loxp细胞系,共获得包含37株整合有不同拷贝数hbv基因组的克隆株,每个克隆株中整合的hbv基因组拷贝数通过定量pcr进行了定量;
2.hepg2-hbv/loxp细胞系本身不表达乙肝表面抗原(hbsag);当通过腺病毒载体引入cre酶后,即可生成重组的hbvrcccdna并开始表达hbsag;hbsag的表达与rcccdna的产生和水平密切相关。
3.hepg2-hbv/loxp细胞系中生成的rcccdna可通过设计特异引物利用定量pcr进行定量检测;并且可以很容易地利用地高辛标记系统通过southernblot进行检测;
4.hepg2-hbv/loxp细胞系中生成的rcccdna可以很好地支持病毒的生命周期;rcccdna具有minichromosome结构,并且可以支持病毒的转录、复制和蛋白表达;
5.将引入cre酶的hepg2-hbv/loxp细胞系用于α-干扰素(ifn-α)、阿德福韦酯(adefovir)和apobec3a(a3a)的抗病毒效果评价,可以很好地反映出这三种抗病毒试剂的不同作用机制。
本发明的实施例中,通过下述方法建立hepg2-hbv/loxp细胞系:
①质粒构建:psbbi-rcccdna质粒由psbbi-gp载体质粒(addgene#60511)插入两端带有loxp位点的hbv单拷贝基因组构建成;pcmv-sb100为cre重组酶表达质粒(addgene#34879);
②细胞转染:hepg2细胞以高糖dmem培养液(bi公司,含10%胎牛血清,2mm谷氨酰胺)培养,将处于生长对数期的细胞,胰酶消化、计数,按1×106细胞/孔的浓度接种至6孔培养板,培养过夜,待细胞约80-90%融合成片时用于转染,按照每孔转染2μg的量,将1.8μgpsbbi-rcccdna与0.2μgpcmv-sb100稀释于100μl纯dmem培养液中,同时将100μl纯dmem培养液与12μlpei转染试剂(polysciences公司)混合,将稀释后的pei与质粒混和,室温静置20分钟,将混合物均匀滴加入6孔板中,8小时后更换新鲜培养液,继续培养;
③克隆筛选:转染后48小时后,扩大培养至10cm培养皿,待细胞贴壁后加入1μg/ml嘌呤霉素进行筛选,每3天换液一次;4周后,嘌呤霉素抗性单克隆形成,共挑取37株单克隆至96孔培养板扩大培养,每4天传一代,以高糖dmem培养液(bi公司,含10%胎牛血清,2mm谷氨酰胺,1μg/ml嘌呤霉素)培养,批量冻存;
④检测hbv基因组整合拷贝数:采用北京全式金公司easypuregenomicdnakit(#ee101)抽提基因组dna,按试剂盒说明书进行操作,定量pcr试剂采用thunderbirdsybrqpcrmix(toyobo公司,#qps-201),扩增仪采用steponeplus(abi公司),hbv序列以引物5’-atgaccgagtacaagcccacggt-3和5’-ttcgaatcaggcaccgggctt-3’进行扩增,同时扩增19号染色体基因组上相同长度序列作为内参。
进一步,本发明进行了pad-cre转导hepg2-hbv/loxp细胞诱导rcccdna生成实验:其中包括,
①构建pad-cre重组腺病毒:将cre重组酶表达序列插入腺病毒载体padpldest构建pad-cre质粒,pad-cre质粒经paci内切酶酶切后转染hek293细胞产生pad-cre重组腺病毒;
②pad-cre转导:hepg2-hbv/loxp细胞以5×106细胞/皿的浓度接种于10cm培养皿,同时加入1×107pad-cre重组腺病毒(moi=2)进行转导,细胞以含有2%胎牛血清的高糖dmem培养液进行培养,每2天换一次液;
③southernblot检测rcccdna:采用hirt抽提法抽提rcccdna,采用roche公司的地高辛探针标记和检测系统进行southernblot检测(dighighprimednalabelinganddetectionstarterkitiimanual);转导4天后,各克隆株能检测到不同信号强度的rcccdna条带,并与该克隆株整合的hbv基因组拷贝数成正相关(如图2a所示,其中显示了hepg2-hbv/loxp3/6/8三个克隆株的结果);
④检测细胞上清hbsag:采用科华公司的乙型肝炎病毒表面抗原诊断试剂盒(elisa)检测培养上清中hbsag的水平,检测波长设为450nm;结果显示,hepg2-hbv/loxp细胞本身不表达hbsag;经pad-cre转导后才开始表达hbsag,并且不同克隆株的hbsag表达水平与其中生成的rcccdna水平成正相关(如图2b所示,其中显示了hepg2-hbv/loxp3/6/8三个克隆株的结果)。
进一步,本发明进行了rcccdna的相关特性检测(以hepg2-hbv/loxp6号克隆株为例),结果显示,rcccdna的生成快速且稳定,pad-cre转导3天后cre切割及rcccdna生成基本完成(如图3a所示);生成后的rcccdna能在细胞内稳定存在至少12天(如图3b所示);rcccdna的结构特征与hbvcccdna类似:rcccdna可支持病毒的转录、复制和蛋白表达。
以及,进行了hepg2-hbv/loxp6号克隆株用于3种抗病毒试剂的药效评价实验,将引入cre酶的hepg2-hbv/loxp6号克隆株用慢乙肝治疗的常规药物α-干扰素(ifn-α)和核苷(酸)类似物阿德福韦酯(adefovir),及已报道的抗病毒蛋白apobec3a(a3a)进行处理,结果显示,adv处理可以有效地抑制病毒复制中间体dna的水平,对其他病毒指标无显著影响;ifn-α处理可以显著地抑制病毒pgrna的水平,在后期对病毒复制也有一定的降低;而作用机制靶向于病毒cccdna的a3a,则可以显著降低rcccdna的水平,进而带来所有病毒指标的下降;表明,本发明的hepg2-hbv/loxp细胞系可用于不同机制抗病毒药物的筛选评价。
本发明建立一种可以简便高效地产生hbv(r)cccdna的细胞系统,建立的细胞系统可为hbvcccdna相关生物学研究和抗hbv药物的筛选和评价提供一个高效、稳定可靠的平台。
附图说明
图1.hepg2-hbv/loxp细胞系建立及rcccdna诱导产生示意图。
图2.hepg2-hbv/loxp代表性克隆株pad-cre转导后rcccdna的产生和hbsag的表达。
图3.rcccdna产生快速而稳定,结构特征与真实cccdna类似。
图4.rcccdna可以支持病毒的转录、复制和蛋白表达。
图5.hepg2-hbv/loxp细胞系用于抗病毒效果评价。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围,本发明的保护范围也不限于下述的实施例。
实施例1hepg2-hbv/loxp细胞系的建立
①质粒构建:psbbi-rcccdna质粒由psbbi-gp载体质粒(addgene#60511)插入两端带有loxp位点的hbv单拷贝基因组构建而成;pcmv-sb100为cre重组酶表达质粒(addgene#34879)。
②细胞转染:hepg2细胞以高糖dmem培养液(bi公司,含10%胎牛血清,2mm谷氨酰胺)培养。将处于生长对数期的细胞,胰酶消化、计数。按1×106细胞/孔的浓度接种至6孔培养板。培养过夜,待细胞约80-90%融合成片时用于转染。按照每孔转染2μg的量,将1.8μgpsbbi-rcccdna与0.2μgpcmv-sb100稀释于100μl纯dmem培养液中,同时将100μl纯dmem培养液与12μlpei转染试剂(polysciences公司)混合。将稀释后的pei与质粒混和,室温静置20分钟。将混合物均匀滴加入6孔板中,8小时后更换新鲜培养液,继续培养。
③克隆筛选:转染后48小时后,扩大培养至10cm培养皿,待细胞贴壁后加入1μg/ml嘌呤霉素进行筛选,每3天换液一次。4周后,嘌呤霉素抗性单克隆形成,共挑取37株单克隆至96孔培养板扩大培养。每4天传一代,以高糖dmem培养液(bi公司,含10%胎牛血清,2mm谷氨酰胺,1μg/ml嘌呤霉素)培养,批量冻存。
④hbv基因组整合拷贝数的检测:采用北京全式金公司easypuregenomicdnakit(#ee101)抽提基因组dna,按试剂盒说明书进行操作。定量pcr试剂采用thunderbirdsybrqpcrmix(toyobo公司,#qps-201),扩增仪采用steponeplus(abi公司)。hbv序列以引物5’-atgaccgagtacaagcccacggt-3和5’-ttcgaatcaggcaccgggctt-3’进行扩增。同时扩增19号染色体基因组上相同长度序列作为内参。
实施例2pad-cre转导hepg2-hbv/loxp细胞诱导rcccdna生成
⑤pad-cre重组腺病毒的构建:将cre重组酶表达序列插入腺病毒载体padpldest以构建pad-cre质粒,pad-cre质粒经paci内切酶酶切后转染hek293细胞以产生pad-cre重组腺病毒。
⑥pad-cre转导:hepg2-hbv/loxp细胞以5×106细胞/皿的浓度接种于10cm培养皿,同时加入1×107pad-cre重组腺病毒(moi=2)进行转导。细胞以含有2%胎牛血清的高糖dmem培养液进行培养,每2天换一次液。
⑦southernblot检测rcccdna:采用hirt抽提法抽提rcccdna,采用roche公司的地高辛探针标记和检测系统进行southernblot检测(dighighprimednalabelinganddetectionstarterkitiimanual)。转导4天后,各克隆株能检测到不同信号强度的rcccdna条带,并与该克隆株整合的hbv基因组拷贝数成正相关,图2a显示了hepg2-hbv/loxp3/6/8三个克隆株的结果。
⑧细胞上清hbsag的检测:采用科华公司的乙型肝炎病毒表面抗原诊断试剂盒(elisa)检测培养上清中hbsag的水平,检测波长设为450nm。结果显示,hepg2-hbv/loxp细胞本身不表达hbsag;经pad-cre转导后才开始表达hbsag,并且不同克隆株的hbsag表达水平与其中生成的rcccdna水平成正相关,图2b显示了hepg2-hbv/loxp3/6/8三个克隆株的结果。
实施例3rcccdna的相关特性检测(以hepg2-hbv/loxp6号克隆株为例)
①rcccdna的生成快速且稳定:在pad-cre转导后的相应时间点收集细胞,抽提基因组dna和rcccdna,分别对基因组中整合的hbv序列和rcccdna进行定量pcr检测;其中rcccdna定量采用针对于rcccdna上特异性内含子序列的引物进行检测。结果表明,hepg2-hbv/loxp6号克隆株中整合的hbv基因组拷贝数为~60拷贝;pad-cre转导3天后,细胞基因组中整合的hbv序列基本检测不到了,而生成的rcccdna拷贝数达到~60拷贝/细胞,表明pad-cre转导3天后,cre切割及rcccdna生成基本完成(图3a)。生成后的rcccdna能在细胞内稳定存在至少12天(图3b)。
②rcccdna的结构特征与hbvcccdna类似:呈现超螺旋状态(图3c,对ecori内切酶敏感而对t5核酸外切酶不敏感);采用染色质免疫共沉淀(chip)技术可检测到rcccdna上存在着多种与hbvcccdna类似的组蛋白修饰位点(图3d)。
③rcccdna可支持病毒的转录、复制和蛋白表达:采用northernblot和southernblot技术分别检测了细胞内hbvmrnas和复制中间体dnas;采用elisa和定量pcr分别检测了细胞培养上清中hbsag/hbeag和hbvdna的含量;采用免疫荧光技术检测了细胞内hbsag和core蛋白的表达。如图4a-e显示,hepg2-hbv/loxp6号克隆株本身除表达微量的hbeag外,并不表达hbsag,不产生病毒转录体和复制产物;在pad-cre转导后,可以检测细胞内hbvmrnas、复制中间体dnas和培养上清中hbsag和hbvdna的的产生并随时间积累而增加;在细胞内也可以检测到hbsag和core蛋白的表达(图4f)。
实施例4hepg2-hbv/loxp6号克隆株用于3种抗病毒试剂的药效评价
将引入cre酶的hepg2-hbv/loxp6号克隆株用慢乙肝治疗的常规药物α-干扰素(ifn-α)和核苷(酸)类似物阿德福韦酯(adefovir),及已报道的抗病毒蛋白apobec3a(a3a)进行处理,以评价该细胞株在抗hbv药物筛选、评价中的应用价值。
如图5a所示,hepg2-hbv/loxp6号克隆株细胞经pad-cre转导3天后,分别加入ifn-α1000iu/ml,adv1μm或转染a3a表达质粒plenti6.3-a3a处理12天,每3天更换一次新鲜培养液。分别在相应时间点收集细胞及培养上清。细胞用于抽提hbvrna、复制中间体dna和rcccdna,定量pcr检测;培养上清用于elisa检测hbsag和hbeag。
结果显示(图5b-e),adv处理可以有效地抑制病毒复制中间体dna的水平,对其他病毒指标无显著影响;ifn-α处理可以显著地抑制病毒pgrna的水平,在后期对病毒复制也有一定的降低;而作用机制靶向于病毒cccdna的a3a,则可以显著降低rcccdna的水平,进而带来所有病毒指标的下降;这些结果与三种抗病毒试剂的作用机制相吻合。因此,hepg2-hbv/loxp细胞系可以很好地用于不同机制抗病毒药物的筛选评价。
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但显然本领域的技术人员可根据本文说明,在本发明的范围内对本发明做出一些修改的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!