一种具有降解无机磷和防病双重作用的解淀粉芽孢杆菌的制作方法
本发明属于农业微生物领域,具体涉及一种具有降解无机磷及防病双重作用的解淀粉芽孢杆菌,还涉及含有该解淀粉芽孢杆菌的微生物菌剂,以及它们在防治作物病害与促进作物生长方面的应用。
背景技术:
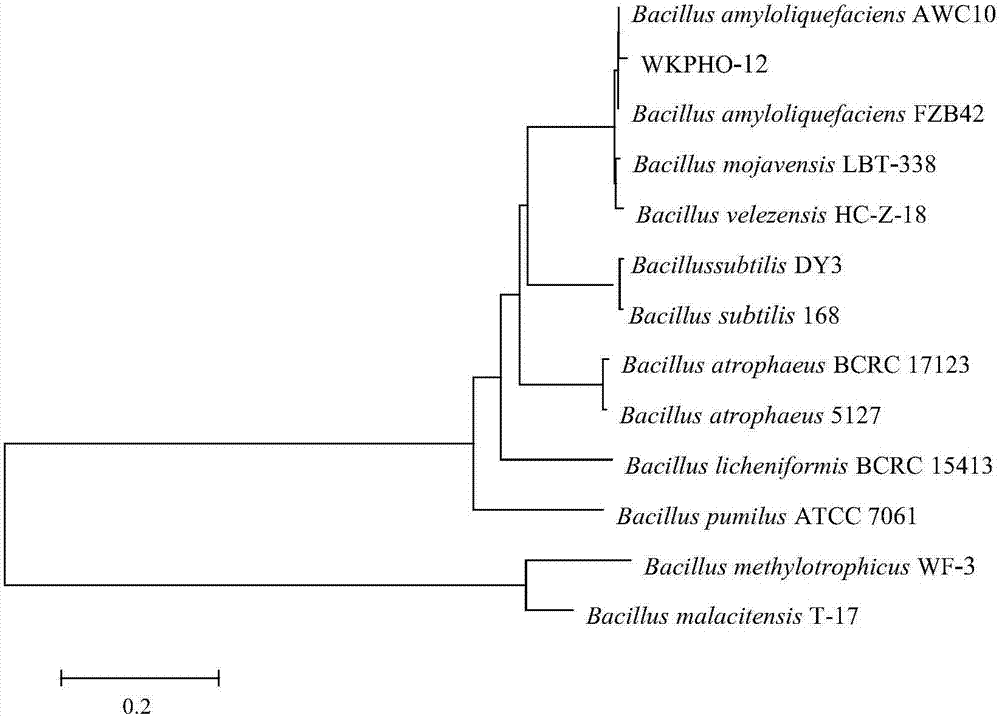
:磷不仅是植物营养中的三大要素之一,同时也是植物体内有机化合物的重要组成成分,对植物的生长发育起着不可或缺的作用。尽管土壤中的含磷量较高,但是其中95%左右的磷为无效形式,可被植物直接吸收利用的无机态磷只占全磷量的2~3%。我国有74%的耕地土壤缺磷,若长期施用化学肥料来补充土壤中的磷,会造成土壤中养分比例失调和土壤理化性质改变。提高土壤中磷的利用率是解决磷素缺乏的关键。解磷菌是一类能将土壤中难溶性或不溶性的磷转化成易于被植物可吸收利用磷的微生物,除此之外,解磷菌还能促进土壤中有益微生物的代谢活动,改善植物根部营养,提高作物产量。目前,已知的解磷细菌多集中在芽孢杆菌属(Bacillus),如解淀粉芽孢杆菌(CN105385638A、CN105420156A)、枯草芽孢杆菌(Bacillussubtilis,CN104263679A、CN103773709A)、巨大芽孢杆菌(Bacillusmegaterium,吴海燕等,吉林农业大学学报,2014(2):171-175;张维娜等,吉林农业科学2012年05期2012)、侧孢芽孢杆菌(Bacilluslaterosporus,宫占元等,黑龙江八一农垦大学学报,2005,17(5):14~17)等。这些已知的解磷菌中均未涉及解磷菌的抑菌防病作用。茄子黄萎病是由大丽轮枝菌(Verticilliumdahliae)引起的一种土传病害。近年来,随着保护地茄子种植面积迅速扩大,其特殊的光温、水肥等条件及连作使茄子黄萎病逐年加重。茄子感病后坐果少、植株早衰甚至死亡。一般发病率在15~20%,严重者发病率达30~50%,对茄子的产量和质量影响极大。目前,生产上防治茄子黄萎病的方法主要是嫁接防治与化学防治。但嫁接工作量大,推广困难;而长期大量使用化学农药导致药剂残留及抗药性的产生。因此,利用有益微生物防治茄子黄萎病是一种有应用前景的防治措施。目前用于防治茄子黄萎病的芽孢杆菌主要有解淀粉芽孢杆菌(CN105238723A)、枯草芽孢杆菌(Bacillussubtilis,CN102925394A;CN102154186A;鲁红学等,湖北农业科学,2013,52(21):5199-5202;程磊等,长江大学学报,自然科学版,2012年06期;孙义等,江苏农业学报,2008,24(4):425-430;林玲等,中国生物防治学报,2010(s1):40-46)、多粘类芽孢杆菌(Paenibacilluspolymyxa,CN103773708A;郑园园等.中国植物病理学会学术年会,2008)等。上述已知的芽孢杆菌功能相对单一,或仅具有解磷作用,或仅具有防治病害作用;其次,随着环境条件的改变,或者病原菌的进化,芽孢杆菌的功能也可能随之进化,发生改变,因此,从土壤中分离、筛选具有高效溶磷功能,且抑菌谱广的芽孢杆菌,对于调节土壤磷素的供需矛盾,提高对植物病害防效,降低生产成本、保护生态环境,促进农业的可持续发展具有重要意义。技术实现要素:本发明目的在于提供一种解淀粉芽孢杆菌菌株,该菌株具有降解无机磷和防治茄子黄萎病等双重作用。本发明第二目的在于提供上述解淀粉芽孢杆菌的用途。本发明第三目的在于提供一种含有上述解淀粉芽孢杆菌的微生物菌剂。本发明第四目的在于提供上述微生物菌剂的制备方法。本发明第五目的在于提供上述微生物菌剂的用途。为实现上述目的,本发明通过以下技术方案实现:一种解淀粉芽孢杆菌(Bacillusamyloliquefaciens)菌株WKPHO-12,其保藏编号为CGMCCNo.14954。上述菌株WKPHO-12在降解无机磷上的应用。上述菌株WKPHO-12在降解土壤无机磷上的应用。上述菌株WKPHO-12在促进作物生长上的应用。上述菌株WKPHO-12在防治植物病害上的应用。上述应用中所述的植物病害是指茄子黄萎病(VerticilliumdahliaeKleb)、黄瓜枯萎病(F.oxysporumf.sp.cucumebrium)、棉花枯萎病(F.oxysporumf.sp.vasinfectum)或马铃薯黑痣病(R.solani)等。上述菌株WKPHO-12在防治茄子黄萎病和降解土壤无机磷上的应用。本发明还提供了含有上述解淀粉芽孢杆菌菌株WKPHO-12的微生物菌剂。上述微生物菌剂,其剂型为液体制剂或固体制剂。上述微生物菌剂中菌株WKPHO-12的活菌数为2.0×106~2.0×108cfu/mL或2.0×106~2.0×108cfu/g。上述微生物菌剂,其液体制剂的制备方法,包括以下步骤:(1)菌种活化:将低温保存的WKPHO-12菌株在LB平板培养基上活化,挑取单菌落在LB斜面培养基上25~35℃培养10~16小时,得活化的菌株;(2)种子液制备:用无菌的接种环刮取一环步骤(1)活化的菌株接种到100mLLB液体培养基中,在25~35℃、摇床转速为150~220rpm的条件下培养10~16小时,得种子液;(3)发酵培养:按照体积比为1~3%的比例将步骤(2)的种子液接入到玉米粉黄豆粉培养基(pH值为7.2)中,在温度为25~35℃、摇床转速为150~220rpm的条件下发酵培养36~40h,得发酵液;然后每隔30分钟检测发酵液中菌体和芽孢数量,待发酵液中成熟芽孢占到芽孢和菌体总数的90%时停止发酵培养;所得即为WKPHO-12菌株的液体制剂。上述制备方法步骤(1)中所述LB平板培养基或LB斜面培养基的组成成分及其重量比为:胰蛋白胨8~12g,酵母提取物4~6g,氯化钠4~6g,琼脂粉12~18g,水1000mL。上述制备方法步骤(2)中所述LB液体培养基的组成成分及其重量比为:胰蛋白胨8~12g,酵母提取物4~6g,氯化钠4~6g,水1000mL。所述的LB平板培养基、LB斜面培养基或LB液体培养基均按照常规方法制备。上述制备方法步骤(3)中所述的玉米粉黄豆粉培养基,其组成成分及其重量百分比为:玉米粉1.0~3.0%,黄豆粉1.0~3.0%,NaCl0.1~1.0%,MnSO4·H2O0.5~1.0%,其余为水。所述的玉米粉黄豆粉培养基的制备方法,按照重量百分比将玉米粉、黄豆粉、NaCl和MnSO4·H2O混合,再加水,调节pH搅拌均匀即可。上述微生物菌剂在在降解无机磷上的应用。上述微生物菌剂在降解土壤无机磷上的应用。上述微生物菌剂在促进作物生长上的应用。上述微生物菌剂在在防治植物病害上的应用。上述应用中所述的植物病害是指茄子黄萎病(VerticilliumdahliaeKleb)、黄瓜枯萎病(F.oxysporumf.sp.cucumebrium)、棉花枯萎病(F.oxysporumf.sp.vasinfectum)或马铃薯黑痣病(R.solani)等。上述微生物菌剂在防治茄子黄萎病和降解土壤无机磷上的应用。上述微生物菌剂的使用方法:将上述微生物菌剂用水稀释至活菌体数为107cfu/mL,于茄子播种前浸种半小时;或将上述微生物菌剂用碳酸钙吸附,制作成WKPHO-12粉剂,于茄子播种前按照药种比1:10拌种。本发明还提供了以上述菌株WKPHO-12为受体菌的基因工程菌。所述基因工程菌提高了降解无机磷的能力,或提高了对病原菌的防效,或降解无机磷和对病原菌的防效的双重功能都得到提高。本发明具有的优点和有益效果:(1)本发明解淀粉芽孢杆菌WKPHO-12是一种既能降解无机磷,又能防治植物病害的具有双重功能的微生物,能实现一菌多用。应用本菌,不仅可以提高土壤中无机磷的利用率,减少磷肥施用量,促进作物生长,降低生产成本,而且对茄子黄萎病等多种病害的具有较高防效,平均防效在70.0%以上。(2)本发明菌株WKPHO-12抑菌谱广,不仅对茄子黄萎菌具有抑制作用,而且对黄瓜枯萎菌、棉花枯萎菌及马铃薯黑痣菌等也具有较好的抑制作用。(3)本发明菌株WKPHO-12对病原菌的专化性强,不易产生抗药性,药效持久性强,减少了施药量和施药次数。(4)本发明微生物菌剂对人、畜安全,没有环境污染;(5)本发明微生物制剂制备方法简单、成本低、使用简单。生物保藏本发明解淀粉芽孢杆菌(Bacillusamyloliquefaciens)菌株WKPHO-12是本发明的发明人自行筛选得到,该菌株己于2017年11月22日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,其保藏编号为:CGMCCNo.14954。附图说明图1.为根据16SrDNA序列获得的WKPHO-12菌株系统发育树图。图2.为根据gyrB基因序列获得的WKPHO-12菌株系统发育树图。具体实施方式下面以具体实施例来进一步清楚地解释本发明,但是不以任何方式构成对本发明的限制。下述实施例中的实验方法,如无特别说明,均为常规方法;下述实施例中的百分含量,如无特别说明,均为重量百分含量。以下实施例中涉及的供试病原菌菌株茄子黄萎菌EVD-1,分离自分离自保定市清苑县张登镇张登店村茄子病果,经保定微控生物科技有限公司分离纯化,经河北农业大学鉴定为大丽轮枝菌(Verticilliumdahaliae),致病力测定表现为强致病力。以下实施例中所用的供试茄子品种农大601,为河北农业大学育成的品种。实施例1本发明菌株WKPHO-12的分离筛选过程和分类鉴定(一)本发明菌株的分离筛选过程:2015年9月在河北省张家口市逐鹿县矾山磷矿地区五点采集土样5份,每份200g。分别称取1.0g风干土样加入带灭菌玻璃珠的三角瓶中,再加入99mL无菌水,静置20min,在摇床上30℃、180r/min充分振荡30min,然后按10倍稀释法进行梯度稀释,分别取10-3、10-4、10-5的稀释液100μL,涂布于解无机磷培养基上,每个浓度3个重复;涂好后在洁净台中静置5-10min,待菌液吸附进培养基内,于35℃恒温培养5~7d。通过透明圈法、钼锑抗比色法筛选具有降解无机磷能力的菌株,同时以茄子黄萎病为靶标,通过平板对峙法和盆栽试验法进行筛选,最终筛选出具有解磷和防治茄子黄萎病双重功能的菌株,将该菌株命名为WKPHO-12。(二)WKPHO-12菌株的分类鉴定:(1)形态特征鉴定在LB培养基上菌体为杆状,培养10h后产生芽胞,芽胞中生,椭圆形,胞囊不膨大,抗酸染色阴性,无伴胞晶体,能运动,鞭毛周生。在营养琼脂平板上,培养初期菌落淡乳白色,脓状,圆形,边缘整齐,菌落隆起呈馒头状,表面湿润;培养后期菌落淡黄色,边缘不整齐,表面干燥有褶皱;在营养琼脂斜面上划线培养,呈直线形;在液体培养基中静止培养,表面形成白色菌膜。这些形态特征与《常见细菌系统鉴定手册》(东秀珠等编著.科学出版社.2001年)中描述的芽孢杆菌属形态特征基本一致,初步判断WKPHO-12菌株属于芽孢杆菌。(2)利用16SrDNA序列鉴定分类以WKPHO-12的基因组DNA为模板,以通用引物F27和R1492为引物进行PCR扩增,所述的引物序列为:F27:5’-AGAGTTTGATCATGGCTCAG-3’;R1492:5’-GGCTACCTTGTTACGACTT-3’;其中PCR的反应体系(50μL)为:10×PCRBuffer(Mg2+)5μL,dNTPMixture(2.5mM)5μL,Taq(5U/μL)1μL,F27(10μmol/L)1μL,R1492(10μmol/L)1μL,WKPHO-12的基因组DNA50ng;ddH2O补足至50μL。PCR的反应条件为95℃5min;95℃30s,55℃30s,72℃1.5min,30个循环;72℃10min。将所得PCR扩增产物进行凝胶电泳,送交上海生工生物工程有限公司测序,得到WKPHO-12的16SrDNA序列(见SEQIDNo:1)。将所得WKPHO-12的16SrDNA序列在Genbank中进行同源性比较,结果发现菌株WKPHO-12与芽孢杆菌属的16SrDNA同源性达到99%;同时利用MEGA软件构建系统发育树,结果(见图1)WKPHO-12与芽孢杆菌属聚合到一起,说明WKPHO-12属于芽孢杆菌属(Bacillus)。(3)利用gyrB基因序列鉴定分类以WKPHO-12基因组DNA为模板,以芽孢杆菌gyrB基因简并引物gyrB-F和gyrB-R为引物进行PCR扩增,得PCR扩增产物;其中所述的gyrB-F和gyrB-R引物的序列为:gyrB-F:5’-TTGRCGGHRGYGGHTATAAAGT-3’;gyrB-R:5’-TCCDCCSTCAGARTCWCCCTC-3’;gyrB的PCR扩增反应体系为50μL:10×PCRBuffer(Mg2+)5μL,dNTPMixture(2.5mM)5μL,Taq(5U/μL)1μL,gyrB-F(10μmol/L)1μL,gyrB-R(10μmol/L)1μL,WKPHO-12基因组DNA50ng,ddH2O补足至50μL。PCR的反应条件为95℃5min;95℃30s,55℃45s,72℃1min,30个循环;72℃10min。将扩增产物送交上海生工生物工程有限公司测序,得WKPHO-12菌株的gyrB基因序列(见SEQIDNo:2)。将获得的WKPHO-12菌株的gyrB基因序列在Genbank中进行同源性比较,结果发现WKPHO-12与解淀粉芽孢杆菌的gyrB基因序列同源性最高,达到99%;同时利用MEGA软件构建系统发育树,结果(见图2)WKPHO-12菌株与解淀粉芽孢杆菌聚合到一起,说明WKPHO-12为解淀粉芽孢杆菌(Bacillusamyloliquefaciens),并且是一个新菌株。综合以上形态特征、16SrDNA和gyrB基因序列同源性对比分析的结果,可知WKPHO-12属于解淀粉芽孢杆菌(Bacillusamyloliquefaciens),并且和现有的解淀粉芽孢杆菌菌株不同,是一个新的解淀粉芽孢杆菌菌株。实施例2本发明含有WKPHO-12菌株的微生物菌剂的制备按照如下步骤进行:(1)菌种活化:将保存于-80℃的解淀粉芽孢杆菌菌株WKPHO-12(其保藏编号为CGMCCNo.14954)在LB平板培养基上进行活化(30℃),挑取单菌落在LB斜面培养基上在30℃下培养12小时,得活化的菌株;LB平板培养基或LB斜面培养基的组成成分及其重量比为:胰蛋白胨10g,酵母提取物5g,氯化钠5g,琼脂粉15g,水1000mL;(2)种子液的制备:在250mL三角瓶中装入LB液体培养基(其组成成分及其重量比为:胰蛋白胨10g,酵母提取物5g,氯化钠5g,水1000mL)100mL,高压湿热灭菌,待温度降到室温后,每瓶中接入一接种环步骤(1)中活化好的菌株,在30℃、摇床转速180rpm的条件下进行振荡培养12小时,得种子液;(3)玉米粉黄豆粉培养基的制备:按照重量百分比将玉米粉2.5%,黄豆粉2.5%,NaCl0.6%,MnSO4·H2O0.6%加入水中,搅拌混合均匀,即得玉米粉黄豆粉培养基;分装于500mL三角瓶中,每瓶200mL;在121℃对玉米粉黄豆粉培养基进行灭菌30分钟,再降温到30℃备用;(4)发酵培养:向步骤(3)所得每瓶玉米粉黄豆粉培养基200mL中接种步骤(2)所得种子液2mL;在30℃、摇床转速180rpm条件下进行发酵培养36小时,以后每隔30分钟从三角瓶中取样进行镜检,对视野中的芽孢和总菌体数进行计数,并计算芽孢率(芽孢率(%)=成熟芽孢数/(成熟芽孢数+菌体数)×100);芽孢率达到90%时停止发酵培养;共发酵培养48小时,得解淀粉芽孢杆菌WKPHO-12的液体制剂。采用平板菌落计数法测定,所得WKPHO-12液体制剂的活菌含量为2.3×108cfu/mL。实施例3本发明菌株WKPHO-12降解无机磷能力定性测定试验按照如下方法进行:用灭菌牙签将实施例2步骤(1)中活化好的WKPHO-12菌株点接接种在解无机磷平板培养基(其组成成分及其重量比为:葡萄糖10.0g,(NH4)2SO40.5g,MgSO4·7H2O0.5g,NaCl0.2g,Ca3(PO4)25.0g,KCl0.2g,MnSO40.03g,FeSO40.003g,琼脂20.0g,蒸馏水1000mL,pH:7.0-8.0)上,然后置于30℃恒温培养箱培养5天,测量透明圈直径及菌落的直径。结果本发明菌株WKPHO-12在含有Ca3(PO4)2的无机磷平板培养基上产生直径13.6毫米的透明圈,说明本发明WKPHO-12菌株能够很好降解无机磷Ca3(PO4)2,具有降解土壤中无机磷的潜力。实施例4本发明菌株WKPHO-12降解无机磷能力定量测定试验本试验于2016年2月上旬在保定微控生物科技有限公司人工气候室内进行。按照如下方法进行:(1)发酵培养基制备:按照比例将葡萄糖10.0g,(NH4)2SO40.5g,MgSO4·7H2O0.5g,NaCl0.2g,Ca3(PO4)25.0g,KCl0.2g,MnSO40.03g,FeSO40.003g加入到蒸馏水1000mL中,混合均匀,即得发酵培养基(pH:7.0~8.0)。将发酵培养基100mL装入300mL锥形瓶中,高温高压灭菌,待用。(2)发酵液制备:将实施例2步骤(2)所得的WKPHO-12菌株种子液和空白对照培养液(不接种WKPHO-12菌株的LB液体培养基)分别按照重量百分比为2%的比例接种到步骤(1)制备的发酵培养基中,每组3个重复,在30℃、180r/min培养6d,得发酵液。(3)发酵液处理:将培养好的发酵液转移至无菌的离心杯中,采用KQ5200DE型数控超生波清洗器进行超声波细胞破碎,破碎条件:200-240V,2A,50/60Hz,时间20min。使之释放出细胞内的有效磷。以8000r/min的转速离心10min后取2.5mL上清液于50mL比色管中,加2滴2,4-二硝基苯酚作指示剂,用10%NaOH和5%稀硫酸溶液调节pH值至溶液刚呈微黄色,加钼锑抗显色剂5mL,定容,反应30min后。用T6新世纪紫外可见分光光度计测定上清液在720nm处的OD值。根据标准曲线得出上清液中的有效磷含量。(4)结果计算:由样品溶液比色所得吸收值在工作曲线上算出相应的比色溶液的含磷量(mg/L),再按下式计算发酵液中有效磷含量:有效磷(mg/L)=比色液的磷(mg/L)×稀释倍数。结果(见表1)接种本发明WKPHO-12菌株的发酵培养液中可溶性磷含量与空白对照相比增加到68.49mg/L,说明本发明WKPHO-12菌株具有降解无机磷磷酸三钙的能力。表1本发明WKPHO-12菌株降解无机磷能力定量测定试验结果菌株编号OD720(nm)可溶性磷含量(mg/L)WKBS-261.35268.49CK0.20310.27实施例5本发明菌株WKPHO-12对茄子植株的促进生长作用试验(一)试验材料:(1)基质:沙子+底物其中:沙子预先用水冲洗3遍,风干备用,pH6.0左右;底物:磷酸三钙,1g/kg基质。(二)试验处理:(1)处理:磷酸三钙+WKPHO-12发酵液+缺磷营养液;(2)对照:磷酸三钙+原发酵培养基+缺磷营养液。(三)试验方法:本试验于2016年6月上旬在保定微控生物科技有限公司实验室内进行。在营养钵中培育农大601茄子苗,于第一片真叶展开时移栽至装沙量3.5kg/盆的花盆中(高:20cm、盆口直径:21cm、盆底直径:14cm),每盆2株,置于温室中培养,缓苗后开始试验。试验设置:处理为浇灌250mL实施例4步骤(2)制备的WKPHO-12菌株发酵液稀释液(浓度为1×107CFU/mL)于作物根部,空白对照为浇灌等量的实施例4步骤(1)制备的原发酵培养基稀释液。重复3次,每重复3盆。期间正常管理,适时补充水分,每次400mL/盆;7d浇一次缺磷营养液(缺磷营养液的组成成分见专利申请201110107663X),每次250mL/盆。50d后测定茄子的株高、地上部鲜重和地下部鲜重、基质中的有效磷以及茄子植株体内磷含量等指标。结果(见表2)经过解淀粉芽孢杆菌WKPHO-12发酵液处理的茄子株高增高了3.17%,与对照无显著性差异;地上部、地下部鲜重增长率分别为24.76%和35.55%,与空白对照之间均存在显著性差异。上述结果说明本发明解淀粉芽孢杆菌WKPHO-12菌株能够显著促进茄子的生长。表2本发明菌株WKPHO-12对盆栽茄子株高和鲜重的影响试验结果从表3中可以看出,经本发明解淀粉芽孢杆菌WKPHO-12处理后,基质中有效磷的增长率为10.31%,而茄子植株中有效磷增长率为107.05%。说明本发明菌株WKPHO-12能够有效降解基质中的无机磷,并促进茄子植株对降解后的有效磷的吸收,从而促进了茄子植株的生长。表3本发明菌株WKPHO-12对基质和茄子植株有效磷的影响试验结果实施例6本发明菌株WKPHO-12对茄子黄萎病菌的抑制作用试验按照如下方法进行:首先将茄子黄萎菌EVD-1在PDA平板上活化培养3-7天,然后用打孔器在菌落边缘区域打孔制成菌片;将菌片转接在另一个PDA平板中央,再将实施例2步骤(1)中活化的解淀粉芽孢杆菌WKPHO-12点接在距指示菌菌片2.0厘米处,设空白对照(不点接WKPHO-12菌株)。在25℃恒温培养3-10天,逐日观察WKPHO-12菌株和供试病原真菌的生长情况,待空白对照病原菌长至培养皿边缘时,测量病原菌的对照生长量(菌落半径)和经解淀粉芽孢杆菌WKPHO-12处理的生长量(接种WKPHO-12后的抑制生长半径),拮抗作用用抑菌率表示。抑菌率计算公式为:抑菌率(%)=(对照生长量-处理生长量)/对照生长量×100)。结果(见表4)本发明菌株WKPHO-12对茄子黄萎菌的抑菌率达62.72%,说明菌株WKPHO-12对茄子黄萎菌具有明显的抑制作用,具有对茄子黄萎菌的生防潜力。表4本发明WKPHO-12菌株对茄子黄萎菌的抑菌作用试验结果病原菌正常生长(mm)抑制生长(mm)抑菌率(%)茄子黄萎菌(V.dahliae)33.812.662.72实施例7本发明WKPHO-12液体制剂对茄子黄萎病的防治效果试验(一)试验处理:(1)WKPHO-12液体制:用水将实施例2制备的WKPHO-12液体制剂稀释100倍。(2)药剂对照:10亿活芽孢/克解淀粉芽孢杆菌可湿性粉剂(保定市科绿丰生化科技有限公司);用水稀释100倍。(3)空白对照:清水(二)试验方法:本试验于2017年3月在保定微控生物科技有限公司实验室内进行。播种前应用实施例2制备的WKPHO-12液体制剂100倍水稀释液浸种半小时;以“10亿活芽孢/克解淀粉芽孢杆菌可湿性粉剂”100倍水稀释液浸种半小时作为药剂对照;以清水浸种半小时作为空白对照。播种后正常培养。待茄子幼苗长出第4~5片真叶时,采用切根法接种茄子黄萎菌EVD-1的孢子悬浮液(107个孢子/mL)。常规管理,继续培养至空白对照充分发病时调查病情指数,计算防治效果。结果(表5)本发明WKPHO-12对茄子黄萎病的防效为72.48%,与药剂对照防治茄子黄萎病的效果(69.58%)相似。说明本发明菌株WKPHO-12及其液体制剂对茄子黄萎病具有很好的防治效果。表5本发明WKPHO-12液体制剂对茄子黄萎病防效试验结果实施例8本发明WKPHO-12固体制剂对茄子黄萎病的防治效果试验(一)试验处理:(1)WKPHO-12粉剂:按照1:1比例向实施例2制备的WKPHO-12液体制剂中添加碳酸钙,制成WKPHO-12粉剂。(2)药剂对照:10亿活芽孢/克解淀粉芽孢杆菌可湿性粉剂(保定市科绿丰生化科技有限公司)。(3)空白对照:未处理(二)试验方法:本试验于2017年6月在保定微控生物科技有限公司实验室内进行。将育苗土高压蒸汽灭菌2小时放至室温,铺满育苗盘,育苗盘内每穴定植1株农大601茄苗,培养至4~5片真叶时备用。将茄子黄萎菌EVD-1菌丝块接种在PDB培养液中,在25℃,180rpm/min培养5天,滤去菌丝得到分生孢子,将分生孢子混入无菌育苗基质中,使其中黄萎菌分生孢子的浓度为106个/克土壤。将混好的带菌育苗基质装入花盆(直径15cm),在其中定植茄苗的位置施入WKPHO-12粉剂2.0克,将茄苗移栽至花盆中(移栽时托起育苗盘使茄苗根梢断掉以利于病原菌侵染)并覆盖带菌土壤,每盆中定植一株茄苗。以穴施10亿芽孢/克解淀粉芽孢杆菌可湿性粉剂2.0克为药剂对照,以不做处理直接移栽的茄苗作为空白对照。每处理重复3次,每重复5盆。移栽后正常培养,至空白对照充分发病时调查病情指数,计算防治效果。结果(表6)本发明菌株WKPHO-12对茄子黄萎病的防效为70.74%,与药剂对照防治茄子黄萎病的效果(73.30%)相当。说明本发明菌株WKPHO-12及其固体制剂对茄子黄萎病具有很好的防治效果。表6本发明WKPHO-12固体制剂对茄子黄萎病防效试验结果处理病情指数防效(%)WKPHO-12粉剂24.94b70.7410亿活芽胞/克解淀粉芽孢杆菌可湿性粉剂22.76b73.30空白对照85.23a--实施例9本发明菌株WKPHO-12对三种病害病原菌的抑制作用试验(一)供试病原菌菌株(1):黄瓜枯萎病菌FOC-1:分离自保定市定兴县东落堡乡东册村黄瓜病株,经河北农业大学鉴定为尖孢镰刀菌黄瓜转化型(Fusariumoxysporumf.sp.cucumebrium)。(2):棉花枯萎病菌FOV-7:分离自邢台市威县棉花病株,经河北农业大学鉴定为尖孢镰刀菌萎蔫专化型(Fusariumoxysporumf.sp.vasinfectum)。(3):马铃薯黑痣病RS-3:分离自张家口市尚义县甲石河乡西杨木沟村马铃薯病株,经河北农业大学鉴定为立枯丝核菌(Rhizoctoniasolani)。以上三个菌株致病力测定表现为强致病力。(二)试验方法:本试验于2017年6月上旬在保定微控生物科技有限公司实验室内进行。首先将供试病原菌在PDA平板上活化培养4天,然后用打孔器在菌落边缘区域打孔制成菌盘,接着将菌盘转接在另一个PDA平板中央,再将实施例2步骤(1)活化后的解淀粉芽孢杆菌WKPHO-12点接在距指示菌菌盘2.0厘米处,设空白对照(不点接WKPHO-12菌株)。在25℃恒温培养,待空白对照即将长满整个培养皿时,测量番茄灰霉菌的对照生长量(菌落半径)和处理生长量(接种WKPHO-12后的抑制生长半径),拮抗作用用抑菌率表示。抑菌率的计算公式为:抑菌率(%)=(对照生长量-处理生长量)/对照生长量×100。表7本发明菌株WKPHO-12对不同病原菌的抑制作用试验结果结果(见表7)本发明菌株WKPHO-12对黄瓜枯萎菌的抑制率为74.05%,对棉花枯萎菌的抑制率为75.38%,对马铃薯黑痣病菌的抑制率为78.04%,说明解淀粉芽孢杆菌WKPHO-12对这三种病原菌具有明显的抑制作用,具有防治黄瓜枯萎病、棉花枯萎病及马铃薯黑痣病的生防潜力。序列表<110>保定微控生物科技有限公司<120>一种具有降解无机磷和防病双重作用的解淀粉芽孢杆菌<130>2017S1137INH<141>2017-12-27<160>2<170>SIPOSequenceListing1.0<210>1<211>1348<212>DNA<213>Bacillusamyloliquefaciens<400>1agactgggataactcagggaaaccggggctaataccggatggttgtctgaaccgcatggt60tcagacataaaaggtggcttcggctaccacttacagatggacccgcgtcgcattagctag120ttggtgaggtaacggctcaccaaggcgacgatgcgtagccgacctgagagggtgatcggc180cacactgggactgagacacggcccagactcctacgggaggcagcagtagggactcttccg240caatggacgaaagtctgacggagcaacgccgcgtgagtgatgaaggttttcggatcgtaa300agctctgttgttagggcagaacaagtgccgttcaaatagggcggcaccttgacggtacct360aaccagaaagccacggctaagtacgtgccagcagccgcggtaatacgtaggtggcaagcg420ttgtccggaattattgggcgtaaagggctcgcaggcggtatcttaagtctgatgtgaaag480cccccggctcaaccggggagggtcattggaaactggggaacttgagtgcagaagaggaga540gtggaattccacgtgtagcggtgaaatgcgtagagatgtggaggaacaccagtggcgaag600ccgactctctggtctgtaactgacgctgaggagcgaaagcgtggggagcgaacaggatta660gaaaccctggtagtccacgccgtaaacgatgagtgctaagtgttagggggtttccgcccc720ttagtgctgcagctaacgcattaagcactccgcctggggagtacggtcgcaagactgaaa780ctcaaaggaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgaagcaa840cgcgaagaaccttaccaggtcttgacatcctctgacaatgctagagataggacgtcccct900tcgggggcagagtgacaggtggtgcatggttgtcgtcagctcgtgacgtgagatgttggg960ttaagtcccgcaacgagcgcaacccttgatcttagttgccagcattcagttgggcactct1020aaggtgactgccggtgacaaaccggaggaaggtggggatgacgtcaaatcatcatgcccc1080ttatgacctgggctactcacgtgctacaatggacagaacaaagggcagcgaaaccgcgag1140gttaagccaatcacacaaatctgttctcagttcggatcgcagtctgcaactcgactgcgt1200gaagctggaatcgctagtaatcgcgaatcagcatgccgcggtgaatacgttcccgggcct1260tgtacacaccgcccgtcacaccacgagagtttgtaacacccgaagtcggtgaggtaacca1320ttatggagccagccgccgaagtgaacag1348<210>2<211>828<212>DNA<213>Bacillusamyloliquefaciens<400>2gacggaaaaatccactatcaggcgtacgagtgcggtgtacctgtggctgatcttgaagtg60atcggtgatactgataagaccggaacgattaagcacttcgttccggatccggaaatcttc120aaagaaacaatcgtatacgactatgatctgctttcaaaccgtgtccgggaattggccttc180ctgactaaaggcgtaaacatcacgattgaagacaaacgtgaaggacaagaacggaaaaac240gagtaccacgacgaaggcggaatcaaaagctatgttgagtacttaaaccgttccaaagaa300gtcgttcatgaagagccgatttatatcgaaggcgagaaagacggcataacggttgaagtt360gcgttgcaatacaacgacagctatacaagcaacatttattctttcacaaataacatcaac420acatacgaaggcgggacgcacgaagccggatttgaaaccggtctgacccgtgtcataaac480gactatgcaagaagaaaagggattttcaaagaaaatgatccgaatttaagcggagatgat540gtgagagaagggctgactgccattatttcaattaagcaccctgatccgcaattcgaaggg600cagacgaaaacgaagctcggcaactccgaagcgagaacgatcactgatacgctgttttct660tctgcgctggaaacatcccttcttgaaaatccggactcagcccgcaaaatcgttgaaaaa720ggtttaatggccgcaagagcgcggatggcagcgaaaaaagcgcgggaattgacccgccgc780aaaagtgcgcttgagatttccaatctgccggacaaactggcggactgt828当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1