木聚糖酶AnXyn10C的T32R突变体及其制备方法和用途与流程
本发明涉及蛋白质工程领域。具体而言,本发明涉及通过对木聚糖酶anxyn10c的关键位点进行点突变,获得热稳定性更好的木聚糖酶anxyn10c突变体。
背景技术:
根据已有的报道,广义上的木聚糖酶分为三种,分别是β-1,4-d-内切木聚糖酶(ec3.2.1.8)、β-1,4-d-外切木聚糖酶(ec3.2.1.92)以及β-木糖苷酶(ec3.2.1.37)。其中,β-1,4-d-内切木聚糖酶(ec3.2.1.8)是降解木聚糖的最主要的酶,该酶作用于β-1,4-木聚糖的主链,并以内切的方式水解木聚糖中的β-1,4-糖苷键,该酶降解木聚糖产生低聚木糖等水解产物。β-1,4-d-外切木聚糖酶(ec3.2.1.92)作用于寡聚木糖及木聚糖的非还原端。β-木糖苷酶通过水解低聚木糖的末端来催化释放木糖残基。此外,狭义的木聚糖酶是指β-1,4-d-内切木聚糖酶(ec3.1.2.8),该酶目前已广泛应用于生物能源、造纸、食品、饲料行业。
目前已知木聚糖酶属于糖基水解酶的一种,根据其氨基酸序列、三维结构、催化位点的几何学性质,木聚糖酶可归类为第5家族、第7家族、第10家族(即f家族)和第11家族(即g家族)等。
此外,根据现有的研究发现,第10家族木聚糖酶的来源主要包括:地细菌、海洋藻类、真菌、酵母菌;第11家族木聚糖酶的来源主要包括:黑曲霉(aspergillusniger)、里氏木霉(trichodermareesei)、短小芽孢杆菌(bacilluspumilus)、枯草芽孢杆菌(bacillussubtilis)、变青链霉菌(streptomyceslividans)、哈茨木霉(trichodermaharzianum)、粪肥纤维单胞菌(cellulomonasefimi)、环状芽孢杆菌(bacilluscirculans)等。
木聚糖酶具有如下的功能区:催化结构域(catalytcdomains,cd)、碳水化合物结合结构域(carbohydrate-bindingmodule,cbm)或纤维素结合结构域(cellulosebindingdomains,cbd)、木聚糖结合结构域(xylanbindingdomains,xbd)、连接序列(linkersequence)和重复序列(repeatedsequences)。其中,f/10家族木聚糖酶的催化结构域具有(β/α)8桶状结构,即tim桶状结构;(β/α)8桶状结构在酶结构中十分常见,其中,由β折叠和α螺旋构成二级结构的框架,而环包含同其催化活性相关的氨基酸。f/10家族木聚糖酶的疏水核心只包含形成β折叠的残基。β折叠和α螺旋的相对位置主要靠具有支链的疏水氨基酸缬氨酸、异亮氨酸和亮氨酸来维持。f/10家族木聚糖酶一般具有碳水化合物结合结构域cbm,而仅有少数g/11家族木聚糖酶具有cbm。g/11家族木聚糖酶的结构主要为β折叠,蛋白整体呈“右手”型。其中,8种g/11家族木聚糖酶的三维结构为“三明治”形状,包括1个α螺旋和2个β折叠,形成能容纳1个木聚糖聚合物的巨大的间隙。
木聚糖酶三维结构中各功能区一般由富含羟基的连接序列(即,环)相连。所述环包含有较多的丝氨酸、脯氨酸或苏氨酸残基,并高度糖基化,从而能够有效抑制外源蛋白酶对酶分子的降解。连接序列通常富含柔性氨基酸,从而形成柔韧的铰链区,使得各个结构域在空间上分离,并在宏观上表现为无规则卷曲。这样的排列有助于结构域各自发挥功能并维持空间构象的稳定。研究表明,连接肽可辅助木聚糖酶经由cbm锚定于细胞壁表面,以催化降解复杂底物。
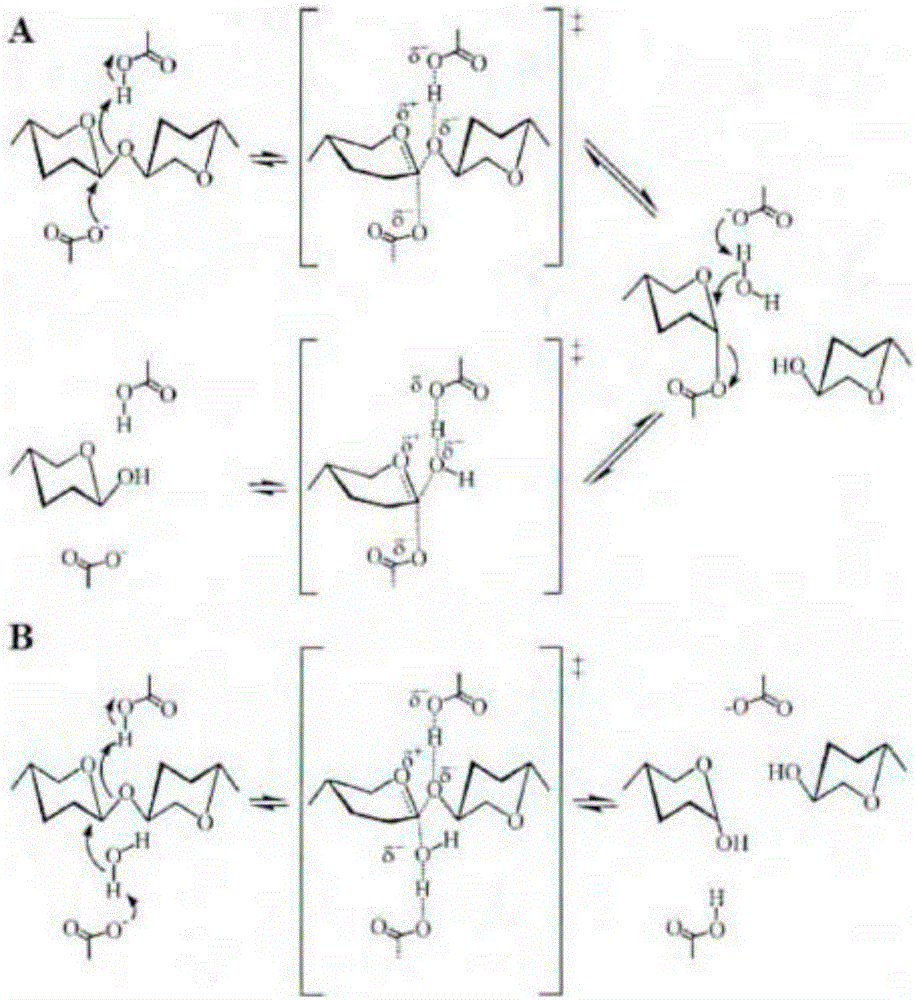
就催化机理而言,木聚糖酶参与的水解反应为典型的酸/碱催化的亲核水解反应。根据产物异头构象的不同,木聚糖酶降解木聚糖的催化反应可分为两大类:保持异头构象的双替换反应(图1a)和形成倒位异头构象的一步置换反应(图1b)。第5家族、第7家族、第10家族和第11家族的木聚糖酶可通过活性中心谷氨酸(glu)残基(分子平均间距
另一催化方式为一步置换反应,由一个普通酸glu、一个普通碱glu-/asp-和亲核水分子的攻击一次完成的。在这个过程中,酸催化剂glu的羧基提供h给o4,碱催化剂glu/asp作用于亲核试剂水,使羟基与碳正离子作用,羟基的异头构象发生倒置。同时,产生的h+通过扩散与离子化的酸催化剂结合,恢复质子状态(参见图1b)。
木聚糖酶的催化关键位点包含组氨酸等极性氨基酸残基或谷氨酸等酸性氨基酸残基。例如,来源于streptomyceslividans的木聚糖酶xlna的活性区具有3个组氨酸(h)残基,其中h81和h207为f/10木聚糖酶超家族的4/7保守氨基酸残基(这两个具有催化作用的残基分别位于第4个和第7个β折叠的碳端)。h81和h207与e236通过氢键缔合,形成电荷网,使得两个催化残基保持离子状态,从而有效地对木聚糖的β-1,4-糖苷键进行水解。就xlna而言,木聚糖酶的作用机制可能是广义的酸碱催化机制,谷氨酸和天冬氨酸等酸性氨基酸残基起着催化残基的作用,它们与空间位置相近的其它极性氨基酸残基相互作用,使得两个催化残基维持离子状态,并保持中间产物的稳定性以及酶的催化活性。一些文献对不同来源的木聚糖酶的晶体结构进行了解析,发现这些木聚糖酶的两个谷氨酸残基(例如glu93和glu182、glu79和glu170、glu86和glu177、glu120和glu209)形成一对催化残基。
木聚糖酶的催化活性受到温度、ph等多种因素的影响。特别地,影响不同家族的木聚糖酶热稳定性的影响因素可能不同。例如,使得f/10家族木聚糖酶具有较强热稳定性的因素包括:①疏水中心的有效包埋;②α螺旋的n端存在脯氨酸;③带电侧链与螺旋偶极子的相互作用;④不存在太长的环状结构。另外,氢键和盐桥对于f/10家族木聚糖酶的热稳定性没有太大影响。就g/11家族木聚糖酶热稳定性而言,研究表明,特定位点的突变,如gly→x、x→pro,对提高g/11家族木聚糖酶的热稳定性十分有效;而在多种g/11木聚糖酶蛋白的保守区以val代替leu或ile,在α-螺旋区以ala代替leu或ile对木聚糖酶的热稳定性也有影响。另外,与芳香族氨基酸的相互作用相比,盐桥对g/11家族木聚糖酶的热稳定性影响较弱。同源性比较结果还显示,二硫键的形成对g/11家族木聚糖酶热稳定性影响不大。
目前,已有诸多研究致力于改善木聚糖酶的热稳定性。例如,专利申请cn102994529a公开了将耐热酶的n末端区域序列替换ausxyn10a的对应序列,从而提高宇佐美曲霉(aspergillususamii)e001木聚糖酶稳定性的方法。获得的重组木聚糖酶最适作用温度为55℃,较原酶提高了10℃,60℃下保温10min残余酶活仍大于40%。专利申请cn103343131a公开了对木聚糖酶xynas9-m进行v81p/g82e、v81p/g82e/d185p/s186e突变,从而得到稳定性改良的木聚糖酶。与野生型相比,该突变体的最适温度提高了20℃,tm值提高了7℃。专利申请cn1219063c公开了一种天然耐高温的木聚糖酶--海栖热袍菌(thermotogamaritima)xynb酶,其工作温度为90℃。
目前的研究发现了多种改善f/10家族木聚糖酶热稳定性的方法,例如在n端/c端α螺旋处引入二硫键、使酶分子表面堆积芳香族氨基酸、在反应体系中加入ca2+等。然而,例如manikandan等从alkalophilicbacillussp.菌株ng-27中分离的xylna酶不含半胱氨酸和二硫键,却有较好的嗜热和嗜碱稳定性。因此,关于提高f/10家族木聚糖酶热稳定性的机制,本领域尚未有公认的结论。
此外,如何通过其它方式有效地得到具有改善的热稳定性的f/10家族木聚糖酶、尤其是anxyn10c酶,并将其在工业生产中加以应用,在本领域中并无相应的报道。
技术实现要素:
本发明的发明人通过深入研究发现,通过对已有的f/10家族木聚糖酶anxyn10c中的特定位点的氨基酸残基进行突变,由突变后的氨基酸残基形成氢键或改变蛋白表面的疏水性,能够有效地改善木聚糖酶anxyn10c的热稳定性,最终适应工业化生产条件中对酶的热稳定性需求。
因此,本发明的一个目的在于提供木聚糖酶anxyn10c的t32r突变体,其中,所述木聚糖酶anxyn10c的t32r突变体具有通过seqidno.1表示的氨基酸序列。
seqidno.1
epieprqasvsidtkfkahgkkylgnigdqyrltknsktpaiikadfgaltpensmkwdatepsrgqfsfsgsdylvnfaqsnnklirghtlvwhsqlpswvqsitdkntlievmknhittvmqhykgkiyawdvvneifnedgslrdsvfykvigedyvriafetaraadpnaklyindynldsasypkltgmvshvkkwiaagipidgigsqthlsagggagisgalnalagagtkeiavteldiagasstdyvevveaclnqpkcigitvwgvadpdswrssstpllfdsnynpkpaytaianal
本发明的另一目的在于提供编码如上所述的木聚糖酶anxyn10c的t32r突变体的多核苷酸,其中,所述多核苷酸具有通过seqidno.2表示的序列。
seqidno.2
gagcccattgaaccccgtcaggcttcagtgagtatcgataccaaattcaaggctcacgggaagaaatatcttggaaacattggtgatcagtacagattgaccaagaactcgaagactccggcaattatcaaggccgattttggcgcgttgactccagagaatagcatgaagtgggatgctactgaaccaagccgtgggcagttctctttctcaggatcagactacctggtcaactttgcccagtctaacaacaagctgatccgcggacatactctcgtgtggcactcgcagctcccctcctgggtccaatccatcacggacaagaatacactgatcgaagtcatgaagaatcacatcaccacagtgatgcaacactataagggcaagatctacgcctgggacgttgtcaatgaaattttcaacgaagatggctccctgcgtgacagcgtcttctacaaggtcatcggcgaggactacgtccggatcgccttcgagactgctcgggctgcagatcccaatgcaaagctctacatcaatgattacaacctggattccgcctcctaccctaaattgaccggcatggttagccatgtcaagaagtggatcgcagctggcatccctatcgatggaatcggttcccaaacccacttgagcgctggtggaggtgctggaatttctggagctctcaatgctctcgcaggtgccggcactaaggaaattgctgtcaccgagcttgacatcgctggcgccagctcgaccgactatgtggaggtcgtcgaagcctgcctgaaccagcccaagtgtatcggtatcaccgtttggggagttgctgacccggactcctggcgctccagctccactcctctgctgttcgacagcaactacaacccgaagcctgcatacactgctatcgcaaatgctctc
本发明的另一目的在于提供一种重组载体,其中,所述重组载体包含如上所述的编码木聚糖酶anxyn10c的t32r突变体的多核苷酸。
本发明的进一步的目的在于提供一种重组菌,所述重组菌包含如上所述的重组载体或在该重组菌的基因组中整合有如上所述的多核苷酸。
本发明的又一目的在于提供制备木聚糖酶anxyn10c的t32r突变体的方法,其中,所述方法包括:获得编码木聚糖酶anxyn10c的t32r突变体的多核苷酸,该多核苷酸具有通过seqidno.2表示的序列;将该多核苷酸与载体进行酶切和连接,得到重组载体;随后,将重组载体导入宿主菌中,得到重组菌;对重组菌进行培养,从而由重组菌产生木聚糖酶anxyn10c的t32r突变体。
本发明的另外的目的在于提供木聚糖酶anxyn10c的t32r突变体在制备木聚糖水解酶制剂中的用途。
附图说明
图1示出了木聚糖酶的催化机制。其中,图1a表示双替换反应;图1b表示一步置换反应。
图2a-图2c示出了野生型的anxyn10c酶(具有对应于seqidno.3的氨基酸序列)及anxyn10c酶的t32r突变体(具有通过seqidno.1表示的氨基酸序列)的结构分析图。其中,图2a表示通过swissmodel同源建模获得的野生型的anxyn10c酶的结构模型(该野生型氨基酸序列第32位的氨基酸残基为t);图2b表示通过swissmodel同源建模获得的anxyn10c酶的t32r突变体的结构模型(该突变体氨基酸序列第32位的氨基酸残基为r);图2c表示通过swissmodel同源建模得到的anxyn10c酶的t32r突变体拉氏构象图。
图3示出了t32r突变体的引物设计示例图。
图4示出了在ph=5下测得的野生型的木聚糖酶anxyn10c和本发明获得的木聚糖酶anxyn10c的t32r突变体的相对酶活随温度的变化结果。
图5示出了在ph=6下测得的野生型的木聚糖酶anxyn10c和本发明获得的木聚糖酶anxyn10c的t32r突变体的相对酶活随温度的变化结果。
具体实施方式
在本发明中,术语“木聚糖酶anxyn10c”、“anxyn10c木聚糖酶”和“anxyn10c酶”可互换使用。目前已知anxyn10c酶属于f/10家族木聚糖酶,其催化结构域具有(β/α)8桶状结构。天然的f/10家族的木聚糖酶存在热稳定性相对较低的缺陷,而工业生产中往往需要具有较高的热稳定性的木聚糖酶,因此,需要对天然的anxyn10c酶(也称为“野生型的anxyn10c酶”或“野生型的木聚糖酶anxyn10c”)进行突变,以得到具有改进的热稳定性的木聚糖酶anxyn10c。
天然的anxyn10c酶具有通过seqidno.3表示的氨基酸序列:
seqidno.3
epieprqasvsidtkfkahgkkylgnigdqytltknsktpaiikadfgaltpensmkwdatepsrgqfsfsgsdylvnfaqsnnklirghtlvwhsqlpswvqsitdkntlievmknhittvmqhykgkiyawdvvneifnedgslrdsvfykvigedyvriafetaraadpnaklyindynldsasypkltgmvshvkkwiaagipidgigsqthlsagggagisgalnalagagtkeiavteldiagasstdyvevveaclnqpkcigitvwgvadpdswrssstpllfdsnynpkpaytaianal
本发明的发明人在对天然的anxyn10c酶进行突变的过程中,通过研究天然的anxyn10c酶的二级结构发现,天然的anxyn10c酶的氨基酸序列中的氨基酸残基“gg”、“ss”和“sss”都位于卷曲(coil)结构中,连接着相邻的结构。因此,本发明的发明人在突变后的氨基酸序列中保留了氨基酸残基“gg”和“ss”和“sss”。
同时,本发明的发明人还发现,天然的anxyn10c酶的氨基酸序列中的以下位点可能是底物结合位点,并因此在突变时加以保留:k57、d59、w94、s96、e138、f140、y181、h216、e244、d246、w274、r283。
此外,本发明的发明人还保留了天然的anxyn10c酶的氨基酸序列中的活性位点:e138、e244。
经分析,通过突变可能提高天然的anxyn10c酶(具有通过seqidno.3表示的氨基酸序列)的热稳定性的氨基酸残基及其位置为t32(即,第32位的氨基酸残基t),对应的氨基酸残基在seqidno.3中以下划线的形式示出。具体而言,本发明的发明人发现,通过对野生型的anxyn10c酶进行如下的突变可能提高其热稳定性:将通过seqidno.3表示的氨基酸序列中的第32位的氨基酸残基t点突变为r。
因此,在本发明的一个实施方式中,本发明提供了木聚糖酶anxyn10c的t32r突变体,其中,所述木聚糖酶anxyn10c的t32r突变体具有通过seqidno.1表示的氨基酸序列。而且,与本发明的通过seqidno.1表示的序列具有90%以上的一致性的氨基酸序列也在本发明的保护范围之内。
在本发明的另一实施方式中,本发明提供了编码如上所述的木聚糖酶anxyn10c的t32r突变体的多核苷酸(下文也称为“基因”或“编码基因”),其中,所述多核苷酸具有通过seqidno.2表示的序列。而且,与本发明的通过seqidno.2表示的序列具有90%以上的一致性的核苷酸序列也在本发明的保护范围之内。
在本发明的另一实施方式中,本发明提供了一种重组载体,其中,所述重组表达载体包含如上所述的编码木聚糖酶anxyn10c的t32r突变体的多核苷酸。所述重组载体可采用本领域已知的任何载体(例如质粒载体、噬菌体载体和病毒载体等)构建得到,优选所述重组载体采用选自如下的载体中的一种或多种构建得到:ppic9k、ppiczα、pgapz、pgapzα、pgapzαa和ppicz。进一步优选地,所述重组载体采用ppic9k构建得到。
在本发明的又一实施方式中,本发明提供了一种重组菌,所述重组菌包含如上所述的重组载体或在该重组菌的基因组中整合有如上所述的多核苷酸。用于构建所述重组菌的宿主菌可为本领域已知的用于基因工程和蛋白质工程的任何合适的菌株,优选包括但不限于:毕赤酵母(pichia)、假丝酵母(candidamycoderma)、多型汉逊酵母(hansenulapolymorpha)、球拟酵母(torulopsis)、裂殖酵母(schizosaccharomyces)和克鲁维酵母(kluyveromyces)。进一步优选地,所述宿主菌为毕赤酵母,更优选为毕赤酵母gs115。
在本发明的另一实施方式中,本发明提供了制备木聚糖酶anxyn10c的t32r突变体的方法,其中,所述方法包括:获得编码木聚糖酶anxyn10c的t32r突变体的多核苷酸,该多核苷酸具有通过seqidno.2表示的序列;将该多核苷酸与载体进行酶切和连接,得到重组载体;随后,将重组载体导入宿主菌中,得到重组菌;对重组菌进行培养,从而由重组菌产生木聚糖酶anxyn10c的t32r突变体。
在本发明优选的实施方式中,具有通过seqidno.2表示的核苷酸序列的编码木聚糖酶anxyn10c的t32r突变体的多核苷酸可通过本领域已知的手段获得,例如overlap-pcr、race等。例如,利用下表1中示出的引物对2-f和21-1-r合成核苷酸片段1,利用引物对21-1-f和2-r合成核苷酸片段2,再以核苷酸片段1和2的混合物为模板,利用引物对2-f和2-r进行overlap-pcr,合成得到最终的编码木聚糖酶anxyn10c的t32r突变体的多核苷酸。可采用本领域技术人员已知的常规的overlap-pcr的实验条件和步骤、或者采用可商购的overlap-pcr试剂盒进行所述overlap-pcr。不受限制的,还可采用其它引物对和本领域已知的其它的基因合成手段来获得编码上述突变体的多核苷酸。
随后,将编码该突变体的多核苷酸与载体通过酶切和连接而得到重组载体,如本领域所已知的,根据所采用的载体,本领域技术人员可以选择合适的用于所述酶切和连接的内切酶和连接酶(例如,ecori、noti内切酶;t4dna连接酶等)。
对于将重组载体导入宿主菌中的具体手段,可采用本领域已知的任何常规手段。例如,使该重组载体通过显微注射、基因枪、转化、感染或转染等本领域已知的方式向宿主菌中导入。对于导入重组载体的宿主菌,通过筛选标记筛选得到阳性的重组菌。优选将阳性的重组菌在相应的液体培养基中进行培养,并任选通过加入合适的试剂诱导重组菌的表达(例如,通过向毕赤酵母培养液中加入甲醇诱导该酵母的表达)。对培养物进行离心并收集得到的菌液,随后通过盐析法、等电点沉淀、亲和层析、超滤等方式纯化蛋白,从而得到木聚糖酶anxyn10c的t32r突变体。
上述的酶切和连接以及显微注射、基因枪、转化、感染或转染均为本领域已知的常规操作。酶切和连接是指采用限制性核酸内切酶对目的dna片段与载体dna分子进行特异性切割,然后使用连接酶将进行酶切后的目的dna分子和载体分子的粘性末端进行连接,从而得到重组载体。转化是指通过采用分子生物学和基因工程中的一些已知方法处理细胞,使经处理后的细胞处于感受态,并由此与外源dna接触,从而使外源dna进入处于感受态的细胞中。常用的转化方法包括原生质体转化法、化学转化法和电穿孔转化法。感染是指用经人工改造的噬菌体活病毒作载体,将该载体与目的dna序列重组后,在体外用噬菌体或病毒的外壳蛋白将重组dna包装成有活力的噬菌体或病毒,从而以感染的方式使重组dna进入宿主细胞中。转染是指通过cacl2、电穿孔等方法将细胞处理成感受态细胞,然后使该感受态细胞接受重组的噬菌体dna。
在本发明的又一实施方式中,本发明提供了木聚糖酶anxyn10c的t32r突变体在制备木聚糖水解酶制剂中的用途。
在本发明优选的实施方式中,所述木聚糖水解酶制剂能够用于在65-75℃下水解木聚糖而不会失活。
实施例
实施例1anxyn10c酶的t32r突变体的制备
本实施例使用的pcr仪为bio-rad(购自北京元业伯乐科技发展有限公司),电转化仪为eppendorfeporator(购自艾本德中国有限公司)。如无特别说明,本实施例使用的试剂购自sigma。
lb培养基:蛋白胨(tryptone)10g/l,酵母粉(yeastextract)5g/l,氯化钠(nacl)5g/l,调整ph至7.0-7.4。
卡那霉素:称取10g卡那霉素溶于蒸馏水中至体积为100ml,得到浓度为100mg/ml的浓缩液,过滤除菌,分装至1.5ml的ep管中,-20℃保存待用;使用终浓度为50μg/ml。
ypd液体培养基:蛋白胨(peptone)20g/l,酵母粉(yeastextract)10g/l,115℃湿热灭菌30min,随后在使用时加入过滤灭菌的葡萄糖母液至终浓度10g/l。
500×生物素(biotin,b):20mg生物素溶于100ml蒸馏水中,过滤除菌,浓度为0.02%(w/v)。
md液体培养基:无氨基酵母氮源(yeastnitrogenbase,ynb)13.4g/l,灭菌;然后在使用时加入过滤灭菌的葡萄糖母液至终浓度为10g/l,并加入2ml500×b。
md固体培养基:ynb13.4g/l,1.5%-1.8%(w/v)的琼脂,灭菌;然后在使用时加入过滤灭菌的葡萄糖母液至终浓度为10g/l,并加入2ml500×b。
bmgy培养基:蛋白胨(peptone)20g/l,酵母粉(yeastextract)10g/l,ynb13.4g/l,100ml1mph6.0磷酸钾缓冲液(提高培养基的ph至6.8,可提高产蛋白能力),灭菌后使用时添加2ml500×b,100ml10×甘油(gy)(10%v/v)。
bmmy培养基:蛋白胨(peptone)20g/l,酵母粉(yeastextract)10g/l,ynb(yeastnitrogenbase)13.4g/l,100ml1mph6.0的磷酸钾缓冲液(提高ph至6.8可提高产蛋白能力),灭菌;随后在使用时添加2ml500×b,1%甲醇(v/v)(诱导酵母表达)。
本发明的anxyn10c酶的突变体优选通过如下方法获得,但对于本领域技术人员来说,可根据实际需要对如下各操作中的具体参数进行适当调整。
1.编码木聚糖酶anxyn10c的t32r突变体的多核苷酸的制备
通过定点突变对野生型黑曲霉(aspergillusnigerbe-2;请参见nasirali,黑曲霉be-2纤维素降解酶系及其基因表达的研究,2016年8月)的木聚糖酶anxyn10c(seqidno:3)进行相应的突变,以获得最终所需的突变体,本实施例所采用的方法为在引物上设计突变位点,通过overlap-pcr得到编码突变体的核苷酸序列。
接下来,对获取编码木聚糖酶anxyn10c的t32r突变体的多核苷酸的方法进行具体阐述。首先,如图3所示,共设计四条引物2-f、2-r、21-1-r、21-2-f(见下表1),引物2-f、2-r分别位于编码木聚糖酶anxyn10c的t32r突变体的基因的5’端和3’端;t32r突变位点位于引物21-1-r、21-2-f上(以下划线示出)。
以引物对2-f和21-1-r合成片段1,以引物对21-2-f和21-2-r合成片段2。再将片段1、2的混合物利用gelextractionkit(200)试剂盒(购自omegabio-tek公司)根据制造商的说明书进行纯化,以片段1和2的纯化产物为模板,以引物对2-f和2-r进行overlap-pcr,合成得到最终的编码所述t32r突变体的基因(其大小为924bp)。将合成得到的编码所述t32r突变体的基因用于后续的重组载体的构建。
表1引物序列
2.重组菌的构建和筛选
2.1载体、克隆菌株和表达菌株
选取毕赤酵母分泌型表达载体ppic9k(invitrogen),该表达载体具有ecori/noti的双酶切位点。选用大肠杆菌dh5α(购自北京全式金生物技术有限公司)作为克隆菌株,毕赤酵母gs115菌株(invitrogen,c181-00)作为表达菌株。
2.1.1基因片段的pcr扩增
利用表1的引物对(其中,f表示正向引物,r表示反向引物),使用kodplus酶试剂盒(购自takara公司,内含5×pcr缓冲液、dntps和mgso4)根据制造商的说明书进行overlap-pcr扩增,扩增上述基因片段的pcr体系和程序如下所示:
2.1.2基因片段和载体的双酶切
利用gelextractionkit(200)试剂盒(购自omegabio-tek公司),根据制造商的说明书对overlap-pcr产物进行回收,使用购自neb公司的ecori-hf酶和noti-hf酶按照制造商的说明书分别对回收后的overlap-pcr产物和ppic9k载体进行双酶切,酶切反应体系如下所示:
37℃过夜酶切。
2.1.3经酶切的突变体基因和载体的连接
利用gelextractionkit(200)试剂盒(购自omegabio-tek公司),根据制造商的说明书对经酶切的突变体基因和ppic9k表达载体进行胶回收后,按照基因:载体=1:6的质量比,使用购自neb的t4dna连接酶按照制造商的说明书进行连接反应,反应体系和条件如下所示:
16℃连接2h。
2.1.4连接产物的转化及阳性克隆筛选
将连接产物转化至大肠杆菌dh5α感受态细胞,转化步骤如下:
①从-80℃冰箱中取出感受态细胞置于冰浴中,待其完全融化;
②往100μl感受态细胞中加入10μl连接产物,轻轻混匀,在冰浴中静置30min;
③将冰浴后的感受态细胞置于42℃水浴中热激60s,然后快速转移到冰浴中,静置5min;
④加入800μl的无抗lb培养基,置于37℃摇床中于150rpm下振荡培养45min;
⑤将离心管3000rpm离心3min,轻轻吸去多余的上清,留下约100μl培养基,轻轻的悬浮细胞,将100μl细胞全部均匀涂布至含有50μg/ml卡那霉素的lb平板上,37℃过夜培养。
将平板上长出的克隆使用通用引物α-factor(购自上海生工生物工程股份有限公司)和3’aox1(seqidno.8)进行菌落pcr验证,pcr鉴定体系及程序如下所示:
在菌落pcr后,对得到的产物进行琼脂糖凝胶电泳,pcr产物大小为1116bp,表明所获得的大肠杆菌包含阳性克隆的重组质粒,并送至上海生工生物工程股份有限公司通过测序加以验证。
2.2重组酵母菌株的构建及筛选
2.2.1载体的线性化
利用plasmidminikiti(200)试剂盒(购自omegabio-tek公司),根据制造商的说明书对上述经测序确认的重组质粒(即,重组表达载体)进行提取,随后使用购自neb的sali酶和cutsmart缓冲液对上述获得的重组质粒进行线性化,用于下一步的电转化,线性化体系及条件如下所示:
37℃过夜酶切。
2.2.2线性化产物的乙醇沉淀
为了使最后回收得到的线性化产物浓度尽可能的高,将线性化后的产物进行乙醇沉淀,具体步骤如下。
①加入1/10体积的3m乙酸钠(ph=5.2)于dna溶液中充分混匀,使其最终浓度为0.3m;
②加入2倍体积用冰预冷的乙醇混合后再次充分混匀,置于-20℃中过夜;
③12,000g离心10min,小心移出上清液,吸去管壁上所有的液滴;
④加入1/2离心管容量的70v/v%乙醇,12000g离心2min,小心移出上清液,吸去管壁上所有的液滴;
⑤室温下将开盖的ep管的置于实验桌上使残留的液体挥发干净;
⑥加适量的ddh2o溶解dna沉淀。
2.2.3毕赤酵母的电转化
毕赤酵母的电转化步骤具体如下:
①接种gs115单菌落到含有5mlypd液体培养基的三角瓶中,30℃过夜培养。
②转接到含有100mlypd液体培养基的500ml三角瓶中,接种量为1v/v%,30℃培养过夜,直到od600=1.3-1.5,得到培养液;
③1500g、4℃条件下离心20ml培养液5min,弃上清液,再用20ml冰浴的双蒸水重悬细胞;加入8ml的预处理液,室温放置30min;
④1500g、4℃条件下离心5min,弃上清液,然后用1.5ml冰浴的1m山梨醇(购自上海阿拉丁生化科技股份有限公司)重悬细胞,转移到1.5ml的ep管中;
⑤1500g、4℃条件下离心5min,弃上清液,然后重复两次操作,共用1.5ml冰浴的1m山梨醇洗涤三次;
⑥1500g、4℃条件下离心5min,弃上清液,然后用80μl冰浴的1m山梨醇重悬细胞,使菌悬液终浓度达到1010个细胞/ml;
⑦将80μl处理好的感受态细胞和5-20μg线性化的重组质粒(溶解在双蒸水中,体积为5-10μl)加入1.5ml预冷离心管中,混匀。然后把混合液转移入预先冰浴的转化杯中(0.2cm型);冰浴装有转化混合液的转化杯5min;
⑧按照如下参数设置电转化仪,并启动电脉冲:
⑨脉冲后立即往转化杯中加入1ml冰浴的1m的山梨醇溶液,然后把转化液转入新的1.5ml离心管中;30℃静置培养1-2h;
⑩吸取50-200μl的gs115的转化液涂布md平板;30℃培养,直到转化子出现。
2.2.4重组酵母的鉴定
使用5’aox1引物和3’aox1引物进行pcr鉴定,将pcr产物进行琼脂糖凝胶电泳,阳性重组酵母显示出两个条带:①约2.2kb的aox1基因的条带;②比目的基因略大的条带。
5’aox1引物:gactggttccaattgacaagc(seq.id.no.9)
3’aox1引物:aggatgtcagaatgccatttgcc(seq.id.no.8)
2.2.5多拷贝的筛选——g418筛选
不同拷贝数的重组菌能够耐受的g418浓度不同,一般一个拷贝的重组子能够耐受0.25mg/ml的g418(购自上海前尘生物科技有限公司)。因此,将鉴定得到的阳性重组酵母分别接种至含2mg/mlg418的ypd平板上,置于30℃下培养。
3.重组酵母的诱导表达
3.1重组酵母的诱导表达
①挑选采用g418筛选后的单菌落,置于含有60mlbmgy培养基的500ml摇瓶中,于30℃、250rpm下培养至od600=2-6(16-18h);
②室温下1500g离心5min,收集菌体,用bmmy液体培养基重悬菌体,使od600=1.0左右;
③将步骤②所得的菌液置于2l的摇瓶中,用八层纱布封口,放置于28℃、250rpm的摇床上继续生长;
④每24h向培养基中添加100%的甲醇至终浓度为1.0v/v%;
⑤按如下时间点分别取1ml菌液样品,置于1.5mlep管中,12,000rpm离心3min,收集上清,用于分析目的蛋白的表达量和菌液最佳收获时间:0h、6h、12h、24h、36h、48h、60h、72h、84h、96h、120h、144h、168h;
3.2诱导表达样品的分析
依照如下实验方案进行sds-page检测:
3.2.1制备sds-page凝胶:
分离胶的制备:
在烧杯中依次加入所需溶液成分,灌入预先装配好的双层玻璃板的间隙中,室温放置20min以上,直至凝胶聚合完全。
浓缩胶的制备:
在烧杯中依次加入所需溶液成分,灌入双层玻璃板间已凝聚的分离胶上方的间隙,室温放置20min以上,直至凝胶聚合完全。
3.2.2将上述得到的重组酵母的培养物在12,000g离心1min,得到上清液,吸取上清液加入到如上制备的凝胶的加样孔道中,上样量为10μl。同时加入蛋白质分子量标准(pagerulerplusprestainedproteinladder26619,thermoscientific,250-10kda)。
200v恒压电泳1.5h后,卸下凝胶。按下表所示配制染色液和脱色液,进行考马斯亮蓝染色,观察样品中的目的蛋白条带。
从电泳图谱可以看出,重组酵母表达出分子量约为23kda大小的条带(即,anxyn10c酶的t32r突变体)。可以说,采用本发明所述的方法能够制备得到木聚糖酶anxyn10c的t32r突变体。
实施例2重组酵母表达产物的活性分析
基于如下方法,分析上述不同时间点取样得到的重组酵母的上清液中的酶活变化。
酶活测定的方法具体如下:在试管中加入采用dns试剂稀释50-100倍的上述上清液0.5ml,加入1w/v%山毛榉木聚糖(购自北京中生瑞泰科技有限公司)底物1ml,盖紧试管塞,放入50℃水浴中10min,取出立即加入3mldns试剂终止反应,沸水浴5min;取出至冰水中冷却,加蒸馏水定容至25ml,上下颠倒试管充分混匀,在540nm的波长下测定吸光度a540。其中,1个酶活单位(iu)定义为:在50℃和ph7.0下每分钟催化降解底物木聚糖生成1μmol还原糖(以木糖计算)所需的酶量。
3.3不同ph和温度下的酶活测定
在ph5.0的50mm柠檬酸缓冲液中,将野生型的木聚糖酶anxyn10c(其中,按照与实施例1相同的方法,在毕赤酵母中表达得到该野生型的木聚糖酶anxyn10c)和木聚糖酶anxyn10c的t32r突变体按照上文所述方法测定在不同温度下的相对活性并进行比较,其中,野生型的木聚糖酶anxyn10c的编码基因为利用如下引物对扩增黑曲霉(a.nigerbe-2)的基因组,并利用primerstarmaxdnapolymerase试剂盒进行pcr扩增获得:
正向引物:ccggaattcgagcccattgaaccccgtcag(seqidno:10)
反向引物:ataagaatgcggccgcttagagagcatttgcgatagcag(seqidno:11)。
结果在图4中示出,以各自最高的酶活作为100,野生型的木聚糖酶anxyn10c在60℃下测得的酶活为96,木聚糖酶anxyn10c的t32r突变体在70℃测得的酶活仍可为96。
另外,在ph6.0的50mm柠檬酸缓冲液中,将野生型的木聚糖酶anxyn10c和木聚糖酶anxyn10c的t32r突变体按照上文所述方法测定在不同温度下的相对活性并进行比较,将结果在图5中示出。以各自最高的酶活作为100,野生型的木聚糖酶anxyn10c在60℃下测得的酶活为96,木聚糖酶anxyn10c的t32r突变体在70℃测得的酶活仍可为94。
由此可见,本发明所述的木聚糖酶anxyn10c的t32r突变体具有显著更好的热稳定性。
实施例3:木聚糖酶anxyn10c的t32r突变体的结构分析
如图2所示,利用swissmodel同源建模对野生型的木聚糖酶anxyn10c及上述实施例中制备的t32r突变体的结构进行分析。
经结构分析表明,在突变前的野生型的木聚糖酶anxyn10c中,第32位的氨基酸残基thr不与周围的氨基酸残基形成氢键(图2a);在进行突变后得到突变体中,第32位的氨基酸残基arg与第27位的氨基酸残基ile和第53位的氨基酸残基glu(e53)之间形成氢键,e53位于相邻的β折叠上,新形成的氢键理论上会使得蛋白结构更为稳定(图2b)。而且氨基酸残基thr和arg形成α螺旋的能力相当,突变后并不会阻碍α螺旋的形成。
进一步分析t32r突变体的拉氏构象图(图2c)后,本发明的发明人发现anxyn10c酶的t32r突变体的热稳定性更好。
序列表
<110>中粮集团有限公司、中粮营养健康研究院有限公司
<120>木聚糖酶anxyn10c的t32r突变及其制备方法和用途
<160>11
<170>siposequencelisting1.0
<210>1
<211>308
<212>prt
<213>artificialsequence(人工序列)
<400>1
gluproilegluproargglnalaservalserileaspthrlysphe
151015
lysalahisglylyslystyrleuglyasnileglyaspglntyrarg
202530
leuthrlysasnserlysthrproalaileilelysalaaspphegly
354045
alaleuthrprogluasnsermetlystrpaspalathrgluproser
505560
argglyglnpheserpheserglyserasptyrleuvalasnpheala
65707580
glnserasnasnlysleuileargglyhisthrleuvaltrphisser
859095
glnleuprosertrpvalglnserilethrasplysasnthrleuile
100105110
gluvalmetlysasnhisilethrthrvalmetglnhistyrlysgly
115120125
lysiletyralatrpaspvalvalasngluilepheasngluaspgly
130135140
serleuargaspservalphetyrlysvalileglygluasptyrval
145150155160
argilealaphegluthralaargalaalaaspproasnalalysleu
165170175
tyrileasnasptyrasnleuaspseralasertyrprolysleuthr
180185190
glymetvalserhisvallyslystrpilealaalaglyileproile
195200205
aspglyileglyserglnthrhisleuseralaglyglyglyalagly
210215220
ileserglyalaleuasnalaleualaglyalaglythrlysgluile
225230235240
alavalthrgluleuaspilealaglyalaserserthrasptyrval
245250255
gluvalvalglualacysleuasnglnprolyscysileglyilethr
260265270
valtrpglyvalalaaspproaspsertrpargserserserthrpro
275280285
leuleupheaspserasntyrasnprolysproalatyrthralaile
290295300
alaasnalaleu
305
<210>2
<211>924
<212>dna
<213>artificialsequence(人工序列)
<400>2
gagcccattgaaccccgtcaggcttcagtgagtatcgataccaaattcaaggctcacggg60
aagaaatatcttggaaacattggtgatcagtacagattgaccaagaactcgaagactccg120
gcaattatcaaggccgattttggcgcgttgactccagagaatagcatgaagtgggatgct180
actgaaccaagccgtgggcagttctctttctcaggatcagactacctggtcaactttgcc240
cagtctaacaacaagctgatccgcggacatactctcgtgtggcactcgcagctcccctcc300
tgggtccaatccatcacggacaagaatacactgatcgaagtcatgaagaatcacatcacc360
acagtgatgcaacactataagggcaagatctacgcctgggacgttgtcaatgaaattttc420
aacgaagatggctccctgcgtgacagcgtcttctacaaggtcatcggcgaggactacgtc480
cggatcgccttcgagactgctcgggctgcagatcccaatgcaaagctctacatcaatgat540
tacaacctggattccgcctcctaccctaaattgaccggcatggttagccatgtcaagaag600
tggatcgcagctggcatccctatcgatggaatcggttcccaaacccacttgagcgctggt660
ggaggtgctggaatttctggagctctcaatgctctcgcaggtgccggcactaaggaaatt720
gctgtcaccgagcttgacatcgctggcgccagctcgaccgactatgtggaggtcgtcgaa780
gcctgcctgaaccagcccaagtgtatcggtatcaccgtttggggagttgctgacccggac840
tcctggcgctccagctccactcctctgctgttcgacagcaactacaacccgaagcctgca900
tacactgctatcgcaaatgctctc924
<210>3
<211>308
<212>prt
<213>aspergillusniger
<400>3
gluproilegluproargglnalaservalserileaspthrlysphe
151015
lysalahisglylyslystyrleuglyasnileglyaspglntyrthr
202530
leuthrlysasnserlysthrproalaileilelysalaaspphegly
354045
alaleuthrprogluasnsermetlystrpaspalathrgluproser
505560
argglyglnpheserpheserglyserasptyrleuvalasnpheala
65707580
glnserasnasnlysleuileargglyhisthrleuvaltrphisser
859095
glnleuprosertrpvalglnserilethrasplysasnthrleuile
100105110
gluvalmetlysasnhisilethrthrvalmetglnhistyrlysgly
115120125
lysiletyralatrpaspvalvalasngluilepheasngluaspgly
130135140
serleuargaspservalphetyrlysvalileglygluasptyrval
145150155160
argilealaphegluthralaargalaalaaspproasnalalysleu
165170175
tyrileasnasptyrasnleuaspseralasertyrprolysleuthr
180185190
glymetvalserhisvallyslystrpilealaalaglyileproile
195200205
aspglyileglyserglnthrhisleuseralaglyglyglyalagly
210215220
ileserglyalaleuasnalaleualaglyalaglythrlysgluile
225230235240
alavalthrgluleuaspilealaglyalaserserthrasptyrval
245250255
gluvalvalglualacysleuasnglnprolyscysileglyilethr
260265270
valtrpglyvalalaaspproaspsertrpargserserserthrpro
275280285
leuleupheaspserasntyrasnprolysproalatyrthralaile
290295300
alaasnalaleu
305
<210>4
<211>35
<212>dna
<213>artificialsequence(人工序列)
<400>4
ccggaattcgaaccaatcgaaccaagacaagcttc35
<210>5
<211>41
<212>dna
<213>artificialsequence(人工序列)
<400>5
ataagaatgcggccgcttacaaagcgttagcgatagcagtg41
<210>6
<211>34
<212>dna
<213>artificialsequence(人工序列)
<400>6
cttagagttcttagtcaatctgtattggtcaccg34
<210>7
<211>34
<212>dna
<213>artificialsequence(人工序列)
<400>7
cggtgaccaatacagattgactaagaactctaag34
<210>8
<211>23
<212>dna
<213>artificialsequence(人工序列)
<400>8
aggatgtcagaatgccatttgcc23
<210>9
<211>21
<212>dna
<213>artificialsequence(人工序列)
<400>9
gactggttccaattgacaagc21
<210>10
<211>30
<212>dna
<213>artificialsequence(人工序列)
<400>10
ccggaattcgagcccattgaaccccgtcag30
<210>11
<211>39
<212>dna
<213>artificialsequence(人工序列)
<400>11
ataagaatgcggccgcttagagagcatttgcgatagcag39
- 还没有人留言评论。精彩留言会获得点赞!