培养生成液制造方法与流程
本发明关于制造一培养生成液的一种培养生成液的制造方法,其使用收集自一捐赠者的一骨髓液所制得的一干细胞。
背景技术:
现有干细胞培养装置包含一培养槽及一支撑件,一培养液填充于该培养槽中,该支撑件于该支撑表面具有一高度差,且涂布有一干细胞附着材,其中多个低部与该支撑表面具有一高度差(请参照日本特开2014-183770号专利案)。该干细胞培养装置用于使该支撑件漂浮于该培养液中,并用于增生该干细胞,该干细胞通过该干细胞附着材以分散的情况附着于该支撑表面,而不致自该支撑表面剥离。
技术实现要素:
本发明所解决的问题
于日本特开2014-183770号专利案公开的干细胞培养装置中,包含经培养的干细胞的一培养液被作为废料丢弃,该培养液包含的经培养的干细胞,其包含分泌自这些干细胞的代谢产物,可以应用于疾病治疗或美容用途。然而,由于多种类的干细胞存在于收集自一捐赠者的组织或其细胞中,培养这些干细胞导致其自我增生,使该培养液中包含分泌自这些干细胞的多种类的代谢产物,因而无法成功地制造一培养生成液,其对于各种疾病治疗或美容用途只具有特定的效果。
本发明的目标是提供一种培养生成液的制造方法,其能够制造出一培养生成液,该培养生成液包含分泌自一单一种类的干细胞的一预定代谢产物,且对于各种疾病治疗或美容用途具有特定的效果。
解决问题的技术手段
为解决前述问题,本发明提供制造一培养生成液的一种培养生成液的制造方法,其使用收集自一捐赠者的一骨髓液所制得的一干细胞。
本发明的培养生成液的制造方法包含:分离骨髓液步骤,将收集自一捐赠者的一骨髓液分离为多层;萃取骨髓液步骤,自于该分离骨髓液步骤中分离为多层的骨髓液中萃取位于一中间层的一中间层骨髓液;第一固定干细胞步骤,将于该萃取骨髓液步骤中萃取出的该中间层骨髓液及一预定培养液注入一第一培养容器中,该第一培养容器具有一预定容量及具有一预定面积的一底表面,将该第一培养容器静置一预定时间,使该中间层骨髓液所包含的一第一干细胞固定于该第一培养容器的一底表面;第一培养干细胞步骤,通过该第一固定干细胞步骤将该第一干细胞固定于该第一培养容器的底表面后,丢弃该第一培养容器中的培养液,将一新的培养液注入该第一培养容器,将该第一培养容器静置一预定时间并培养该第一干细胞,直到该第一干细胞的总表面积达该第一培养容器的底表面积的一第一目标比;第一收集干细胞步骤,通过该第一培养干细胞步骤,于培养该第一干细胞的过程中,当该第一干细胞的总表面积达该第一目标比时,自该第一培养容器收集该第一干细胞;分离干细胞步骤,将收集自该第一收集干细胞步骤的该第一干细胞离心分离为多层;第二收集干细胞步骤,自于该分离干细胞步骤中分离为多层的第一干细胞中,收集位于最底层的一第二干细胞;第二固定干细胞步骤,将收集自该第二收集干细胞步骤中收集的该第二干细胞及一预定培养液注入一第二培养容器,该第二培养容器的容量大于该第一培养容器,且该第二培养容器的底表面积也大于该第一培养容器,将该第二培养容器静置一预定时间,使该第二干细胞固定于该第二培养容器的一底表面;第二培养干细胞步骤,通过该第二固定干细胞步骤将该第二干细胞固定于该第二培养容器的底表面后,丢弃该第二培养容器中的培养液,将一新的培养液注入该第二培养容器,将该第二培养容器静置一预定时间,并培养该第二干细胞直到该第二干细胞的总表面积达该第二培养容器的底表面积的一第二目标比;及第一萃取培养生成液步骤,通过该第二培养干细胞步骤,于培养的过程中,当该第二干细胞的总表面积达该第二目标比时,自该第二培养容器中萃一培养生成液,该培养生成液包含分泌自该单一种类的增生的第二干细胞的一预定代谢产物。
本发明的培养生成液的制造方法的一实施例中,于该第一固定干细胞步骤及该第一培养干细胞步骤中,该第一培养容器以一预定角度静置一预定时间,且于该第二固定干细胞步骤及该第二培养干细胞步骤中,该第二培养容器以一预定角度静置一预定时间。
本发明的培养生成液的制造方法的另一实施例中,该培养生成液的制造方法包含:第二收集干细胞步骤,通过该第一萃取培养生成液步骤自该第二培养容器萃取一培养生成液后,自该第二培养容器收集该第二干细胞;第三固定干细胞步骤,将于该第二收集干细胞步骤中收集的第二干细胞及一新的培养液注入一第三培养容器,该第三培养容器具有一预定容量及具有一预定面积的一底表面,该容量及该底表面积均大于该第二培养容器,将该第三培养容器静置一预定时间,使该第二干细胞固定于该第三培养容器的一底表面;第三培养干细胞步骤,通过该第三固定干细胞步骤将该第二干细胞固定于该第三培养(漏了容器)的底表面后,丢该第三培养容器中的培养液,将一新的培养液注入该第三培养容器,将该第三培养容器静置一预定时间,并培养该第二干细胞直到该第二干细胞的总表面积相对该第三培养容器的底表面积达一第三目标比;及第二萃取培养生成液步骤,通过该第三培养干细胞步骤,于培养的过程中,当该第二干细胞的总表面积达该第三目标比时,自该第三培养容器中萃一培养生成液,该培养生成液包含分泌自该单一种类的增生的第二干细胞的一预定代谢产物。
本发明的培养生成液的制造方法的另一实施例中,于该第三固定干细胞步骤及该第三培养干细胞步骤中,该第三培养容器以一预定角度静置一预定时间。
本发明的培养生成液的制造方法的另一实施例中,于该分离骨髓液步骤中,自该捐赠者收集2~3mL的一骨髓液,将该2~3mL的骨髓液注入一沿垂直方向延伸的分离容器,该分离容器于与体温大致相同的温度下静置一预定时间,该骨髓液于该分离容器中垂直分离为多层,且于该萃取骨髓液步骤中,萃取位于在该分离容器中分离为多层的骨髓液的该中间层的中间层骨髓液。
本发明的培养生成液的制造方法的另一实施例中,该第一培养容器的容量约为20~30mL,该第一干细胞的起始平面形状略呈圆形,该第一干细胞的变形的平面形状主要略呈圆形,接着该第一干细胞沿单一方向延伸为不规则形状的扁形,且于该第一固定干细胞步骤中,该第一培养容器于与体温大致相同的温度下静置12~24小时,并于第12~24小时内,以每隔约1~2小时的间隔观察该第一培养容器中的该第一干细胞自该起始平面形状变形的状态,当该第一干细胞自该起始平面形状变形为该不规则扁形,即判断该第一干细胞固定于该第一培养容器的底表面。
本发明的培养生成液的制造方法的另一实施例中,于该第一收集干细胞步骤中,该第一培养容器于与体温大致相同的温度下静置36~48小时,并于36~48小时内,以每隔约1~2小时的间隔观察固定于该第一培养容器的底表面的第一干细胞的总表面积相对于该第一培养容器的底表面积。
本发明的培养生成液的制造方法的另一实施例中,该第一干细胞的总表面积相对于该第一培养容器的底表面积的第一目标比为70~80%。
本发明的培养生成液的制造方法的另一实施例中,于该分离干细胞步骤中,将该第一干细胞注入一分离容器,该分离容器置于一离心机以离心分离该第一干细胞,且于该第一收集干细胞步骤中,于该分离容器中离心分离为多层的第一干细胞中,收集位于最底层的第二干细胞。
本发明的培养生成液的制造方法的另一实施例中,该第二培养容器的容量约为40~60mL,该第三培养容器的容量约为70~80mL,该第二干细胞的起始平面形状略呈圆形,该第二干细胞的变形的平面形状主要略呈圆形,接着该第二干细胞沿单一方向延伸为不规则形状的扁形,且于该第二固定干细胞步骤及该第三固定干细胞步骤中,该第二培养容器及该第三培养容器于与体温大致相同的温度下静置36~48小时,并于36~48小时内,以每隔约1~2小时的间隔观察该第二培养容器及该第三培养容器中的该第二干细胞自该起始平面形状变形的状态,当该第二干细胞自该起始平面形状变形为该不规则扁形,即判断该第二干细胞固定于该第二培养容器及该第三培养容器的底表面。
本发明的培养生成液的制造方法的另一实施例中,于该第二收集干细胞步骤及该第三收集干细胞步骤中,该第二培养容器及该第三培养容器于与体温大致相同的温度下静置36~48小时,并于36~48小时内,以每隔约1~2小时的间隔观察固定于该第二培养容器的底表面的第二干细胞的总表面积相对于该第二培养容器的底面积,及固定于该第三培养容器的底表面的第二干细胞的总表面积相对于该第三培养容器的底面积。
本发明的培养生成液的制造方法的另一实施例中,该第二干细胞的总表面积相对于该第二培养容器的底表面积的第二目标比为88~92%,该第三干细胞的总表面积相对于该第三培养容器的底表面积的第三目标比为88~92%。
本发明的培养生成液的制造方法的另一实施例中,该第一干细胞及该第二干细胞为间充质干细胞。
本发明的效果
本发明的培养生成液的制造方法是萃取分离为多层的骨髓液中位于中间层的一中间层骨髓液,以一培养液培养该中间层骨髓液,使一第一干细胞固定于该第一培养容器的一底表面,在培养该第一干细胞的过程中,当该第一干细胞的总面积达该第一培养容器的底表面积的一第一目标比时,自该第一培养容器收集该第一干细胞,收集分离为多层的第一干细胞中位于最底层的第二干细胞,以一培养液培养该第二干细胞,使该第二干细胞固定于一第二培养容器的底表面,将一新的培养液注入该第二培养容器,培养该第二干细胞,及在培养该第二干细胞的过程中,当该第二干细胞的总面积达该第二培养容器的底表面积的一第二目标比时,自该第二培养容器萃取一培养生成液,该培养生成液包含分泌自该单一种类的增生的第二干细胞的一预定代谢产物。因此,使用经培养的单一种类的第二干细胞,不会包含分泌自多种类的干细胞的多种类的代谢产物,而只包含分泌自单一种类的第二干细胞的一预定代谢产物,且可以制造获得对特定疾病提供单一特定效果,及具有肌肤保养、头发保养及身体保养等预定美容用途的一培养生成液,可以制造获得对于治疗特定疾病具有有效用途的一培养生成液,及可以制造获得对于特定美容用途具有有效用途的一培养生成液。该培养生成液的制造方法可以制造获得一培养生成液,使用通过移除不必要的干细胞所获得的纯的(干净的)第二干细胞,及使该培养生成液仅包含分泌自单一种类的第二干细胞的一预定代谢产物,因此提供对于治疗特定疾病具有明显效果,且可以制造获得对治疗前述疾病有效的一培养生成液,使制造获得对于特定美容用途具有明显效果的一培养生成液变得可行。
该培养生成液的制造方法中,于该第一固定干细胞步骤及该第一培养干细胞步骤中,使该第一培养容器一预定角度静置一预定时间,且于该第二固定干细胞步骤及该第二培养干细胞步骤中,使该第二培养容器以一预定角度静置一预定时间,可以确认地将该第一干细胞固定于该第一培养容器的底表面,且可以通过于该第一固定干细胞步骤及该第一培养干细胞步骤中,使该第一培养容器以一预定角度静置依预定时间,可以确认地促进该第一干细胞的增生。该培养生成液的制造方法于该第二固定干细胞步骤及该第二培养干细胞步骤,使该第二培养容器以一预定角度静置一预定时间,可以确认将该第二干细胞固定于该第二培养容器的底表面,且可以确认第促进该第二干细胞的增生。
该培养生成液的制造方法中,于自该第二培养容器中萃取一培养生成液后,自该第二培养容器收集该第二干细胞,以一培养液培养该第二干细胞,使该第二干细胞固定于一第三培养容器的底表面,该第三培养容器与该第二培养容器相比,具有较大的容量及较大的底表面积,将一新的培养液注入该第三培养容器,培养该第二干细胞,及于培养该第二干细胞的过程中当该第二干细胞的总面积相对于该第三培养容器的表面积达该第三目标比时,自该第三培养容器萃取一培养生成液,其包含分泌自单一种类的增生的第二干细胞的一预定代谢产物,进一步于该第三培养容器中培养该第二干细胞,于培养该第二干细胞的过程中,当该第二干细胞的总表面积相对于该第三培养容器的底表面积达该第三目标比时,自该第三培养容器萃取一培养生成液,该培养生成液包含分泌自该单一种类的增生的第二干细胞的一预定代谢产物,因此在培养干细胞的过程中,并不会培养多种类的干细胞,也不会包含分泌自多种类的干细胞的多种类的代谢产物,而只会包含分泌自该单一种类的第二干细胞的一预定代谢产物,可以只制造获得针对预定疾病及预定美容用途具有特定效果的一培养生成液,可以制造获得可以有效治疗预定疾病的一培养生成液,及可以制造获得可以有效应用于预定美容用途的一培养生成液。该培养生成液的制造方法通过使用具有比该第二培养容器更大的容量的第三培养容器,可以一次就制造获得大量的培养生成液。
该培养生成液的制造方法中,于该第三固定干细胞步骤及该第三培养干细胞步骤中,使该第三培养容器以一预定角度静置一预定时间,可以确认地使第二干细胞固定于该第二培养容器的一底表面,且可以通过于该第三固定干细胞步骤及该第三培养干细胞步骤中,使该第三培养容器以一预定角度静置一预定时间,确认地促进该第二干细胞的增生。
该培养生成液的制造方法中,于分离骨髓液步骤中自一捐赠者收集2~3mL的一骨髓液,将2~3mL的一骨髓液注入一沿垂直方向延伸的分离容器,使该分离容器于与体温大致相同的温度下静置预定时间,垂直地将该分离容器中的骨髓液分为多层,及于该萃取骨髓液步骤中萃取位于在该分离容器中分离为多层的骨髓液的该中间层的中间层骨髓液,使包含多种类的干细胞的一骨髓液于与体温大致相同的温度下静置预定时间,使其被垂直分离为多层,因此可以确认地自该骨髓液中萃取特定的中间层骨髓液,及自该中间层骨髓液培养一单一种类的第二干细胞,因此可以通过移除不必要的干细胞来制造获得一培养生成液,该培养生成液只包含分泌自一单一种类的干细胞的一预定代谢产物,且对于预定疾病及预定美容用途具有特定的效果,也可以制造获得对于治疗预定疾病可以具有效果的一培养生成液,也可以制造获得对于预定美容用途具有效果的一培养生成液。
该培养生成液的制造方法中,该第一培养容器的容量约为20~30mL,该第一干细胞的起始平面形状略呈圆形,该第一干细胞的变形的平面形状主要略呈圆形,接着该第一干细胞沿单一方向延伸为不规则形状的扁形。且于该第一固定干细胞步骤中,该第一培养容器于与体温大致相同的温度下静置12~24小时,并于12~24小时内,以每隔约1~2小时的间隔观察该第一培养容器中的该第一干细胞自该起始平面形状变形的状态,当该第一干细胞自该起始平面形状变形为该不规则扁形,即判断该第一干细胞固定于该第一培养容器的底表面。当该第一培养容器的容量超过30mL,该第一干细胞将无法固定于该第一培养容器的底表面,及该第一干细胞的增生趋缓;但是使用该容量的第一培养容器,可以使该第一干细胞立刻且容易地固定于该第一培养容器的底表面,可以通过使该第一干细胞于该第一培养容器中增生,可以于短时间内制造获得一单一种类的干细胞,且通过于短时间内移除不必要的干细胞,而可以制造获得大量的培养生成液,其中包含只分泌自一单一种类的干细胞的一预定代谢产物。该培养生成液的制造方法中,使该第一培养容器于与体温大致相同的温度下静置12~24小时,并于12~24小时内,以每隔约1~2小时的间隔观察该第一培养容器中的该第一干细胞自该起始平面形状变形的状态,当该第一干细胞的变形的平面形状主要略呈圆形,接着该第一干细胞沿单一方向延伸为不规则形状的扁形,即判断该第一干细胞固定于该第一培养容器的底表面,因此绝对不会错认该第一干细胞固定于该第一培养容器的底表面,依据该第一干细胞的平面形状的变化,可以合适地确认该第一干细胞固定于该第一培养容器的底表面,于确认该第一干细胞固定于该第一容器的底表面后,丢弃该第一培养容器中的培养液,将一新的培养液注入该第一培养容器,以确实地促进该第一干细胞的增生,且通过使用该第一干细胞可以确实地制造获得只包含分泌自单一种类的干细胞的一预定产物的培养生成液。
该培养生成液的制造方法中,于该第一收集干细胞步骤中,使该第一培养容器于与体温大致相同的温度下静置36~48小时,并于36~48小时内,以每隔约1~2小时的间隔观察固定于该第一培养容器的底表面的第一干细胞的总表面积相对于该第一培养容器的底表面积,通过以每隔1~2小时的间隔观察该总表面积,可以合适地确认该第一干细胞的总表面积与该第一培养容器的底表面积的面积之间的关系,可以确实地确认该第一干细胞的总表面积达该第一培养容器的底面积的一第一目标比,维持该第一干细胞的活性,且不会错失自该第一培养容器中收集该第一干细胞的良好时机,自该第一培养容器中收集该第一干细胞,且使用该第一干细胞可以确实地制造获得包含只分泌自一单一种类的干细胞的一预定代谢产物的一培养生成液。
该培养生成液的制造方法中,该第一干细胞的总表面积相对于该第一培养容器的底表面积的第一目标比为70~80%,当该第一干细胞的增生超过80%,使该第一干细胞的总表面积相对于该第一培养容器的底表面积超过80%,该第一干细胞的活性会逐渐减少,且当该第一干细胞增生为70~80%,使该第一干细胞的总表面积相对于该第一培养容器的底表面积,自该第一培养容器中收集该第一干细胞,因此可以依据该第一干细胞的增生,以维持该第一干细胞的活性,并通过使用该第一干细胞,可以确实地制造获得包含只分泌自一单一种类的干细胞的一预定代谢产物的一培养生成液。
该培养生成液的制造方法中,于该分离干细胞步骤中,将该第一干细胞注入一分离容器,于该第一收集干细胞步骤中,将该分离容器置于一离心机,以离心分离该第一干细胞,并收集该分离容器中离心分离为多层的第一干细胞中位于最底层的第二干细胞,将包含不必要的干细胞的第一干细胞离心分离为多层,及自离心分离为多层的第一干细胞中收集位于最底层的第二干细胞,因此能够确实地自该第一干细胞中萃取特定的第二干细胞,及自该第二干细胞中移除不必要的干细胞。该培养生成液的制造方法可以只培养特定种类的第二干细胞,及通过使用该第一干细胞,可以确实地制造获得包含只分泌自一单一种类的干细胞的一预定代谢产物的一培养生成液。
该培养生成液的制造方法中,该第二培养容器的容量约为40~60mL,该第三培养容器的容量约为70~80mL,该第二干细胞的起始平面形状略呈圆形,该第二干细胞的变形的平面形状主要略呈圆形,接着该第二干细胞沿单一方向延伸为不规则形状的扁形。且于该第二固定干细胞步骤及该第三固定干细胞步骤中,该第二培养容器及该第三培养容器于与体温大致相同的温度下静置36~48小时,并于36~48小时内,以每隔约1~2小时的间隔观察该第二培养容器及该第三培养容器中的该第二干细胞自该起始平面形状变形的状态,当该第二干细胞自该起始平面形状变形为该不规则扁形,即判断该第二干细胞固定于该第二培养容器的底表面及该第三培养容器的底表面。当该第二培养容器的容量超过60mL,及该第三培养容器的容量超过80mL,该第二干细胞将无法固定于该第二培养容器的底表面及该第三培养容器的底表面,及该第二干细胞的增生趋缓;但是使用该容量的第二培养容器及第三培养容器,可以使该第二干细胞立刻且容易地固定于该第二培养容器的底表面及该第三培养容器的底表面,可以通过使该第二干细胞于该第二培养容器及该第三培养容器中增生,可以于短时间内制造获得一单一种类的第二干细胞,且通过于短时间内移除不必要的干细胞,而可以制造获得大量的培养生成液,其中包含只分泌自单一种类的第二干细胞的一预定代谢产物。该培养生成液的制造方法中,使该第二培养容器及该第三培养容器于与体温大致相同的温度下静置36~48小时,并于36~48小时内,以每隔约1~2小时的间隔观察该第二培养容器及该第三培养容器中的第二干细胞自该起始平面形状变形的状态当该第二干细胞的变形的平面形状主要略呈圆形,接着该第二干细胞沿单一方向延伸为不规则形状的扁形,即判断该第二干细胞固定于该第二培养容器及该第三培养容器的底表面,因此绝对不会错认该第二干细胞固定于该第二培养容器及该第三培养容器的底表面,依据该第二干细胞的平面形状的变化,可以合适地确认该第二干细胞固定于该第二培养容器及该第三培养容器的底表面,于确认该第二干细胞固定于该第二培养容器及该第三培养容器的底表面后,丢弃该第二培养容器及该第三培养容器中的培养液,将一新的培养液注入该第二培养容器及该第三培养容器,以确实地促进该第二干细胞的增生,且通过使用该第二干细胞可以确实地制造获得只包含分泌自单一种类的第二干细胞的一预定产物的培养生成液。
该培养生成液的制造方法中,于该第二干细胞收集步骤及该第三干细胞收集步骤中,使该第二培养容器及该第三培养容器于与体温大致相同的温度下静置36~48小时,并于36~48小时内,以每隔1~2小时的间隔观察固定于该第二培养容器的底表面的第二干细胞的总表面积相对于该第二培养容器的底面积,及固定于该第三培养容器的底表面的第二干细胞的总表面积相对于该第三培养容器的底面积,通过以每隔约1~2小时的间隔观察该总面积,可以合适地确认该第二干细胞的总表面积相对于该第二培养容器及该第三培养容器的底表面积之间的关系,可以确实地确认该第二干细胞的总表面积达该第二培养容器的底面积的一第二目标比,及该第三干细胞的总表面积相对于该第三培养容器的底表面积达一第三目标比,维持该第二干细胞的活性,且不会错失自该第二培养容器及该第三培养容器中收集该第二干细胞的良好时机,自该第二培养容器及该第三培养容器中收集该第二干细胞,且使用该第二干细胞可以确实地制造获得包含只分泌自一单一种类的干细胞的一预定代谢产物的一培养生成液。
该培养生成液的制造方法中,该第二干细胞的总表面积相对于该第二培养容器的底表面积的第二目标比为88~92%,该第二干细胞的总表面积相对于该第三培养容器的底表面积的第三目标比为88~92%,当该第二干细胞的增生超过92%,使该第二干细胞的总表面积相对于该第二培养容器及该第三培养容器的底表面积超过92%,该第二干细胞的活性会逐渐减少,且当该第二干细胞增生为88~92%,使该第二干细胞的总表面积相对于该第二培养容器及该第三培养容器的底表面积,自该第二培养容器及该第三培养容器中收集该第二干细胞,因此可以依据该第二干细胞的增生,以维持该第二干细胞的活性,并通过使用该第二干细胞,可以确实地制造获得包含指分泌自一单一种类的第二干细胞的一预定代谢产物的一培养生成液。
该培养生成液的制造方法中,该第一干细胞及该第二干细胞为间充质干细胞,使用培养的单一种类的第二干细胞,不会包含分泌自多种类的干细胞的多种类的代谢产物,只会包含分泌自单一种类的第二干细胞的一预定代谢产物,且可以制造获得针对预定疾病只具有特定效果的培养生成液,可以制造获得具有预定美容用途(例如,肌肤保养、头发保养及身体保养)的培养生成液,可以制造获得对于治疗预定疾病具有良好效果的一培养生成液,及可以制造获得对于预定美容用途具有良好效果的一培养生成液。该培养生成液的制造方法可以制造获得一培养生成液,通过移除不必要的干细胞所获得的纯的第二干细胞的使用,使该培养生成液只包含分泌自单一种类的第二干细胞的一预定代谢产物,因此提供对于预定疾病的治疗的特殊效果,及制造获得能够有效治疗这些疾病的一培养生成液,使制造获得针对特定美容用途具有显著效果的一培养生成液变的可行。
附图说明
[图1]作为一实施例的培养生成液制造系统的示意图。
[图2]为一说明图,其显示一分离骨髓液步骤的一实施例。
[图3]为一说明图,其显示接续图2的一分离骨髓液步骤。
[图4]为一说明图,其显示接续图3的一分离骨髓液步骤。
[图5]为一说明图,其显示一第一观察干细胞步骤的一实施例。
[图6]为一第一平面培养容器的侧视图。
[图7]为一局部放大图,其显示第一间充质干细胞的平面形状的一实施例。
[图8]为一局部放大图,其显示第一间充质干细胞的平面形状的另一实施例。
[图9]为一局部放大图,其显示第一间充质干细胞的平面形状的另一实施例。
[图10]为一说明图,其显示一分离干细胞步骤的一实施例。
[图11]为一说明图,其显示一第二萃取干细胞步骤的一实施例。
[图12]为一说明图,其显示一第三观察干细胞步骤的一实施例。
[图13]为一第二平面培养容器的侧视图。
[图14]为一局部放大图,其显示第二间充质干细胞的平面形状的一实施例。
[图15]为一局部放大图,其显示第二间充质干细胞的平面形状的另一实施例。
[图16]为一局部放大图,其显示第二间充质干细胞的平面形状的另一实施例。
[图17]为一说明图,其显示被萃取的培养生成液及被储存的第二间充质干细胞的一实施例。
[图18]为一说明图,其显示一第五观察干细胞步骤的一实施例。
[图19]为一第三平面培养容器的侧视图。
附图标记说明
10 培养生成液制造系统
11 计算机
12 条形码读取器
13 电子显微镜
14 键盘
15 鼠标
16 显示器
17 第一代码表
18 原始骨髓液
19 玻璃试管
20 试管架
21 恒温水浴
22 中间层骨髓液
23 培养液
24 第一培养容器(第一平面培养容器)
25 第二培养容器(第二平面培养容器)
26 第一间充质干细胞(第一干细胞)
27 底部
28 离心机
29 玻璃试管
30 第二间充质干细胞(第二干细胞)
31 培养生成液
32 保存容器
33 保存容器
34 冰箱
35 第三培养容器(第三平面培养容器)
36 样品架
37 上表面
38 底部
39 间隔件
40 顶部
41 注入孔
42 盖体
43 顶部
44 底部
45 注入孔
46 盖体
47 顶部
48 底部
49 注入孔
50 盖体。
具体实施方式
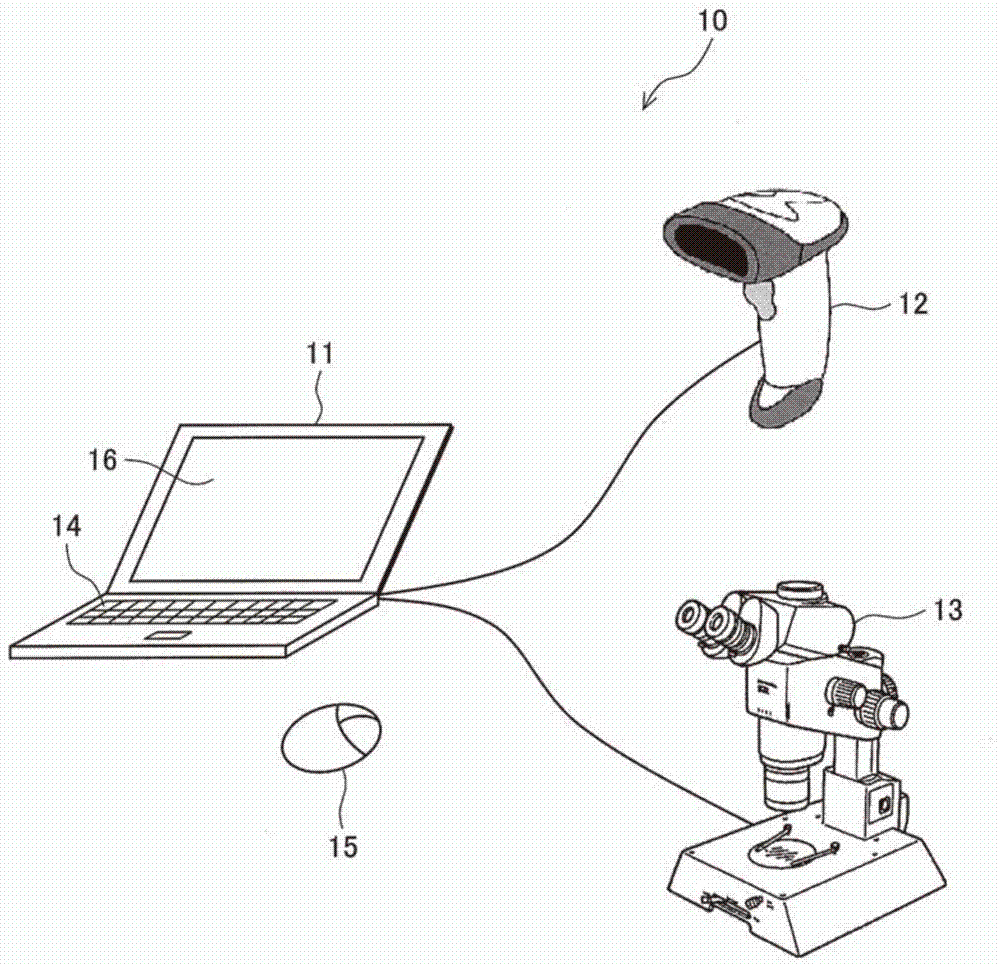
搭配例如图1等的附图所示,图1为作为一实施例的一培养生成液制造系统10的示意图。本发明的培养生成液的制造方法的细节将会如后说明。附带一提,图2为一说明图,其显示一分离骨髓液步骤的一实施例,图3为一说明图,其显示接续图2的一分离骨髓液步骤,图4为一说明图,其显示接续图3的一分离骨髓液步骤。
该培养生成液的制造方法培养一骨髓液所包含的多种种类的间充质干细胞中的单一及特定种类的间充质干细胞(单一种类的干细胞,及制造获得包含分泌自单一种类的间充质干细胞的一预定代谢产物的一培养生成液。详而言之,该培养生成液的制造方法可以制造获得一培养生成液,通过使用收集自多个捐赠者(人体)的一骨髓液(原始骨髓液)作为起始原料及一培养生成液制造系统10,通过一分离骨髓液步骤、一萃取骨髓液步骤、一第一固定干细胞步骤、一第一培养干细胞步骤、一第一收集干细胞步骤、一分离干细胞步骤、一第二收集干细胞步骤、一第二固定干细胞步骤、一第二培养干细胞步骤、一第一萃取培养生成液步骤。更进一步,通过使用该培养生成液制造系统10,该培养生成液可以通过一第二收集干细胞步骤、一第三固定干细胞步骤、一第三培养干细胞步骤及一第二萃取培养生成液步骤而被制造获得。
该第一固定干细胞步骤包含一第一观察干细胞步骤,该第二收集干细胞步骤包含一第二观察干细胞步骤,该第二固定干细胞步骤包含一第三观察干细胞步骤,该第一萃取培养生成液步骤包含一第四观察干细胞步骤,该第三固定干细胞步骤包含一第五观察干细胞步骤,及该第二萃取培养生成液步骤包含一第六观察干细胞步骤.
该培养生成液制造系统10具有一计算机11、一条形码读取器12及一电子显微镜13,该计算机11具有一中央处理器(CPU或虚拟CPU)、一内存储存单元(内存或虚拟内存)及一大量储存区域(一硬盘或一虚拟硬盘等),且由一物理操作系统或一虚拟操作系统所操控。该计算机11通过一接口(无线或有线)连接例如一键盘14及一鼠标15等的一输入设备,及例如一显示器16及一打印机(图未示)等的一输出装置。
于该培养生成液制造系统10中,以该二维条形码﹝QR code(注册商标)﹞来处理捐赠者数据(捐赠者可识别讯息),于该捐赠者资料中包含该捐赠者的姓名、地址、电话号码、生日、性别、血型、身高、体重、电子邮件信箱等。于该培养生成液制造系统10中,该二维条形码(QR code)是作为一二维条形码(two-dimentaional code),且除了该二维条形码(QR code)外,也可以使用一矩阵系统SP条形码(matrix system SP code)、vericode条形码(VeriCode)、maxicode条形码(MaxiCode)、CP条形码(CP code)、DataMatric条形码(DataMatric)、Code1条形码(Code1)、Aztec Code条形码(AztecCode)、intacta code条形码(intacta code)及card e条形码(card e)。附带一提,该培养生成液制造系统10中所使用的二维条形码包含未来所要开发的所有二维条形码。
于该分离骨髓液步骤中,将收集自一捐赠者的一骨髓液18分离为多层,于该收集骨髓液步骤中,自该捐赠者的胸骨(breastbone)或髂骨(ilium)﹝骨盆(pelvis)﹞收集2~3毫升的骨髓液18,以「骨髓穿刺法(bone marrow aspiration)」(即,〝MARK〞,指骨髓)收集该骨髓液18,对该捐赠者施予局部麻醉(local anesthesia),续穿刺骨髓,及抽吸出一骨髓液﹝骨髓血液(bone marrow blood)﹞。于收集该骨髓液18的同时,医生、护士及研究人员等负责人员于该计算机11中启动(activate)该培养生成液制造系统10,并以键盘14、鼠标15等输入设备将该捐赠者数据输入至该计算机11。
该计算机11生成一独特的捐赠者识别符(donor identifier),其具体指定所输入的每次每一个捐赠者的捐赠者资料(每次收集自该捐赠者的骨髓液18)并以该捐赠者资料与该捐赠者识别符﹝捐赠者数据储存手段(donor data storage means)﹞相关联的方式储存(记忆)于该储存区域。该计算机11以一二维条形码写入功能(QR code writer funcion)﹝二维条形码转换手段(QR code coverting means)﹞将输入的捐赠者数据转换为一二维条形码(QR code、two-dimentional code),并将该二维条形码打印输出为第一代码表17﹝二维条形码输出手段(QR code output means)﹞,并以该二维条形码与该捐赠者识别符相关联的方式储存(记忆)于该储存区域,该捐赠者识别符具体指定各捐赠者﹝二维条形码储存手段(QR code storage means)﹞。当输入第二捐赠者数据时,输出打印有一二维条形码的一第二代码表,当输入第三捐赠者数据时,输出打印有一二维条形码的一第三代码表,据此可以根据不同的捐赠者输出第一至第n代码表。
于打印于该第一代码表18a的二维条形码打印有编号1(NO.1),该编号1(NO.1),指一分离骨髓液步骤、一萃取骨髓液步骤、一第一观察干细胞步骤、一第一固定干细胞步骤、一第一培养干细胞步骤、一第二观察干细胞步骤、一第一收集干细胞步骤、一分离干细胞步骤、一第二收集干细胞步骤、一第三观察干细胞步骤、一第二固定干细胞步骤、一第二培养干细胞步骤、一第四观察干细胞步骤、一第一萃取培养生成液步骤、一第二收集干细胞步骤、一第三固定干细胞步骤、一第三培养干细胞步骤、一第二萃取培养生成液步骤、一第二收集干细胞步骤、一第五观察干细胞步骤、一第三固定干细胞步骤、一第三培养干细胞步骤及一第六观察干细胞步骤、一第二萃取培养生成液步骤。该计算机11依据每次进行的自该分离骨髓液步骤至该第一萃取培养生成液步骤中的每一个步骤,比对储存于该储存区域的捐赠者数据及通过该条形码读取器12显示的二维条形码显示的捐赠者数据。
请参照图2所示,将收集自该捐赠者的2~3毫升的骨髓液18注入(储存于)沿该垂直方向延伸的玻璃试管19(该分离容器)中。于2~3毫升的骨髓液18中,包含0.5~1毫升(约5×107细胞/毫升)的多类型的间充质干细胞。一第一代码表17黏贴于内部注入有该骨髓液18的玻璃试管19的外周面。请参照图3所示,内部注入有该骨髓液18的玻璃试管19置于一试管架20,且该试管架20容置于一恒温水浴21中。
医生、护士及研究人员等负责人员将印有该二维条形码的第一代码表17黏贴于该玻璃试管19的外环周面,接着以该条形码读取器12读取该玻璃试管19的二维条形码,该条形码读取器12通过一接口(有线或无线)连接该计算机11,该条形码读取器12将所读取的二维条形码传输至该计算机11。
该计算机11析取该编号1(NO.1)及传输自该条形码读取器12的二维条形码所指、来自该储存区域的捐赠者数据,将其读取至该高速缓存储存器(cache memory),并显示于一显示器16的一步骤第一显示屏幕(图未示)。该步骤第一显示屏幕上显示该编号1(NO.1)及该捐赠者资料,于此同时,该步骤第一显示屏幕上也显示有一骨髓液分离钮、一骨髓液萃取钮、一干细胞第一观察钮、一干细胞第二观察钮、一干细胞第一收集钮及一注销钮。当点击该注销钮时,该计算机11中的培养生成液制造系统10即会停止。
在点击该显示器16上的骨髓液分离钮之后,该负责人员自一注射器将该骨髓液18注入该玻璃试管19中,其中被注入该骨髓液18的玻璃试管19插设于该试管架20上。请参照图3所示,该负责人员使该试管架20容纳于该恒温水浴21中,且被注入该骨髓液18的玻璃试管19静置(将其静静放置不要移动)于该恒温水浴21一预定时间(约2小时),该恒温水浴21中的温度维持于约36~37℃,其为与体温大致相同的温度。该计算机11于该显示器16上显示印于该第一代码表17的二维条形码所指的该编号1(NO.1)及该捐赠者资料,该显示器16上也显示一骨髓液分离进行讯息及一骨髓液分离终止钮。
该玻璃试管19静置于该恒温水浴21一预定时间(约2小时),如图4所示,以使注入该试管20中的骨髓液18于该试管20中垂直分离为多层(一分离骨髓液步骤),一般而言,培养干细胞需要150~200mL的骨髓液;但是于该培养生成液的制造方法中,只需要收集自一捐赠者的少量(2~3mL)的骨髓液18,即可以制造获得一单一种类的干细胞,因此只需要自该捐赠者收集少量(2~3mL)的骨髓液18,且可以在收集该骨髓液18当时对该捐赠者的负担也可以降到最低。
用以将该骨髓液18分离为多层的分离骨髓液步骤后进行该萃取骨髓液步骤。于该萃取骨髓液步骤中,自分离为多层的骨髓液18中萃取一中间层骨髓液22,在确认该骨髓液18分离为多层之后,负责人员点击显示于该显示器16上的该骨髓液分离终止钮。当点击该骨髓液分离终止钮,该计算机11于该显示器16上显示一步骤第二显示屏幕(图未示),于该步骤第二显示屏幕中显示编号1(NO.1)及该捐赠者数据,以及一骨髓液分离终止讯息、一骨髓液萃取钮、一干细胞第一观察钮、一干细胞第二观察钮及一干细胞第一收集钮。
负责人员点击该步骤第二显示屏幕上的该骨髓液萃取钮,使该条形码读取器12读取该玻璃试管19上的二维条形码,当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的该捐赠者数据(自该内存读取的捐赠者数据)及该条形码读取器12所读取的显示于该二维条形码的该捐赠者资料,且当这些捐赠者资料相符,该显示器16上会显示编号1(NO.1)及该捐赠者数据,以及一骨髓液分离终止讯息、一骨髓液萃取进行讯息及一骨髓液萃取终止钮。当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
负责人员自该恒温水浴21中取出该试管架20,自该试管架20中移除该玻璃试管19,及自分离为多层的骨髓液18中萃取位于特定层的一中间层骨髓液22(一萃取骨髓液步骤)。负责人员使用一注入器(injector)(图未示)自分离为多层的骨髓液18的厚度为2~4mm的该中间层萃取(抽取)一中间层骨髓液22;或者,负责人员使用一移液器(pipette)(图未示)自分离为多层的骨髓液18的厚度为2~4mm的该中间层萃取(抽取)一中间层骨髓液22。
在使包含多种间充质干细胞的一骨髓液18垂直分离为多层后,该培养生成液的制造方法可以确实地使用一注入器或一移液器,以自该骨髓液18中萃取一特定的中间层骨髓液,及移除该骨髓液18中包含的不必要的间充质干细胞。
图5为一说明图,其显示一第一观察干细胞步骤的一实施例,图6为一第一平面培养容器的侧视图,图7为一局部放大图,其显示第一间充质干细胞26的平面形状的一实施例,图8为一局部放大图,其显示第一间充质干细胞26的平面形状的另一实施例,图7~8为由该电子显微镜13所拍摄的第一间充质干细胞26的平面形状的放大图像。
用以自该骨髓液18中萃取位于该中间层的该特定的中间层骨髓液22的萃取骨髓液步骤后进行该第一观察干细胞步骤。该第一观察干细胞步骤中,该中间层骨髓液22及该培养液23被注入(储存于)该第一平面培养容器24(第一培养容器)中,该培养容器24维持于与体温大致相同的温度下(约36~37℃)静置12~24小时(将其静静放置不要移动)。
在自该骨髓液18中萃取该特定的中间层骨髓液22后,医生、护士及研究人员等负责人员点击显示于该显示器16上的该骨髓液萃取终止钮。当点击该骨髓液萃取终止钮,该计算机11于该显示器16上显示一步骤第三显示屏幕(图未示),该步骤第三显示屏幕显示编号1(NO.1)及该捐赠者数据,以及一骨髓液分离终止讯息、一骨髓液萃取终止讯息、一干细胞第一观察钮、一干细胞第二观察钮及一干细胞第一收集钮。
负责人员将印制有二维条形码的第一代码表17贴附于该第一平面培养容器24的底部27(底墙的外表面),接着,负责人员点击该步骤第三显示屏幕上的该干细胞第一观察钮,及以该条形码读取器12读取该培养容器24的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的该捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一骨髓液分离终止讯息、一骨髓液萃取终止讯息、一干细胞第一观察进行讯息及一干细胞第一观察终止钮。当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
负责人员以该注入器或该移液器将抽取的中间层骨髓液22注入(储存)该培养容器24,及使用该注入器或该移液器将该培养液23注入该培养容器24。该第一平面培养容器24(第一培养容器)由透明玻璃或透明塑料所制得,且为其平面形状略呈方形、具有小容量,且底部27具有一预定面积的一平面容器。该第一平面培养容器24包含一顶部40、一底部38及位于该顶部40的一注入孔41,一盖体42以防水的方式封闭该注入孔41,该第一平面培养容器24可以为平面形状为圆形或椭圆形、具有一小容量,且一底部27具有一预定面积的一平面容器。用于第一观察干细胞步骤的第一平面培养容器24的容量约为20~30mL(较佳为25mL),且其底表面积约为25~36mm2,该培养容器24其一侧的长度为5~6mm。
该培养液23包含一矿物盐溶液及添加有青霉素(penicillin)(约100单位/mL)、两性霉素(amphotericin)(约100ng/mL)、链霉素(streptomycin)(约100mkg/mL)、L-麸酰胺酸(约2~4毫升)及20%胎牛血清的一胺基酸。包含于该中间层骨髓液22中的第一间充质干细胞26被注入该培养容器24中,并随时间流逝而固定于该培养容器24的底部27,以该培养液23进行培养,并渐渐于该培养容器24的底部27增生(分化)而形成细胞集落(colony)。
该培养液可以为DMEM培养液(Dulbecco’s Modified Eagle’s Medium)、GMEM培养液(Grasgow Minimum Essential Medium)、RPMI640培养液等,该培养液可以包含胰岛素(insulin)、运铁蛋白(transferrin)、乙醇胺(ethanolamine)、硒(selenium)、2-巯基乙醇(2-mercaptoethanol)、L-丙氨酰-L-谷氨酰胺(L-alanyl-L-glutamine)、丙酮酸钠(sodium pyruvate)、L-丙氨酸(L-alanine)、L-天冬酰胺(L-asparagine)、L-天冬氨酸(L-aspalathin acid)、甘氨酸(glycine)、脯氨酸(L-proline)及L-丝氨酸(L-serine)。
在将该中间层骨髓液22及该培养液23注入该第一平面培养容器24后,负责人员将该培养容器24设置于(置放于)该电子显微镜13的一样品架上。一间隔件39(spacer)位于该电子显微镜13的样品架36的上表面37及该第一平面培养容器24的底部38之间,使该培养容器24的底部38由该间隔件39所撑起,使该培养容器24的底部38及该培养容器24的顶部40(注入孔41)分别位于较高及较低的位置,并使该培养容器24维持一预定角度。又,一间隔件39也可以位于该电子显微镜13的样品架36的上表面37及该第一平面培养容器24的顶部40之间,使该培养容器24的顶部40由该间隔件39所撑起,使该培养容器24的顶部40及该培养容器24的底部38分别位于较高及较低的位置,并使该培养容器24维持一预定角度。该第一平面培养容器24相对于该样品架36的上表面37的倾斜角α1介于2~5°的范围内,较佳介于2~3°的范围内。
该培养生成液的制造方法中,通过使该第一平面培养容器24相对于该样品架36的上表面37具有该倾斜角,因此使该培养容器24中的中间骨髓液22及培养液23朝向该培养容器24的顶部40的一侧(或该底部38的一侧)呈倾斜状态,使该中间骨髓液22及该培养液23的水压于该培养容器24的顶部49的一侧(或该底部38的一侧)上升,使该第一间充质干细胞26集中于该培养容器24的底部38的一侧,进而增加该第一间充质干细胞26的活性,使该第一间充质干细胞26可以容易地、快速地固定于该培养容器24的底部27。
该电子显微镜13通过一接口(有线或无线)连接该计算机11,该电子显微镜13包含一影像拍摄功能(imaging function),以一影像传感器(image sensor)拍摄一被摄物(subject)的一放大图像,该电子显微镜13包含一影像传输功能(image transmitting function),用以将该放大图像发送至该计算机11。该电子显微镜13以每隔约1~2小时的间隔拍摄注入至该培养容器24的中间层骨髓液22所包含的第一间充质干细胞26的平面形状的放大图像,并将所拍摄的干细胞26的平面形状的放大图像以每隔约1~2小时的间隔传输至该计算机11,该电子显微镜13的拍摄图像的时间间隔与图像传输的时间间隔能够以例如该键盘14及该鼠标15等输入设备,于1~2小时的范围内自行设置。
该计算机11将传输自该电子显微镜13的第一间充质干细胞26的平面形状的放大图像及一拍摄时间,以与捐赠者识别符相关的状态储存于该储存区域中(第一储存干细胞图像步骤)。该计算机11于该显示器16上显示传输自该电子显微镜13的干细胞28的平面形状的放大图像及该拍摄时间,于12~24小时内,负责人员以每隔约1~2小时的间隔确认(查看)显示于该显示器16上的干细胞26的平面形状的放大图像,观察包含于该中间层骨髓液22的干细胞26的平面形状的变化(第一观察干细胞步骤)。于12~24小时内,负责人员也能够以每隔约1~2小时的间隔,直接自该电子显微镜13的观察窗观察该第一间充质干细胞26的平面形状的变化。
该培养生成液的制造方法中,通过培养该中间层骨髓液所含有的第一间充质干细胞26,将该第一间充质干细胞26固定于该第一平面培养容器24(第一培养容器)的底部27(第一固定干细胞步骤),该第一间充质干细胞26的起始平面形状为略呈圆形,且当该干细胞26的平面形状为略呈圆形,该干细胞26尚未固定于该培养容器24的底部27(底墙的内表面),此时该干细胞26尚不会开始增生(分化)。变形的第一间充质干细胞26的平面形状在固定前为主要略呈圆形,且当该干细胞26朝单一方向(预定方向)以无定形的形状延伸(扩张)则为一扁形,因此使该干细胞26可以固定于该培养容器24的底部27(底墙的内表面),并使该干细胞26得以开始增生(分化)。
依据该第一观察干细胞步骤的观察结果(如图6所示),当显示于该显示器16上的第一间充质干细胞26的平面形状的局部放大图仍为略呈圆形时,负责人员确认该干细胞26尚未固定于该培养容器24的底部27(底墙的内表面),并以每隔约1~2小时的间隔持续观察该干细胞26的平面形状的变化。依据该第一观察干细胞步骤的观察结果(如图7所示),当显示于该显示器16上的该第一间充质干细胞26的平面形状自略呈圆形变形为主要略呈圆形及不规则扁形时,负责人员确认该干细胞26已固定于该培养容器24的底部27。
使用容量超过30mL、底面积超过36mm2的大型培养容器以固定该第一间充质干细胞26,将不容易使该干细胞26固定于该容器的底表面,且该干细胞26的增生也会趋缓,但是该培养生成液的制造方法中,通过使用上述容量及上述底表面积的第一平面培养容器24,可以容易地使该干细胞26固定于该培养容器24的底部27,并使该干细胞26可以于该培养容器24中快速地增生。
该培养生成液的制造方法使该培养容器24于与体温大致相同的温度下静置12~24小时,并于12~24小时中,以每隔约1~2小时的间隔观察该培养容器24中的第一间充质干细胞26自该起始平面形状的变形状态,因此绝对不会没有注意到该干细胞26的变形,可以精确地确认该干细胞26固定于该培养容器24的底部27。
图9为一局部放大图,其显示第一间充质干细胞26的平面形状的另一实施例。图9为由一电子显微镜13所拍摄的第一间充质干细胞26的平面形状的放大图像。依据该第一观察干细胞步骤的观察结果,该第一间充质干细胞26(第一干细胞)自略呈圆形(起始平面形状)变形为主要略呈圆形及不规则扁形,且用以确认该干细胞26固定于该第一平面培养容器24(第一培养容器)的底部27的第一固定干细胞步骤后进行该第一培养干细胞步骤及该第二观察干细胞步骤。
于该第一培养干细胞步骤及该第二观察干细胞步骤中,自该培养容器24中丢弃(抛弃)注入该培养容器24的培养液23,并将一新的培养液23注入(储存于)该培养容器24。接着,该培养容器24于与体温大致相同的温度下(约36~37℃)静置36~48小时(将其静静放置不要移动),并培养该干细胞26直到该第一间充质干细胞26的总表面积达该培养容器24的底表面积的一第一目标比(第一培养干细胞步骤)。
通过于该培养容器24静置36~48小时的时间中,以每隔约1~2小时的间隔利用该电子显微镜13观察固定于该培养容器24的底部27的第一间充质干细胞26的总表面积相对于该培养容器24的底表面积之间的关系,并确认该干细胞26的总表面积是否达该培养容器24的底表面积的第一目标比,该第一间充质干细胞26的总表面积相对于该培养容器24的底表面积的第一目标比为70~80%﹝融合度为70~80%(70~80%confluent)﹞。
于确认包含有该第一间充质干细胞26的中间层骨髓液22固定于该培养容器24的底部27后,医生、护士及研究人员等负责人员点击显示于该显示器16上的干细胞第一观察终止钮,当点击该干细胞第一观察终止钮,该计算机11于该显示器16上显示一步骤第四显示屏幕(图未示),该步骤第四显示屏幕上显示编号1(NO.1)及该捐赠者数据,以及一骨髓液分离终止讯息、一骨髓液萃取终止讯息、一干细胞第一观察终止讯息、一干细胞第二观察钮及一干细胞第一收集钮。
负责人员点击该步骤第四显示屏幕上的干细胞第二观察钮,自该电子显微镜16上的样品架上移除该培养容器24,并以该条形码读取器12读取该培养容器24的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示编号1(NO.1)及该捐赠者数据,以及一骨髓液分离终止讯息、一骨髓液萃取终止讯息、一干细胞第一观察终止讯息、一干细胞第二观察进行讯息及一干细胞第二观察终止钮,当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
于该第一观察干细胞步骤中,负责人员自该培养容器24中丢弃(抛弃)注入该培养容器24的培养液23,并将一新的培养液23注入(储存于)该培养容器24。该新的培养液23与该第一观察干细胞步骤中所注入者相同。负责人员将一新的培养液23注入该培养容器24,续将该培养容器24设置于(置放于)该电子显微镜13的样品架上。
一间隔件39位于该电子显微镜13的样品架36的上表面37及该第一平面培养容器24的底部38之间,使该培养容器24的底部38由该间隔件39所撑起,使该培养容器24的底部38及该培养容器24的顶部40(注入孔41)分别位于较高及较低的位置,并使该分别位于较高及较低的位置培养容器24维持一预定角度(请参照图6所示)。又,一间隔件39也可以位于该电子显微镜13的样品架36的上表面37及该第一平面培养容器24的顶部40之间,使该培养容器24的顶部40由该间隔件39所撑起,使该培养容器24的顶部40及该培养容器24的底部38分别位于较高及较低的位置,and使该培养容器24维持一预定角度。该第一平面培养容器24相对于该样品架36的上表面37的倾斜角α1介于2~5°的范围内,较佳介于2~3°的范围内。
该培养生成液的制造方法中,通过确认该第一间充质干细胞26的固定,续丢弃该培养容器24中的培养液23,并将一新的培养液23注入该培养容器24,因此可以确实地促进该干细胞26的增生。该培养生成液的制造方法中,通过使该第一平面培养容器24相对于该样品架36的上表面37具有该倾斜角,因此使该培养容器24中的第一间充质干细胞26及培养液23朝向该培养容器24的顶部40的一侧(或该底部38的一侧)呈倾斜状态,使该第一间充质干细胞26及该培养液23的水压于该培养容器24的顶部40的一侧(或该底部38的一侧)上升,使该第一间充质干细胞26集中于该培养容器24的底部38的一侧,进而增加第一间充质干细胞26的活性,使该第一间充质干细胞26可以容易地、立即地于该培养容器24的底部27增生(分化)。
该电子显微镜13以每隔约1~2小时的间隔拍摄该培养容器24中的第一间充质干细胞26的平面形状的放大图像,并将所拍摄的干细胞26的平面形状的放大图像以每隔约1~2小时的间隔传输至该计算机11,该计算机11将传输自该电子显微镜13的干细胞26的平面形状的放大图像及一拍摄时间,以与该捐赠者识别符相关的状态储存于该储存区域(第二储存干细胞图像步骤)。该计算机11于该显示器16上显示传输自该电子显微镜13的干细胞26的平面形状的放大图像及该拍摄时间。
于36~48小时内,负责人员以每隔约1~2小时的间隔确认(查看)显示于该显示器16上的该第一间充质干细胞26的平面形状的放大图像,观察固定于该培养容器24的底部27的干细胞26的总表面积与该培养容器24的底表面积之间的关系,并确认该干细胞26的总表面积是否达该培养容器24的底表面积的第一目标比(融合度为70~80%)(第二观察干细胞步骤)。于36~48小时内,负责人员也能够以每隔约1~2小时的间隔,直接自该电子显微镜13的观察窗观察该第一间充质干细胞26的总表面积相对于该培养容器24的底表面积之间的关系,并确认该干细胞26的总表面积是否达该培养容器24的底表面积的第一目标比(融合度为70~80%)。
依据该第二观察干细胞步骤的观察结果(如图7所示),当显示于该显示器16上的第一间充质干细胞26的总表面积尚未达该培养容器24的底表面积的第一目标比(融合度为70~80%)时,负责人员以每隔约1~2小时的间隔持续观察该干细胞26的总表面积与该培养容器24的底表面积之间的关系,当显示于该显示器16上的所有区域的放大图像的第一间充质干细胞26的总表面积达该第一目标比时,确认该干细胞26的总表面积达该培养容器24的底表面积的第一目标比。
依据该第二观察干细胞步骤的观察结果,该第一间充质干细胞26于该培养容器24的底部27(底墙的内表面)增生以形成细胞集落,并延伸其平面形状,且当显示于该显示器16上的干细胞26的总表面积达该培养容器24的底表面积的第一目标比(融合度为70~80%)时(如图8所示),进行用以自该培养容器24收集该干细胞26的一第一收集干细胞步骤。依据该第一间充质干细胞26的总表面积达该第一目标比,以该第一收集干细胞步骤自该培养容器24收集于该培养容器24中增生(分化)的第一间充质干细胞26。
确认该第一间充质干细胞26的总表面积达该培养容器24的底表面积的第一目标比后,医生、护士及研究人员等负责人员点击显示于该显示器16上的干细胞第二观察终止钮。当点击该干细胞第二观察终止钮,该计算机11于该显示器16上显示一步骤第五显示屏幕(图未示),该步骤第五显示屏幕显示该编号1(NO.1)及该捐赠者数据,以及一骨髓液分离终止讯息、一骨髓液萃取终止讯息、一干细胞第一观察终止讯息、一干细胞第二观察终止讯息及一干细胞第一收集钮。
负责人员点击该步骤第五显示屏幕上的干细胞第一收集钮,并以该条形码读取器12读取该培养容器24的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一骨髓液分离终止讯息、一骨髓液萃取终止讯息、一干细胞第一观察终止讯息、一干细胞第二观察终止讯息、一干细胞第一收集进行讯息及一干细胞第一收集终止钮,当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
于该第二观察干细胞步骤中,负责人员使用一注入器或一移液器自该培养容器24中丢弃(抛弃)注入该培养容器24的培养液23,以磷酸盐缓冲生理盐水(PBS)清洗该培养容器24后,以该注入器或该移液器抽取一胰蛋白酶溶液(trypsin solution)并注入该培养容器24。当将该胰蛋白酶溶液注入该培养容器24,固定于该培养容器24的底部27的第一间充质干细胞26会由于该胰蛋白酶溶液而自该底部27剥离,并漂浮于该胰蛋白酶溶液的表面。负责人员使用一移液器收集(抽取)干细胞26,并将该干细胞26储存于该移液器(第一收集干细胞步骤)。
该培养生成液的制造方法通过以每隔约1~2小时的间隔观察该总表面积,以精确地确认该第一间充质干细胞26的总表面积相对于该培养容器24的底表面积之间的关系,因此可以确实地确认该干细胞26的总表面积达该培养容器24的底表面积的第一目标比。
图10为一说明图,其显示一分离干细胞步骤的一实施例。用以自该培养容器24收集该第一间充质干细胞26的第一收集干细胞步骤后进行一分离干细胞步骤。该分离干细胞步骤以该离心机28将收集的第一间充质干细胞26离心分离为多层,于自该培养容器24将该第一间充质干细胞26抽取于一移液器后,医生、护士及研究人员等负责人员点击显示于该显示器16上的干细胞第一收集终止钮。
当点击该干细胞第一收集终止钮,该计算机11于该显示器16显示一步骤第六显示屏幕(图未示)。该步骤第六显示屏幕显示该编号1(NO.1)及该捐赠者数据,以及一干细胞分离钮、一干细胞第二萃取钮、一干细胞第三观察钮、一干细胞第四观察钮及一第一萃取钮。负责人员将印制有二维条形码的第一代码表17贴附于用以注入该第一间充质干细胞26的玻璃试管29的外环面。
接着,负责人员点击该步骤第六显示屏幕上的干细胞分离钮,以该条形码读取器12读取该玻璃试管29的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞分离进行讯息及一干细胞分离终止钮,当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
负责人员以一移液器将该第一间充质干细胞26注入(储存于)该玻璃试管29,并将该玻璃试管29设置于(置放于)该离心机28中。以该离心机28离心分离该干细胞26一预定时间后,负责人员自该离心机28中取出该玻璃试管29,该玻璃试管29中的第一间充质干细胞26通过该离心机28垂直分离为多层(分离干细胞步骤)。
图11为一说明图,其显示一第二萃取干细胞步骤的一实施例。用以将该第一间充质干细胞26分离为多层的分离干细胞步骤后进行一第二收集干细胞步骤,该第二收集干细胞步骤自分离为多层的第一间充质干细胞26中收集位于较低层(最底层)的第二间充质干细胞30。于以该离心机28将该第一间充质干细胞26垂直分离为多层后,医生、护士及研究人员等负责人员自该离心机26移除该玻璃试管29,并点击显示于该显示器16上的干细胞分离终止钮。
当点击该干细胞分离终止钮,该计算机11于该显示器16上显示一步骤第七显示屏幕(图未示),该步骤第七显示屏幕显示该编号1(NO.1)及该捐赠者数据,以及一干细胞分离终止讯息、一干细胞第二收集钮、一干细胞第三观察钮、一干细胞第四观察钮及一培养生成液第一萃取钮。
负责人员点击该步骤第七显示屏幕上的干细胞第二收集钮,以该条形码读取器12读取该玻璃试管29的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞分离终止讯息、一干细胞第二收集进行讯息及一干细胞第二收集终止钮,当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
负责人员收集于该玻璃试管29中分离为多层的第一间充质干细胞26中位于较低层(最底层)的第二间充质干细胞30(第二收集干细胞步骤)。负责人员使用一注入器自分离为多层的第一间充质干细胞26收集(抽取)位于较低层(最底层)的第二间充质干细胞30,或者,负责人员使用该移液器自分离为多层的第一间充质干细胞26收集(抽取)位于较低层(最底层)的第二间充质干细胞30。
该培养生成液的制造方法中,通过以该离心机28离心分离包含有不必要的干细胞的第一间充质干细胞26以将其垂直分离为多层,并收集离心分离为多层的干细胞26中位于较低层(最底层)的第二间充质干细胞30因此可以自该干细胞26中确实地收集一特定的第二间充质干细胞30,且自该干细胞26中移除不必要的间充质干细胞。
当该第一间充质干细胞26增生至其总表面积相对于该第一平面培养容器24(第一培养容器)的底表面积超过80%时,该干细胞26的活性会渐渐消失。该培养生成液的制造方法中,当该干细胞26增生至其总表面积相对于该培养容器24的底表面积为70~80%时,即收集该干细胞26,因此可以维持该干细胞26的活性,且该干细胞26可以在保持其活性的状况下增生,进而能够自该干细胞26收集具有活性的第二间充质干细胞30。
图12为一说明图,其显示一第三观察干细胞步骤的一实施例,图13为一第二平面培养容器的侧视图,图14为一局部放大图,其显示第二间充质干细胞30的平面形状的一实施例,
图15为一局部放大图,其显示第二间充质干细胞30的平面形状的另一实施例,图14~15为由一电子显微镜13所拍摄的第二间充质干细胞30的平面形状的放大图像。
用以自该第一间充质干细胞26中萃取位于较低层(最底层)的特定的第二间充质干细胞30的第二收集干细胞步骤后进行一第三观察干细胞步骤及一第二固定干细胞步骤。于该第三观察干细胞步骤及该第二固定干细胞步骤中,将该第二间充质干细胞30及该培养液23注入(储存于)该第二平面培养容器25(第二培养容器),该培养容器25于与体温大致相同的温度下(约36~37℃)静置36~48小时(将其静静放置不要移动)。
通过于36~48小时中,利用该电子显微镜13,以每隔约1~2小时的间隔观察该培养容器25中的第二间充质干细胞30(第二干细胞)自该起始平面形状的变形状态,可以确认该干细胞30是否固定于该培养容器25的底部27。印制有用以确认捐赠者的二维条形码的第一代码表17贴附于注入有该第二间充质干细胞30及该培养液23的培养容器25的底部27(底墙的外表面)。
在自该第一间充质干细胞26中萃取特定的第二间充质干细胞30后,医生、护士及研究人员等负责人员点击显示于该显示器16上的该干细胞第二收集萃取终止钮。当点击该干细胞第二收集终止钮,该计算机11于该显示器16上显示一步骤第八显示屏幕(图未示),该步骤第八显示屏幕显示编号1(NO.1)及该捐赠者数据,以及一干细胞分离终止讯息、一干细胞第二收集终止讯息、一干细胞第三观察钮、一干细胞第四观察钮及一培养生成液第一萃取钮。
负责人员将印制有二维条形码的第一代码表17贴附于该第二平面培养容器25的底部27(底墙的外表面),接着,负责人员点击该步骤第八显示屏幕上的干细胞第三观察钮,及以该条形码读取器12读取该培养容器25的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞分离终止讯息、一干细胞第二收集终止讯息、一干细胞第三观察进行讯息及一干细胞第三观察终止钮。当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
负责人员以该注入器或该移液器将抽取的第二间充质干细胞30注入(储存于)该培养容器25,及将该培养液23注入(储存于)该培养容器25。该第二平面培养容器(第二培养容器)25由透明玻璃或透明塑料所制得,且为其平面形状略呈方形、具有一预定容量,且底部27具有一预定面积的一平面容器,该底部27的面积大约为该第一平面培养容器24(第一培养容器)的两倍。该第二平面培养容器25包含一顶部43、一底部44及位于该顶部43的一注入孔45,一盖体46以防水的形式封闭该注入孔45,该第二平面培养容器25可以为平面形状为圆形或椭圆形、具有一预定容量,且底部27具有一预定面积的一平面容器。
用于该第三观察干细胞步骤的第二平面培养容器(第二培养容器)25的容量约为40~60mL(较佳为50mL),且其底面积约为50~72mm2,该培养容器25其一侧的长度约为7~8.5mm。该培养液23与该第一观察干细胞步骤中所注入者相同。注入该培养容器25的第二间充质干细胞30随时间流逝而固定于该培养容器25的底部27以该培养液23进行培养,并渐渐于该培养容器25的底部27增生(分化)而形成细胞集落。
在将该第二间充质干细胞30及该培养液23注入该第二平面培养容器25后,负责人员将该培养容器25设置于(置放于)该电子显微镜13的一样品架36上。一间隔件39位于该电子显微镜13的样品架36的上表面37及该第二平面培养容器25的底部44之间,使该培养容器25的底部44由该间隔件39所撑起,使该培养容器25的底部44及该培养容器25的顶部43(注入孔45)分别位于较高及较低的位置,并使该培养容器25维持一预定角度。又,间隔件39也可以位于该电子显微镜13的样品架36的上表面37及该第二平面培养容器25的顶部43之间,使该培养容器25的顶部43由该间隔件39所撑起,使该培养容器25的顶部43及该培养容器25的底部44分别位于较高及较低的位置,并使该培养容器25维持一预定角度。该第二平面培养容器25相对于该样品架36的上表面37的倾斜角α2介于2~5°的范围内,较佳介于2~3°的范围内。
该培养生成液的制造方法中,通过使该第二平面培养容器25相对于该样品架36的上表面37具有该倾斜角,因此使该培养容器25中的第二间充质干细胞30及培养液23朝向该培养容器25的顶部43的一侧(或该底部44的一侧)呈倾斜状态,使该第二间充质干细胞30及该培养液23的水压于该培养容器25的顶部43的一侧(或该底部44的一侧)上升,使该第二间充质干细胞30集中于该培养容器25的底部44的一侧,进而增加该第二间充质干细胞30的活性,使该第二间充质干细胞30可以容易地、快速地固定于该培养容器25的底部27。
该电子显微镜13以每隔约1~2小时的间隔拍摄注入至该培养容器25的第二间充质干细胞30的平面形状的第二间充质干细胞30的平面形状的放大图像,并将所拍摄的干细胞30的平面形状的放大图像以每隔约1~2小时的间隔传输至该计算机11。该计算机11将传输自该电子显微镜13的第二间充质干细胞30的平面形状的放大图像及一拍摄时间,以与捐赠者识别符相关的状态储存于储存区域(第三储存干细胞图像步骤)。该计算机11于该显示器16上显示传输自该电子显微镜13干细胞30的平面形状的放大图像及该拍摄时间,于36~48小时内,负责人员以每隔约1~2小时的间隔确认(查看)显示于该显示器16上的干细胞30的平面形状的放大图像,观察该干细胞30的平面形状的变化(第三观察干细胞步骤)。于36~48小时内,负责人员也能够以每隔约1~2小时,直接自该电子显微镜13的观察窗观察该干细胞30的平面形状的变化。
该第二间充质干细胞30的起始平面形状为略呈圆形,且当该干细胞30的平面形状为略呈圆形,该干细胞30尚未固定于该培养容器25的底部27(底墙的内表面),此时该干细胞30尚不会开始增生(分化)。变形的第二间充质干细胞30的平面形状在固定前为主要略呈圆形,且当该干细胞30朝单一方向以无定形的形状延伸则为一扁形,该干细胞30可以固定于该培养容器25的底部27(底墙的内表面),并使该干细胞30得以开始增生(分化)。
依据该第三观察干细胞步骤的观察结果,当显示于该显示器16上的第二间充质干细胞30的平面形状仍为略呈圆形(如图12所示)时,负责人员确认该干细胞30尚未固定于该培养容器25的底部27(底墙的内表面),并以每隔约1~2小时的间隔持续观察该干细胞30的平面形状的变化。依据该第三观察干细胞步骤的观察结果,当显示于该显示器16上的第二间充质干细胞30的平面形状自略呈圆形变形为主要略呈圆形及不规则扁形(如图13所示)时,负责人员确认该干细胞30固定于该培养容器25的底部27(第二固定干细胞步骤)。
使用容量超过60mL、底面积超过72mm2的大型培养容器以固定该第二间充质干细胞30,将不容易使该干细胞30固定于该容器的底表面,且该干细胞30的增生也会趋缓,但是该培养生成液的制造方法中,通过使用上述容量及上述底表面积的第二平面培养容器25,可以容易地使该干细胞30固定于该培养容器25的底部27,并使该干细胞30可以于该培养容器25中快速地增生。
该培养生成液的制造方法使该培养容器25于与体温大致相同的温度下静置36~48小时,并于36~48小时中,以每隔约1~2小时的间隔观察该培养容器25中的第二间充质干细胞30自该起始平面形状的变形状态,因此绝对不会没有注意到该干细胞30的变形,可以精确地确认该干细胞30固定于该培养容器25的底部27。
图16为一局部放大图,其显示第二间充质干细胞30的平面形状的另一实施例,图17为一说明图,其显示被萃取的培养生成液31及被储存的第二间充质干细胞30的一实施例,图16为由一电子显微镜13所拍摄的第二间充质干细胞30的平面形状的放大图像。依据该第三观察干细胞步骤的观察结果,第二间充质干细胞30(第二干细胞)自略呈圆形(起始平面形状)变形为主要略呈圆形及不规则扁形,且用以确认该干细胞30固定于该第二平面培养容器25(第二培养容器)的底部27的第三观察干细胞步骤后进行该第二培养干细胞步骤及该第四观察干细胞步骤。
于该第二培养干细胞步骤及该第四观察干细胞步骤中,自该培养容器25中丢弃(抛弃)注入该培养容器25中的培养液23,及将一新的培养液23注入(储存于)该培养容器25。该培养容器25于与体温大致相同的温度下(约36~37℃)静置36~48小时(将其静静放置不要移动),并于该培养容器25中培养该第二间充质干细胞30(第二培养干细胞步骤)。通过于该培养容器25静置36~48小时的时间中,以每隔约1~2小时的间隔利用该电子显微镜13观察固定于该培养容器25的底部27的第二间充质干细胞30的总表面积相对于该培养容器25的底表面积的间的关,并确认该干细胞30的总表面积达该培养容器25的底表面积的第二目标比,该第二间充质干细胞30的总表面积相对于该培养容器25的底表面积的第二目标比为88~92%(融合度为88~92%)。
于确认该第二间充质干细胞30固定于该培养容器25的底部27后,医生、护士及研究人员等负责人员点击显示于该显示器16上的干细胞第三观察终止钮,当点击该干细胞第三观察终止钮,该计算机11于该显示器16上显示一步骤第八显示屏幕(图未示),该步骤第八显示屏幕上显示编号1(NO.1)及该捐赠者数据,以及一干细胞分离终止讯息、一干细胞第二收集终止讯息、一干细胞第三观察终止讯息、一干细胞第四观察钮及一培养生成液第一萃取钮。
负责人员点击该步骤第八显示屏幕上的干细胞第四观察钮,自该电子显微镜13的样品架上移除该培养容器25,并以该条形码读取器12读取该培养容器25的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞分离终止讯息、一干细胞第二收集终止讯息、一干细胞第三观察终止讯息、一干细胞第四观察进行讯息及一干细胞第四观察终止钮。当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
于该第二培养干细胞步骤及该第四观察干细胞步骤中,负责人员自该培养容器25中丢弃(抛弃)注入该培养容器25的培养液23,及将一新的培养液23注入(储存于)该培养容器25。该新的培养液23与该第一观察干细胞步骤中所注入者相同。负责人员将一新的培养液23注入该培养容器25,续将该培养容器25设置于(置放于)该电子显微镜13的样品架上。一间隔件39位于该电子显微镜13的样品架36的上表面37及该第二平面培养容器25的底部44之间,使该培养容器25的底部44由该间隔件39所撑起,使该培养容器25的底部44及该培养容器25的顶部43(注入孔45)分别位于较高及较低的位置,并使该培养容器25维持一预定角度。又,一间隔件39也可以位于该电子显微镜13的样品架36的上表面37及该第二平面培养容器25的顶部43之间,使该培养容器25的顶部43由该间隔件39所撑起,使该培养容器25的顶部43及该培养容器25的底部44分别位于较高及较低的位置,并使该培养容器25维持一预定角度。该第二平面培养容器25相对于该样品架36的上表面37的倾斜角α2介于2~5°的范围内,较佳介于2~3°的范围内。
该培养生成液的制造方法中,通过确认该第二间充质干细胞30的固定,续丢弃该培养容器25中的培养液23,并将一新的培养液23注入该培养容器25,因此可以确实地促进该第二间充质干细胞30的增生。该培养生成液的制造方法通过使该第二平面培养容器25相对于该样品架36的上表面37具有该倾斜角,因此使该培养容器25中的第二间充质干细胞30及培养液23朝向该培养容器25的顶部43的一侧(或该底部44的一侧)呈倾斜状态,使该第二间充质干细胞30及该培养液23的水压于该培养容器25的顶部43的一侧(或该底部44的一侧)上升,使该第二间充质干细胞30集中于该培养容器25的底部44的一侧,进而增加该第二间充质干细胞30的活性,使该第二间充质干细胞30可以容易地、快速地于该培养容器25的底部27增生(分化)。
该电子显微镜13以每隔约1~2小时的间隔拍摄该培养容器25中的第二间充质干细胞30的平面形状的放大图像,并将所拍摄的干细胞30的平面形状的放大图像以每隔约1~2小时的间隔传输至该计算机11,该计算机11将传输自该电子显微镜13的第二间充质干细胞30的平面形状的放大图像及一拍摄时间,以与该捐赠者识别符相关的状态储存于该储存区域(第四储存干细胞图像步骤)。该计算机11于该显示器16上显示传输自该电子显微镜13的第二间充质干细胞30的平面形状的放大图像及该拍摄时间。
于36~48小时内,负责人员以每隔约1~2小时的间隔确认(查看)显示于该显示器16上的第二间充质干细胞30的平面形状的放大图像,观察固定于该培养容器25的底部27的干细胞30的总表面积与该培养容器25的底表面积之间的关系,并确认该干细胞30的总表面积是否达该培养容器25的底表面积的第二目标比(融合度为88~92%)(第四观察干细胞步骤)。于36~48小时内,负责人员也能够以每隔约1~2小时的间隔,直接自该电子显微镜13的观察窗观察该第二间充质干细胞30的总表面积相对于该培养容器25的底表面积之间的关系,并确认该干细胞30的总表面积是否达该培养容器25的底表面积的第二目标比(融合度为88~92%)。
依据该第四观察干细胞步骤的观察结果(如图13所示),当显示于该显示器16上的第二间充质干细胞30的总表面积尚未达该培养容器25的底表面积的第二目标比(融合度为88~92%)时,负责人员以每隔约1~2小时的间隔持续观察该干细胞30的总表面积与该培养容器25的底表面积之间的关系,当显示于该显示器16上的所有区域的放大图像的第二间充质干细胞30的总表面积达该第二目标比时,确认该干细胞30的总表面积达该培养容器25的底表面积的第二目标比。
依据该第四观察干细胞步骤的观察结果,该第二间充质干细胞30于该第二平面培养容器25(第二培养容器)的底部27(底墙的内表面)增生以形成细胞集落,并延伸其平面形状,当显示于该显示器16上的干细胞30的总表面积达该培养容器25的底表面积的第二目标比(融合度为88~92%)时(如图14所示),于该培养容器25增生一单一种类的第二间充质干细胞30增生,且制造获得包含分泌自一单一种类的干细胞的一预定代谢产物30的一培养生成液31。
当该第二间充质干细胞30增生至其总表面积相对于该第二平面培养容器25(第二培养容器)的底表面积超过92%时,该干细胞30的活性会渐渐消失。该培养生成液的制造方法中,当该干细胞30增生至其总表面积相对于该培养容器25的底表面积为88~92%时,即自该培养容器25萃取该干细胞30,因此可以维持该干细胞30的活性,进而能够增生该干细胞30。
当该干细胞30的总表面积达该培养容器25的底表面积的第二目标比,进行用以自该培养容器25萃取一培养生成液31的一第一萃取培养生成液步骤。于该第一萃取培养生成液步骤中,自该培养容器25萃取包含分泌自具有活性的第二间充质干细胞30的一预定代谢产物的培养生成液31。该培养生成液的制造方法中,通过以每隔约1~2小时的间隔观察该总表面积,以精确地确认该第二间充质干细胞30的总表面积相对于该培养容器25的底表面积的关系,因此可以确实地确认该干细胞30的总表面积达该培养容器25的底表面积的第二目标比。
确认该第二间充质干细胞30的总表面积达该培养容器25的底表面积的第二目标比后,医生、护士及研究人员等负责人员点击显示于该显示器16上的干细胞第四观察终止钮,当点击该干细胞第四观察终止钮,该计算机11于该显示器16上显示一步骤第九显示屏幕(图未示),该步骤第九显示屏幕显示该编号1(NO.1)及该捐赠者数据,以及一干细胞分离终止讯息、一干细胞第二收集终止讯息、一干细胞第三观察终止讯息、一干细胞第四观察终止讯息及一培养生成液第一萃取钮。
负责人员点击该步骤第九显示屏幕上的培养生成液第一萃取钮,以该条形码读取器12读取该培养容器25的二维条形码,当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的捐赠者数据显示于该显示器16上的(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞分离终止讯息、一干细胞第二收集终止讯息、一干细胞第三观察终止讯息、一干细胞第四观察终止讯息及一培养生成液第一萃取终止钮。当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
于该第四观察干细胞步骤中,负责人员使用一注入器或一移液器自该培养容器25抽取由注入该培养容器25的培养液23所转变的培养生成液31(第一萃取培养生成液步骤),将该培养生成液31注入(储存于)该保存容器32,注入该保存容器32的培养生成液31为包含分泌自单一及特定种类的间充质干细胞(一单一种类的干细胞)的一预定代谢产物,且该单一及特定种类的间充质干细胞已移除不必要的间充质干细胞而具有活性。
负责人员将该培养生成液31注入该保存容器32,续将印制有二维条形码的第一代码表17贴附于该保存容器32的外周面,负责人员点击显示于该显示器16上的第九显示屏幕的培养生成液第一萃取终止钮,并以该条形码读取器12读取该保存容器32的二维条形码,续将注入有该培养生成液31的保存容器32储存于该冰箱34,该培养生成液31储存于约为3~4℃的冰箱34。
当二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞分离终止讯息、一干细胞第二收集终止讯息、一干细胞第三观察终止讯息、一干细胞第四观察终止讯息、一培养生成液萃取终止讯息、一培养生成液制造终止钮及一培养生成液制造继续钮。当一培养生成液的制造终止,点击该培养生成液制造终止钮,点击该培养生成液制造终止钮以停止该计算机11上的培养生成液制造系统10。
当点击该培养生成液制造终止钮,进行用以自该培养容器25收集一干细胞30的一收集干细胞步骤。于该收集干细胞步骤中,自该培养容器25中收集于该培养容器25中增生(分化)的第二间充质干细胞30。以该磷酸盐缓冲生理盐水清洗该培养容器25后,将一胰蛋白酶溶液注入该培养容器25,当将该胰蛋白酶溶液注入该培养容器25,固定于该培养容器25的底部27的第二间充质干细胞30将会由于该胰蛋白酶溶液而自该底部27剥离,并漂浮于该胰蛋白酶溶液的表面。负责人员以一注入器或一移液器抽取该第二间充质干细胞30,并自该注入器或该移液器将该干细胞30注入(储存于)该保存容器33。
注入该保存容器33的第二间充质干细胞30为一单一及特定种类的间充质干细胞(一单一种类的干细胞),其已移除不必要的间充质干细胞而具有活性。负责人员将该第二间充质干细胞30(一单一种类的间充质干细胞)注入该保存容器33,续将印制有二维条形码的第一代码表17贴附于该保存容器33的外周面,及将注入有该第二间充质干细胞30的表存容器33储存于该冰箱34,该第二间充质干细胞30(一单一种类的间充质干细胞)储存于约为3~4℃的冰箱34。
该培养生成液的制造方法中通过萃取分离为多层的骨髓液中位于中间层的一中间层骨髓液、以该培养液23共同培养该中间层骨髓液、将一第一间充质干细胞26(第一干细胞)固定于该第一培养容器24的底部27、于培养该干细胞26时,当该干细胞26的总表面积达该第一培养容器24的底表面积的第一目标比,自该培养容器24收集该干细胞26、收集分离为多层的干细胞26中位于较低层(最底层)的一第二间充质干细胞30(第二干细胞、将该干细胞30固定于该第二培养容器25的底部27、将一新的培养液23注入该培养容器25、以该培养液23共培养该干细胞30,及于培养该干细胞30时,当该干细胞30的总表面积达该培养容器25的底表面积的一第二目标比,自该培养容器25萃取包含有分泌自增生的一单一种类的干细胞的一预定代谢产物30的一培养生成液31,因而能够使用培养的具有活性的单一种类的第二干细胞30,不会包含分泌自多种类的干细胞的多种类的代谢产物,而只有分泌自一具有活性的单一种类的干细胞30的一预定代谢产物,进而能够制造获得对预定疾病及预定美容用途(例如,肌肤保养、头发保养及身体保养)可以具有特定效果的一培养生成液31、对于治疗预定疾病具有良好效果的一培养生成液31,及对于预定美容用途具有良好效果的一培养生成液31。
该培养生成液的制造方法通过使用通过移除不必要的干细胞而获得的纯的第二间充质干细胞30(第二干细胞),可以制造获得一培养生成液31,并使该培养生成液31只包含分泌自一单一种类的第二干细胞的一预定代谢产物,因此对治疗预定疾病提供显著的效果,且制造获得对于治疗前述疾病具有良好效果的一培养生成液31,而能够制造获得对于预定美容用途具有显著效果的一培养生成液31。通过该培养生成液的制造方法所制造获得的培养生成液31可以通过施予皮肤而治疗烧伤和湿疹等皮肤疾病,通过滴入一只眼睛而作为眼药水,灌入鼻子来治疗花粉症,并通过施予头皮而治疗头皮疾病。又,该培养生成液31可以用于治疗皮肤粗糙、丘疹及晒黑,且可以应用于皮肤美白及去除皱纹等美容用途。
图18为一说明图,其显示一第五观察干细胞步骤的一实施例,图19为一第三平面培养容器的侧视图。当持续制造获得该培养生成液,进行用以自该培养容器25收集于该培养容器25中增生(分化)该第二间充质干细胞30的一第二收集干细胞步骤。于该该第二收集干细胞步骤中,自该培养容器25收集于该培养容器25中增生(分化)的第二间充质干细胞30。
医生、护士及研究人员等负责人员点击显示于该显示器16上的培养生成液制造继续钮,当点击该培养生成液制造继续钮,该计算机11于该显示器16上显示一步骤第十显示屏幕(图未示),该步骤第十显示屏幕上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞第二收集钮、一干细胞第五观察钮、一干细胞第六观察钮及一培养生成液第二萃取钮。
负责人员点击显示于该步骤第十显示屏幕上的干细胞第二收集钮,以该条形码读取器12读取该培养容器25的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的捐赠者数据显示于该显示器16上的(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及捐赠者数据,以及一干细胞第二收集进行讯息、一干细胞第二收集终止钮、一干细胞第五观察钮、一干细胞第六观察钮及一培养生成液第二萃取钮。当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
以磷酸盐缓冲生理盐水清洗该培养容器25后,负责人员将一胰蛋白酶溶液注入该培养容器25,并以一注入器或一移液器收集(抽取)漂浮于该胰蛋白酶溶液表面的第二间充质干细胞30,将该干细胞26储存于该注入器或该移液器(该第二收集干细胞步骤)。自该培养容器25收集该干细胞30后,负责人员点击该干细胞第二收集萃取终止钮,当点击该干细胞第二收集终止钮,该计算机11于该显示器16上显示一步骤第十一显示屏幕(图未示),该步骤第十一显示屏幕上显示该编号1(NO.1)及该捐赠者数据,以及干细胞第二收集终止讯息、一干细胞第五观察钮、一干细胞第六观察钮及一培养生成液第二萃取钮。
用以自该培养容器25收集该第二间充质干细胞30的第二收集干细胞步骤后进行一第五观察干细胞步骤及一第三固定干细胞步骤。于该第五观察干细胞步骤及该第三固定干细胞步骤中,将该第二间充质干细胞30及该培养液23注入该第三平面培养容器35(第三培养容器),该培养容器35于与体温大致相同的温度下(约36~37℃)静置36~48小时(将其静静放置不要移动)。
通过于36~48小时中,利用该电子显微镜13,以每隔约1~2小时的间隔观察该培养容器35中的第二间充质干细胞30(第二干细胞)自该起始平面形状的变形状态,可以确认该干细胞30是否固定于该培养容器35的底部27。印制有用以确认捐赠者的二维条形码的第一代码表17贴附于该培养容器35的底部27(底墙的外表面)。
医生、护士及研究人员等负责人员自该培养容器25收集该第二间充质干细胞30,续将印制有二维条形码的第一代码表17贴附于该第三平面培养容器35的底部27(底墙的外表面),接着,负责人员点击该步骤第十一显示屏幕上的干细胞第五观察钮,及以该条形码读取器12读取该培养容器25的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞第二收集终止讯息、一干细胞第五观察进行讯息、一干细胞第五观察终止钮、一干细胞第六观察钮及一培养生成液第二萃取钮。当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
负责人员将以该注入器或该移液器抽取的第二间充质干细胞30注入(储存于)该培养容器35,并将该培养液23注入(储存于)该培养容器35。该第三平面培养容器35(第三培养容器)由透明玻璃或透明塑料所制得,且为其平面形状略呈方形、具有一预定容量,且底部27具有一预定面积的一平面容器,该底部27的面积大于该第二平面培养容器25(第二培养容器)。该第三平面培养容器35包含一顶部47、一底部48及位于该顶部47的一注入孔49,一盖体50以防水的方式封闭该注入孔49,该第三平面培养容器35可以为平面形状为圆形或椭圆形、具有一预定容量,且一底部27具有一预定面积的一平面容器。
用于该第五观察干细胞步骤地第三平面培养容器35(第三培养容器)的容量约为70~80mL(较佳为75mL),且其底表面积约为75~108mm2,该第三平面培养容器其一侧的长度约为8.7~10.4mm。该培养液23与该第一观察干细胞步骤中所注入者相同。注入该培养容器35的第二间充质干细胞30随时间流逝而固定于该培养容器35的底部27以该培养液23进行培养,并渐渐于该培养容器35的底部27增生(分化)而形成细胞集落。
在将该第二间充质干细胞30及该培养液23注入该培养容器35后,负责人员将该培养容器35设置于(置放于)该电子显微镜13的一样品架上。一间隔件39位于该电子显微镜13的样品架36的上表面37及该第三平面培养容器35的底部48之间,使该培养容器35的底部48由该间隔件39所撑起,使该培养容器25的底部48及该培养容器25的顶部47(注入孔49)分别位于较高及较低的位置,并使该培养容器35维持一预定角度。又,一间隔件39也可以位于该电子显微镜13的样品架36的上表面37及该第三平面培养容器35的顶部48之间,以通过该间隔件39维持该培养容器35的顶部47,使该培养容器35的顶部47及该培养容器35的底部49分别位于较高及较低的位置,并使该培养容器35维持一预定角度。该第三平面培养容器35相对于该样品架36的上表面37的倾斜角α2介于2~5°的范围内,较佳介于2~3°的范围内。
该培养生成液的制造方法中,通过使该第三平面培养容器35相对于该样品架36的上表面37具有该倾斜角,因此使该培养容器35中的第二间充质干细胞30及培养液23朝向该培养容器35的顶部47的一侧(或该底部48的一侧)呈倾斜状态,使该第二间充质干细胞30及该培养液23的水压于该培养容器35的顶部47的一侧(或该底部48的一侧)上升,使该第二间充质干细胞30集中于该培养容器35的底部48的一侧,进而增加该第二间充质干细胞30的活性,使该第二间充质干细胞30可以容易地、快速地固定于培养容器35的底部27。
该电子显微镜13以每隔约1~2小时的间隔拍摄注入至该培养容器35的第二间充质干细胞30的平面形状的放大图像,并将所拍摄的干细胞30的平面形状的放大图像以每隔约1~2小时的间隔传输至该计算机11。该计算机11将传输自该电子显微镜13的第二间充质干细胞30的平面形状的放大图像及一拍摄时间,以与该捐赠者识别符相关的状态储存于该储存区域(第五储存干细胞图像步骤)。该计算机11于该显示器16上显示传输自该电子显微镜13的干细胞30的平面形状的放大图像及该拍摄时间,于36~48小时内,负责人员以每隔约1~2小时的间隔确认(查看)显示于该显示器16上的干细胞30的平面形状的放大图像,观察该干细胞30的平面形状的变化(第五观察干细胞步骤)。于36~48小时内,负责人员也能够以每隔约1~2小时的间隔,直接自该电子显微镜13的观察窗该干细胞30的平面形状的变化。
该第二间充质干细胞30的起始平面形状为略呈圆形,且当该干细胞30的平面形状为略呈圆形,该干细胞30尚未固定于培养容器35的底部27(底墙的内表面),此时该干细胞30尚不会开始增生(分化)。变形的第二间充质干细胞30的平面形状在固定前为主要略呈圆形,且当该干细胞30朝单一方向以无定形的形状延伸则为一扁形,因此使该干细胞30可以固定于该培养容器35的底部27(底墙的内表面),并使该干细胞30得以开始增生(分化)。
依据该第五观察干细胞步骤的观察结果,当显示于该显示器16上的第二间充质干细胞30的平面形状仍为略呈圆形(如图12所示)时,负责人员确认该干细胞30尚未固定于该培养容器35的底部27(底墙的内表面),并以每隔约1~2小时的间隔持续观察该干细胞30的平面形状的变化。依据该第三观察干细胞步骤的观察结果,当显示于该显示器16上的第二间充质干细胞30的平面形状自略呈圆形变形为主要略呈圆形及不规则扁形(如图13所示)时,负责人员确认该干细胞30固定于该培养容器35的底部27(第三固定干细胞步骤)。
使用容量超过80mL、底面积超过108mm2的大型培养容器以固定该第二间充质干细胞30,将不容易使该干细胞30固定于该容器的底表面,且该干细胞30的增生也会趋缓,但是该培养生成液的制造方法中,通过使用上述容量及上述底表面积的第三平面培养容器35,可以容易地使该干细胞30固定于该培养容器35的底部27,并使该干细胞30可以于该培养容器35中快速地增生。
该培养生成液的制造方法使该培养容器35于与体温大致相同的温度下静置36~48小时,并于36~48小时中,以每隔约1~2小时的间隔观察该培养容器35中的第二间充质干细胞30自该起始平面形状的变形状态,因此绝对不会没有注意到该干细胞30的变形,可以精确地确认该干细胞3固定于该培养容器35的底部27。
依据该第五观察干细胞步骤的观察结果,该第二间充质干细胞30(第二干细胞)自略呈圆形(起始平面形状)变形为主要略呈圆形及不规则扁形,且用以确认该干细胞30固定于该第三平面培养容器35(第三培养容器)的底部27的第三固定干细胞步骤后进行该第三培养干细胞步骤及一第六观察干细胞步骤。
于该第三培养干细胞步骤及该第六观察干细胞步骤中,自该培养容器35丢弃(抛弃)注入该培养容器35的培养液23,及将一新的培养液23注入(储存于)该培养容器35。该培养容器35于与体温大致相同的温度下(约36~37℃)静置36~48小时(将其静静放置不要移动),并于该培养容器35中培养该第二间充质干细胞30(第三培养干细胞步骤)。通过于该培养容器35静置36~48小时的时间中,以每隔约1~2小时的间隔利用该电子显微镜13观察固定于该培养容器35的底部27的第二间充质干细胞30的总表面积相对于该培养容器35的底表面积之间的关系,并确认该干细胞30的总表面积达该培养容器35的底表面积的第三目标比,该第二间充质干细胞30的总表面积相对于该培养容器35的底表面积的第三目标比为88~92%(融合度为88~92%)。
确认该第二间充质干细胞30固定于该培养容器35的底部27后,医生、护士及研究人员等负责人员点击显示于该显示器16上的干细胞第五观察终止钮。当点击该干细胞第五观察终止钮,该计算机11于该显示器16上显示一步骤第十二显示屏幕(图未示),该步骤第十二显示屏幕上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞第二收集终止讯息、一干细胞第五观察终止讯息、一干细胞第六观察钮及一培养生成液第二萃取钮。
负责人员点击该步骤第十二显示屏幕上的干细胞第六观察钮,自该电子显微镜13的样品架上移除该培养容器35,以该条形码读取器12读取该培养容器35的二维条形码。当该二维条形码自该条形码读取器12传输至该计算机11,该计算机11比对显示于该显示器16上的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞第二收集终止讯息、一干细胞第五观察终止讯息、一干细胞第六观察进行讯息、一干细胞第六观察终止钮及一培养生成液第二萃取钮。当这些捐赠者数据不符,该计算机11于该显示器16上显示一错误讯息及一培养取消讯息。
于该第五观察干细胞步骤中,负责人员自该培养容器35丢弃(抛弃)注入该培养容器35的培养液23,及将一新的培养液23注入(储存于)该培养容器35。该新的培养液23与该第一观察干细胞步骤中所注入者相同。负责人员将一新的培养液23注入该培养容器35,续将该培养容器35设置于(置放于)该电子显微镜13的样品架36上。
一间隔件39位于该电子显微镜13的样品架36的上表面37及该第三平面培养容器35的底部48之间,使该培养容器35的底部48由该间隔件39所撑起,使该培养容器25的底部48及该培养容器25的顶部47(注入孔49)分别位于较高及较低的位置,并使该培养容器35维持一预定角度。又,一间隔件39也可以位于该电子显微镜13的样品架36的上表面37及该第三平面培养容器35的顶部48之间,使该培养容器35的顶部47由该间隔件39所撑起,使该培养容器35的顶部47及该培养容器35的底部49分别位于较高及较低的位置,并使该培养容器35维持一预定角度。该第三平面培养容器35相对于该样品架36的上表面37的倾斜角α2介于2~5°的范围内,较佳介于2~3°的范围内。
该培养生成液的制造方法中,通过确认该第二间充质干细胞30的固定,续丢弃该培养容器25中的培养液23,并将一新的培养液23注入该培养容器35,因此可以确实地促进该第二间充质干细胞30的增生。该培养生成液的制造方法中,通过使该第三平面培养容器35相对于该样品架36的上表面37具有该倾斜角,因此使该培养容器35中的第二间充质干细胞30及培养液23朝向该培养容器35的顶部47的一侧(或该底部48的一侧)呈倾斜状态,使该第二间充质干细胞30及该培养液23的水压于该培养容器35的顶部47的一侧(或该底部48的一侧)上升,使该第二间充质干细胞30集中于该培养容器35的底部48的一侧,进而增加该第二间充质干细胞30的活性,使该第二间充质干细胞30可以容易地、快速地于该培养容器35的底部27增生(分化)。
该电子显微镜13以每隔约1~2小时的间隔拍摄于该培养容器35中的第二间充质干细胞30的平面形状的放大图像,并将所拍摄的干细胞30的平面形状的放大图像以每隔约1~2小时的间隔传输至该计算机11。该计算机11将传输自该电子显微镜13的第二间充质干细胞30的平面形状的放大图像及一拍摄时间,以与捐赠者识别符相关的状态储存于该储存区域中(第六储存干细胞图像步骤)。该计算机11于该显示器16上显示传输自该电子显微镜13的第二间充质干细胞30的平面形状的放大图像及该拍摄时间。
于36~48小时内,负责人员以每隔约1~2小时的间隔确认(查看)显示于该显示器16上的第二间充质干细胞30的平面形状的放大图像,观察固定于该培养容器35的底部27的干细胞30的总表面积相对于该培养容器35的底表面积之间的关系,并确认该干细胞30的总表面积是否达该培养容器35的底表面积的第三目标比(融合度为88~92%)(第六观察干细胞步骤)。于36~48小时内,负责人员也能够以每隔约1~2小时的间隔,直接自该电子显微镜13的观察窗观察该第二间充质干细胞30的总表面积相对于该培养容器35的底表面积之间的关系,并确认该干细胞30的总表面积是否达该培养容器35的底表面积的第三目标比(融合度为88~92%)。
依据该第六观察干细胞步骤的观察结果,当显示于该显示器16上的第二间充质干细胞30的总表面积尚未达该培养容器35的底表面积的第三目标比(融合度为88~92%)时,负责人员以每隔约1~2小时的间隔持续观察该干细胞30的总表面积与该培养容器35的底表面积之间的关系(如图13所示),当显示于该显示器16上的所有区域的放大图像的第二间充质干细胞30的总表面积达该第三目标比时,确认该干细胞30的总表面积达该培养容器35的底表面积的第三目标比。
依据该第六观察干细胞步骤的观察结果,该第二间充质干细胞30于该第三平面培养容器35(第三培养容器)的底部27(底墙的内表面)增生以形成细胞集落,并延伸其平面形状,且当显示于该显示器16上的干细胞30的总表面积达该培养容器35的底表面积的第三目标比(融合度为88~92%)时(如图14所示),于该培养容器30中增生一单一种类的第二间充质干细胞30,且制造获得包含分泌自一单一种类的干细胞的一预定代谢产物30的一培养生成液31。
当该第二间充质干细胞30增生至其总表面积相对于该第三平面培养容器35(第三培养容器)的底表面积超过92%时,该干细胞30的活性会渐渐消失。该培养生成液的制造方法中,当该干细胞30增生至其总表面积相对于该培养容器35的底表面积为88~92%时,即自该培养容器35萃取该干细胞30,因此可以维持该干细胞30的活性,进而可以增生该干细胞30。
当该干细胞30的总表面积达该培养容器35的底表面积的第三目标比时,进行用以自该培养容器35萃取该培养生成液31的一第二萃取培养生成液步骤。于该第二萃取培养生成液步骤中,自该培养容器35萃取包含分泌自具有活性的第二间充质干细胞30的一预定代谢产物的培养生成液31。该培养生成液的制造方法中,通过以每隔约1~2小时的间隔观察该总面积,以精确地确认该第二间充质干细胞30的总表面积相对于该培养容器35的底表面积的关系,因此可以确实地确认该干细胞30的总表面积达该培养容器35的底表面积的第三目标比。
确认该第二间充质干细胞30的总表面积达该培养容器35的底表面积的第三目标比后,医生、护士及研究人员等负责人员点击显示于该显示器16上的干细胞第六观察终止钮,当点击该干细胞第六观察终止钮,该计算机11于该显示器16上显示一步骤第十三显示屏幕(图未示),该步骤第十三显示屏幕上显示该编号1(NO.1)及该捐赠者数据,以及一干细胞第二收集终止讯息、一干细胞第五观察终止讯息、一干细胞第六观察终止讯息及一培养生成液第二萃取钮。
于该第六观察干细胞步骤中,负责人员使用一注入器或一移液器自该培养容器35抽取由注入该培养容器35的培养液23所转变的培养生成液31(第二萃取培养生成液步骤),将该培养生成液31注入(储存于)该保存容器32,注入该保存容器32的培养生成液31为包含分泌自一单一及特定种类的间充质干细胞(一单一种类的干细胞)的一预定代谢产物,且该单一及特定种类的间充质干细胞已移除不必要的间充质干细胞而具有活性。
负责人员将该培养生成液31注入该保存容器32,续将印制有二维条形码的第一代码表17贴附于该保存容器32的外周面,负责人员点击显示于该显示器16上的第十三显示屏幕的培养生成液第二萃取终止钮,并以该条形码读取器12读取该保存容器32的二维条形码,续将注入有该培养生成液31的保存容器32储存于该冰箱34,该培养生成液31储存于约为3~4℃的冰箱34。
当该二维条形码自该条形码读取器12传输至该计算机11,计算机比对11显示于该显示器16上的捐赠者数据(自该内存读取的捐赠者数据)及由该条形码读取器12所读取的二维条形码所指的捐赠者数据,且当这些捐赠者资料相符,该显示器16上显示该编号1(NO.1)及该捐赠者数据,以及一培养生成液萃取终止讯息及一培养生成液制造终止钮。负责人员点击该培养生成液制造终止钮,点击该培养生成液制造终止钮以停止该计算机11上的培养生成液制造系统10。
当点击该培养生成液制造终止钮,进行用以自该培养容器25收集该干细胞30的一收集干细胞步骤。于该收集干细胞步骤中,自该培养容器35收集于该培养容器35中增生(分化)的第二间充质干细胞30,以磷酸盐缓冲生理盐水清洗该培养容器35后,负责人员将一胰蛋白酶溶液注入该培养容器35,使用一注入器或一移液器抽取漂浮于该胰蛋白脢溶液表面的第二间充质干细胞30,并自该注入器或该移液器将该干细胞30注入(储存于)该保存容器33。
注入该保存容器33的第二间充质干细胞30为一单一及特定种类的间充质干细胞(单一种类的干细胞),其已移除不必要的间充质干细胞而具有活性。负责人员将该第二间充质干细胞30(一单一种类的间充质干细胞)注入该保存容器33,续将印制有二维条形码的第一代码表17贴附于该保存容器33的外周面,将注入有该第二间充质干细胞30的保存容器33储存于该冰箱34,该第二间充质干细胞30(一单一种类的间充质干细胞)储存于约为3~4℃的冰箱34。
该培养生成液的制造方法中,通过自该第二培养容器25萃取一培养生成液31后,自该第二培养容器25收集该第二干细胞30、与一培养液23共培养该干细胞30、将该干细胞30固定于一第三培养容器35的底部27,该第三培养容器35具有大于该第二培养容器25的容量、将一新的培养液23注入该培养容器35、培养该干细胞30,及于培养该干细胞30的过程中,当该干细胞30的总表面积达该培养容器35的底表面积的第三目标比,自该培养容器35萃取该培养生成液31,该培养生成液31包含分泌自增生的具有活性的单一种类的第二干细胞30的一预定代谢产物,因此于培养该干细胞30的过程中,不会培养多种类的干细胞,不会制造获得包含分泌自多种类的干细胞的多种类的代谢产物,只会包含分泌自具有活性的单一种类的第二干细胞30的一预定代谢产物,可以制造获得针对预定疾病及预订美容用殂具有特定效果的一培养生成液31,制造获得对治疗预定疾病具有良好效果的一培养生成液31,及制造获得对预订美容用途具有良好效果的一培养生成液31。
- 还没有人留言评论。精彩留言会获得点赞!