一种肾脏的制造方法与流程
本发明涉及一种肾脏的制造方法。更详细而言,涉及肾脏的制造方法、肾脏、非人动物、移植用脏器、肾脏制造用试剂盒、肾脏再生用药物、肾脏的移植方法以及肾病的治疗方法。本申请基于2016年6月29日在日本提出申请的日本特愿2016-129393号而主张优先权,且将其内容引用于本文。
背景技术:
由于老龄化、适应疾病的扩大等,人工透析患者急速增加。虽然通过透析医疗能够挽救这些患者的生命,但通过人工透析无法补偿全部的肾功能,因此,存在患者的心血管疾病增加,致死率上升的趋势。另外,透析患者的时间负担、精神负担非常大,难以重新回到社会的情况也较多。
另外,世界上需要进行肾脏移植的晚期肾病的患者存在约2百万人,由于供体脏器不足,其数量存在进一步增加的趋势。因此,晚期肾病是医疗上的重大的问题。
目前,能够由ips细胞/es细胞等多能干细胞诱导各种组织特异性的前体细胞或组织干细胞(例如参照非专利文献1)。然而,例如肾脏是自修复能力低的脏器,肾功能依赖于由多种细胞构成的复杂结构。因此,目前尚未实现由肾脏前体细胞来再生具有复杂的三维结构的肾脏。
现有技术文献
非专利文献
非专利文献1:takasatom,etal.,directinghumanembryonicstemcelldifferentiationtowardsarenallineagegeneratesaself-organizingkidney,nat.cellbiol.,16(1),118-126,2014.
技术实现要素:
发明所要解决的技术问题
本发明的目的在于提供由肾脏前体细胞制作肾脏的技术。
用于解决问题的技术方案
本发明包括以下技术方案。
(1)一种肾脏的制造方法,其包括:组织特异性地去除非人动物的后肾的后肾间充质的工序;将源自与所述非人动物同种异体或异种的非人动物的肾脏前体细胞移植到所述后肾的工序;以及,使所述后肾的产生得以进行且其中移植后的所述肾脏前体细胞分化成熟并形成肾脏的一部分的工序。
(2)如(1)所述的肾脏的制造方法,其还包括:组织特异性地去除所述后肾的输尿管芽的工序;以及将源自与所述非人动物同种异体或异种的非人动物的肾脏前体细胞移植到所述后肾的工序。
(3)如(1)或(2)所述的肾脏的制造方法,其中,所述肾脏前体细胞为猫细胞。
(4)如(1)至(3)中任一项所述的肾脏的制造方法,其中,所述非人动物为猪。
(5)如(1)至(3)中任一项所述的肾脏的制造方法,其中,所述非人动物为小鼠。
(6)如(1)至(3)中任一项所述的肾脏的制造方法,其中,所述非人动物为猫。
(7)一种肾脏,其是通过(1)至(6)中任一项所述的制造方法而制造的。
(8)一种肾脏,其包含源自非人动物的细胞和源自与所述非人动物同种异体或异种的非人动物的细胞,并且源自与所述非人动物同种异体或异种的非人动物的所述细胞的比例为70质量%以上。
(9)如(8)所述的肾脏,其中,源自与所述非人动物同种异体或异种的非人动物的所述细胞为猫细胞。
(10)一种非人动物,其具有(7)至(9)中任一项所述的肾脏。
(11)一种移植用脏器,其具备(7)至(9)中任一项所述的肾脏、输尿管以及膀胱。
(12)如(11)所述的移植用脏器,其中,所述输尿管及所述膀胱源自所述非人动物。
(13)一种肾脏制造用试剂盒,其具备非人动物的后肾、组织特异性地去除所述后肾的后肾间充质的药剂、以及源自与所述非人动物同种异体或异种的非人动物的肾脏前体细胞。
(14)如(13)所述的肾脏制造用试剂盒,其还具备组织特异性地去除所述后肾的输尿管芽的药剂。
(15)一种肾脏再生用药物,其具备非人动物的后肾、组织特异性地去除所述后肾的后肾间充质的药剂、以及源自非人动物的肾脏前体细胞。
(16)如(15)所述的肾脏再生用药物,其还具备组织特异性地去除所述后肾的输尿管芽的药剂。
(17)一种肾脏的移植方法,其包括:将如(11)或(12)所述的移植用脏器移植到患病动物(被感染动物)的体内的工序;以及,从移植起经过规定期间后将上述移植用脏器的膀胱与患病动物的输尿管连接的工序。
(18)一种肾病的治疗方法,其包括:将非人动物的后肾及泄殖腔移植到患病动物的体内的工序;
组织特异性地去除所述后肾的后肾间充质的工序;将肾脏前体细胞移植到所述后肾且其中移植后的所述肾脏前体细胞分化成熟而形成肾脏的一部分、所述泄殖腔分化成熟而形成膀胱、该膀胱通过输尿管而连接于所述肾脏的工序;以及,从所述肾脏前体细胞的移植起经过规定期间后将所述膀胱与患病动物的输尿管连接的工序(b)。
发明效果
基于本发明能够提供由肾脏前体细胞制作肾脏的技术。
附图说明
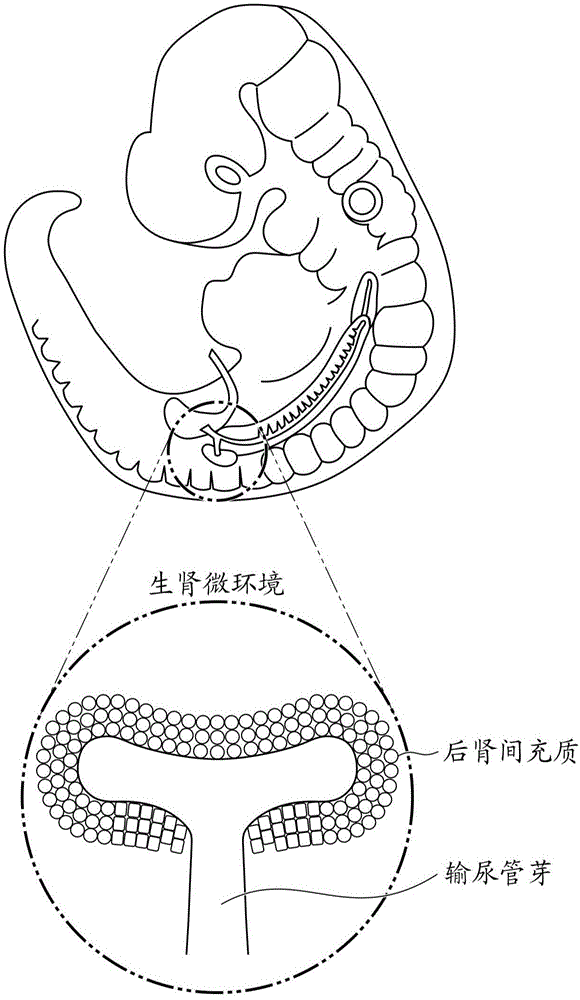
图1是表示胎生11天左右的小鼠的胚胎(胎儿)的示意图。
图2(a)至(c)是说明肾脏产生的情形的示意图。
图3是表示实验例3中的肾脏组织标本的免疫染色结果的照片。
图4是表示实验例4中的肾脏组织标本的免疫染色结果的照片。
图5(a)及(b)是拍摄实验例5中在小鼠体内再生的肾脏而得的照片。
图6(a)及(b)是实验例5中在小鼠体内再生的肾脏的组织切片标本的显微照片。
图7(a)至(c)是示出实验例6中的后肾的组织标本的免疫染色结果的照片。
具体实施方式
[肾脏的制造方法]
图1是表示胎生11天左右的小鼠的胚胎(胎儿)的示意图。肾脏经由前肾、中肾、后肾这3个阶段而形成。其中,前肾及中肾在之后发生退行性化生(retroplasia)。在哺乳类成体中发挥作用的肾脏是后肾。
如图1所示,肾脏是通过输尿管芽与其周围的后肾间充质的相互作用而形成的。输尿管芽构成集合管至输尿管,后肾间充质中所含的肾单位前体细胞成为肾小球及肾小管的起源。本说明书中,将包含输尿管芽及后肾间充质的生肾区域称为生肾微环境(niche)。
在一个实施方式中,本发明提供一种肾脏的制造方法,其包括:组织特异性地去除非人动物的后肾的后肾间充质的工序(i);将源自与上述非人动物同种异体或异种的非人动物的肾脏前体细胞移植到上述后肾的工序(ii);以及,使上述后肾的产生得以进行并且其中移植后的上述肾脏前体细胞分化成熟且形成肾脏的一部分的工序(iii)。
以往,向生肾微环境的细胞移植的固着效率非常差。与此相对,如实施例中后面所述的那样,基于本实施方式的制造方法,能够使移植的肾脏前体细胞以高效率进行植入。进而,移植的肾脏前体细胞能够继承宿主的产生程序而自主地进行复杂的分化诱导而形成肾脏的一部分。
参照图2对本实施方式的肾脏的制造方法详细地进行说明。图2(a)至(c)是说明肾脏产生的情形的示意图。其中,图2(a)与本实施方式的肾脏的制造方法对应。
在图2(a)中,通过添加去除药剂而去除非人动物的胚的初期肾脏的后肾间充质。由此,成为不存在源自宿主的肾干细胞的状态、即微环境处于空置状态。接下来,向生肾微环境移植新的肾脏前体细胞(肾干细胞)。如此一来,移植的肾脏前体细胞固着且通过继承宿主的产生程序而使肾脏的产生得以进行。其结果,通过移植的肾脏前体细胞而再生肾脏。
另一方面,在图2(b)中,通过添加去除药剂而去除非人动物的胚的初期肾脏的后肾间充质。由此,成为不存在源自宿主的肾干细胞的状态、即微环境处于空置状态。在图2(b)中,不进行新的肾脏前体细胞的移植。即使在该状态下使肾脏的产生得以进行,肾脏也会退化。
另外,在图2(c)中,在使源自宿主的肾干细胞残留于非人动物的胚的初期肾脏的后肾间充质状态下移植新的肾脏前体细胞。然而,因占据生肾微环境的源自宿主的现有的细胞产生的竞争强,移植的肾脏前体细胞不会固着。其结果,形成由源自宿主的细胞构成的肾脏。
下面,对本实施方式的肾脏的制造方法的各工序详细地进行说明。
(工序(i))
在本工序中,组织特异性地去除非人动物的胚的后肾间充质。作为非人动物,没有特别限制,例如可以为猪。猪的脏器的大小适于向人等的移植,也建立了基因改造技术。或者,非人动物也可以为小鼠;对于小鼠由于建立有基因改造技术、各种实验体系,因此容易利用。或者,非人动物也可以为猫;猫作为宠物最普遍的动物之一,是慢性肾病的患病率非常高的动物。例如,也有如下报告:猫的死因中约30%为慢些肾衰竭,猫50%以上由于肾功能降低而死亡或者被予以安乐死。从这样的方面出发,作为患有肾病的猫的延长寿命技术之一,潜在地具有肾脏移植的需要。
后肾间充质的组织特异性的去除,只要能够组织特异性地去除后肾间充质就没有特别限制,可以通过使用例如基因重组技术来进行。
以小鼠的体系为例进行说明组织特异性地去除后肾间充质的更具体的方法。作为组织特异性地去除后肾间充质的方法,例如可举出使表达cre重组酶活性依赖性地表达白喉毒素受体(dtr)的idtr小鼠与在six2的启动子的下游导入有cre重组酶基因的six2-cre小鼠进行交配,使所得到的后代的后肾组织与白喉毒素进行接触。
idtr小鼠在编码白喉毒素受体的基因的上游具有由2个loxp序列夹住的转录终止序列。因此,不会直接表达白喉毒素受体。然而,若通过cre重组酶将由2个loxp序列夹住的转录终止序列去除,则会变得表达白喉毒素受体。
小鼠由于不具有白喉毒素受体,因此,即使原本使小鼠的细胞与白喉毒素接触,细胞也不会死亡。然而,已知若使白喉毒素与表达了白喉毒素受体的小鼠细胞接触则死亡。上述的例子中利用了该现象。
首先,若使idtr小鼠与后肾间充质特异性地表达cre重组酶的six2-cre小鼠进行交配,则在得到的后代中出现在后肾组织中组织特异性地表达白喉毒素受体的小鼠。应予说明,six2是在后肾间充质中特异性地表达的转录因子。
接下来,若使白喉毒素与上述的小鼠的后肾接触,则后肾间充质特异性使细胞死亡,其能够组织特异性地去除后肾间充质。即,能够将生肾微环境空出来。
白喉毒素的接触可以通过向亲本小鼠或小鼠的胚胎注射白喉毒素等来进行。或者,可以通过从小鼠的胚胎中摘除后肾并将摘除的后肾进行器官培养、在其培养基中添加白喉毒素等而进行。或者,可以通过将摘除的后肾移植到患病动物的主动脉旁区域、大网膜并在患病动物的体内局部给药白喉毒素等而进行。在本说明书中,作为患病动物,例如可举出猫、狗、马(特别是赛马)、猴、牛、绵羊、猪、山羊、兔、仓鼠、豚鼠、大鼠、小鼠等。
上述方法是组织特异性地去除后肾间充质的方法之一,并不限于小鼠,能够应用于所有非人动物。
(工序(ii))
接下来,在本工序中,将源自与上述非人动物同种异体或异种的非人动物的肾脏前体细胞移植到后肾。工序(i)及工序(ii)可以并行地实施。即,空出微环境的时期和移植肾脏前体细胞的时期可以重叠。例如,可以同时实施去除药剂的添加和肾脏前体细胞的移植。
作为肾脏前体细胞,例如可举出由源自哺乳动物的间充质干细胞(mscs)以及ips细胞、es细胞等多能干细胞进行分化诱导而得到的肾脏前体细胞(肾脏干细胞)等。肾脏前体细胞可以为源自患病动物的细胞,也可以为患病动物中的排斥反应得到抑制的异体细胞。
肾脏前体细胞优选为源自作为移植制造后的肾脏的对象的患病动物的细胞。例如可举出由从源自患病动物的骨髓、脂肪组织、循环血或脐带血中分取得到的间充质干细胞等分化诱导而得到的肾脏前体细胞。也可以是通过从患病动物自身的骨髓、循环血或脐带血中分取得到的间充质干细胞进行分化诱导而得到的肾脏前体细胞。分取法只要利用一般的外科医学方法即可。对于所分取的细胞,选择最佳条件,优选进行细胞继代培养2~5代。另外,为了在抑制间充质干细胞转化的同时持续进行培养,可以使用cambrexbioscience公司制造的人类间充质干细胞专用培养基试剂盒等进行培养。
可以根据期望来使用腺病毒或逆转录病毒等向肾脏前体细胞导入期望的基因。例如,为了辅助肾脏形成,可以进行基因导入以表达胶质细胞源性神经营养因子(glialcellline-derivedneurotrophicfactor-gdnf)。这是因为即将形成肾脏之前的间充质组织表达gdnf,通过引入表达作为其受体的c-ret的输尿管芽,从而完成肾脏产生的最初的重要阶段。
作为移植的方法,例如只要使用注射针等向后肾注入源自非人动物的肾脏前体细胞即可。移植的肾脏前体细胞的数量优选例如1×103~1×106个左右。肾脏前体细胞的移植也可以在活体外施行,因此,不需要手艺熟练,非常容易。
肾脏前体细胞可以为猫细胞。此时,所制造的肾脏由移植到生肾微环境的猫细胞构成。该肾脏能够移植到作为患病动物的猫而发挥作用。若肾脏前体细胞为患病动物的细胞或与患病动物的排斥反应得到抑制的细胞,则更优选。
肾脏前体细胞也可以为源自除猫以外的非人动物的细胞。作为除猫以外的非人动物,可举出上述的患病动物。此时,所制造的肾脏由移植到生肾微环境的源自非人动物的细胞构成。该肾脏能够移植到作为患病动物的非人动物而发挥作用。若肾脏前体细胞为患病动物的细胞或者与患病动物的排斥反应得到抑制的细胞,则更优选。
(工序(iii))
接下来,在本工序中,使移植了肾脏前体细胞的后肾的产生得以进行。其结果,移植后的肾脏前体细胞分化成熟,形成肾脏的一部分。对于后肾的产生的进行,在不从胚中摘除后肾而移植了肾脏前体细胞的情况下,可以通过将胚再次返回到亲本动物的子宫而使其生长,或者通过进行全胚胎培养等来实施。或者,在摘除后肾而移植了肾脏前体细胞的情况下,可以通过持续进行后肾的器官培养来实施。或者,在将后肾移植到患病动物的主动脉旁区域、大网膜且在患病动物的体内移植肾脏前体细胞的情况下,可以通过直接使后肾生长来实施。
其结果,如实施例中后述那样,移植后的肾脏前体细胞继承宿主的产生程序,一边与残留的输尿管芽相互作用一边自主地进行复杂的分化诱导而形成肾小球、肾小管。另外,为了完全地去除构成宿主侧的后肾间充质的肾脏前体细胞,再生的肾小球及肾小管实质上仅由源自移植的肾脏前体细胞的细胞所构成。
在此,所谓“实质上”是指在利用非人动物的生肾微环境制造肾脏的情况下不排除混入除了移植的肾脏前体细胞以外的细胞的意思。换言之,再生的肾小球及肾小管优选70质量%以上由移植的肾脏前体细胞构成,更优选80质量%以上由移植的肾脏前体细胞构成,进一步优选90质量%以上由移植的肾脏前体细胞构成,进一步更优选95质量%以上由移植的肾脏前体细胞构成,特别优选99质量%以上由移植的肾脏前体细胞构成。
本实施方式的肾脏的制造方法可以还包括:组织特异性地去除上述后肾的输尿管芽的工序(iv),以及将源自与上述非人动物同种异体或异种的非人动物的肾脏前体细胞移植到上述后肾的工序(v)。另外,工序(iv)及(v)可以在上述的工序(i)至(iii)之前实施,也可以在上述的工序(i)至(iii)之后实施。另外,可以在工序(iv)及(v)后进一步实施工序(iii)。
由此,不仅是后肾间充质,而且输尿管芽也可以被替换为源自移植的肾脏前体细胞的细胞。其结果,可以制造实质上仅由来源于移植的源自非人动物的肾脏前体细胞的细胞所构成的肾脏。以下,对各工序进行说明。
(工序(iv))
在本工序中,组织特异性地去除非人动物的后肾的输尿管芽。对于输尿管芽的组织特异性的去除,只要能够组织特异性地去除输尿管芽就没有特别限制,可以通过使用例如基因重组技术来进行。
例如,在上述的将idtr小鼠与six2-cre小鼠进行交配而得到的小鼠中,可以使用在输尿管芽特异性启动子的下游进一步导入有编码cre-er蛋白的基因的小鼠。在此,作为输尿管芽特异性启动子,可举出细胞角蛋白8的启动子、hoxb7的启动子等。
作为这样的小鼠,例如可举出具有six2-cretg/wt细胞角蛋白8-cre-ertg/wt的基因型的idtr小鼠、具有six2-cretg/wthoxb7-cre-ertg/wt的基因型的idtr小鼠等。在此,“tg”表示转基因,“wt”表示野生型。
cre-er蛋白是cre重组酶与突变雌激素受体的融合蛋白。对于上述小鼠,作为输尿管芽的标记的细胞角蛋白8或hoxb7的启动子依赖性地表达cre-er。
cre-er蛋白通常存在于细胞质,但通过与作为雌激素衍生物的他莫昔芬结合而移入核内,对loxp序列引起重组。对此加以利用,可以针对cre-loxp系统起作用的时期进行他莫昔芬依赖性地调节。因此,即使cre-er及cre同时表达,通过是否给药他莫昔芬,也能够控制cre-er的活性表达。在此,也可以使用作为cre-er的变体的cre-ert、cre-ert2等代替cre-er。
对于上述的小鼠,后肾间充质特异性地表达白喉毒素受体。因此,首先施行上述的工序(i)、(ii)、(iii)即可。具体而言,通过使上述的小鼠的胚的后肾接触白喉毒素,将后肾间充质去除。接下来,通过上述的方法,将源自非人动物的肾脏前体细胞移植到后肾,使后肾的产生得以进行。其结果,通过移植的源自非人动物的肾脏前体细胞来再生后肾间充质。
接下来,若使该后肾接触他莫昔芬,则输尿管芽特异性地表达白喉毒素受体。因此,通过使该后肾接触白喉毒素,则能够组织特异性地去除输尿管芽。即,能够将生肾微环境空出来。
在上述小鼠的例子中,在后肾间充质特异性启动子的下游导入编码cre蛋白的基因,在输尿管芽特异性启动子的下游导入编码cre-er蛋白的基因。然而,也可以在后肾间充质特异性启动子的下游导入编码cre-er蛋白的基因,在输尿管芽特异性启动子的下游导入编码cre蛋白的基因。另外,也可以使用作为cre-er的变体的cre-ert、cre-ert2等代替cre-er。
例如,也可以使用:针对使idtr小鼠与在后肾间充质特异性启动子的下游导入有编码cre-er蛋白的基因的小鼠进行交配得到的小鼠,进一步导入在输尿管芽特异性的启动子的下游导入编码cre蛋白的基因而获得的小鼠。
更具体而言,例如可举出具有six2-cre-ertg/wthoxb7-cretg/wt的基因型的idtr小鼠等。在此,“tg”、“wt”表示与上述的“tg”、“wt”相同的含义。
对于该小鼠,后肾间充质特异性地表达cre-er。另外,输尿管芽特异性地表达白喉毒素受体。因此,在使用该小鼠的情况下,在实施工序(i)至(iii)之前,实施工序(iv)及(v)。具体而言,通过使该小鼠的胚的后肾接触白喉毒素,能够去除输尿管芽。
上述方法是组织特异性地去除输尿管芽的方法之一,并不限于小鼠,也能够应用于所有非人动物。
(工序(v))
接下来,在本工序中,通过将源自与上述非人动物同种异体或异种的非人动物的肾脏前体细胞移植到上述后肾,使输尿管芽的产生得以进行。其结果,通过移植的非人动物肾脏前体细胞而再生输尿管芽。工序(iv)及工序(v)可以并行地实施。即,空出微环境的时期和移植肾脏前体细胞的时期可以重叠。例如,可以同时实施去除药剂的添加和肾脏前体细胞的移植。
接下来,实施上述的工序(iii),使移植了源自非人动物的肾脏前体细胞的胚(后肾)的产生得以进行。其结果,移植的源自非人动物的肾脏前体细胞分化成熟,形成肾脏的一部分。
作为源自非人动物的肾脏前体细胞,可以使用与上述同样的源自非人动物的肾脏前体细胞。在此,在肾脏前体细胞与上述的后肾间充质的再生中的肾脏前体细胞来源相同的情况下,对于所制造的肾脏,不仅肾小球、肾小管由来源相同的细胞构成,集合管、输尿管也由来源相同的细胞构成。
因此,若肾脏前体细胞为源自患病动物的细胞或与患病动物的排斥反应得到抑制的细胞,则移植到患病动物时,能够制造排斥反应更少的肾脏。
例如,使用具有six2-cre-ertg/wthoxb7-cretg/wt的基因型的idtr小鼠先实施工序(iv)及(v)时,接下来可以实施上述的工序(i)、(ii)、(iii)。即,若通过移植的源自非人动物的肾脏前体细胞来使得再生了输尿管芽的小鼠的后肾接触他莫昔芬,则这次后肾间充质特异性地表达白喉毒素受体。因此,通过使该后肾接触白喉毒素,这次能够组织特异性地去除后肾间充质。即,能够将生肾微环境空出来。
上述方法是组织特异性地去除输尿管芽的方法之一,并不限于小鼠,也能够应用于所有非人动物。
在本实施方式的肾脏的制造方法中,后肾间充质的去除和输尿管芽的去除可以先进行任一者。当先进行输尿管芽的去除时,可以适当改变上述的cre-loxp系统。
另外,在本实施方式的肾脏的制造方法中,作为使细胞死亡的系统,能够应用于作为对象的非人动物的种类,只要能够组织特异性、时期特异性地运作,即可没有特别限制地使用。
因此,也可以是通过除了白喉毒素受体以外的系统来使细胞死亡的构成方案。例如,可举出在组织特异性启动子的下游进行cre重组酶活性依赖性地表达白喉毒素(diphteriatoxinasubunit,dt-a)的系统。该系统能够应用于原本对白喉毒素具有敏感性的非人动物。作为这样的非人动物,例如可举出猪。
或者,可举出在组织特异性启动子的下游表达通过给药更昔洛韦而诱导细胞凋亡的源自疱疹病毒的胸苷激酶基因(hsv-tk)的系统。表达了hsv-tk的细胞在更昔洛韦给药下诱导细胞死亡。
或者,也可以采用通过给药ap20187而使caspase3、caspase8、caspase9等二聚化而诱导细胞凋亡的系统。
对于本实施方式的肾脏的制造方法而言,只要能够组织特异性地去除后肾的后肾间充质或输尿管芽,就不限定于上述制造方法,可以使用各种基因重组系统或基因重组系统组合。
[肾脏]
在一个实施方式中,本发明提供一种通过上述的制造方法所制造的肾脏。本实施方式的肾脏利用作为宿主的非人动物的生肾微环境及产生程序,由所期望的源自非人动物的肾脏前体细胞来制造。因此,能够移植到患病动物而发挥作用。
如上所述,本实施方式的肾脏是通过后肾间充质或输尿管芽或者它们两者被替换成移植的源自非人动物的肾脏前体细胞而形成的。因此,特别是在作为后肾间充质和输尿管芽两者被替换成移植的源自非人动物的肾脏前体细胞而得到的肾脏的情况下,该肾脏实质上仅由来源于移植的源自非人动物的肾脏前体细胞的细胞所构成。因此,难以通过确定构成肾脏的细胞来确定:是通过上述制造方法所制造的肾脏,还是作为制备移植的源自非人动物的肾脏前体细胞的基础的、患病动物原本的肾脏。
上述的肾脏含有源自非人动物的细胞和源自与上述非人动物同种异体或异种的非人动物的细胞,并且源自与上述非人动物同种异体或异种的非人动物的上述细胞的比例可以为70质量%以上,更优选为80质量%以上,进一步优选为90质量%以上,进一步更优选为95质量%以上,特别优选为99质量%以上。
在此,作为非人动物,如上所述,例如可举出猪、小鼠、猫等。另外,作为源自与这些非人动物同种异体或异种的非人动物的细胞,可举出源自上述的患病动物的细胞等。这样的肾脏可以通过上述的肾脏的制造方法来制造。
本实施方式的肾脏例如可以为通过上述的制造方法将后肾间充质替换为移植的源自非人动物的肾脏前体细胞而形成的肾脏。此时,源自输尿管芽的集合管、输尿管来源于作为宿主的非人动物。
或者,本实施方式的肾脏可以为通过上述的制造方法将输尿管芽替换为移植的源自非人动物的肾脏前体细胞而形成的肾脏。此时,源自后肾间充质的肾小球、肾小管来源于作为宿主的非人动物。
或者,本实施方式的肾脏可以为通过上述的制造方法将后肾间充质和输尿管芽两者替换为移植的源自非人动物的肾脏前体细胞而形成的肾脏。此时,肾小球、肾小管、集合管、输尿管实质上全部来源于移植的源自非人动物的肾脏前体细胞。然而,有时在所形成的肾脏残留源自作为宿主的非人动物的细胞。
[移植用脏器]
在一个实施方式中,本发明提供具备上述任一者的肾脏、输尿管以及膀胱的移植用脏器。
发明人等以前发现:即使能够通过再生肾脏的移植而生成尿也因无法排泄生成的尿而引起肾积水并无法长期持续肾功能。发明人等以前还发现:通过移植具备肾脏、输尿管以及膀胱的结构体而不是仅移植肾脏,不仅可以生成尿而且可以排泄生成的尿。
因此,本实施方式的移植用脏器由于具备肾脏、输尿管以及膀胱的缘故,即使在移植到患病动物的情况下,也可以不仅生成尿而且排泄生成的尿,并能够长时间持续肾功能。
本实施方式的移植用脏器可以移植到患病动物的主动脉旁区域、大网膜,也可以移植到例如患病动物的脾脏(脾动脉的周边)。另外,上述的构成移植用脏器的膀胱也可以与患病动物的输尿管连接。由此,形成依次连接有肾脏、第1输尿管、第1膀胱、第2输尿管以及第2膀胱的脏器结构体。在此,第2输尿管和第2膀胱为患病动物原本具有的输尿管及膀胱。
通过形成这样的脏器结构体,会变得进一步容易排泄由构成上述移植用脏器的再生肾脏生成的尿。
在本实施方式的移植用脏器中,上述输尿管(第1输尿管)及上述膀胱(第1膀胱)可以源自上述肾脏的制造方法中的非人动物。由于输尿管、膀胱通常的免疫原性低,因此,即使输尿管、膀胱源自异种动物也不易造成问题。在此,非人动物是,在上述肾脏的制造方法中提供作为锚地(anchorage)的生肾微环境的宿主动物。即,本实施方式的移植用脏器可以由通过上述的制造方法而形成的肾脏、与其连接的输尿管以及与其连接的膀胱构成。
本实施方式的移植用脏器可以在肾脏、输尿管及膀胱连接的状态下从非人动物中摘除而进行保存、流通。在此,可以将移植用脏器冷冻而进行保存、流通。或者,本实施方式的移植用脏器能够以具有本实施方式的移植用脏器的非人动物的形态进行流通。
[肾脏制造用试剂盒]
在一个实施方式中,本发明提供一种肾脏制造用试剂盒,其具备非人动物的后肾、组织特异性地去除上述胚的后肾间充质的药剂以及源自与上述非人动物同种异体或异种的非人动物的肾脏前体细胞。
通过使用本实施方式的试剂盒实施上述的肾脏的制造方法,能够制造肾脏。作为非人动物,如上所述,可举出猪、小鼠、猫等。非人动物的后肾能够以胚的形态提供,也能够以包含胚胎的亲本动物的形态提供。另外,后肾也可以处于与后来作为膀胱的泄殖腔进行连接的状态。此时,后肾形成肾脏及输尿管并且泄殖腔形成膀胱,形成为这些肾脏、输尿管、膀胱被连接的状态。其结果,如上所述,所制造的肾脏不仅可以生成尿而且可以排泄所生成的尿。
在本实施方式的试剂盒中,作为组织特异性地去除后肾间充质的药剂,例如可举出上述的白喉毒素等。此时,作为非人动物,可举出通过cre-loxp系统等而后肾间充质特异性地表达白喉毒素受体的非人动物。
或者,只要能够组织特异性地去除后肾间充质,则也可以使用上述系统以外的各种条件性敲除系统。作为组织特异性地去除后肾间充质的药剂,根据使用的系统,可以使用白喉毒素(idtr系统)、他莫昔芬(cre-ert2系统)、他克莫司(mos-icsp3系统)、多西环素、四环素(tet-on/off系统)、更昔洛韦(源自疱疹病毒的胸苷激酶基因系统)等。
这些条件性敲除系统可以使用基因组编辑技术等而制作,能够在非人动物的生肾微环境中组织特异性地去除细胞。另外,能够通过投放药剂而调节去除细胞的时期。通过使用这些系统,能够时空特异性地控制靶细胞的去除,能够构建适于肾脏再生的存活锚地。
对于组织特异性地去除后肾间充质的药剂的给药方法没有特别限制,只要根据使用的药剂适当选择即可。例如可举出在活体外在器官培养等的培养基中添加;在活体内进行局部给药、腹腔内给药、静脉内注射、口服给药等。
另外,作为源自与非人动物同种异体或异种的非人动物的肾脏前体细胞,例如可举出来自上述的患病动物的肾脏前体细胞等。作为肾脏前体细胞,可举出:由来自患病动物的ips细胞、间充质干细胞(mscs)等分化诱导而得到的肾脏前体细胞,由患病动物中的排斥反应得到抑制的异体的ips细胞、es细胞分化诱导而得到的肾脏前体细胞等。上述异体的ips细胞例如可以从细胞库等获得。
肾脏的制造可以在患病动物的体外进行后移植到患病动物的主动脉旁区域、大网膜。或者,肾脏的制造也可以在患病动物的体内进行。更详细而言,首先,将非人动物的后肾移植到患病动物的主动脉旁区域、大网膜,在患病动物的体内空出后肾的微环境,并移植肾脏前体细胞,从而可以制造肾脏。根据该方法,引入再生肾脏的血管系统成为患病动物的血管并且能够构建功能性肾脏这方面是有利的。
本实施方式的试剂盒可以还具备组织特异性地去除上述后肾的输尿管芽的药剂。由此,能够制造不仅源自后肾间充质的组织而且源自输尿管芽的组织也都源自移植的肾脏前体细胞的肾脏。
作为组织特异性地去除输尿管芽的药剂,例如可举出上述的他莫昔芬与白喉毒素的组合等。此时,作为非人动物,可举出通过cre-loxp系统等而后肾间充质特异性地表达白喉毒素受体,并且通过给药他莫昔芬而输尿管芽特异性地表达白喉毒素受体的非人动物。
或者,也可以使用的上述的各种条件性敲除系统中的任一者而去除输尿管芽。此时,组织特异性地去除输尿管芽的药剂成为对应于采用的系统的适当的药剂。
通过组合上述各种条件性敲除系统,能够在任意时期去除多个对象组织。例如,可以在使用他莫昔芬组织特异性地去除输尿管芽后,使用他克莫司阶段性且组织特异性地去除后肾间充质。其结果,能够使大致(几乎全部)的肾脏组织源自移植的肾脏前体细胞。
[肾脏再生用药物]
在一个实施方式中,本发明提供一种肾脏再生用药物,其具备非人动物的后肾、组织特异性地去除上述后肾的后肾间充质的药剂以及源自非人动物的肾脏前体细胞。
根据本实施方式的药物,可以在患病动物的体内进行上述肾脏的再生。本实施方式的药物以下述方式使用。首先,将非人动物的后肾移植到患病动物的主动脉旁区域、大网膜。作为患病动物,可举出上述患病动物。作为非人动物的后肾,可以使用与上述肾脏制造用试剂盒中的后肾同样的后肾。
接下来,对患病动物给药以组织特异性地去除后肾间充质的药剂。作为药剂,可以使用与上述肾脏制造用试剂盒中的药剂同样的药剂。药剂的给药根据使用的药剂适当通过局部给药、腹腔内给药、静脈内注射、口服给药等进行即可。
接下来,移植来自非人动物的肾脏前体细胞。作为源自非人动物的肾脏前体细胞,例如可举出:由源自患病动物的ips细胞、间充质干细胞(mscs)等分化诱导而得到的肾脏前体细胞,由患病动物中的排斥反应得到抑制的异体的ips细胞、es细胞等多能干细胞进行分化诱导而得到的肾脏前体细胞等。然后,通过使移植的后肾的产生得以进行,在患病动物的体内制造(再生)由移植的肾脏前体细胞构成的肾脏。
基于本实施方式的药物,在引入再生肾脏的血管系统成为患病动物的血管并能够构建功能性肾脏这方面是有利的。
上述的肾脏再生用药物可以还具备组织特异性地去除后肾的输尿管芽的药剂。由此,能够再生不仅源自后肾间充质的组织而且源自输尿管芽的组织也都源自移植的肾脏前体细胞的肾脏。作为组织特异性地去除后肾的输尿管芽的药剂,可以使用与上述肾脏制造用试剂盒中的药剂同样的药剂。
[肾脏的移植方法]
在一个实施方式中,本发明提供一种肾脏的移植方法,其包括:将具备上述的肾脏、输尿管以及膀胱的移植用脏器移植到患病动物的体内的工序(a);以及,从移植起经过规定期间后将上述移植用脏器的膀胱与患病动物的输尿管连接的工序(b)。作为患病动物,可举出与上述的患病动物同样的患病动物。
本实施方式的方法也可以说是肾病的治疗方法。作为移植用脏器,可以使用上述的移植用脏器。
通过将上述工序(a)中移植的移植用脏器放置规定期间,使移植用脏器生长、开始产生尿。规定期间只要是使移植用脏器充分生长并且引起肾积水之前的期间即可。规定期间只要根据患病动物的症状等而适当调整即可,例如可以为1周~10周。
接下来,从移植起经过规定期间后(1周~10周后)实施工序(b)。在工序(b)中,将移植用脏器的膀胱与患病动物的输尿管连接。在此,患病动物的输尿管与患病动物的膀胱连接。
通过将移植用脏器的膀胱与患病动物的膀胱用患病动物的输尿管连接,能够将移植用脏器产生的尿排列到患病动物的膀胱。更详细而言,移植用脏器的肾脏产生的尿通过移植用脏器的输尿管来排泄到移植用脏器的膀胱,接着通过患病动物的输尿管从移植用脏器的膀胱排泄到患病动物的膀胱。
通过本实施方式的方法,能够将移植用脏器的肾脏产生的尿排泄到患病动物的膀胱。
[肾病的治疗方法]
在一个实施方式中,本发明提供一种肾病的治疗方法,其包括:将非人动物的后肾及泄殖腔移植到患病动物的体内的工序(a1);组织特异性地去除上述后肾的后肾间充质的工序(a2);将肾脏前体细胞移植到上述后肾并且其中移植后的上述肾脏前体细胞分化成熟而形成肾脏的一部分、上述泄殖腔分化成熟而形成膀胱且该膀胱通过输尿管连接于上述肾脏的工序(a3);以及,从上述肾脏前体细胞的移植起经过规定期间后将上述膀胱与患病动物的输尿管连接的工序(b)。作为患病动物,可举出上述患病动物。
在本实施方式的方法中,在患病动物的体内进行肾脏的制造(再生)。工序(a2)及工序(a3)可以并行地实施。即,空出微环境的时期和移植肾脏前体细胞的时期可以重叠。例如,可以同时实施去除药剂的添加和肾脏前体细胞的移植。作为肾脏前体细胞,可举出与上述的肾脏再生用药物中的肾脏前体细胞同样的肾脏前体细胞。
上述工序(a3)中的自肾脏前体细胞的移植起经过规定期间时,移植后的肾脏前体细胞形成肾脏、开始产生尿。规定期间只要是肾脏及膀胱充分地生长且引起肾积水之前的期间即可。规定期间只要根据患病动物的症状等适当调整即可,例如可以为2周~4周。
接下来,从移植起经过规定期间后(2周~4周后)实施工序(b)。在工序(b)中,将泄殖腔分化成熟而形成的膀胱与患病动物的输尿管连接。在此,患病动物的输尿管与患病动物的膀胱连接。
本实施方式的治疗方法可以还具备组织特异性地去除上述后肾的输尿管芽的工序(a2’)。由此,不仅后肾间充质而且输尿管芽也能够替换为来源于移植的源自非人动物的肾脏前体细胞的细胞。其结果,能够制造实质上仅由来源于移植的源自非人动物的肾脏前体细胞的细胞所构成的肾脏。
当实施工序(a2’)时,工序(a2)及工序(a2’)可以先实施任一者,但优选在实施一者后至实施另一者前设有4天~7天的期间。在该期间,使移植的源自非人动物的肾脏前体细胞进行产生程序而分化。
工序(a2)和工序(a3)或者工序(a2’)和工序(a3)可以并行来实施。即,空出微环境的时期和移植源自非人动物的肾脏前体细胞的时期可以重叠。例如,可以同时实施去除药剂的添加和源自非人动物的肾脏前体细胞的移植。
例如,可以首先同时实施工序(a2)和工序(a3)并在规定期间后同时实施工序(a2’)和工序(a3)。或者,可以首先同时实施工序(a2’)和工序(a3)并在规定期间后同时实施工序(a2)和工序(a3)。
实施例
接下来示出实验例进一步对本发明详细地进行说明,但本发明并不限定于以下的实验例。
[实验例1]
(小鼠胚胎中的后肾间充质的组织特异性的去除)
使cre重组酶活性依赖性地表达白喉毒素受体(dtr)的idtr小鼠与在six2的启动子的下游导入有cre重组酶基因的six2-cre小鼠进行交配。应予说明,six2是在后肾间充质中特异性地表达的转录因子。
接下来,从胎生第13天的f1小鼠中选择后肾间充质特异性地表达白喉毒素受体的小鼠并摘除后肾。将摘除的后肾依照常规方法进行器官培养,在培养基中添加白喉毒素。其结果,表达了白喉毒素受体的后肾间充质的six2阳性肾脏前体细胞死亡。由此,后肾间充质被组织特异性地去除。
[实验例2]
(肾脏前体细胞的移植)
依照常规方法由后肾制备源自野生型小鼠的肾脏前体细胞,使用细胞解离试剂解离成单一细胞。接下来,将肾脏前体细胞1×105个移植到实验例1中制备的后肾间充质被组织特异性地去除的后肾组织。然后,持续进行后肾组织的器官培养。
[实验例3]
(肾脏组织的免疫染色1)
将实验例2的后肾组织自肾脏前体细胞移植起培养5天后,进行4%多聚甲醛固定而制作组织切片标本。接下来,将作为后肾间充质的标记的six2及作为输尿管芽的标记的细胞角蛋白8分别进行免疫染色。图3是表示免疫染色结果的荧光显微照片。倍率为100倍。在图3中,six2阳性细胞源自移植的肾脏前体细胞。另外,细胞角蛋白8阳性细胞源自宿主动物(实验例1的f1小鼠)。
其结果确认到:以源自实验例1的f1小鼠的输尿管芽作为锚地,实验例2中移植的肾脏前体细胞继承宿主的产生程序,自主地进行复杂的分化诱导而形成后肾间充质。该结果显示:通过上述方法能够将构成后肾间充质的细胞替换为源自移植的肾脏前体细胞的细胞。
[实验例4]
(肾脏组织的免疫染色2)
通过常规方法由后肾制备源自重组有绿色荧光蛋白质(gfp)基因的转基因小鼠(gfptg小鼠)的肾脏前体细胞,使用细胞解离试剂解离成单一细胞。接下来,将肾脏前体细胞1×105个移植到与实验例1同样地制备的后肾间充质被组织特异性地去除的后肾组织。然后,持续进行后肾组织的器官培养。
接下来,从肾脏前体细胞移植起培养7天后,进行4%多聚甲醛固定而制作组织切片标本。接下来,将作为输尿管芽的标记的细胞角蛋白8及作为肾小球的标记的wilmstumorsuppressorprotein-1(wt1)分别进行免疫染色。接下来,用荧光显微镜观察移植细胞所表达的gfp、免疫染色的细胞角蛋白8及wt1的荧光。图4是表示免疫染色结果的荧光显微照片。倍率为200倍。在图4中,gfp阳性细胞及wt1阳性细胞源自移植的肾脏前体细胞。另外,细胞角蛋白8阳性细胞源自宿主动物(实验例1的f1小鼠)。
其结果确认到:移植的源自gfptg小鼠的肾脏前体细胞形成了肾小球、肾小管。该结果显示:通过上述的方法能够由肾脏前体细胞形成功能性肾脏组织。
[实验例5]
(小鼠活体内的肾脏的再生)
将使idtr小鼠与six2-cre小鼠进行交配而得到的在后肾组织中组织特异性地表达白喉毒素受体的胚胎的后肾及泄殖腔移植到野生型小鼠的主动脉旁区域。
接下来,通过给药白喉毒素,去除上述后肾的后肾间充质,移植源自gfptg小鼠的肾脏前体细胞1×105个。接下来,将移植了后肾的小鼠饲养7天。
接下来,将上述小鼠剖腹,观察由移植的后肾形成的肾脏(再生肾脏)。
图5(a)是拍摄再生肾脏所存在的区域而得的照片。倍率为15倍。右上可见野生型小鼠(宿主)的肾脏。在由中央附近的虚线包围的区域存在再生肾脏。
图5(b)是示出在与图5(a)相同的视场中观察gfp的荧光而得的结果的照片。倍率为15倍。其结果观察到:源自移植的肾脏前体细胞的gfp的荧光。该结果显示:在小鼠体内实现了活体内肾脏的再生。
图6(a)是将上述再生肾脏进行4%多聚甲醛固定而制作的组织切片标本的光学显微照片。倍率为400倍。图6(a)中,在箭头所示的部分观察到再生的肾小球。
图6(b)是示出在与图6(a)相同的视场中观察gfp的荧光而得的结果的荧光显微照片。倍率为400倍。图6(b)中,在箭头所示的部分观察到gfp的荧光。该结果显示:再生肾小球源自移植的肾脏前体细胞。
由以上结果表明:在活体内也能够进行肾脏的再生。
[实验例6]
(小鼠胚的后肾间充质和输尿管芽的两者替换)
《输尿管芽的组织特异性的去除》
在本实验例中,使用具有six2-cre-ertg/wthoxb7-cretg/wt的基因型的idtr小鼠。首先,与实验例1同样地从小鼠胚中摘除后肾并进行器官培养。接下来,在培养基中添加白喉毒素而组织特异性地去除输尿管芽。
《肾脏前体细胞的移植》
接下来,与实验例2同样地将源自野生型小鼠的肾脏前体细胞1×105个移植到取出了输尿管芽的小鼠后肾。然后,持续进行5天后肾的器官培养。
《后肾间充质的组织特异性的去除》
接下来,在器官培养的培养基中添加他莫昔芬及白喉毒素。其结果,在作为后肾间充质特异性的标记的six2表达细胞中,cre-er移入核内而引起重组并表达了白喉毒素受体。其结果,后肾间充质的细胞因白喉毒素而死亡。由此,组织特异性地去除后肾间充质。
《肾脏前体细胞的移植》
接下来,与实验例2同样地,将源自野生型小鼠的肾脏前体细胞1×105个再次移植到去除了后肾间充质的小鼠后肾。然后,持续进行3天~5天后肾的器官培养。
《免疫染色》
接下来,将器官培养后的后肾进行4%多聚甲醛固定而制作组织切片标本。接下来,利用将输尿管芽染色的抗钙结合蛋白抗体进行免疫染色并利用荧光显微镜进行观察。
图7(a)是阳性对照的后肾的代表性的照片。在阳性对照中,在输尿管芽的去除阶段未添加白喉毒素,并且也未移植肾脏前体细胞。因此,在阳性对照中,保持了源自原本的输尿管芽的组织。
图7(b)是阴性对照的后肾的代表性的照片。在阴性对照中,在输尿管芽的去除阶段添加白喉毒素,并且未移植肾脏前体细胞。因此,在阴性对照中,输尿管芽被组织特异性地去除,由于未移植肾脏前体细胞的缘故,输尿管芽缺失。
图7(c)是试验组的后肾的代表性的照片。在试验组中,输尿管芽被组织特异性地去除,并且移植了肾脏前体细胞。其结果确认到:通过移植的肾脏前体细胞替换了输尿管芽并且源自输尿管芽的组织的生长。
下述表1是测量阳性对照(n=5)、阴性对照(n=5)及试验组(n=5)的后肾中的输尿管芽的顶端数量而得的结果。
表1
其结果确认到:与阳性对照相比,阴性对照中输尿管芽的顶端数量减少。与此相对,在试验组中,测量到与阳性对照相同程度的输尿管芽的顶端数量。该结果显示:基于本实验例的方法,能够将后肾间充质和输尿管芽这两者用移植的肾脏前体细胞替换。
工业实用性
基于本发明,能够提供由肾脏前体细胞制作肾脏的技术。
- 还没有人留言评论。精彩留言会获得点赞!