一种对非靶生物体具有低毒性的新型天然灭藻剂的制作方法
本发明涉及从稀有放线菌菌株植物栖居拟孢囊菌(kibdelosporangiumphytohabitans)xy-r10的肉汤培养物分离的一种新型天然产物及其防治有害藻类水华的效果。
背景技术:
有害藻类水华(hab)这种威胁我们的环境、经济和健康的全球性问题主要由两种类别的藻类引起(glibert,p.m.等,oceanography,2005,vol.18(2),135-147)。其中一个在海洋中形成赤潮(redtides)的主要由甲藻引起。一些声名狼藉的形成水华的甲藻包括血红哈卡藻(akashiwosanguinea)(wardle,w.j.等,在“国家海洋渔业局国家海洋和大气管理局技术报告”(nationaloceanicandatmosphericadministrationtechnicalreportnationalmarinefisheriesservice)中,1998,143,33-40;bricelj,v.m.等,jshellfishres.1992,11(2),331-347;friedman,c.s.等,jshellfishres.2002,22(2),603;botes,l.等,harmfulalgae.2003,2,247-259;jessup,d.a.等,plosone.2009,4(2),e4550;meyer,s.e.等,硕士论文,圣地亚哥州立大学(sandiegostateuniversity),圣地亚哥(sandiego).2012)、塔玛亚历山大藻(alexandriumtamarense)(anderson,d.等,中国华南的麻痹性贝类中毒(paralyticshellfishpoisoninginsouthernchina),toxicon.1996,34(5),579-590)、海洋原甲藻(prorocentrummicans)(zhou,m.j.等,advanceinearthscience.2006,21(7),673-679)。有毒的塔玛亚历山大藻(a.tamarense)菌株产生麻痹性贝类中毒(psp)毒素,并且在人类中在食用受污染的贝类后引起大量疾病,甚至是死亡。另一方面,血红哈卡藻(akashiwosanguinea)不产生psp毒素,但是已报道它的广泛分布和频繁爆发与其他海洋物种的死亡率相一致,所述物种包括甲壳类(wardle,w.j.等,在“国家海洋渔业局国家海洋和大气管理局技术报告”(nationaloceanicandatmosphericadministrationtechnicalreportnationalmarinefisheriesservice)中,1998,143,33-40)、牡蛎(bricelj,v.m.等,jshellfishres.1992,11(2),331-347;friedman,c.s.等,jshellfishres.2002,22(2),603;botes,l.等,harmfulalgae.2003,2,247-259)、鲍鱼、海胆和海鸟(jessup,d.a.等,plosone.2009,4(2),e4550;meyer,s.e.等,硕士论文,圣地亚哥州立大学(sandiegostateuniversity),圣地亚哥(sandiego).2012)。在淡水体中形成绿潮(greentides)的另一类主要由蓝藻构成。其中,铜绿微囊藻(microcystisaeruginosa)具有极大的经济和生态重要性,因为它产生有毒的微囊藻毒素,这是在许多国家、特别是人口密集地区中通常存在于饮用水中并引起公共卫生问题和环境问题的一类污染物(yen,h.等,在《亚洲饮用水处理、供应和管理》(drinkingwatertreatment,supplyandmanagementinasia)中,2006,6,161-167;vasconcelos,v.m.,pereira,e.waterres.2001,35(5),1354-1357;tencalla,f.g.等,aquat.toxicol.1994,30(3),215-224;jochimsen,e.m.等,n.engl.j.med.1998,338(13),873-878;carmichael,w.w.hum.ecol.riskassess.2001,7(5),1393-1407)。
为了控制hab,已采取物理或化学方法,但是由于它们的高成本、二次污染或不实用性,它们中很少的方法是适用的(anderson,d.m.,回到有害的赤潮(turningbacktheharmfulredtides),nature.1997,38,513-514;lee,y.j.等,harmfulalgae.2008,7,154–162;anderson,d.m.oceancoastmanag.2009,52,342–347)。例如,硫酸铜(cuso4)这种常用的灭藻剂可能通过抑制整个浮游植物群落压迫并杀死水生动物,并随后引起水质劣化(hrudey,s.等,水中的有毒蓝藻,它们的公共卫生结果、监测和管理指南(toxiccyanobacteriainwater.aguidetotheirpublichealthconsequences,monitoringandmanagement),london,routledge.1999;li,f.m.,hu,h.y.applenvironmicrob.2005,71,6545-6553;wang,b.;等,harmfulalgae.2012,13,83-88)。尽管生物方法在控制hab中相对有效(yoshinaga,i.等,mar.ecol.prog.ser.1998,170,33-44;mayali,x.等,j.eukaryot.microbiol.2004,51(2),139-144),但它们的机制通常复杂并且仍然难以解析,对它们的发展造成障碍。已研究了许多海洋细菌属的溶藻效应和在调控hab的生长中的重要作用(mayali,x.等,j.eukaryot.microbiol.2004,51(2),139-144;kodama,m.等,《柏林有害藻类的生态学》(ecologyofharmfulalgaeberlin).2006,243-255;yang,c.y.等,harmfulalgae.2012,20,132-141),但已分离并鉴定的溶藻化合物仍然非常少。溶藻细菌与有害藻类之间的关系相当复杂并且已被研究过(kodama,m.等,《柏林有害藻类的生态学》(ecologyofharmfulalgaeberlin),2006,243-255;amin,s.a.等,microbiol.mol.biol.rev.2012,76,667-684)。
在发现更有效和环境友好的灭藻剂的过程中,最大的注意力必须放在调查活性化合物对无毒性水生生物体的毒性上。小型淡水鱼物种斑马鱼(daniorerio)在生态毒理学中充当重要的模型生物体(hill,a.j.等,toxicol.sci.2005,86,6-19;bopp,s.k.等,环境与可持续发展研究所(instituteforenvironmentandsustainability),联合研究中心(jointresearchcenter),欧盟委员会(europeancommission),欧洲共同体(europeancommunities),卢森堡(luxembourg).2006)。大型水蚤(daphniamagna)是在淡水生态毒理学研究中广泛使用的模型生物体(seda,j.,petrusek,a.j.limnol.2011,70,337)。中国水螅(hydrasinensis)(beach,m.j.;pascoe,d.waterres.1998,32,101-106)、尾草履虫(parameciumcaudatum)(takiguchi,n.等,j.biosci.bioeng.2002,93,416-420)、盐水丰年虫(artemiasalina)(p.k.krishnakumar等,fish.technol.2007,44,85-92;awolola,g.v.等,int.j.biol.chem.sci.2010,4,633-641)被当作用于研究各种不同化合物的短期毒性的良好的代表性生物体。
拟孢囊菌属(kibdelosporangium)是稀有的放线菌属之一,并且众所周知,该属的成员产生具有糖肽、大环内酯和聚酮结构的新型抗生素,其具有抗癌、抗微生物和抗病毒活性(tiwari,k.等,crit.rev.biotechnol.2012,32(2),108-132)。相反,关于次生代谢物的报告很少来自于最近测序的植物栖居拟孢囊菌(k.phytohabitans),其具有超过10mb的相当大的基因组(xing,k.等,antonievanleeuwenhoek.2012,101,433-441;qin,s.等,appl.soilecol.2015,93,47-55)。
2,2’-联吡啶家族的天然产物的成员包括浅蓝霉素(caerulomycins)(funk,a.等,canadianjournalofmicrobiology.1959,5(4),317-321;mcinnes,a.等,canadianjournalofchemistry,1977,55(24),4159-4165)、collismycins(shindo,k.等,j.antibiot.1994,47,1072-1074)、sf2738b-f(gomi,s.等,j.antibiot.1994,47,1385-1394)、pyrisulfoxins(tsuge,n.等,j.antibiot.1999,52,505-507)等,已与各种不同的生物活性例如抗细菌、抗真菌、抗氧化、抗炎和细胞毒性活性相关联(funk,a.等,canadianjournalofmicrobiology.1959,5(4),317-321;mcinnes,a.等,canadianjournalofchemistry,1977,55(24),4159-4165;shindo,k.等,j.antibiot.1994,47,1072-1074;gomi,s.等,j.antibiot.1994,47,1385-1394;tsuge,n.等,j.antibiot.1999,52,505-507;stadler,m.arch.pharm.(weinheim)2001,334,143-147;singlaa.k.等,transplantation2014,97,57-59;martinez,a.等,wo2007017146a3.2007)。同时,浅蓝霉素和collismycins的独特结构和它们的显著生物活性吸引了许多合成努力,并且实现了浅蓝霉素a、b、c、e的全合成(trecourt,f.等,j.org.chem.1996,61,1673-1676;mongin,f.等,j.org.chem.2002,67,3272-3276;bobrov,d.n.;tyvorskii,v.i.tetrahedron2010,66,5432-5434)、collismycinsa和c的全合成(trecourt,f.等,j.org.chem.1998,63,2892-2897)。
技术实现要素:
一方面,本发明提供了一种式i的化合物:
其中x=h、r1、or1或卤素原子;
y是任选取代的c1至c16直链或支链烷基;
r1是h、c1至c6脂族烃或环烷烃或卤素原子。
在本发明的某些实施方式中,所述r1选自由甲基、乙基、正丙基、异丙基、正丁基和异丁基组成的组。
在本发明的某些实施方式中,所述y选自由甲基、乙基、正丙基、异丙基、正丁基和异丁基组成的组。
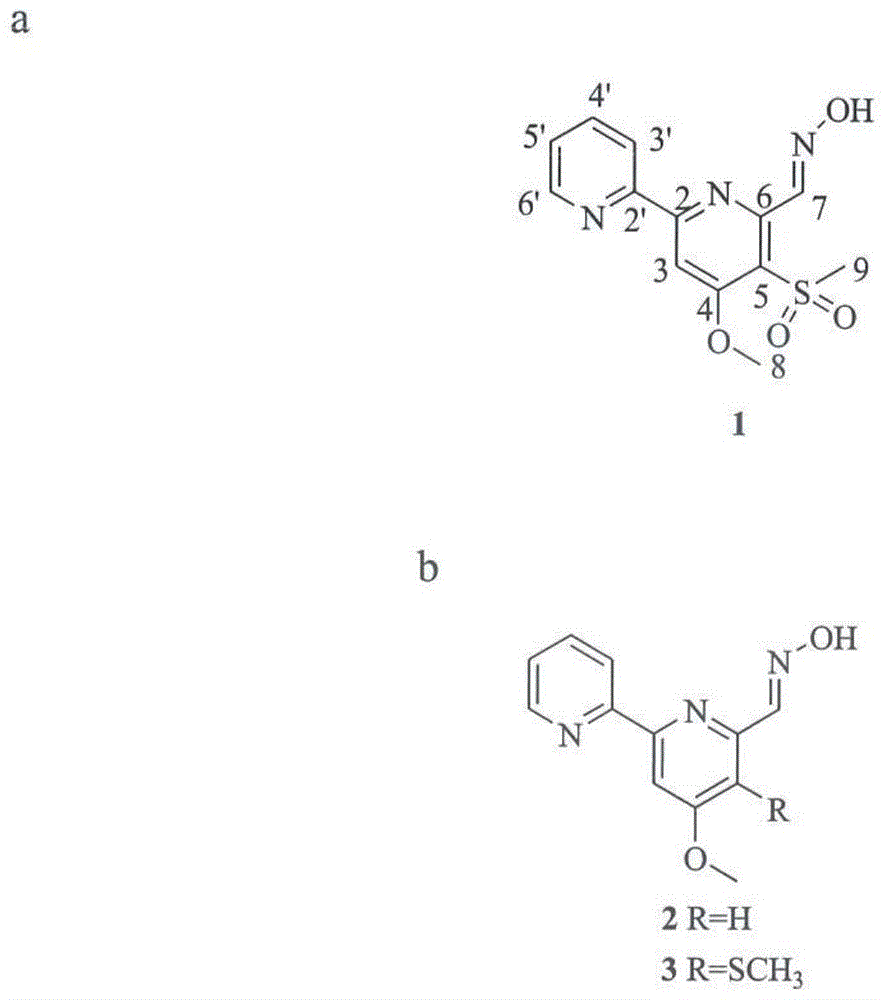
在本发明的特定实施方式中,其中所述化合物是式ii的4-甲氧基-5-甲基磺酰基-2,2'-联吡啶-6-甲醛肟:
另一方面,本发明提供了一种组合物,其包含至少一种前述化合物。
另一方面,本发明提供了一种具有杀真菌和溶藻活性的灭藻剂,其特征在于含有前述化合物或前述组合物。
另一方面,本发明提供了一种灭藻剂,其包含前述化合物或前述组合物及其可接受的盐。
在本发明的某些实施方式中,其中所述组合物还包含可接受的稀释剂、添加剂和/或载体。
另一方面,本发明还提供了前述化合物或前述灭藻剂或前述组合物的用途,其用于裂解真核或原核藻类的细胞。
在本发明的某些实施方式中,其中所述藻类选自由血红哈卡藻(akashiwosanguinea)、塔玛亚历山大藻(alexandriumtamarense)、海洋原甲藻(prorocentrummicans)、海洋卡盾藻(chattonellamarina)、赤潮异弯藻(heterosigmaakashiwo)、铜绿微囊藻(microcystisaeruginosa)组成的组。
另一方面,本发明提供了一种用于控制有害藻类水华的方法,所述方法使用有效浓度的前述化合物或前述灭藻剂或前述组合物,其中所述有效浓度为0.1μg/ml至100μg/ml。
在本发明的某些实施方式中,其中所述有效浓度为1-10μg/ml。
另一方面,本发明还提供了一种铁螯合剂,其包含前述化合物或前述灭藻剂或前述组合物。
另一方面,本发明还提供了前述化合物或前述灭藻剂或前述组合物在治疗与细胞内铁相关的疾病中的用途。
在本发明的某些实施方式中,其中所述疾病选自由免疫抑制性疾病、肿瘤、细菌性疾病组成的组。
另一方面,本发明还提供了一种用于从植物栖居拟孢囊菌(kibdelosporangiumphytohabitans)xy-r10分离可用作溶藻化合物的如前所述权利要求任一项中所定义的化合物的方法,所述方法包括:
[a]将所述细菌植物栖居拟孢囊菌(kibdelosporangiumphytohabitans)xy-r10在培养肉汤中于25-30℃下培养1-10天;
[b]用体积为所述营养肉汤体积的两倍的etoac萃取所述培养肉汤,并干燥合并的etoac层;
[c]使用水/甲醇(7:3,v/v)的洗脱剂,用反相硅胶层析分离所述活性级分;
[d]使用25%acn-h2o的洗脱剂,使用半制备hplc纯化所述活性级分,以获得纯的化合物。
在本发明的某些实施方式中,其中将所述细菌培养6天的时间。
在本发明的某些实施方式中,其中将所述细菌在28℃下培养。
另一方面,本发明还提供了式iii的化合物的用途,其用于裂解真核或原核藻类的细胞,
其中r是h、sch3或so2r2;
r2是任选取代的c1至c16直链或支链烷基。
在本发明的某些实施方式中,所述r2选自由甲基、乙基、正丙基、异丙基、正丁基和异丁基组成的组。
在某些实施方式中,其中所述藻类选自由血红哈卡藻(akashiwosanguinea)、塔玛亚历山大藻(alexandriumtamarense)、海洋原甲藻(prorocentrummicans)、海洋卡盾藻(chattonellamarina)、赤潮异弯藻(heterosigmaakashiwo)、铜绿微囊藻(microcystisaeruginosa)组成的组。
重要性
本发明提供了来自于植物栖居拟孢囊菌(k.phytohabitans)xy-r10的属于2,2’-联吡啶基家族的天然产物的新的溶藻化合物。在6种有害藻类物种上评估了拟孢囊菌霉素a(kibdelomycina)的溶藻效率。还检查了拟孢囊菌霉素a对5种不同水生生物体物种的毒性。拟孢囊菌霉素a是良好的灭藻剂。更重要的是,它对非靶生物体显示出非常低的毒性。拟孢囊菌霉素a是代替cuso4的一种潜在的环境友好的灭藻剂。
附图说明
图1示出化合物拟孢囊菌霉素a(kibdelomycina)及其类似物浅蓝霉素a(caerulomycina)、collismysina的化学结构。
图2示出拟孢囊菌霉素a的关键hmbc(keyhmbc)相关性。
图3示出拟孢囊菌霉素a的1hnmr(600mhz,d6-dmso)波谱。
图4示出拟孢囊菌霉素的13cnmr(600mhz,d6-dmso)波谱。
图5示出拟孢囊菌霉素a的13cnmr波谱(包括dept90、dept135)。
图6示出拟孢囊菌霉素a的1h–1hcosy(d6-dmso)波谱。
图7示出拟孢囊菌霉素a的hsqc(d6-dmso)波谱。
图8示出拟孢囊菌霉素a的hmbc(d6-dmso)波谱。
图9示出拟孢囊菌霉素a的hresims波谱。
图10示出拟孢囊菌霉素a的x-射线晶体结构。
图11示出拟孢囊菌霉素a对血红哈卡藻(a.sanguinea)藻类细胞的溶藻效应。光学显微镜图像(×10、×40放大倍数;a、d)显示出培养基中的完整藻类细胞,而图像(×10、×40放大倍数;b、c)显示出固定化的变形的细胞,并且图像(×10、×40放大倍数;e,f)显示出裂解的藻类细胞。标尺条在a、b、c中表示100μm,在d、e、f中表示50μm。
图12示出拟孢囊菌霉素a对铜绿微囊藻(m.aeruginosa)的时间依赖性的溶藻效率。向实验组添加2微升拟孢囊菌霉素a(10μg/μl),添加cuso4(2.5μg/μl)作为阳性对照。所述值是三个实验的平均值±sd。当*p<0.05;**p<0.01时,报告显著性差异。
图13示出feso4对在36h和48h结束时保护藻类细胞免于裂解的影响。在将藻类培养物用拟孢囊菌霉素a处理不同时间段后向它们添加feso4。
图14示出(a)向溶解在甲醇中的纯拟孢囊菌霉素a添加feso4水溶液,以引起紫色形成;(b)从ms分析推演的所述紫色化合物的分子量表明两分子的拟孢囊菌霉素螯合一分子的fe(ii);(c)以1:2的摩尔比将feso4添加到拟孢囊菌霉素a导致在hplc分析中产生单一峰,进一步表明所述络合物在两分子的拟孢囊菌霉素a与一分子的fe(ii)之间形成。
图15示出将藻类培养物用拟孢囊菌霉素a处理,并且在所述藻类细胞中可以检测到对应于所述fe(ii)-拟孢囊菌霉素a络合物的同一个峰。
图16示出拟孢囊菌霉素a对铜绿假单胞菌(pseudomonasaeruginosa)的抗细菌活性。
表1示出在本研究中使用的藻类的名单。
表2示出拟孢囊菌霉素a的1nmr数据(600mhz,δ以ppm为单位,j以hz为单位)和13cnmr数据(150mhz,δ以ppm为单位)。
表3示出拟孢囊菌霉素a的溶藻/抗藻活性。
表4示出拟孢囊菌霉素a、浅蓝霉素a、collismysina和cuso4对血红哈卡藻(akashiwosanguinea)的溶藻效果和对斑马鱼(daniorerio)胚胎和大型水蚤(daphniamagna)的毒性。
发明详述
下文将参考实施例对本发明进行进一步说明。应该理解,这些实施例仅用于描述本发明,但不限制本发明的范围。在下面的实施例中描述的没有具体条件的实验方法通常在常规条件下进行,并且使用的没有具体描述的材料购自常见化学试剂公司。
在详细描述本发明之前,应该理解本发明不限于特定生物系统或细胞类型。还应该理解,本文中使用的术语仅仅是出于描述特定实施方式的目的,并且不是限制性的。当在本说明书和随附的权利要求书中使用时,没有具体数目的指称包括复数指称物,除非内容明确说明不是如此。
在本公开中使用的术语“拟孢囊菌霉素a”是指从菌株植物栖居拟孢囊菌(kibdelosporangiumphytohabitans)xy-r10分离的化合物;拟孢囊菌霉素a的结构是4-甲氧基-5-甲基磺酰基-2,2’-联吡啶-6-甲醛肟;并且拟孢囊菌霉素a可以化学合成或从天然材料例如但不限于植物栖居拟孢囊菌(kibdelosporangiumphytohabitans)分离。
实施例
实施例1:拟孢囊菌霉素a的分离
菌株植物栖居拟孢囊菌(kibdelosporangiumphytohabitans)xy-r10从红树林植物秋茄树(kandeliacandel(l.)druce)的根部沉积物(3–5cm)分离,所述沉积物从中国香港的米埔内后海湾拉姆萨尔湿地(maipoinnerdeepbayramsarsite)(e114.05°,n22.49°)收集。将所述细菌在多个250ml锥形瓶中,在28℃和200rpm搅拌下培养6天,每个锥形瓶含有80mlsgtpy培养基(5g淀粉,5g葡萄糖,1g胰蛋白胨,1g蛋白胨,1g酵母提取物,17g海盐,溶解在1l蒸馏水中)。将所述培养肉汤(10l)用两倍体积的etoac萃取三次。将合并的etoac层通过蒸发器干燥以得到etoac萃取物(1.5g),使用水/甲醇(7:3,v/v)的洗脱剂对其进行反相硅胶层析,以得到5个级分。然后使用半制备hplc(phenomenex,5μm,10×250mm,4ml/min)将活性级分进一步纯化,用25%acn-h2o洗脱,以获得纯的化合物(5mg)。
浅蓝霉素a(1mg)、collismysina(1mg)分别从商业化供应商abcam(shanghai,china)和alfachemistry(newyork,unitedstates)获得。
实施例2:来自于植物栖居拟孢囊菌(k.phytohabitans)xy-r10的溶藻化合物的鉴定
尽管已经分离到大量具有溶藻效应的细菌,但活性化合物由于广泛的各种不同特征,它们的鉴定仍具有挑战性(skerratt,j.h.等,mar.ecol.prog.ser.2002,244,1-15)。因此,仅仅纯化并鉴定到几种细菌灭藻剂,包括抗生素样物质(nakashima,t.等,appl.microbiol.biotechnol.2006,73,684-690)、生物表面活性剂(ahn,c.y.等,biotechnol.lett.2003,25,1137-1142;wang,x.等,harmfulalgae2005,4,433-443)、肽类(jeongs.y.等,tetrahedronlett.200344,8005-8007)、蛋白酶(lee,s.o.等,biosci.biotechnol.biochem.2002,66,1366-1369)和其他蛋白质(mitsutani,a.等,phycologia.2001,40,286-291;wang,b.等,harmfulalgae2012,13,83–88)。
在本研究中,将血红哈卡藻(akashiwosanguinea)(表1)用guillard’sf/2培养基(guillard,r.r.l.等,dinoflagellates.1984,391-442)或bg-11培养基,在恒定温度(20±2℃或25℃)和光照(2000lx,12-h光/12-h暗周期)条件下培养;对得到的级分和活性化合物的溶藻活性进行研究,并通过在24孔板中在血红哈卡藻(akashiwosanguinea)上的溶藻试验来确认。我们发现,植物栖居拟孢囊菌(kibdelosporangiumphytohabitans)xy-r10的粗提物能够杀死不同藻类物种的细胞。在生物测定指导的分级后,获得了具有强溶藻活性的拟孢囊菌霉素a。
表1本研究中使用的藻类的名单
此外,通过广泛的nmr和高分辨率质谱数据确立了所述活性化合物的结构,并通过单晶体x射线衍射分析确认。1h-和13c-nmr波谱数据在brukerdrx-600mhz上,在d6-dmso中使用tms作为内标获得。质谱数据通过与microtof-esi-ms系统(brukerdaltonicsgmbh,bremen,germany)联合的uplc(watersacquity,usa)进行分析。单晶体数据在xcalibur,atlas,gemini超衍射仪上测量。
具体来说,为了鉴定拟孢囊菌霉素a的化学结构,进行了高分辨率质谱和高场nmr波谱分析。拟孢囊菌霉素a的1hnmr波谱显示出在δh3.41、4.16处的两个单峰甲基信号,δh7.57、8.02、8.20、8.42、8.77、8.84处的5个双峰烯烃或芳烃信号,δh11.73处的一个可交换的质子信号。13cnmr和dept数据显示拟孢囊菌霉素a含有两个甲基(δc44.72、57.25)、11个烯烃或芳烃碳原子(表2)。这些光谱学特点表明拟孢囊菌霉素a属于2,2’-联吡啶家族,并且最类似于作为抗生素分离到的pyrisulfoxina(tsuge,n.等,j.antibiot.1999,52,505-507)。这两种化合物之间在nmr波谱中的仅有显著差异是c-5的化学位移(在1中的δc124.5相比于pyrisulfoxina中的δc127.7)和c-9的化学位移(1中的δc44.72相比于pyrisulfoxina中的δc39.4)。通过hresims数据从m/z308.0668处的正离子[m+h]+推演,确定拟孢囊菌霉素a的分子量为307.5143,而pyrisulfoxina的分子量为291.2546。拟孢囊菌霉素a与pyrisulfoxina相比分子量大16道尔顿、c-5的低场位移和c-9的高场位移,表明在拟孢囊菌霉素a中磺酰基代替了pyrisulfoxina中的亚砜基团。hmbc分析将甲基质子h-9(δh3.41)连接到芳香环的季碳c-5(δc124.5)(图1、2),因此将甲基磺酰基分配在c-5位置处。拟孢囊菌霉素a的平面构型也通过x射线单晶衍射数据的分析得以确认(图3–10)。这些数据合在一起,表明从植物栖居拟孢囊菌(k.phytohabitans)xy-r10分离到的溶藻化合物是4-甲氧基-5-甲基磺酰基-2,2’-联吡啶-6-甲醛肟,这种新的化合物被我们命名为拟孢囊菌霉素a。
表2.拟孢囊菌霉素a的1nmr数据(600mhz,δinppm,jinhz)和13cnmr数据(150mhz,δinppm)
admso-d6.bcdcl3.b数据由tsuge等报道。43
实施例3:拟孢囊菌霉素a的溶藻/抗藻活性
评估了拟孢囊菌霉素a针对包括血红哈卡藻(akashiwosanguinea)、塔玛亚历山大藻(alexandriumtamarense)、海洋原甲藻(prorocentrummicans)、古老卡盾藻(chattonellaantiqua)、赤潮异弯藻(heterosigmaakashiwo)的5种真核藻类物种的溶藻活性以及它针对声名狼藉的蓝藻水华形成物种铜绿微囊藻(microcystisaeruginosa)的抗藻活性(这些藻类物种使用guillard’sf/2培养基(guillard,r.r.l.等,dinoflagellates.1984,391-442)或bg-11培养基,在恒定温度(20±2℃或25℃)和光照(2000lx,12-h光/12-h暗周期)条件下培养,表1)。
将所有测试化合物溶解在dmso中,以分别制造50、25、10、5、2.5、1.25、0.625、0.312、0.156mg/ml的储用溶液。然后将1μl所述测试溶液添加到24孔板(nunc,usa)的孔中的1ml藻类培养物。使用cuso4作为阳性对照,并使用dmso作为阴性对照。
具体来说,对于溶藻活性生物测定法来说,测试了三种甲藻(血红哈卡藻(a.sanguinea)、塔玛亚历山大藻(a.tamarense)、海洋原甲藻(p.micans))和两种绿胞藻(古老卡盾藻(c.antiqua)、赤潮异弯藻(h.akashiwo))。将所述藻类菌株培养到指数期后期并添加到测试溶液。然后在0h、6h、12h、24h、36h、48h在光学显微镜下检查血红哈卡藻(a.sanguinea)细胞的形态,而其他的藻类物种在4天的孵育期间每天检查。拟孢囊菌霉素a在所有5种藻类物种上进行测试,而cearulomycina和collismysina由于量有限而仅在血红哈卡藻(a.sanguinea)上进行测试。
对于抗藻生物测定法来说,将铜绿微囊藻(microcystisaeruginosa)培养到细胞密度达到约5×107cfu/ml。在0、2、4、6、8、10天按照chen等人描述的方法(chen,y.w.等,jlakesci.2006,18,550-552)确定所述蓝藻培养物的叶绿素a(chl-a)含量。抗藻效率使用下述公式计算:
抗藻效率(%)=(1–ct/cc)×100%,
其中cc和ct分别是用抗藻化合物处理的对照组和样品的chl-a含量。
在本研究中,所有溶藻和抗藻生物测定建立三份平行样,并使用不同批次的藻类培养物进行至少三次。
结果显示,拟孢囊菌霉素a能够裂解所有处理过的血红哈卡藻(a.sanguinea)、塔玛亚历山大藻(a.tamarense)、海洋原甲藻(p.micans)、古老卡盾藻(c.antiqua)、赤潮异弯藻(h.akashiwo)细胞,最低抑制浓度(mic值)分别为1.25、10、5、10、5μg/ml(表3)。因此,当以质量浓度比较mic值时,拟孢囊菌霉素a与广泛使用的灭藻剂cuso4相比有效性略低。此外,如果以摩尔浓度来比较mic,则所述两种灭藻剂具有几乎相同的有效性(表3)。在48小时内,拟孢囊菌霉素a已经能够裂解所有处理过的血红哈卡藻(a.sanguinea)和海洋原甲藻(p.micans)细胞。对于塔玛亚历山大藻(a.tamarense)、赤潮异弯藻(h.akashiwo)和海洋卡盾藻(c.marina)来说,需要3至4天来裂解所有的藻类细胞。此外,拟孢囊菌霉素a对铜绿微囊藻(m.aeruginosa)显示出抗藻活性,mic值为20μg/ml(表3),并且在孵育的第5天抑制效果变得明显。
表3.拟孢囊菌霉素a的溶藻/抗藻活性
这里的mic值是指与对照相比测试藻类(除了铜绿微囊藻(m.aeruginosa)之外)群体的100%的细胞被裂解时的最低浓度,而对于铜绿微囊藻(m.aeruginosa)来说mic值是指对铜绿微囊藻(m.aeruginosa)的溶藻效率高达95%时的最低浓度。
在本研究中,选择血红哈卡藻(akashiwosanguinea)用于更深入研究是因为它的形态容易观察。当在不利培养条件下或暴露于外源物质胁迫时,血红哈卡藻(a.sanguinea)的细胞由于缺少刚性细胞结构而常常经历严重的形态变化。在用拟孢囊菌霉素a(1.25μg/ml)处理24h内,血红哈卡藻(a.sanguinea)细胞减缓它们的泳动速度。在处理36h后,大多数血红哈卡藻(a.sanguinea)细胞变得颜色更深、固定化和轻微变形(图11;图像b、e)。最终所有细胞在48h内裂解(图11;图像c、f)。由于大多数血红哈卡藻(a.sanguinea)细胞在前36小时内内不表现出明显变化,但在随后的12小时左右内突然一起爆裂,因此计算拟孢囊菌霉素a的时间依赖性溶藻效率是不现实的。
在最近几十年中,蓝藻铜绿微囊藻(microcystisaeruginosa)在研究中吸引了越来越多的注意,这是因为它们通过在全球淡水中产生毒素而对公共健康造成威胁(reynolds,c.s.等,biol.res.1975,50,437-481)。在我们的研究中,拟孢囊菌霉素a对铜绿微囊藻(m.aeruginosa)显示出抗藻活性,mic值为20μg/ml。当将铜绿微囊藻(m.aeruginosa)的藻类培养物用拟孢囊菌霉素a(20μg/ml)处理4天时,针对铜绿微囊藻(m.aeruginosa)的溶藻效率已达到48.48±1.07%(图12)。在第10天,所述溶藻效率高达96.54±0.27%(图12),意味着铜绿微囊藻(m.aeruginosa)的生长几乎完全被抑制。使用略微更高的浓度,拟孢囊菌霉素a在抑制铜绿微囊藻(m.aeruginosa)的生长中可以与cuso4同样有效地工作。
实施例4:拟孢囊菌霉素a对非靶生物体的低毒性
将斑马鱼(daniorerio)胚胎(受精后2天)、大型水蚤(daphniamagna)的幼体、新孵化的盐水丰年虫(artemiasalina)、中国水螅(hydrasinensis)和尾草履虫(paramoeciumcaudatum)的成体用作试验物种。斑马鱼科研团体采用鱼浸液(fishwater)(ph7.2–7.6,电导率500ms,硝酸盐<5ppm),在14h光/10h暗的光照周期中在28.5℃下饲养。训练有素的雌性产下新鲜的受精卵。胚胎可以在鱼浸液(fishwater)中养育,并按照kimmel等人的描述(kimmel,c.b.等,dev.dyn.1995,203,253-310)确定阶段。为了最小化不想要的胚胎死亡和副作用,选择处于胚盾期(shieldstage)(~2dpf)的胚胎,然后使用解剖显微镜和倒置复合显微镜观察胚胎。使用6–8个健康胚胎(~2dpf)并将其装入u形底96孔板的每个孔中(200μl鱼浸液(fishwater)),添加拟孢囊菌霉素a、cearulomycina、collismysina和cuso4以分别获得0.31、0.65、1.25、2.5、5、25、75、125μg/ml的浓度。鱼浸液(fishwater)中1%的dmso(v/v)充当阴性对照。
根据oecd指南202,大型水蚤(d.magna)在含有人造elendtm4培养基的玻璃容器中,在16:8的光-暗周期下,在20±1℃下培养(oecd,2004,oecd指南202,用于化学品测试的oecd指南,水蚤属物种的急性固定试验(oecdguidelinesfortestingofchemicals.daphniasp.,acuteimmobilizationtest),paris.antkowiak,w.z.;gessner,w.p.tetrahedronlett.1979,21,1931-1934)。所述生物体每周用蛋白核小球藻(chlorellapyrenoidsa)喂养三次并更新培养基。将10只健康大型水蚤(d.magna)(<24h)置于24孔板中,用一张柔软的吸水纸轻柔吸取过量的水,并立即添加1ml含有测试化合物的大型水蚤(d.magna)培养基。
中国水螅(hydrasinensis)在竖直保持在装有水螅培养基“m”的15升玻璃水族箱中的架子中,在22–24℃下培养(litchfield,j.d.等,j.pharm.exp.ther.1949,96,399–408),并将所述试验生物体用少量麦粒喂养。尾草履虫(p.caudatum)在小麦培养基中,在22–24℃下在暗处培养。盐水丰年虫(a.salina)按照已发表的流程培养(meyer,b.n.等,plantamedica1982,45,31-34;solis,p.n.等,plantamedica.1993,59,250-252)。将几滴含有尾草履虫(p.caudatum)、中国水螅(h.sinensis)、盐水丰年虫(a.salina)的所需个体的水置于24孔板中。用一张柔软的吸水纸轻柔吸取过量的水,并立即分别添加1ml尾草履虫(p.caudatum)、中国水螅(h.sinensis)、盐水丰年虫(a.salina)培养基。拟孢囊菌霉素a以25μg/ml、50μg/ml、75μg/ml、100μg/ml、125μg/ml的浓度测试。添加dmso作为溶剂对照。
所有上述毒性试验在每个实验中使用三份平行样,并使用不同批次的生物体重复至少三次。数据使用spss15.0软件进行分析,并表示成三份平行样的平均值±标准偏差(sd)。使用所述平均值作图,并且所有误差条指示三份平行样的sd。在所有试验中处理与对照之间的统计比较通过单因素方差分析(one-wayanova)然后通过tukey’s检验来确定。p<0.05被认为是统计学显著的。
拟孢囊菌霉素a属于2,2’-联吡啶家族的天然产物,其已报道与各种不同的重要生物活性相关(funk,a.等,canadianjournalofmicrobiology.1959,5(4),317-321;mcinnes,a.等,canadianjournalofchemistry,1977,55(24),4159-4165;shindo,k.等,j.antibiot.1994,47,1072-1074;gomi,s.等,j.antibiot.1994,47,1385-1394;tsuge,n.等,j.antibiot.1999,52,505-507;stadler,m.等,arch.pharm.(weinheim)2001,334,143-147;singlaa.k.等,transplantation2014,97,57-59;martinez,a.等,wo2007017146a3.2007)。两种结构相似的化合物浅蓝霉素a和collismysina表现出惊人多的生物活性,包括抗细菌和抗真菌(funk,a.等,canadianjournalofmicrobiology.1959,5(4),317-321)、抗变形虫(chatterjeed.k.等,zparasitenkd1984,70,569-573;kaurs.等,britishjournalofpharmacology2015,172,2286-2299)、抗增殖(kawatani,m.等,molcancerther2013,12,a243)、免疫抑制(singlaa.k.等,transplantation2014,97,57-59)和神经保护活性(sialerac.等,chem.lett.2013,23,5707-5709)。由于它们高度相似的结构,因此比较浅蓝霉素a和collismysina与拟孢囊菌霉素a对有害藻类的效应是有趣的。
拟孢囊菌霉素a、浅蓝霉素a和collismysina裂解血红哈卡藻(a.sanguinea)的100%的藻类细胞,mic值分别为1.25μg/ml、1.25μg/ml和0.31μg/ml(表4)。对于裂解血红哈卡藻(a.sanguinea)来说,collismysina甚至比cuso4更为有效。拟孢囊菌霉素a、浅蓝霉素a和collismysina的溶藻活性可能主要是由2,2’-联吡啶-6-甲醛肟的骨架造成的。
表4.拟孢囊菌霉素a、浅蓝霉素a、collismysina和cuso4对血红哈卡藻(akashiwosanguinea)的溶藻效果以及对斑马鱼(daniorerio)胚胎和大型水蚤(daphniamagna)的毒性
值是三个实验的平均值±sd。
在发现更有效且环境友好的灭藻剂的过程中,最大的注意力不应排他性地集中于对靶生物体的活性。所述化合物的毒性与它们的活性同样重要。为了检查所述灭藻剂的毒性,我们从非靶生物体选择了5种代表性水生物种,包括斑马鱼(daniorerio)胚胎、中国水螅(hydrasinensis)、尾草履虫(paramoeciumcaudatum)、大型水蚤(daphniamagna)和盐水丰年虫(artemiasalina)。令人吃惊的是,拟孢囊菌霉素a在125μg/ml的浓度下不杀死中国水螅(hydrasinensis)、尾草履虫(paramoeciumcaudatum)或盐水丰年虫(artemiasalina)。此外,拟孢囊菌霉素a对斑马鱼(daniorerio)胚胎的lc50值也大于125μg/ml。捕食藻类作为主要食物来源的大型水蚤(daphniamagna)对拟孢囊菌霉素a的耐受性仅仅略低一些(lc50=47.24±5.4μg/ml)。所述lc与mic值之间的巨大差异表明拟孢囊菌霉素a可能对非靶生物体具有低毒性。
相比之下,浅蓝霉素a和collismysina对斑马鱼(daniorerio)胚胎的毒性比拟孢囊菌霉素a高至少150倍,lc50值分别为0.873±0.05μg/ml和0.76±0.15μg/ml。并且它们对大型水蚤(daphniamagna)的毒性也比拟孢囊菌霉素a高至少20倍,lc50值分别为2.05±0.10μg/ml和1.60±0.12μg/ml。如果添加足够量的浅蓝霉素a和collismysina以在真实环境中达到溶藻效果,则其他水生生物体的安全性将会受损。这些数据清楚地证实,尽管浅蓝霉素a和collismysina在抑制藻类生长中比拟孢囊菌霉素a更加高效一点,但它们的高毒性仍排除了它们作为环境友好的灭藻剂的可能性。这三种结构相似的化合物的毒性的显著差异的一种可能的解释,可能是它们转运到藻类之外的生物体的细胞内空间的不同能力。拟孢囊菌霉素a中甲基磺酰基的存在可能是显著降低它的毒性的主要原因。在藻类之外的水生生物体中,拟孢囊菌霉素a可能不能通过生物膜以充当铁螯合剂,而浅蓝霉素a和collismysina可以到达细胞内并严重干扰涉及铁分子的某些必不可少的生物化学功能。然而隐含的准确机制仍有待进一步研究。从同样的观点来看,目前全世界广泛采用的灭藻剂cuso4不是理想的灭藻剂,这是因为它分别针对靶和非靶生物体的mic和lc值之间的差异小(表4)。
实施例5:拟孢囊菌霉素a是fe(ii)螯合剂
已报道,cearulomycina通过剥夺细胞内铁来发挥其免疫抑制效应(singlaa.k.等,transplantation2014,97,57-59),并且collismycina可以充当铁螯合剂来抑制肿瘤细胞生长(kawatani,m.等,molcancerther2013,12,a243)。由于光合作用和氮同化两者在关键酶中都需要贴,因此水华中快速增殖的藻类细胞必定对铁具有高需求。因此,可以推测拟孢囊菌霉素a、浅蓝霉素a和collismysina通过劫持细胞内铁来杀死藻类细胞。
为了证明我们的假设,在将藻类培养物用拟孢囊菌霉素a处理不同时间长度后向它们添加feso4。图13显示,如果藻类细胞仅在前3h用所述化合物处理,则在36h和48h结束时feso4可以完全保护所述藻类细胞免于裂解。相反,在用所述化合物处理36h后,没有藻类细胞仍然存活。如果在添加feso4之前将所述藻类细胞用所述化合物处理6h和12h,则在48h孵育结束时它们的存活率仅仅降低一点。此外,向溶解在甲醇中的纯拟孢囊菌霉素a添加feso4水溶液,将立即引起紫色形成(图14a)。从ms分析推演的所述紫色化合物的分子量表明两分子的拟孢囊菌霉素螯合一分子的fe(ii)(图14b)。此外,以1:2的摩尔比率将feso4添加到拟孢囊菌霉素a在hplc分析中产生单一峰,进一步支持了所述络合物在两分子的拟孢囊菌霉素a与一分子的fe(ii)之间形成(图14c)。此外,我们分析了用拟孢囊菌霉素a处理的藻类培养物,并且可以在藻类细胞内检测到对应于fe(ii)-拟孢囊菌霉素a络合物的相同的峰(图15)。所有证据合在一起表明拟孢囊菌霉素a通过充当fe(ii)螯合剂来抑制藻类生长。
由于铁螯合剂通常具有抗细菌效应,因此我们试验了拟孢囊菌霉素a的抗细菌效应,并且确实发现它能抑制声名狼藉的机会病原体铜绿假单胞菌(pseudomonasaeruginosa)的生长,mic值约为100μg/ml左右(图16)。
总的来说,我们发现了一种新的灭藻剂拟孢囊菌霉素a,其作用方式可能在藻类中充当选择性铁螯合剂。初步数据表明它对非靶水生生物体具有非常低的毒性,使它成为环境友好的灭藻剂的有希望的候选物。
- 还没有人留言评论。精彩留言会获得点赞!