一种PDGFRβ靶向性肿瘤坏死因子相关凋亡诱导配体变异体及其制备方法和用途与流程
本发明涉及生物技术药物领域,具体涉及pdgfrβ靶向性肿瘤促凋亡诱导配体变异体及其制备方法和用途。
背景技术:
肿瘤坏死因子凋亡相关诱导配体(trail)属于肿瘤坏死因子(tnf)家族成员,其c末端114-281位氨基酸可以被蛋白酶水解为可溶性的胞外段,形成同源三聚体,具有受体结合能力。trail的膜受体包括死亡受体(dr4和dr5)和诱骗受体(dcr1和dcr2)。死亡受体dr4和dr5分子中含有死亡结构域,与trail结合后能向胞内传递死亡信号,诱导细胞凋亡。相反,诱骗受体dcr1分子不含死亡结构域,dcr2的死亡结构域不完整,二者能与trail结合,但不能传递死亡信号,因而不诱导细胞凋亡。肿瘤细胞和一些异常活化细胞均高表达死亡受体,trail能促进这些细胞凋亡。正常细胞往往高表达诱骗受体而免于trail的伤害。因此,trail可能被发展为理想的治疗性药物。
研究发现,肿瘤细胞表面高表达死亡受体,因而trail体外条件下显示了超强的肿瘤细胞杀伤活性,被认为是潜在的抗肿瘤药物。但是,trail的体内抗肿瘤效果与其体外对肿瘤细胞的杀伤活性不匹配。可能的原因包括:1)trail分子量小,体内半衰期短。解决的办法包括利用聚乙二醇修饰或血清白蛋白融合/结合等方法延长半衰期。2)由于诱骗受体广泛表达于正常组织,trail进入体内后被正常组织大量消耗,到达肿瘤部位量少,因而抗肿瘤效果不佳。改善的方法主要是利用导向分子递送trail,使其富集于肿瘤部位,进而提高抗肿瘤效果。已有研究以肿瘤细胞或肿瘤新生血管内皮细胞为靶细胞进行trail的递送。周细胞是重要的血管壁细胞,其分布于血管内皮细胞后侧,对血管的形成及稳定有重要的调控作用。但是,尚无利用周细胞作为靶细胞向瘤内提送trail的研究。
肝星状细胞活化是肝纤维化的始动环节。抑制或清除活化的肝星状细胞能延缓肝纤维化过程。研究发现,肝星状细胞活化过程中会高表达死亡受体dr4和dr5。因此,trail能够诱导活化的肝星状细胞凋亡而显示抗纤维化作用。已有研究用peg修饰的长效化trail缓解了大鼠肝纤维化进程。但是,由于trail对肝星状细胞缺乏靶向性,治疗效果不佳。
技术实现要素:
为了解决上述问题,本发明提供了一种pdgfrβ靶向性肿瘤促凋亡诱导配体变异体及其制备方法和用途。
本发明肿瘤坏死因子相关凋亡诱导配体变异体,它是肿瘤坏死因子相关凋亡诱导配体与zpdgfrβ的融合蛋白,zpdgfrβ通过连接子连接在肿瘤坏死因子相关凋亡诱导配体的n末端或者c末端。
其中,所述zpdgfrβ的氨基酸序列如seqidno:1所示。优选地,所述zpdgfrβ由seqidno:2所示的核苷酸序列编码。
其中,所述肿瘤坏死因子相关凋亡诱导配体的氨基酸序列如seqidno:3所示。优选地,所述肿瘤坏死因子相关凋亡诱导配体由seqidno:4所示的核苷酸序列编码。
其中,所述连接子由2~20个氨基酸组成。
其中,所述连接子是(g4s)3连接子,其氨基酸序列如seqidno:5所示。优选地,所述连接子由seqidno:6所示的核苷酸序列编码。
其中,所述变异体的氨基酸序列如seqidno:7所示。优选地,所述变异体由seqidno:8所示的核苷酸序列编码。
本发明还提供了一种核苷酸序列,它包括肿瘤坏死因子相关凋亡诱导配体的编码序列与zpdgfrβ的编码序列,二者之间通过连接子的编码序列连接。
其中,所述zpdgfrβ的编码序列如seqidno:2所示。
其中,所述肿瘤坏死因子相关凋亡诱导配体的编码序列如seqidno:4所示。
其中,所述连接子是(g4s)3连接子,其核苷酸序列如seqidno:6所示。
其中,其如seqidno:8所示。
本发明还提供了前述核苷酸序列的重组载体或重组菌。
本发明还提供了一种制备前述肿瘤坏死因子相关凋亡诱导配体变异体的方法,其特征在于:它是以前述核苷酸序列为目标片段,采用基因工程的方法制备得到的。
本发明还提供了前述肿瘤坏死因子相关凋亡诱导配体变异体在制备治疗细胞增生性疾病的药物中的用途。
其中,所述治疗细胞增生性疾病的药物是治疗肿瘤或自身免疫性疾病的药物。所述肿瘤为结直肠腺癌。
本发明还提供了一种抗肿瘤药物,它是以前述肿瘤坏死因子相关凋亡诱导配体变异体为活性成分,加上药学上可接受的辅料制备而成的制剂。
本发明还提供了前述肿瘤坏死因子相关凋亡诱导配体变异体在制备治疗器官纤维化疾病的药物中的用途。
其中,所述药物是治疗肝脏纤维化的药物。
本发明还提供了一种治疗肝脏纤维化的药物,它是以前述肿瘤坏死因子相关凋亡诱导配体变异体为活性成分,加上药学上可接受的辅料制备而成的制剂。
本发明利用能特异性识别pdgfrβ亲和体zpdgfrβ为导向分子,将其与人源trail(htrail)融合,构建了融合蛋白z-htrail,并发现其体内外抗肿瘤和抗肝纤维化作用比htrail明显增强,临床应用前景良好。
根据本发明的上述内容,按照本发明相关领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
附图说明
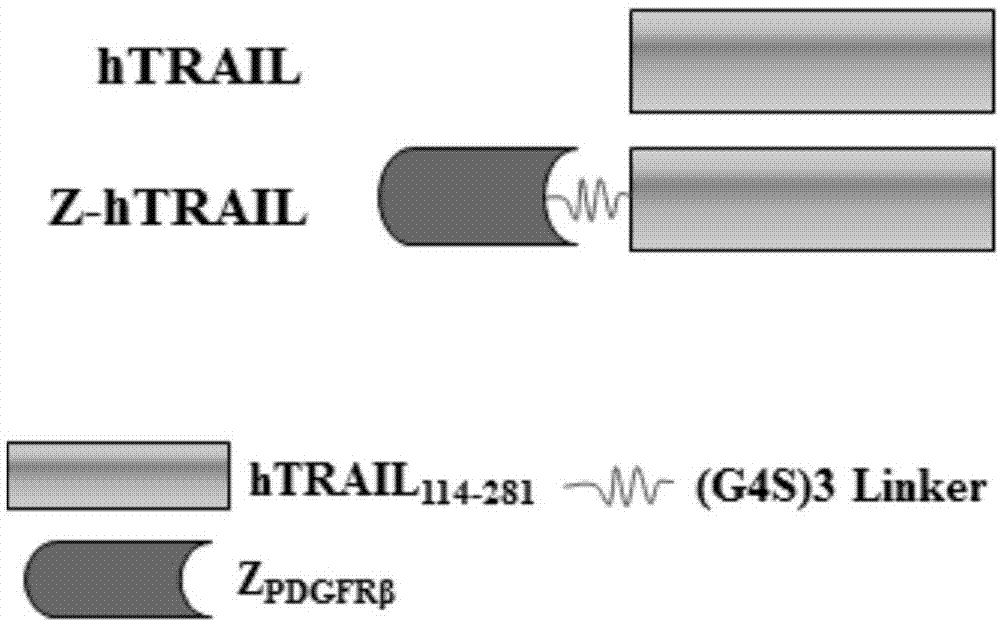
图1变异体z-htrail的分子设计;
图2z-htrail和htrail的sds-page电泳;
图3z-htrail和htrail凝胶过滤层析;
图4z-htrail和htrail与周细胞结合后对肿瘤细胞的杀伤;
图5z-htrail和htrail的肿瘤靶向性比较;a:瘤内富集的活体观察b:组织分布;
图6z-htrail和htrail对ls174t肿瘤的体内治疗效果;
图7z-htrail和htrail对colo205肿瘤的体内治疗效果;
图8z-htrail和htrail对hct116肿瘤的体内治疗效果;
图9z-htrail和htrail对肝星状细胞的结合(a)和杀伤(b);
图10z-htrail和htrail治疗后小鼠肝功能指标;
图11z-htrail和htrail治疗后小鼠肝组织天狼星红染色;
图12z-htrail和htrail治疗后小鼠肝组织纤维化评分(a)和羟脯氨酸含量(b);
图13对照蛋白zf-trail和trail的体外细胞杀伤(a)和体内抗肿瘤效果(b,c)比较。
具体实施方式
以下通过实施例形式的具体实施方式,对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实施例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
实施例1z-htrail变异体的分子设计及克隆构建
1、z-htrail变异体的分子设计
zpdgfrβ由58个氨基酸组成(表1)。htrail为人trail胞外段114-281的氨基酸组成的片段(见表1)。通过(g4s)3linker将zpdgfrβ连接在htrail的n末端,构建融合蛋白zpdgfrβ-(g4s)3-htrail(简称z-htrail)(图1)。
2、z-trail变异体表达载体的构建
根据zpdgfrβ的氨基酸序列,设计其初始编码基因,再经核酸分析软件优化后,由南京金斯瑞公司进行基因序列的合成。合成时在序列的两端分别添加ecori/bamhi限制性内切酶酶切位点(ecori:gaattc/bamhiggatcc)。通过双酶切和连接作用,将zpdgfrβ的基因序列装载到pqe30-htrail(装载后的z-htrail片段的核苷酸序列如表1所示)的表达质粒上。连接产物转化top10大肠杆菌感受态后,获得重组质粒。通过对重组质粒进行测序后发现zpdgfrβ片段成功装载到表达质粒载体上。将表达质粒pqe30-z-htrail转入m15大肠杆菌感受态中,成功构建表达菌株m15-pqe30-z-htrail。
表1本发明涉及的融合蛋白氨基酸和核苷酸序列
实施例2z-trail变异体的蛋白表达及分离纯化
挑取表达菌株m15-pqe30-z-htrail(实施例1制备)的单克隆接种到双抗性(含氨苄西林100μg/ml,卡那霉素30μg/ml)lb液体培养基中,37℃振荡培养,当菌液浓度a600至0.8左右时,加入0.05mm异丙基-β-d-硫代半乳糖苷(isopropylβ-d-1-thiogalactopyranoside,iptg),26℃振荡诱导培养14-16小时。离心(7000g,10min)收集菌体,用lysisbuffer(50mm磷酸盐缓冲液,ph8.0;300mmnacl;20mm咪唑;10mmβ-巯基乙醇)重悬,加入苯甲基磺酰氟(phenylmethanesulfonylfluoride,pmsf)至终浓度为1mm,冰浴条件下超声破菌(功率300w,工作10s,间隔30s,共40min)。破菌完成后,离心(4℃,25000g,10min),重复4次,收集破菌上清。获得的上清与ni-nta树脂凝胶(购自qiagen)按照适量体积比(如v/v=50:1)混合,4℃振荡结合2h。将结合后的凝胶填料灌入层析柱,待蛋白样品过柱完成后,用washbuffer(50mm磷酸盐缓冲液,ph8.0;300mmnacl;40mm咪唑;10mmβ-巯基乙醇)洗涤凝胶柱30倍柱体积以上。然后用elutionbuffer(50mm磷酸盐缓冲液,ph7.6;300mmnacl;300mm咪唑;10mmβ-巯基乙醇)洗脱收集蛋白样品,sds-page电泳显示为单一条带(图2)。凝胶过滤层析显示为单峰(图3)。
结果表明我们获得了纯的变异体蛋白z-htrail,采用磷酸盐缓冲液pbs(10mmna2hpo4,137mmnacl,2.68mmkcl,2mmkh2po4,ph7.4)透析过夜备用。
实施例3z-trail变异体结合周细胞后杀伤周围的肿瘤细胞
利用pdgfrβ特异性抗体与周细胞孵育后,再用流式细胞术分析。结果如图4a所示,周细胞表面高表达pdgfrβ。将周细胞与fam标记的z-htrail(取实施例2制备z-htrail,fam标记)或htrail共孵育,然后用流式细胞术分析,发现z-htrail能与周细胞结合,且这种结合能被pdgfrβ特异性抗体封闭,说明融合zpdgfrβ可让htrail与周细胞结合。为检测与z-htrail与周细胞结合后是否还具有肿瘤细胞杀伤功能,先将周细胞与z-htrail(实施例2制备)(1μm)预孵育1h,pbs洗涤后再与肿瘤细胞(ls174t和hct116,1.5*104;colo205,2*104)共培养过夜,cck-8检测细胞存活率。
结果如图4b所示,肿瘤细胞的存活率随与z-htrail孵育的周细胞数目的增多而降低。与htrail孵育的周细胞共培养后,肿瘤细胞的存活率与周细胞数目多少无明显关系。这说明本发明z-htrail能与周细胞结合并杀伤肿瘤细胞。而htrail不能与周细胞结合,因此无法杀伤肿瘤细胞。
实施例4z-trail变异体的肿瘤靶向性分析
本发明z-htrail(实施例2制备)的ph调至8.0后与荧光染料cf750按照摩尔比1:8进行混合标记。室温反应1h后,用pbs缓冲液透析排除游离的cf750荧光染料。标记后的蛋白通过尾静脉注射入ls174t荷瘤裸鼠模型中,利用小动物活体成像系统spectrallagoandlagoximagingsystems探究z-htrail的肿瘤靶向性。
结果显示,给药后0.5h,z-htrail组的肿瘤部位有较强的荧光信号,其强度明显高于htrail组,两组荷瘤裸鼠肾脏部位均能检测到很强的荧光信号。在随后的时间点(1,2,4,6h),z-htrail组肿瘤部位依然检测到较强的荧光信号,而htrail组荧光信号迅速减弱直至消失(图5a)。6h后处死荷瘤鼠,剥离其主要脏器及肿瘤组织后进行扫描,结果显示,z-htrail组肿瘤组织中可检测到较强的荧光信号,其信号强度约为htrail组的3倍(图5b)。
这些结果表明,本发明z-htrail比htrail能够在肿瘤部位富集,显示出更好的肿瘤靶向性。
实施例5z-trail变异体的体内抗肿瘤效果
利用ls174t,hct116以及colo205荷瘤裸鼠模型进一步评价本发明z-htrail(实施例2制备)的体内抗肿瘤效果。
在ls174t肿瘤(结直肠腺癌)模型中,10mg/kg的htrail以及相同摩尔数的变异体z-htrail通过尾静脉给药三次,第16天时处死裸鼠时,pbs组瘤体平均大小为850±150mm3,htrail组为390±80mm3,而z-htrail组则最小,仅有102±75mm3;瘤体平均重量为pbs组0.652±0.2g,htrail组0.302±0.608g,z-htrail组则仅有0.091±0.039g(图6)。
在colo205肿瘤(结直肠腺癌)模型中,5mg/kg的htrail以及相同摩尔数的变异体z-htrail通过尾静脉给药两次,第20天时处死裸鼠时,pbs组瘤体平均大小为670±140mm3,htrail组为400±80mm3,而z-htrail组则最小,仅有70±60mm3;瘤体平均重量为pbs组0.266±0.114g,htrail组0.23±0.053g,z-htrail组则仅有0.038±0.035g(图7)。
在hct116肿瘤(结直肠腺癌)模型中,10mg/kg的htrail以及相同摩尔数的变异体z-htrail通过尾静脉给药四次,第19天时处死裸鼠时,pbs组瘤体平均大小为782±106.53mm3,htrail组为368.4±104.6mm3,而z-htrail组则最小,仅有205.1±74.6mm3;瘤体平均重量为pbs组0.491±0.032g,htrail组0.319±0.06g,z-htrail组则仅有0.11±0.036g(图8)。
这些结果表明,本发明z-htrail比htrail具有更强的体内抗肿瘤能力,说明融合zpdgfrβ能够显著增强htrail的体内抗肿瘤效果,尤其是对结直肠癌的疗效明确。
实施例6z-trail变异体的抗肝纤维化作用
活化的肝星状细胞是促进肝纤维化的关键细胞。活化星状细胞高表达pdgfrβ和死亡受体,因此,与htrail相比,z-htrail可能在活化星状细胞的结合和杀伤方面更具优势。将fam标记的蛋白与活化星状细胞孵育,然后通过流式检测发现,结合到活化星状细胞的z-htrail(实施例2制备)比htrail多。用不同浓度蛋白处理活化星状细胞,第二天再用cck8测定残余细胞数量。以pbs处理的细胞存活率为100%,计算蛋白的细胞杀伤率。显示,10和20nm的z-htrail作用后的细胞存活率分别为24.6±4.5%和14.2±1.2%,而相同剂量htrail作用后的细胞存活率分别为81.4±4.8%和59.7±0.25%(图9)。这说明z-htrail比htrail体外条件下杀伤活化星状细胞的能力更强。
为了比较z-htrail和htrail的体内抗纤维化效果,我们建立了小鼠肝纤维化模型。将四氯化碳溶于橄榄油中,浓度为25%。对四周龄雌性c57小鼠腹腔注射溶解好的四氯化碳,注射频率为每周两次,注射剂量为首次2.5ml/kg,之后均为5ml/kg。建模4周时,将实验鼠分为模型组和治疗组。模型组注射pbs,治疗组分别给予z-htrail或htrail蛋白(10mg/kg),每周两次。治疗期间,三组小鼠维持四氯化碳注射。在第六周收取小鼠血清,检测血清谷草转氨酶、谷丙转氨酶和总胆红素。肝脏组织切片,用天狼星红染色显示胶原纤维并对纤维化程度按ishak标准进行评分,同时用试剂盒检测肝脏中羟脯氨酸,反映胶原纤维含量。
图10显示,模型组肝功能指标(血清谷草转氨酶、谷丙转氨酶及总胆红素)水平与正常组有显著差异,说明肝细胞损伤严重,建模成功。
htrail治疗组三种血清指标水平与模型组无明显差异。但z-htrail治疗组三种血清指标均低于htrail治疗组。天狼星红染色显示z-htrail治疗组肝内胶原纤维沉积少于htrail治疗组(图11),纤维化评分和羟脯氨酸含量均低于htrail治疗组(图12)。
以上结果说明,本发明z-htrail相对于htrail对小鼠肝脏纤维化具有更好的治疗效果。
对比例1融合其它亲合体对trail抗肿瘤效果的影响
为了说明融合zpdgfrβ对增强trail活性的重要性,我们选择了与zpdgfrβ序列相似,但识别特异性不同的亲合体zfcrn为对照。将zfcrn与htrail连接,构建融合蛋白zf-htrail。进一步与htrail比较,确定融合对照亲合体是否同样可以增强htrail的抗肿瘤效果。
1、zf-htrail变异体的分子设计和制备
按照实施例1,设计将zfcrn连接在htrailn末端,构建融合蛋白zf-htrail。按照实施例2,用与z-htrail相同的条件,用大肠杆菌表达系统制备融合蛋白zf-htrail。
2、zf-htrail变异体的对肿瘤细胞的体外杀伤及体内抗肿瘤作用
为了测试zf-htrail对肿瘤细胞的杀伤活性,先将ls174t细胞(1×104个)接种于96孔板,贴壁过夜后加入不同浓度蛋白。作用过夜后,再加cck-8测定残存细胞的数量。对照孔中加入相同体积的pbs。以pbs处理组的细胞存活率为100%,计算zf-htrail对肿瘤细胞的杀伤效率。与htrail进行比较,判断融合zfcrn是否影响了htrail对肿瘤细胞的杀伤活性。结果如图13a所示,zf-htrail对ls174t细胞的杀伤效率与htrail相似,说明融合zfcrn对htrail的活性没有显著影响。
按照实施例5描述的方法,比较zf-htrail与trail对ls174t肿瘤的治疗效果。在裸鼠皮下接种ls174细胞后7天,尾静脉注射zf-htrail、htrail或pbs。然后每天测量肿瘤体积,绘制生长曲线。观察结束,处死小鼠,剥取瘤体称重。如图13b所示,zf-htrail和htrail处理组肿瘤生长速度慢于pbs处理组,瘤体重量也轻于pbs组。但是,zf-htrail和htrail处理的肿瘤无论是生长速度还是瘤重都没有明显差异,说明融合亲合体zfcrn并没有显著增强htrail的体内抗肿瘤效果。
表2对照蛋白氨基酸和核苷酸序列
综上,本发明利用能特异性识别pdgfrβ亲和体zpdgfrβ为导向分子,将其与人源trail(htrail)融合构建的融合蛋白z-htrail,其体内外抗肿瘤和抗肝纤维化作用比htrail明显增强,而采用其他识别因子,如,zfcrn构建的融合蛋白则效果不佳。
- 还没有人留言评论。精彩留言会获得点赞!