髓系肿瘤的高通量测序检测的制作方法
本发明属于血液病分子诊断学领域,具体涉及髓系肿瘤的高通量测序检测。
背景技术:
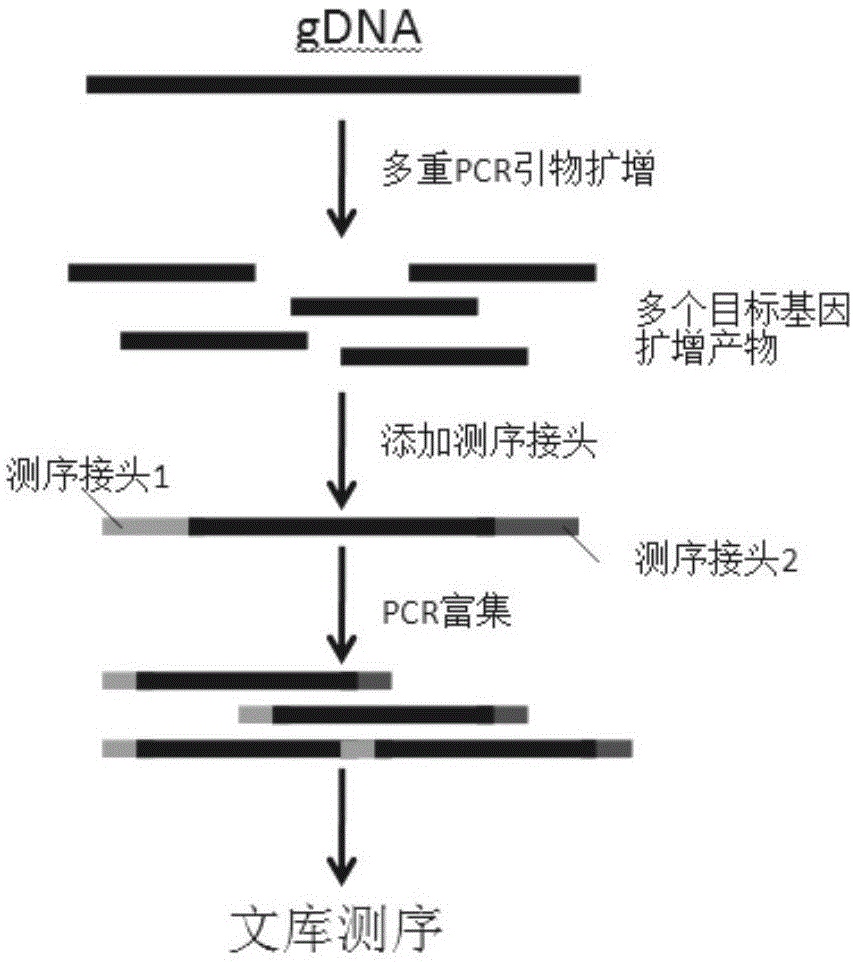
:髓系肿瘤是一类起源于造血干/祖细胞克隆性造血系统的疾病,按照世界卫生组织(worldhealthorganization,who)最新的分类,髓系肿瘤包括了急性髓系白血病(acutemyeloidleukemia,aml)、骨髓增生性肿瘤(myeloproliferativeneoplasms,mpn)、骨髓增生异常综合征(myelodysplasticsyndromes,mds)、mpn伴mds、髓系/淋系肿瘤伴嗜酸性粒细胞增多和pdgfrα、pdgfrβ、fgfr1异常或伴pcm1-jak2基因融合等等多种类型。各类型中又可分为多种亚型,大部分亚型与基因突变有关。如mpn下的亚型中,慢性粒细胞白血病(chronicmyeloidleukemia,cml)被定义为具有费城染色体(ph染色体)的一类疾病,即该亚型均具有bcr-abl1融合基因;而真性红细胞增多症(pv)、原发性血小板增多症(et)和原发性骨髓纤维化(pmf)则具有共同的热点突变——jak2基因的v617f突变这一特征。除了大部分亚型具有其基因突变特点以外,一些亚型由于具有明确的预后或者用药相关的基因突变也被who划分出来,如髓系/淋系肿瘤伴嗜酸性粒细胞增多和pdgfrα、pdgfrβ、fgfr1异常或伴pcm1-jak2融合基因这一分类中,pdgfrα、pdgfrβ均与酪氨酸激酶抑制剂直接相关,而fgfr1突变则涉及到预后不良、pcm1-jak2融合基因对jak2抑制剂敏感等等。进一步的,在aml分型中,类似runx1-runx1t1、cbfβ-myh11、pml-rarα均被who单独划分为一类亚型。整体而言,髓系肿瘤分型复杂,其分型既涉及到了形态学,又涉及到了免疫及分子等层面,而近年来,特别是分子学层面的分型被逐步提升到相当重要的一个地位。2016年who分型指南中,参考的是目前主流的micm分型方法,micm分型法包括了形态病理学(morphology)、免疫表型(immunology)、细胞遗传学(cytogenetics)、分子遗传学(moleculargenetics)4个层面,并且近年来,who分型越来越倾向于分子遗传学层面的分型。而髓系肿瘤以分子学异常种类多样(包括插入/缺失突变、点突变及融合基因等等)、突变涉及面广泛(包括疾病的分型、预后及用药等等)导致其检测及靶向治疗较一般癌种更为精细。髓系肿瘤经典的分子学异常包括了bcr-abl1、pdgfrα/β、runx1-runx1t1、cbfβ-myh11、mllt3-kmt2a等融合基因以及flt3、c-kit、npm1、jak2、cebpa、notch1、kmt2a、abl1、tp53、mpl、calr等等基因突变。这些分子遗传学异常一部分决定了髓系肿瘤的分型,如mpn中如发现bcr-abl1融合基因突变则可分型为慢性粒细胞白血病这一亚型;而在40%的慢性粒单核细胞白血病(chronicmyelomonocyticleukemia,cmml)中可发现有asxl1突变,46%cmml可发现有srsf2基因突变等等。进一步在用药方面,根据不同分子学异常,对于髓系肿瘤有一系列靶向药物可以选择,包括伊马替尼、芦可替尼、利妥昔单抗等等,其在使用这些靶药前,需要对患者进行基因检测从而进行基因异常类型鉴定,达到靶向治疗这一目的。在我国髓系肿瘤中,仅白血病发病率就约有2.76/10万人,而其中90%左右发生在成人中,同时在儿童中也是最常见的恶性肿瘤之一。在欧美等发达国家中,髓系肿瘤的5年生存率已经达到80%以上,而国内患者的平均5年生存率明显低于欧美,提示我国在髓系肿瘤治疗方面与发达国家相比仍有一定的差距。髓系疾病的诊疗发展到现在,已经被分为诸多亚型,并涉及到了的庞大基因网络,其基因突变也涵盖了几乎所有的突变种类。这也导致了血液病的精准医疗需要更为全面而精细的检测手段来辅助临床诊疗的开展。当前,由于方法的局限性,融合基因的检测大多数还停留在rna水平。只有少数断点位置固定的融合基因可以基于dna进行准确的检测。而传统的点突变及插入、缺失突变,则可以通过多种分子学检测方法进行检测,如聚合酶链式反应法(polymerasechainreaction,pcr)所衍生的技术,如荧光探针定量法(taqman-realtime-pcr法)、桑格毛细管电泳法(sanger法)等等方法。这些方法目前广泛应用在各大机构当中,并已经非常成熟。但随着基因突变检验需求的日益增加以及检测位点的日益增多,目前的方法已经不能很好的满足各大科研机构以及临床机构的需求。所以基于二代测序的技术在近年来被迅速应用到血液疾病乃至各大肿瘤的检测应用当中。二代测序准确率可以达到99.9%,相比传统的一代测序以及定量pcr,该准确率有着数量级的提升,并且通过最新的分子标签(moleculerbarcode)技术,二代测序的检测下限可以达到0.1%。基于二代测序技术,目前已经有一些血液病相关的技术及产品,但由于血液肿瘤领域研究进展快,相关基因及位点更新也较快,导致目前主要相关产品及服务涉及到下述2个问题:(1)整体检测内容相对滞后,相关检测基因跟不上当前血液肿瘤领域目前的发展速度,并且产品未见更新;(2)检测内容较少,涵盖基因突变位点基本只涉及到分型或者预后当中的一种或几种疾病,临床指导性不强。这些不仅限制了临床相关血液肿瘤诊疗的发展,还限制了二代测序技术在血液科疾病临床应用的普及。亟待髓系综合大检测基因基因的组合及引物(以下简称panel)出现。技术实现要素:本发明的一方面提供髓系肿瘤相关基因组合在构建检测髓系肿瘤的高通量测序文库中的应用,所述基因组合包含表1所示的全部80个基因。表180个基因及转录本列表在一些实施方案中,所述基因组合用于制备能够特异性检测所述基因组合的引物组合或探针组合,所述能够特异性检测所述基因组合的引物组合或探针组合用于构建检测髓系肿瘤的高通量测序文库。因此,本发明的另一方面提供能够特异性检测所述基因组合的引物组合或探针组合在构建检测髓系肿瘤的高通量测序文库中的应用。在一些实施方案中,所述引物组合包括表2所示的全部引物(即seqidno:1-seqidno:1786)。表2893对引物序列本发明的另一方面提供引物组合,所述引物组合包括表2所示的全部引物(即seqidno:1-seqidno:1786)。本发明的另一方面提供构建检测髓系肿瘤的高通量测序文库的方法,包括如下步骤:(1)以目标dna为模板,使用能够特异性检测表1所示全部基因组合的引物组合进行多重pcr反应;(2)向步骤(1)的反应产物添加ngs测序标签,并在两端连接测序所需的接头,获得带测序接头的目标dna片段混合物,即高通量测序文库。在一些实施方案中,所述引物组合包括表2所示的全部引物(即seqidno:1-seqidno:1786)。在一些实施方案中,多重pcr反应的程序是:99保持2分钟;19个循环,每个循环9915秒,602分钟;10保持。在一些实施方案中,所述目标dna是从骨髓或外周血中提取的基因组dna。本发明的另一方面提供检测髓系肿瘤的高通量测序文库,所述文库是通过上述方法获得的文库。本发明的另一方面提供能够特异性检测表1所述基因组合的引物组合或探针组合在制备髓系肿瘤诊断试剂中的应用。本发明的另一方面提供上述基因组合、上述引物组合或上述高通量测序文库在制备髓系肿瘤诊断试剂中的应用。本发明的另一方面提供能够特异性检测表1所述基因组合的引物组合或探针组合在制备髓系肿瘤诊断试剂盒中的应用。本发明的另一方面提供上述基因组合、上述引物组合或上述高通量测序文库在制备髓系肿瘤诊断试剂盒中的应用。本发明的另一方面提供髓系肿瘤诊断试剂盒,其包含上述引物组合。本发明中所述的基因组合所包括的基因的名称及其ncbigenbank编号在表1中列出,即本发明中所述的基因组合所包括的基因具有表1所示的基因名称以及表1所示的ncbigenbank编号。本发明的有益效果在于:(1)低起始量的同时能检测广泛位点:本发明采用多重pcr法构建文库,其优点在于,相比于传统的taqman-qpcr法检测突变,多重pcr法能一次性检测几百、上千个片段及相关位点,具有传统pcr及ddpcr无法达到的通量。此外,多重pcr法构建dna文库,仅需要最低1ng的dna起始量,并且非常快捷(总计仅需要7小时建库时间)。与杂交捕获法构建ngsdna文库相比,该方法大大降低了dna的量的需求。在进行现有的snv、indel检测中该方法尤其适用。(2)灵敏度高:采用中等深度测序(1000×),结合falsefilter生信算法,可以精确地检测到1%以上的真实突变。有效地过滤掉测序本身产生的错误突变。(3)实用性强:髓系相关肿瘤患者检测均可,本发明所设计的panel,明收集目前髓系肿瘤相关的最新、最全的基因列表,补充了现有国内panel的不足,更新到目前国际上最新研究成果相关的基因;极大的增强了本panel在国内临床及科研领域的适用性。此外,通过自主数据库,本发明在panel中添加了国人特有的基因位点,能更好的检测出国人相关髓系血液肿瘤突变情况。本发明的panel所选基因均具备明确的临床意义,旨在降低无效数据及模糊测序结果对疾病诊疗造成的干扰,同时节约整体实验成本。(4)本发明的893对引物混合在一个体系中,引物与引物之间、引物与非扩增区域之间的干扰几乎不存在,保证了每个特异性目的片段均能正常扩增。附图说明图1是两步法多重pcr原理示意图:gdna经过由多对pcr引物组合而成的panel的扩增后,得到含有大量目的dna碱基片段的初始文库,通过将测序仪测序所需识别的其实接头序列1、2连接到个片段两端后,进一步通过pcr进行目标dna文库的富集,最终形成最后的文库后,即可进行测序。图2是实施例2的测序下机数据,其中:ampliconmeancoverage表示该样本的平均覆盖度,uniformityofconverage(pct>0.2*mean)表示该样本的0.2x均一性,coveragebyampliconregion表示893对扩增子每一个扩增子本次测序的深度(横坐标为扩增子对应的引物编号,纵坐标表示测序深度,即覆盖度)。具体实施方式本发明依据最新的数据库及文献,并通过收取大量实际国人样本测序数据进行分析,得到一套囊括髓系所有肿瘤相关基因的panel,基于此,本发明的目的在于解决目前国内尚缺乏针对国人的全面髓系肿瘤panel的问题,提供所述panel在构建检测髓系肿瘤的高通量测序文库中的应用,以及其在制备髓系肿瘤诊断试剂盒中的应用。通过本发明,可以检测包括aml、mds、mpn等等髓系肿瘤在内所有的髓系肿瘤相关基因突变,并通过该检测对髓系肿瘤进行精准诊断分型、靶向治疗、预后分层及耐药监测等,为全面、准确获取髓系肿瘤患者分子遗传学背景提供有力的帮助。髓系肿瘤是起源于造血干/祖细胞克隆性造血系统的疾病,包括但不限于急性髓系白血病(acutemyeloidleukemia,aml)、骨髓增生性肿瘤(myeloproliferativeneoplasms,mpn)、骨髓增生异常综合征(myelodysplasticsyndromes,mds)、mpn伴mds、髓系/淋系肿瘤伴嗜酸性粒细胞增等,以及它们的各种亚型。本发明中,“panel”也被称为“基因组合”。本发明的panel包括但不限于表1所示的80个肿瘤相关基因。包含表1所示的80个肿瘤相关基因以及其他肿瘤相关基因的panel也在本发明的保护范围之内。在一些实施方案中,本发明的panel由表1所示的80个肿瘤相关基因组成。本发明的panel用于构建检测髓系肿瘤的高通量测序文库时,可以设计能够特异性检测panel中所包含的基因的外显子区域或热点区域的引物或探针,利用这些引物或探针构建检测髓系肿瘤的高通量测序文库。利用本发明的panel,可以设计针对所述panel所含基因的特异性引物,对从样本中提取的dna进行多重pcr,在pcr产物上添加ngs测序标签和接头,扩增后获得高通量测序文库。所述特异性引物可以是能够特异性扩增所述panel所含基因的外显子区域或热点区域的引物。还可以利用本发明的panel设计针对所述panel的特异性探针,将从样本中提取的dna片段化,进行末端修复,并在每个dna片段上添加ngs测序标签和接头,扩增dna片段,富集与所述探针杂交的dna片段,获得高通量测序文库。所述特异性探针可以是能够特异性杂交所述panel所含基因的外显子区域或热点区域的探针。本发明还涉及构建检测髓系肿瘤的高通量测序文库的方法,包括如下步骤:(1)以目标dna为模板,使用能够特异性检测所述基因组合的引物组合进行多重pcr反应;(2)向步骤(1)的反应产物添加ngs测序标签,并在两端连接测序所需的接头,获得带测序接头的目标dna片段混合物,即高通量测序文库。在一些实施方案中,多重pcr反应的程序是:99保持2分钟;19个循环,每个循环9915秒,602分钟;10保持。目标dna可以是基因组dna(gdna),优选是从骨髓或外周血等样本中提取的基因组dna。基因组dna的提取方法是本领域技术人员熟知的,可以采用商购的试剂盒,优选qiagen相应的dna提取试剂盒。并可以结合nanodrop、qubit等仪器进行提取后dna浓度及质量监控。目标dna还可以是从血液、血浆或血清中提取的细胞游离dna(cellfreedna,cfdna)。cfdna的提取方法是本领域技术人员熟知的,亦可以使用商购的试剂盒。目标dna可以是来自多种样本的dna,例如来自多种样本的基因组dna,如来自不同受试者的基因组dna。当目标dna为来自多种样本的dna时,为每种样本的dna片段添加不同的ngs测序标签,以区分不同的样本。本发明中所述的“多重pcr”是指在一个反应体系中将模板dna与多对引物混合,使用相同的反应条件进行pcr扩增反应。本领域技术人员可以利用本领域已知的方法设计多重pcr反应所使用的引物。多重pcr是本领域技术人员熟知技术,主要的反应组分包括模板dna、dna聚合酶、dntp、缓冲液等。多重pcr反应所使用的设备以及反应参数是本领域技术人员所知晓的或能够容易地确定的。本申请的实施例也提供了示例性的多重pcr方法。多重pcr所使用的试剂,优选采用商业试剂,如lifetech公司的《ampliseqlibrarykit》。本发明中的“ngs测序标签”即index,可以采用illumina通用index序列。本发明中“接头”,可以采用illumina对应接头序列。上述文库构建方法获得的最终文库结构可以是tcgtcggcagcgtcagatgtgtataagagacag-xxxxxxx-aaaaaaaaaa-ctgtctcttatacacatctccgagcccacgagac,其中,第一部分以及最后一部分碱基序列为illumina测序所需的两端接头碱基序列,“xxxxxxxx”为不同序列的index,用以区分不同样本的dna数据,“aaaaaaa”为pcr产物,其长度在150bp左右。接头序列包括并不仅限于上述序列,可以为其它illumina对应接头序列。接头序列可以是illumina的测序通用接头,也可以是lifetech的测序接头,如采用lifetech的接头,后续测序及分析流程与lifetech相应的流程一致。本发明提供特别优选的引物组合以及该引物组合在构建检测髓系肿瘤的高通量测序文库中的应用。优选地,所述引物组合包括但不限于893对引物(见表2,即seqidno:1-seqidno:1786),这些引物能够扩增上述80个基因的外显子区域或热点区域,每对引物对应的产物长度均在100~200bp之间。在一些实施方案中,本发明的引物组合由表2所示的893对引物(即seqidno:1-seqidno:1786)组成。表2所述的893对引物(即seqidno:1-seqidno:1786)混合在一个体系中,引物与引物之间、引物与非扩增区域之间的干扰几乎不存在,保证了每个特异性目的片段均能正常扩增。除了表2所述的893对引物之外,本发明的引物组合还可以包含其他引物,所述其他引物可以是针对其他肿瘤相关基因的引物,也可以是针对表1所述的80个肿瘤相关基因中的任一个或任几个的引物。当所述其他引物与表2所述的893对引物混合在一个体系中时,应当满足以下条件:引物与引物之间、引物与非扩增区域之间的干扰几乎不存在,保证每个特异性目的片段均能正常扩增。本发明还涉及通过上述方法构建获得的高通量测序文库。通过对所构建的检测髓系肿瘤的高通量测序文库进行测序以及数据分析,可以寻找到致病突变,明确疾病分型、用药或预后情况,为临床诊断和精准用药提供依据。对文库进行测序时,测序仪可以采用illumina平台配套仪器。测序过程中对各个dna片段的核苷酸序列进行读取并记录,生成fastq/bam等数据文件。测序深度平均在1000×左右,保证低比例突变能被有效地检测到。本发明可以应用多种illumina测序仪进行测序,包括从miseq、hiseq到novaseq等等机型均在适用机型范围内。同时,针对life公司的测序仪,本发明可适用于pgm、proton、s5三个不同平台的life公司测序仪。对得到的数据进行分析的示例性具体过程为:a)原始数据经过index拆分后,得到不同样本的原始测序数据,接着利用bwa软件对数据进行比对,比对到人类基因组数据库hg19参考序列上,同时筛除低于q30质量的数据;b)利用samtools及gatk等软件,对上述处理完毕后的数据进行进一步分析得到所需的snp及indel信息;c)计算strandbiassore,分值需大于或等于40,并利用falsefilter生信软件进行假阳性位点筛除。最终得到一份含有真实突变信息的文件(vcf文件);d)利用上述获得目标片段中的基因突变(snv)及微小插入/缺失突变(indel)数据,通过annovar、clinvar、dbsnp、cosmic等软件及数据库进行突变的解读。对数据进行分析,包括但不限于不同样本的数据拆分、数据质量控制(q30)、snpcall、coverageanalysis等等部分,可以使用商业化的软件或自主开发的相关软件进行分析。本发明的基因组合、引物组合或高通量测序文库可用于制备髓系肿瘤诊断试剂。所述髓系肿瘤诊断试剂优选是髓系肿瘤高通量测序诊断试剂,即通过高通量测序诊断髓系肿瘤的试剂,例如所述试剂可以是用于通过高通量测序和数据分析获得肿瘤相关基因的外显子区域和/或热点区域的突变情况,从而诊断髓系肿瘤的试剂。本发明的基因组合、引物组合或高通量测序文库可用于制备髓系肿瘤诊断试剂盒。所述髓系肿瘤诊断试剂盒优选是髓系肿瘤高通量测序诊断试剂盒,其中包含通过高通量测序诊断髓系肿瘤的试剂,例如所述试剂可以包括用于通过高通量测序和数据分析获得肿瘤相关基因的外显子区域和/或热点区域的突变情况,从而诊断髓系肿瘤。例如,所述试剂盒中可以包含能够特异性检测本发明的基因组合的引物组合。在一些实施方案中,所述引物组合包含表2所示的引物(即seqidno:1-seqidno:1786)。在一些实施方案中,所述试剂盒还包含进行多重pcr反应所需的一种多种其它试剂。多重pcr是本领域中已知的技术,主要的反应组分包括模板dna、dna聚合酶、dntp、缓冲液等。多重pcr反应所使用的设备以及反应参数是本领域技术人员所知晓的或能够容易地确定的。本申请的实施例也提供了示例性的多重pcr方法。在一些实施方案中,试剂盒还可以包含用于处理多重pcr扩增产物以使得该扩增产物能用于高通量测序技术中的试剂。多重pcr扩增产物通常需要进行处理,例如,末端修复,连接接头和标签、纯化、修复缺口等。对于掌握高通量测序的普通技术人员而言,上述处理步骤和所需要的试剂是容易理解的。本申请的实施例也提供了示例性的处理方法。本发明中,术语“诊断”包括鉴定、确认和/或表征髓系肿瘤的存在或不存在,及其发展阶段。本发明利用多重pcr方法进行所述基因组合的文库构建,但不仅限于该方法,例如杂交捕获等其它方法进行该基因组合的文库构建同样在本发明的保护范围内。下面通过实施例,并结合附图,对本发明的技术方案作进一步详细的说明,但本发明不限于下面的实施例。实施例1通过检索国内外各大权威数据库(包括cosmic、ncbi等等数据库),并结合权威期刊杂志进行基因panel信息的第一步收集。同时,对自主检测得到的数据进行深度分析,通过精准临床分型以及基因通路分型进行基因归类,通过检出率以及q30等质控数据进行突变位点的数据过滤,得到一批过滤剩下后基因panel,并与第一步的基因组合进行并集处理,最终整理得到80个基因的panel。该panel除涵盖目前权威杂志上几乎所有髓系肿瘤相关基因以外,还包括了国人的热点突变基因,并涵盖了髓系肿瘤从分型到预后所有层面的相关基因位点,具强的临床指导意义。所涉及的80个基因的信息见表1。针对这80个基因的外显子区域或热点区域,进行多重pcr引物设计,通过进行引物与引物、引物与模板之间的非特异性结合概率计算来选取非特异性最低的引物组合,着重避免引物末端出现的非特异性结合情况的出现。同时,设计引物时需要考虑每对引物对应扩增产物的长度在100~200bp之间,保证设计的引物所扩增得到的最终产物能有效的进行后续的测序反应。所设计的893对引物的序列信息见表2。将所设计的引物合成后,混合成引物库。实施例2一、样本dna的提取采用商业化的血液样本dna提取试剂盒(凯杰qiagen,《genereaddnaffpekit》),将切片上的福尔马林处理包埋样本(简称ffpe样本,来自于人)提取成dna溶液,按说明书进行操作。采用nonodrop测定dna260/280质量,利用qubit仪器检测dna浓度。二、dna多重pcr文库制备利用步骤一中得到的dna样本和实施例1中获得的引物库进行建库,使用lifetech公司的《ampliseqlibrarykit》,按说明书进行操作,具体步骤如下:1)将dna按照如下体系配置:组分髓系panel反应体系(10μl)高保真pcr缓冲液25倍浓度的引物库2基因组dna,10ngy去离子水(6-y)总体积10备注:y为10ngdna所需加入的液体体积。2)将上述加入dna的反应液放入到热循环仪中按照如下程序进行反应:3)将1μlfupa溶液加入到上述得到的pcr反应液,混匀后放置于热循环仪中进行如下反应:4)上述反应结束后,按照如下配方进行下一步反应液配置,其中稀释特异性标签混合液中含有接头:组分体积switch溶液2μl稀释特异性标签混合液1μldna连接酶1μl总体积(包含11μl消化的扩增子)14μl5)将上述反应液放置于热循环仪中进行如下反应:温度时间22℃30min72℃10min10℃保持(最多1小时)6)上述反应结束后,按如下步骤进行纯化:a.打开pcr管或96孔板薄膜,每孔加22.5μl(1.5x样本体积)ampurexp磁珠,移液器上下吹打5次,将dna和磁珠充分混匀。b.混合液室温孵育5分钟。c.将混合液放到磁力架上,静置2分钟,直到混合液变清澈。小心的去除上清,不要扰动磁珠。d.每管加150μl新配制70%乙醇,转动管壁,使磁珠从管壁的一侧转到另一侧,重复几次,吸弃上清,不要扰动磁珠。e.重复步骤d一次。f.确保所有乙醇被除尽,pcr管或96孔板放在磁力架上,室温空气干燥5分钟。7)待酒精完全干燥后,打开pcr管或96孔板薄膜,每孔加25μl高保真platinumpcr超级混合液,1μl文库扩增引物。高保真platinumpcr超级混合液和文库扩增引物可以提前混匀。8)将混合液放置于热循环仪上,进行如下反应:9)每管加12.5μl(0.5x样本体积)ampurexp磁珠,每管大约25μl样本。盖上pcr管或96孔板薄膜。涡旋混匀或移液器上下吹打5次混匀。10)室温孵育5分钟。11)将pcr管或96孔板放到磁力架上,至少5分钟,直到溶液澄清。12)紧接着上面步骤,每管加30μl(1.2x样本体积)ampurexp磁珠,每管大约25μl样本。盖上pcr管或96孔板薄膜。涡旋混匀或移液器上下吹打5次混匀。13)混合液室温孵育5分钟。14)将混合液放到磁力架上,静置2分钟,直到混合液变清澈。小心的去除上清,不要扰动磁珠。15)每管加150μl新配置70%乙醇,转动管壁,使磁珠从管壁的一侧转到另一侧,重复几次,吸弃上清,不要扰动磁珠。16)重复步骤15)一次。17)确保所有乙醇被除尽,pcr管或96孔板放在磁力架上,室温空气干燥5分钟。18)各pcr管或96孔板每孔加25μl去核酸水溶解ampurexp磁珠,盖上pcr管或96孔板薄膜。涡旋混匀或移液器上下吹打5次混匀。19)将pcr管或96孔板放到磁力架上,至少2分钟,直到溶液澄清。小心吸取上清20μl,上清即文库,做好标记。20)将上述文库进行qubit仪器质控检测,并记录浓度。浓度低于0.2ng/μl的文库视为不合格文库。三、文库测序将上述文库按illumina测序准备流程操作,在miseq机器上进行测序。四、数据分析1)原始总数据经过机器拆分后,得到样本的原始测序数据,如图2和表3所示。表3下机数据其中,测序质量大于q30的数据达到96.35%,测序的引物扩增均一性(uniformity)达到了97.54%,表示96.35%的数据达到了错误率为0.1%甚至更低的质控标准,以及97.54%的引物扩增差异控制在了10倍以内。该均一性的值已达到同类试剂盒上等水平。2)利用bwa软件对数据进行比对,比对到人类基因组数据库hg19参考序列上,同时筛除低于q30质量的数据。3)利用samtools对上述处理完毕后的数据进行进一步分析得到所需的snp及indel信息。4)利用falsefliter进行假阳性突变的过滤,生成最终的vcf文件。5)通过annovar软件对上述snp及indel进行注释,并结合clinvar、cosmic、pubmed等数据库整理突变意义信息,获得如表4所示的突变检测结果。表4突变检测结果本发明的实施方式并不限于上述实施例所述,在不偏离本发明的精神和范围的情况下,本领域普通技术人员可以在形式和细节上对本发明做出各种改变和改进,而这些均被认为落入了本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1