杆状病毒表达的猪瘟E2亚单位疫苗的制备方法及应用与流程
本发明属于分子生物学及兽用生物制品技术领域,具体涉及杆状病毒表达的猪瘟e2亚单位疫苗的制备方法及其应用。
背景技术:
猪瘟(classicalswinefever,csf)是由猪瘟病毒(classicalswinefevervirus,csfv)引起猪的一种高度接触性、致死性的传染病,临床上以发病急、高热稽留、全身泛发性点状出血和脾梗死为主要特征,主要危害家猪和野猪,给世界养猪业造成了巨大的经济损失。猪瘟的流行趋势发生了很大变化,呈现典型猪瘟和非典型猪瘟共存,隐性感染和持续感染并现,且免疫失败的现象时有发生。这种新的流行形式给全世界养猪业提出了新的挑战。
目前,疫苗接种仍然是防制猪瘟的重要措施,但是传统疫苗由于是弱毒疫苗,不能区分感染和免疫动物(differentiatinginfectedfromvaccinatedanimals,diva),因而不能满足防制猪瘟的需求。
技术实现要素:
本发明要解决的技术问题是,克服现有技术中的不足,提供了一种杆状病毒表达的猪瘟e2亚单位疫苗的制备方法及应用。
为解决技术问题,本发明的解决方案是:
提供一种杆状病毒表达的猪瘟e2亚单位疫苗,是通过杆状病毒表达系统表达的含有信号肽的猪瘟sp-e2蛋白,其中信号肽sp的序列如seqidno.1所示,表达e2蛋白的核酸序列如seqidno.2所示。
本发明所述的猪瘟e2亚单位疫苗的氨基酸序列如seqidno.3所示。
本发明进一步提供了所述猪瘟e2亚单位疫苗在防治猪瘟病毒感染中的应用。
本发明所述猪瘟sp-e2亚单位疫苗的制备方法,包括步骤如下:
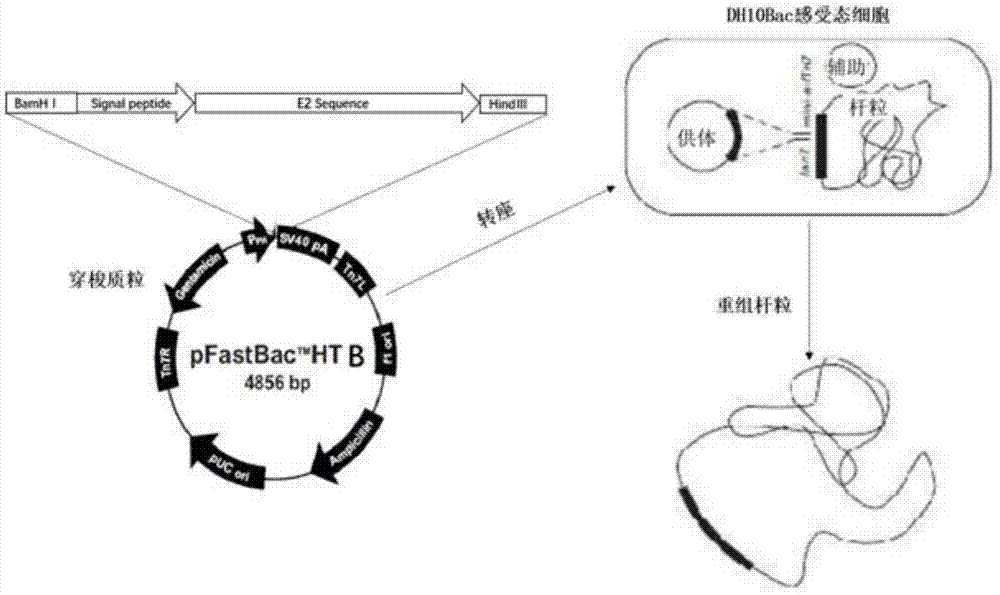
1)构建含有e2及其信号肽目的基因的穿梭质粒,将其转化dh10bac感受态细胞,使其发生转座,通过蓝白斑筛选,获得重组杆粒;
2)将重组杆粒转染昆虫细胞,获得杆状病毒,并将杆状病毒在昆虫细胞上进行传代;
3)将p3代病毒液感染大量的昆虫细胞,纯化并获取e2蛋白;
4)利用sp-e2蛋白与seppic206水佐剂充分乳化,制得猪瘟sp-e2亚单位疫苗。
进一步地,该方法的具体操作步骤如下所述:
(1)目的基因的扩增
根据genbank设计引物sp-f、sp-r、e2-f和e2-r;
先以引物sp-f、sp-r扩增获得sp信号肽,以引物e2-f、e2-r扩增获得e2片段,再以sp信号肽、e2蛋白为模板,引物sp-f、e2-r扩增获得目的基因sp-e2;
引物sp-f、sp-r、e2-f和e2-r的序列如seqidno.4~7所示;
(2)穿梭质粒的构建
pfastbachtb质粒以ecorⅰ和xholⅰ限制性内切酶37℃酶切2h后回收,将酶切的载体与目的基因用同源重组酶37℃重组30min,转化ecoli感受态细胞,挑斑鉴定,阳性菌送测序;
(3)重组杆粒的获取
将阳性质粒转化dh10bac感受态细胞,48h后挑选白斑,用引物m13-f和m13-r进行pcr鉴定后抽提杆粒;
引物m13-f和m13-r的序列如seqidno.8~9所示;
(4)转染及杆状病毒的获取
用脂质体转染试剂
(5)sp-e2的westernblot鉴定
将p1代毒液加入长至70%-80%密度的highfive细胞的96孔板,27℃感染96h后进行westernblot鉴定,一抗为csfv的阳性血清、阴性血清及单抗,二抗为hrp标记的兔抗猪二抗、fitc标记的羊抗鼠二抗;
(6)sp-e2的ifa鉴定
将p1代毒液加入长至70%-80%密度的highfive细胞的96孔板,27℃感染48h后进行间接免疫荧光实验,一抗为csfv的阳性血清、阴性血清及单抗,二抗为fitc标记的兔抗猪二抗、fitc标记的羊抗鼠二抗;
(7)蛋白的表达及纯化
用50ml培养基在250ml摇瓶里培养highfive细胞,当细胞密度到达1.5×106个/ml时,以moi=1感染细胞,27℃,115rpm/h培养96h,4000rpm离心10min,收集上清,用镍柱纯化蛋白,将纯化的蛋白进行定量及westernblot鉴定。
发明原理描述:
猪瘟病毒为黄病毒科瘟病毒属成员,含有一个大的开放阅读框(openreadingframe,orf),该阅读框编码一个含3898个氨基酸的多聚蛋白,此多聚蛋白在宿主细胞和病毒自身蛋白酶作用下,加工形成4个结构蛋白(c、erns、e1和e2)和8个非结构蛋白(npro、p7、ns2、ns3、ns4a、ns4b、ns5a和ns5b)。其中囊膜糖蛋白e2是主要保护性抗原蛋白,可以诱导抗猪瘟的保护性免疫。
杆状病毒表达系统在近年来迅速发展,由于其操作简单、安全性高、可通过悬浮培养规模表达蛋白、有翻译后修饰作用、其蛋白的免疫原性及构想与天然蛋白相似等优点而得到广泛的应用。利用杆状病毒表达系统制备猪瘟e2亚单位疫苗免疫原性强,安全性好,通过鉴别诊断能够区分感染及免疫动物,能从根本上净化猪瘟病毒。
由于杆状病毒表达系统表达不同的猪瘟e2蛋白,其表达产量、免疫效果等方面有较大差异,导致杆状病毒表达系统表达的猪瘟e2亚单位疫苗还未普及
与现有技术相比,本发明的有益效果是:
1、本发明研制的sp-e2亚单位疫苗免疫小鼠后能够优先于其qz14-e2、hz08-e2蛋白的产生猪瘟的特异性抗体,且中和抗体水平远高于qz14-e2、hz08-e2蛋白;免疫猪后可诱导产生特异性抗体。
2、本发明的疫苗具有产量高,免疫原性强,安全性好,通过鉴别诊断能够区分感染及免疫动物,能够从根本上净化猪瘟病毒。
附图说明
图1为sp-e2重组杆状病毒构建示意图。
图2为目的基因pcr扩增及重组杆粒的pcr鉴定图(左图为目的基因的扩增图,右图为重组杆粒的pcr的鉴定图)。
图3为sp-e2蛋白在昆虫细胞中的表达结果(左图为sds-page结果,右图为westernblot图)。
图4为sp-e2蛋白在昆虫细胞中的ifa鉴定结果(sf9细胞感染bac-sp-e248h后,用猪瘟标准阳性血清、标准阴性血清,单抗ifa鉴定sp-e2在昆虫细胞的表达情况)。
图5为sp-e2、e2、csp-ce2、sp-ce2、csp-e2蛋白纯化鉴定结果(左图为蛋白10倍浓缩图,右图为蛋白2倍浓缩图)。
图6为小鼠免疫sp-e2亚单位疫苗0、7、14、21、28天的血清的中和效价、elisa及ifa结果。(图中a为血清的elisa结果,b为血清的中和效价,c为免疫7天的血清的ifa结果,d为免疫14天的血清的ifa结果)
图7为猪免疫sp-e2亚单位疫苗0、7、14、21、28天的血清阻断elisa结果。
具体实施方式
以下实施例用于说明本发明,而不意图限制本发明的范围。
本发明蛋白的表达过程中所用引物的序列如下表所示:
实施例1猪瘟sp-e2蛋白的表达
1)目的基因的扩增
根据genbank设计引物sp-f、sp-r、e2-f、e2-r,先以sp-f、sp-r扩增获得sp信号肽,以e2-f、e2-r扩增获得e2片段,再以sp、e2为模板,sp-f、e2-r引物扩增获得目的基因sp-e2(如图2所示)。
2)穿梭质粒的构建
pfastbachtb质粒以ecorⅰ和xholⅰ限制性内切酶37℃酶切2h后回收,将酶切的载体与目的基因用同源重组酶37℃重组30min,转化ecoli感受态细胞,挑斑鉴定,阳性菌送测序。
3)重组杆粒的获取
将阳性质粒转化dh10bac感受态细胞,48h后挑选白斑,用m13引物进行pcr鉴定(如图2所示)后抽提杆粒。
4)转染及杆状病毒的获取
用脂质体转染试剂
5)sp-e2的westernblot鉴定
将p1代毒液加入长至70%-80%密度的highfive细胞的96孔板,27℃感染96h后进行westernblot鉴定,一抗为csfv的阳性血清、阴性血清及单抗,二抗为hrp标记的兔抗猪二抗、fitc标记的羊抗鼠二抗,结果如图3所示。
6)sp-e2的ifa鉴定
将p1代毒液加入长至70%-80%密度的highfive细胞的96孔板,27℃感染48h
后进行间接免疫荧光实验,一抗为csfv的阳性血清、阴性血清及单抗,二抗为fitc标记的兔抗猪二抗、fitc标记的羊抗鼠二抗,结果如图4所示。
7)蛋白的表达及纯化
用50ml培养基在250ml摇瓶里培养highfive细胞,当细胞密度到达1.5×106个/ml时,以moi=1感染细胞,27℃,115rpm/h培养96h,4000rpm离心10min,收集上清,用镍柱纯化蛋白,将纯化的蛋白进行定量及westernblot鉴定。
如图5所示,sp信号肽可使e2蛋白呈分泌表达,且能够提高ce2、e2的蛋白表达量。
实施例2本发明的猪瘟sp-e2蛋白亚单位疫苗的制备及动物免疫实验。
将实施例1表达的sp-e2蛋白与seppic206水佐剂以1:1的比例350rpm混匀10min,密封4℃避光保存。
试验例1
16只6周龄的雌性balb/c小鼠随机分为四组,每组4只,第一组皮下注射sp-e2蛋白50μg,第二组皮下注射hz08-e2蛋白50μg,第三组皮下注射qz14-e2蛋白50μg,第四组皮下注射pbs,首免14天时进行二次免疫,分别于首免后的0d、7d、14d、21的、28d采血,分别用间接elisa、间接免疫荧光,血清的中和实验,如图6所示,实验表明sp-e2亚单位疫苗免疫小鼠后能够优先于其qz14-e2、hz08-e2蛋白的产生猪瘟的特异性抗体,且中和抗体水平远高于qz14-e2、hz08-e2蛋白如图6所示。
试验例2
12头仔猪,随机分为4组,免疫组每组3头,免疫剂量分别为5μg、15μg、30μg,对照组1头,免疫dmem培养基,分别于免疫0d、7d、14d、21、28d采血,进行阻断elisa试剂盒检测,如图7所示,免疫5μg的猪在免疫21d时抗体转阳性,而免疫15μg、30μg的猪在免疫14d时抗体部分转阳性,21d时抗体全部转阳性,由此可以看出猪瘟sp-e2蛋白亚单位疫苗的免疫效果良好。
以上所述仅是本发明的实施方式。
应当指出,对于本技术邻域的技术人员,在不脱离本发明技术原理的前提下,还可以做出若干改进,这些改进也视为本发明的保护范围。
序列表
<110>浙江大学
<120>杆状病毒表达的猪瘟e2亚单位疫苗的制备方法及应用
<160>9
<170>siposequencelisting1.0
<210>1
<211>72
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgataaaagtattaagagggcaggtcgtgcaaggtataatatggctgctgctggtgacc60
ggggcacaaggg72
<210>2
<211>993
<212>dna
<213>人工序列(artificialsequence)
<400>2
cggctgtcctgcaaggaagactacaggtatgcgatatcatcaaccaatgagatagggccg60
ctaggggctgaaggcctcaccaccacctggagagagtatagccatggtttgcagctggat120
gacgggactgtcagggccatctgcactgcggggtccttcaaagttatagcacttaatgtg180
gtcagtaggaggtacctggcatcattacacaagagggctttgcccacctcagtaacattt240
gaactcctatttgatgggactagcccagcaattgaggagatgggagatgactttggattt300
gggctgtgcccttttgacacaaccccagtggtcaaagggaagtacaataccactctatta360
aacggcagtgctttctacctagtctgcccaataggatggacgggtgtcatagagtgcacg420
gcagtgagccccacaaccttaagaacagaagtggtgaagaccttcaagagagagaagcct480
ttcccacacagagtggattgcgtgaccactatagtagaaaaagaagacctgttctactgc540
aagtgggggggtaattggacatgtgtgaaaggcaacccggtgacctacatgggggggcaa600
gtaaaacaatgcaggtggtgcggttttgacttcaaggagcccgatgggctcccacactac660
cccataggcaagtgcatcctagcaaatgagacgggttacagggtagtggattccacagac720
tgcaatagagatggcgtcgttatcagcactgaaggagaacacgagtgcttgattggtaac780
accaccgtcaaggtgcacgcgttggatggaagactgggccctatgccgtgcagacccaaa840
gaaatcgtctctagcgcgggacctgtaaggaaaacttcctgtactttcaattacacaaag900
acactaagaaacaagtactatgagcccagggacagctattttcagcaatatatgcttaag960
ggcgagtaccaatactggtttgacctggacgtg993
<210>3
<211>355
<212>prt
<213>编码猪瘟e2-sp的氨基酸序列(artificialsequence)
<400>3
metilelysvalleuargglyglnvalvalglnglyileiletrpleu
151015
leuleuvalthrglyalaglnglyargleusercyslysgluasptyr
202530
argtyralaileserserthrasngluileglyproleuglyalaglu
354045
glyleuthrthrthrtrpargglutyrserhisglyleuglnleuasp
505560
aspglythrvalargalailecysthralaglyserphelysvalile
65707580
alaleuasnvalvalserargargtyrleualaserleuhislysarg
859095
alaleuprothrservalthrphegluleuleupheaspglythrser
100105110
proalailegluglumetglyaspasppheglypheglyleucyspro
115120125
pheaspthrthrprovalvallysglylystyrasnthrthrleuleu
130135140
asnglyseralaphetyrleuvalcysproileglytrpthrglyval
145150155160
ileglucysthralavalserprothrthrleuargthrgluvalval
165170175
lysthrphelysargglulyspropheprohisargvalaspcysval
180185190
thrthrilevalglulysgluaspleuphetyrcyslystrpglygly
195200205
asntrpthrcysvallysglyasnprovalthrtyrmetglyglygln
210215220
vallysglncysargtrpcysglypheaspphelysgluproaspgly
225230235240
leuprohistyrproileglylyscysileleualaasngluthrgly
245250255
tyrargvalvalaspserthraspcysasnargaspglyvalvalile
260265270
serthrgluglygluhisglucysleuileglyasnthrthrvallys
275280285
valhisalaleuaspglyargleuglyprometprocysargprolys
290295300
gluilevalserseralaglyprovalarglysthrsercysthrphe
305310315320
asntyrthrlysthrleuargasnlystyrtyrgluproargaspser
325330335
tyrpheglnglntyrmetleulysglyglutyrglntyrtrppheasp
340345350
leuaspval
355
<210>4
<211>37
<212>dna
<213>人工序列(artificialsequence)
<400>4
aagcgcgcggaattcatgataaaagtattaagagggc37
<210>5
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>5
cccttgtgccccggtcaccagc22
<210>6
<211>37
<212>dna
<213>人工序列(artificialsequence)
<400>6
accggggcacaagggcggctgtcctgtaaggaagact37
<210>7
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>7
ctcgacaagcttctacacgtccaggtcaaaccagtatt38
<210>8
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>8
tgtaaaacgacggccagt18
<210>9
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>9
caggaaacagctatgacc18
- 还没有人留言评论。精彩留言会获得点赞!