一种达沙替尼晶型及其制备方法与流程
本发明涉及药物技术领域,具体涉及技术领域一种达沙替尼晶型及制备方法。
背景技术:
达沙替尼(dasatinib),化学名为:n-(2-氯-6-甲基苯基)-2-[[6-[4-(2-羟乙基)-1-哌嗪基]-2-甲基-4-嘧啶基]氨基]-5-噻唑甲酰胺,分子式为c22h26c1n7o2s,分子量为488.00600,cas863127-77-9。达沙替尼为抗肿瘤药,商品名为sprycel,是由bms公司研发的一种口服的络氨酸激酶抑制剂,临床上主要治疗对甲磺酸伊马替尼耐药,或不耐受的费城染色体阳性(ph+)慢性髓细胞白血病(cml)慢性期、加速期和急变期(急粒变和急淋变)成年患者。
化学结构如下:
不同的晶型可以表现出不同的化学和物理特性,这些性质对药物有着直接影响。百时美施贵宝(bms)在专利cn200580011916.6介绍了达沙替尼一水合物晶型的特征数据及其制备方法(在乙醇与水的混合溶剂中进行转化),同时还介绍了达沙替尼的正丁醇溶剂化物、乙醇化物和无水物的制备及特征;cn201019026056.3中介绍了晶型i的特征数据,但技术存在不足,制备工艺较为繁锁,析晶工艺不稳定,重现性差,产品质量不稳定;另外还介绍了晶型ii的特征和制备方法,但制备方法繁琐(采用二甲基甲酰胺为溶剂把样品溶解,然后在丙酮中扩散形成),不利于工业化。专利cn201310347301.7公开了一种达沙替尼新晶型v,但制备步骤繁琐,不利于工业化生产。cn201210478501.1公开了一种达沙替尼一水合物的新多晶型物α,但其溶解度有待进一步提高。cn201210314388.3公开了一种达沙替尼多晶型物iii,但其制备工艺繁琐,增加了工业化生产有机废液的处理,且晶型溶解度较低。201110316498.9公开了一种达沙替尼一水合物新晶型iii,虽然制备工艺简单,但所得晶型溶解度有待提高,溶出度较低。cn201019026056.3公开了一种达沙替尼一水合物的晶型i和多晶型物ii,但制备工艺复杂,温度控制点较多,晶体质量难于控制,而且工业化生产带来大量待处理的有机废液,给环境保护带来压力。cn200910196987.8公开了达沙替尼晶型i、ii、iii、iv,但晶型的溶解度较低。
不同的达沙替尼晶型具有不同的稳定性、物理性质、溶解度等,而这些性质可以直接影响原料药和制剂的稳定性和生物利用度。现有技术中,达沙替尼晶型的溶解度和稳定性还需进一步提高。
技术实现要素:
鉴于现有技术的不足,本发明提供了一种达沙替尼晶型。
一种达沙替尼晶型,其x-射线粉末衍射光谱用2θ表示在5.8±0.2°,7.2±0.2°,14.4±0.2°,16.0±0.2°处有衍射峰。
优选地,x-射线粉末衍射光谱用2θ表示在5.8±0.2°,7.2±0.2°,11.6±0.2°,14.4±0.2°,16.0±0.2°,18.7±0.2°,19.2±0.2°,24.2±0.2°,25.1±0.2°,30.6±0.2°处有衍射峰。
进一步优选地,x-射线粉末衍射光谱用2θ表示在5.8±0.2°,7.2±0.2°,11.6±0.2°,12.0±0.2°,12.7±0.2°,14.4±0.2°,16.0±0.2°,16.9±0.2°,17.4±0.2°,17.9±0.2°,18.7±0.2°,19.2±0.2°,19.6±0.2°,20.8±0.2°,21.6±0.2°,22.2±0.2°,24.2±0.2°,24.6±0.2°,25.1±0.2°,26.0±0.2°,29.1±0.2°,29.8±0.2°,30.6±0.2°31.1±0.2°,32.2±0.2°,35.0±0.2°,37.7±0.2°,44.0±0.2°处有衍射峰。
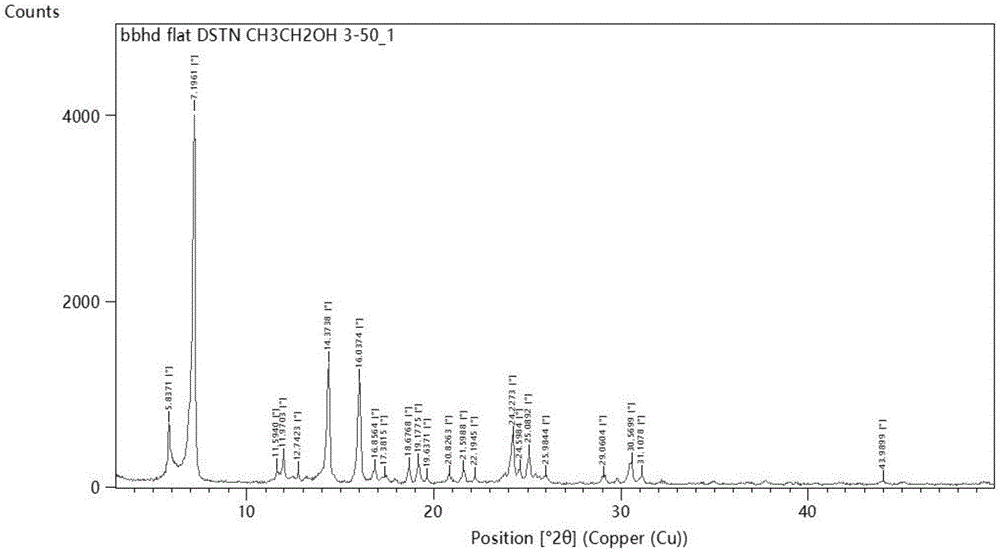
更加优选地,所述达沙替尼晶型具有如图1所示的x-射线粉末衍射图谱,x-衍射具体数据如表1所示:
表1达沙替尼晶型的x-射线粉末衍射数据
本发明中x-射线粉末衍射测试仪器及测试条件为:帕纳科empyreanx-射线粉末衍射仪;光源铜靶,平板样品台,bbhd入射光路,pzxcel衍射光路,电压45kv,电流40ma,发散狭缝为1/4°,防散射狭缝为1°,索拉狭缝为0.04rad,每步计数时间0.5s,扫描范围3~50°。
本发明提供的达沙替尼晶型,其进x-射线单晶衍射测试分析。测试条件为:理学xtalabsynergyx-射线单晶衍射仪;光源铜靶,温度293k,电压50kv,电流1ma,收集方法为正交法,扫描时间5min。采用cu-ka靶射线扫描进行数据收集,进一步进行结构解析得到x-射线单晶衍射图(sxrd),如图2所示。其晶胞参数为a=16.8809(14),b=9.0607(7),c=22.2061(19),α=90,β=114.610(4)°,γ=90,z=4,z′=1,v=3088.0(5)。从sxrd图2中可以看出,一个晶胞中一分子的达沙替尼含有两个乙醇分子,晶型为达沙替尼乙醇化合物。
另一方面,本发明还提供所述达沙替尼新晶型的制备方法,具体而言,本发明采用如下步骤制备所述晶型:
(1)将达沙替尼一水合物加入无水乙醇中;
(2)将步骤(1)所得混合溶液加热至达沙替尼一水合物完全溶解;
(3)步骤(2)所得溶液缓慢降温后,过滤,挥发,析晶;
(4)过滤,减压干燥。
优选地,所述步骤(1)无水乙醇溶液中,达沙替尼的浓度为0.1~9mg/ml。
优选地,所述步骤(2)加热溶解的温度为35~70℃。
优选地,所述步骤(2)加热时间为20min-2h。
更加优选地,采用如下步骤制备所述晶型:
(1)将达沙替尼一水合物加入无水乙醇溶液中,其中达沙替尼一水合物在无水乙醇溶液中的浓度为0.1~9mg/ml;
(2)将步骤(1)所得混合溶液在台式超声波仪中进行超声加热使其溶解,加热时间为20min-2h,加热溶解的温度为35~70℃;
(3)将步骤(2)所得溶液缓慢降温,过滤,置于小烧杯中,封口膜封口,扎孔,挥发,结晶;
(4)过滤,减压干燥即得达沙替尼单晶。
本发明还提供了所述的达沙替尼晶型的用途,其用于制备预防和/或治疗癌症的药物、或用于制备抑制肿瘤细胞的药物。其中所述的癌症选自慢性髓细胞性白血病(cml)、胃肠道间质瘤(gist)、小细胞肺癌(sclc)、非小细胞肺癌(nsclc)、卵巢癌、黑素瘤、肥大细胞增生病、生殖细胞瘤、急性髓细胞性白血病(aml)、儿科肉瘤、乳腺癌、结肠直肠癌、胰腺癌和前列腺癌。
本发明还提供了一种药物组合物,它包含安全有效量范围内的活性成分达沙替尼晶型,以及药学上可接受的载体。
“安全有效量”指的是:活性成分的量足以明显改善病情,而不至于产生严重的副作用。通常,药物组合物含有1-2000mg活性成分/剂,更佳地,含有10-200mg活性成分/剂。较佳地,所述的“一剂”为一个药片。
“药学上可以接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂、润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
本发明的活性成分或药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、瘤内、直肠、肠胃外(静脉内、肌肉内或皮下)等。本发明化合物可以单独给药,或者与其他药学上可接受的化合物联合给药。
与现有技术相比,本发明提供的达沙替尼晶型主要优点为:
1、产品为达沙替尼新晶型,理化性能优异,稳定性好。
2、制备方法简便易行,适合工业化生产。
3、该晶型产物稳定,且能显著改善本品制剂的溶出度。
附图说明
图1:达沙替尼晶型x-射线粉末衍射图。
图2:达沙替尼晶型x-射线单晶衍射图。
具体实施方式
下面通过实施例来进一步说明本发明。应该正确理解的是:本发明的实施例仅仅是用于说明本发明而给出,而不是对本发明的限制,所以,在本发明的方法前提下对本发明的简单改进均属本发明要求保护的范围。
实施例1
(1)将达沙替尼粗品一水合物加入无水乙醇溶液中,其中达沙替尼在无水乙醇溶液中的浓度为0.1mg/ml;
(2)在台式超声波仪中进行超声加热使其溶解,加热20min,温度为35℃;
(3)缓慢降温至0℃,过滤,置于小烧杯中,封口膜封口,扎孔,挥发,结晶20min;
(4)过滤,50℃下减压干燥即得达沙替尼单晶。
产品收率85.7%,产品纯度99.91%。经测定,其x-射线粉末衍射图谱与图1基本一致。
实施例2
(1)将达沙替尼一水合物加入无水乙醇溶液中,其中达沙替尼在无水乙醇溶液中的浓度为7mg/ml,;
(2)在台式超声波仪中进行超声加热使其溶解,加热1h,温度为45℃;
(3)缓慢降温至35℃,过滤,置于小烧杯中,封口膜封口,扎孔,于室温下挥发,结晶10h;
(4)过滤,40℃下减压干燥即得达沙替尼单晶。
产品收率90.5%,产品纯度99.98%。经测定,其x-射线粉末衍射图谱与图1基本一致。
实施例3
(1)将达沙替尼一水合物加入无水乙醇溶液中,其中达沙替尼在无水乙醇溶液中的浓度为9mg/ml;
(2)在台式超声波仪中进行超声加热使其溶解,加热2h,温度为70℃;
(3)缓慢降温至55℃,过滤,置于小烧杯中,封口膜封口,扎孔,于室温下挥发,结晶48h;
(4)过滤,60℃下减压干燥即得达沙替尼单晶。
产品收率88.8%,产品纯度99.95%。经测定,其x-射线粉末衍射图谱与图1基本一致。
实施例4
1.达沙替尼片剂的处方
2.制备工艺
将上述达沙替尼单晶与除硬脂酸镁以外的全部或部分辅料在湿法制机中混合均匀,加入适量的纯化水制颗粒;沸腾床干燥湿颗粒;整粒后加入剩余部分的辅料,在多向混合器中混合均匀;向上述混合物中加入硬脂酸镁并混合均匀;待测定颗粒含量后,旋转压片机压片;按照常规方法配制薄膜包衣液,在高效包衣机中包覆薄膜。
对比实施例1
将达沙替尼无定形粉末12kg和无水甲醇360l加入至反应器中,室温搅拌加热至65℃,养晶1小时,自然降至室温。抽虑,滤饼用无水甲醇洗涤并抽干,在45℃-55℃,真空度≤-0.090mpa条件下减压干燥,得白色的现有达沙替尼无水合物新晶型8.9kg,收率75.0%,产品纯度99.93%。
对比实施例2
于30l反应瓶中加入1.68kg达沙替尼无定形粉末,8.4ldmf加热溶解,过滤,浓缩至大量固体析出,加入16.8l乙醇回流搅拌1h,冷却至室温,过滤,滤饼用乙醇洗涤。
在于30l反应瓶中加入上述滤饼、16.8l乙醇、1.68ldmf,搅拌下加热回流1小时,冷却至室温,过滤,滤饼用乙醇洗涤,用16.8l乙醇热回流1h,冷却至室温后过滤,105℃减压干燥12小时,得白色现有达沙替尼晶体,收率95.6%,产品纯度99.94%。
对比实施例3
将达沙替尼无定形粉末悬浮于其重量5倍量(v/w,单位l/kg)体积的无水乙醇4.6l中,60-65℃保温搅拌0.5h,再加入粗品重量2倍量(v/w,单位l/kg)的dmf1.8l,升温至75-80℃,搅拌溶解,保温常压蒸馏,当回收到的溶剂体积达到粗品重量的0.7-0.8倍(v/w,单位l/kg),即约0.7l时,停止蒸馏,趁热过滤该溶液,滤液降温至40-45℃,加入甲基叔丁基醚(粗品重量的4倍量)3.8l,降温至5-10℃(0.5h之内达到所需温度),搅拌析晶2h。用甲基叔丁基醚洗涤滤饼,55-60℃真空干燥8h,得到高纯度的现有达沙替尼无水物约688g,精制收率74%,总收率56%,纯度99.92%。
对比实施例4
将达沙替尼无定形粉末10g溶于温度为40℃的二甲基亚砜、异丙醇和乙睛的混合溶剂中40ml,其中,混合溶剂中,二甲基亚砜、异丙醇和乙睛的体积比为10∶1∶1.5;溶解完成之后,在溶有达沙替尼的溶液中加入乙酸乙酯溶剂,乙酸乙酯的加入量为溶液体积相等,同时以速率300r/min搅拌5分钟,然后停止搅拌,在2小时内将温度降到室温,在室温保持3小时,再进一步降温至-5℃,最后,在-5℃放置3小时,析出晶体,用无水乙醚洗涤、干燥后得到现有达沙替尼晶体。
产品收率81.5%,产品纯度99.85%。
对比实施例5
(1)将达沙替尼一水合物加入无水乙醇溶液中,其中达沙替尼在无水乙醇溶液中的浓度为15mg/ml,;
(2)在台式超声波仪中进行超声加热使其溶解,加热1h,温度为50℃;
(3)缓慢降温至30℃,过滤,置于小烧杯中,封口膜封口,扎孔,于室温下挥发,结晶72小时;
(4)过滤,50℃下减压干燥即得达沙替尼单晶。
产品收率40.5%,产品纯度99.89%。经测定,其x-射线粉末衍射图谱与图1基本一致。
对比实施例6
(1)将达沙替尼一水合物加入无水乙醇溶液中,其中达沙替尼在无水乙醇溶液中的浓度为9mg/ml;
(2)在台式超声波仪中进行超声加热使其溶解,加热3h,温度为25℃;
(3)缓慢降温至30℃,过滤,置于小烧杯中,封口膜封口,扎孔,于室温下挥发,结晶36小时;
(4)过滤,50℃下减压干燥即得达沙替尼单晶。
产品收率31.7%,产品纯度99.90%。经测定,其x-射线粉末衍射图谱与图1基本一致。
对比实施例7
(1)将达沙替尼一水合物加入无水乙醇溶液中,其中达沙替尼在无水乙醇溶液中的浓度为0.5mg/ml;
(2)在台式超声波仪中进行超声加热使其溶解,加热10min,温度为80℃;
(3)缓慢降温至50℃,过滤,置于小烧杯中,封口膜封口,扎孔,于室温下挥发,结晶36小时;
(4)过滤,50℃下减压干燥即得达沙替尼单晶。
产品收率46.3%,产品纯度99.65%。经测定,其x-射线粉末衍射图谱与图1基本一致。
验证实施例
1.溶解性实验
精密称取实施例1-3、对比实施例1-4所得达沙替尼晶型及现有达沙替尼晶型i和iv适量,缓慢加入一定量的溶剂,每隔5分钟强力振摇30秒,观察30分钟内的溶解情况,结果见表2。
表2达沙替尼晶型在不同溶剂中溶解情况
对比实施例1-4、达沙替尼晶型i和iv为现有晶型,与现有晶型相比,本发明的达沙替尼新晶型的溶解度更加优良。
2.稳定性实验
将本发明的实施例1-3、对比实施例1-4所得晶型及现有达沙替尼晶型i和iv采用上市包装进行加速试验,置40±2℃;rh80±5%的恒温恒湿培养箱6个月,分别于1、2、3、6个月末取样检验外观、有关物质、含量和干燥失重,并与0月结果比较分析。结果见表3。
表3达沙替尼晶型加速试验结果
本发明新晶体在加速实验条件下,放置6个月均无明显吸湿,晶型未改变,稳定性良好,适于长期贮存和应用于制剂。
3.溶出度实验
实施例1-3、对比实施例1-4所得晶型及现有达沙替尼晶型i和iv按如下方法测定溶出度。以含1%曲拉通的醋酸盐缓冲液(ph4.0+0.05%)1000ml为溶出介质,转速每分钟60转,依法操作,温度37℃,在0min、10min、20min、30min、45min取样10ml,过滤,滤液作为供试品溶液,等量补充同温度新鲜的溶出介质;另取达沙替尼对照品适量,溶解并稀释制成0.05mg/ml的溶液作为对照品溶液,分别精密量取5μl,注入色谱仪,记录色谱图,按外标法以峰面积计算溶出量。
表4达沙替尼晶型溶出度
现有晶型10min溶出度最高为81%,本发明的达沙替尼乙醇溶剂合物新晶体在溶出10min时,累计溶出度≥90%,明显优于现有晶型。
- 还没有人留言评论。精彩留言会获得点赞!